细胞色素P450基因多态性与抗血小板治疗
- 格式:pdf
- 大小:221.98 KB
- 文档页数:3

细胞色素氧化酶CYP1A2与药物代谢的研究进展[摘要] CYP1A2是一种重要的细胞色素P450酶,在药物代谢、前毒物和前致癌物激活的过程中起着重要作用。
许多因素均可导致CYP1A2的活性发生改变,如多环芳香族碳水化合物、吸烟、咖啡因、烧烤食物、十字花科蔬菜、剧烈运动以及某些药物如奥美拉唑和卡马西平等可以诱导CYP1A2的活性;低蛋白饮食、肝硬化、炎症可以使肝脏内CYP1A2的合成减少,从而导致体内活性降低;而许多临床药物如氟伏沙明、喹诺酮类抗生素、普罗帕酮、口服避孕药等可以抑制CYP1A2的活性。
实验室常用同位素标记法和HPLC法进行CYP1A2活性的测定。
[关键词] CYP1A2;代谢;活性测定;中药细胞色素氧化酶P450( cytochrome P450, CYP450)超家族是重要的生物转化酶系,根据1993年Nelson等科学家制定的,根据P450分子的氨基酸序列的统一命名法,CYP450可以被进一步分为几个族。
涉及大多数药物代谢的CYP450酶系主要有CYP1, CYP2, CYP3三个族,CYP1A2酶亚家族主要在肝脏表达,占体内CYP450酶总量的13%,仅次于CYP3A酶和CYP2C 酶,居第3位。
代谢临床5%~10% 的常规应用药物,故CYP1A2酶的活性与许多药物的疗效或毒性相关, 其还参与多种与癌症发生密切相关的化学性毒物(如亚硝胺)和内源性激素的代谢,具有重要的药理学和毒理学意义。
CYP1A2酶基因多态性和表型差异的研究,可用于评价临床药物治疗效果。
1、CYP1A2酶参与的代谢1-1 CYP1A2酶与环境有害物质的代谢[1]1-1-1芳香胺类和杂环类芳香胺类和杂环类为前致癌物质,在人体往往经N-氧化转化成直接致癌物,CYP1A2酶在此激活过程中具有决定性的催化作用。
调查表明,CYP1A2酶分别介导约91%的2-氨基-3,8-三甲基咪唑[4,5-f]喹嗯啉以及约70%的2-氨基-1-甲基-6-苯咪唑[4,5-f]吡啶的代谢清除,两者在油炸鱼和油炸猪肉中含量丰富。

由首都医科大学附属北京天坛医院王拥军教授主持进行的氯吡格雷联合阿司匹林与阿司匹林单独治疗急性非致残性脑血管事件高危人群研究(colopidogrel in high-risk patients with acute non-disabling cerebrovascular events,简称CHANCE研究)该研究已被世界权威医学期刊《新英格兰医学杂志》(NEJM)接受,将于今天在新英格兰杂志发表。
此项研究在今年2月份美国夏威夷举行的2013年国际卒中大会(ISC)上公布后,引起广泛反响,在今天的天坛会正式发布。
这是目前为止,全球最大多中心、随机、双盲、双模拟、平行对照小卒中和TIA临床研究。
CHANCE研究结果显示,在短暂性脑缺血发作(TIA)或小卒中后相对短期应用阿司匹林及氯吡格雷联合治疗在降低卒中复发风险方面优于阿司匹林单独治疗,且并不伴有严重出血并发症风险的显著增加。
这项仅在中国进行的CHANCE研究领先于另一项在美国招募和进行的类似研究,即TIA和卒中血小板定向抑制(POINT)研究。
该研究纳入了5170例患者40岁及以上的TIA或小卒中的患者。
其发病时间在24小时内,被随机分配到两组:阿司匹林(首日负荷剂量为75-300mg,随后75mg/天)加安慰剂治疗组,或相同的阿司匹林剂量加氯吡格雷(首日负荷剂量为300mg,随后75mg/天)治疗组。
双抗治疗组的患者还需要经过21天之后停用阿司匹林,因为与其他亚组人群类似,中国的患者具有相对较高的出血风险。
研究结果表明,同时接受阿司匹林和氯吡格雷双抗治疗的患者卒中复发率更低。
90天随访时,双抗治疗组患者无卒中(包括缺血性和出血性卒中)生存的风险比(HR)为0.68(95%CI,0.57 - 0.81,P <0.001)。
对于联合次要终点事件(卒中,心肌梗死,血管性死亡),HR为0.69(95%CI,0.58 - 0.82,P <0.001)。

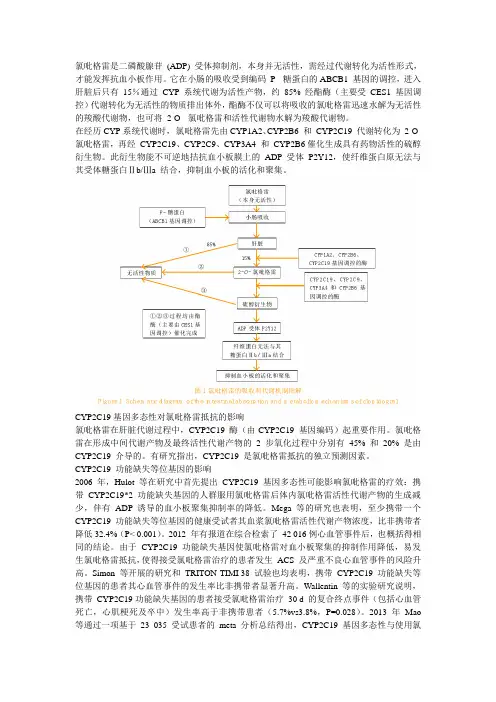
氯吡格雷是二磷酸腺苷(ADP) 受体抑制剂,本身并无活性,需经过代谢转化为活性形式,才能发挥抗血小板作用。
它在小肠的吸收受到编码P- 糖蛋白的ABCB1 基因的调控,进入肝脏后只有15%通过CYP系统代谢为活性产物,约85% 经酯酶(主要受CES1基因调控)代谢转化为无活性的物质排出体外,酯酶不仅可以将吸收的氯吡格雷迅速水解为无活性的羧酸代谢物,也可将2-O- 氯吡格雷和活性代谢物水解为羧酸代谢物。
在经历CYP系统代谢时,氯吡格雷先由CYP1A2、CYP2B6 和CYP2C19 代谢转化为2-O- 氯吡格雷,再经CYP2C19、CYP2C9、CYP3A4 和CYP2B6催化生成具有药物活性的硫醇衍生物。
此衍生物能不可逆地拮抗血小板膜上的ADP 受体P2Y12,使纤维蛋白原无法与其受体糖蛋白Ⅱb/Ⅲa 结合,抑制血小板的活化和聚集。
CYP2C19基因多态性对氯吡格雷抵抗的影响氯吡格雷在肝脏代谢过程中,CYP2C19 酶(由CYP2C19 基因编码)起重要作用。
氯吡格雷在形成中间代谢产物及最终活性代谢产物的 2 步氧化过程中分别有45% 和20% 是由CYP2C19 介导的。
有研究指出,CYP2C19 是氯吡格雷抵抗的独立预测因素。
CYP2C19 功能缺失等位基因的影响2006 年,Hulot 等在研究中首先提出CYP2C19基因多态性可能影响氯吡格雷的疗效:携带CYP2C19*2 功能缺失基因的人群服用氯吡格雷后体内氯吡格雷活性代谢产物的生成减少,伴有ADP 诱导的血小板聚集抑制率的降低。
Mega 等的研究也表明,至少携带一个CYP2C19 功能缺失等位基因的健康受试者其血浆氯吡格雷活性代谢产物浓度,比非携带者降低32.4%(P< 0.001)。
2012 年有报道在综合检索了42 016例心血管事件后,也概括得相同的结论。
由于CYP2C19 功能缺失基因使氯吡格雷对血小板聚集的抑制作用降低,易发生氯吡格雷抵抗,使得接受氯吡格雷治疗的患者发生ACS 及严重不良心血管事件的风险升高。

细胞色素P450还原酶细胞色素P450还原酶简介细胞色素P450还原酶(Cytochrome P450 reductase)是一种酶,属于细胞色素P450酶超家族的一员。
它在生物体内广泛存在,参与多种生物过程,包括药物代谢、甾体激素合成以及内源性化合物的降解等。
细胞色素P450还原酶的结构和功能1.结构细胞色素P450还原酶是一种单个多功能酶,由3个不同的功能模块组成:还原酶域、连接域和催化酶域。
2.功能细胞色素P450还原酶的主要功能是通过电子转移,将电子提供给细胞色素P450酶,从而催化底物的氧化反应。
其功能模块各司其职,使其能够与细胞色素P450酶高效结合并完成电子转移。
细胞色素P450还原酶的生物学意义和应用1.生物学意义细胞色素P450还原酶在维持生物体内稳态、保护细胞功能以及应对外界环境变化等方面发挥着重要作用。
它参与许多生物过程,例如药物代谢,通过催化底物的氧化反应,加速药物的降解和排出,从而影响药物的疗效和副作用。
2.应用由于细胞色素P450还原酶对药物代谢的影响,它在药物研发和药物安全性评价中起着重要作用。
通过研究细胞色素P450还原酶的结构和功能,可以更好地设计和开发药物,提高药物的疗效和安全性。
细胞色素P450还原酶的研究进展和挑战1.研究进展近年来,对细胞色素P450还原酶的研究取得了重要进展。
通过结构生物学、分子生物学和蛋白质工程等技术手段的发展,研究者们揭示了细胞色素P450还原酶的三维结构,探究了其电子转移机制,并发现了一些与药物代谢相关的基因多态性。
2.挑战尽管对细胞色素P450还原酶的研究有了许多进展,但仍然存在一些挑战。
其中之一是细胞色素P450还原酶的催化机制尚未完全揭示,这限制了对其在药物代谢中的应用。
此外,基因多态性与药物代谢的关系也还需要进一步深入研究。
细胞色素P450还原酶与药物代谢的关系1.细胞色素P450还原酶的种类和药物代谢细胞色素P450还原酶是一大家族的酶,不同亚型具有不同的催化活性。

药物代谢酶基因多态性与个体化用药随着基因测序技术的发展,人们对于个体差异在药物代谢和疗效方面的影响越来越重视。
药物代谢酶基因多态性与个体化用药相关的研究得到了广泛关注。
在这篇文章中,我们将探讨药物代谢酶基因多态性对个体化用药的影响,并介绍一些相关的研究进展。
1. 药物代谢酶基因多态性概述药物代谢酶是参与药物在体内转化和清除的重要蛋白质。
这些酶通过催化反应使药物分子转化为更容易被排出体外的代谢产物。
然而,由于每个人身体内这些酶的活性和表达水平存在差异,导致了我们对同一剂量的药物有不同的反应。
这种差异主要源于调控这些酶活性和表达水平的遗传因素。
2. 基因多态性对个体化用药的影响2.1 基因多态性与药效药物经过代谢酶的作用转化成药物代谢产物,而这些代谢产物才是对疾病起治疗作用的主要形式。
然而,由于基因多态性的存在,个体体内可能存在对药物代谢产物敏感或相对不敏感的情况。
具体来说,某些基因变异可能导致药物在体内更快或更慢地被代谢,进而影响到药效的表现。
2.2 基因多态性与药物副作用药物副作用是使用药物过程中不可避免的问题。
然而,在个体差异方面,一些人可能对特定药物副作用反应过度敏感,甚至在正常剂量下也会出现严重反应。
实际上,在某些情况下,这种差异可能源自于基因多态性所带来的调节差异。
3. 药物代谢酶基因多态性研究进展3.1 CYP450基因和个体化用药细胞色素P450(CYP450)是广泛参与药物代谢的酶家族之一。
其中CYP2C9、CYP2C19和CYP2D6等亚型在药物代谢中起着重要的作用。
多个研究表明,针对这些基因的多态性变异可以影响药物在体内的代谢速率、药物作用强度和副作用发生风险。
3.2 TPMT基因在个体化用药中的应用噻嗪硫尿嘧啶甲基转移酶(TPMT)是一种参与硫酸盐类药物代谢的酶。
TPMT基因存在多个常见变异位点,其中rs1142345 (Arg240His) 和rs1800460 (Ala154Thr) 最为常见。

CYP2C19基因多态性与氯吡格雷疗效作者:赵丽艳付青姐来源:《中国保健营养·中旬刊》2013年第11期【摘要】氯吡格雷是目前临床预防和治疗ACS等心血管疾病血栓事件的双联抗血小板治疗的首选药物之一,它需经过CYP450酶代谢成活性产物来发挥其抗血小板作用,而其中CYP2C19基因多态性是影响氯吡格雷临床疗效的重要因素,本文综述了这一领域的最新进展,以期为临床评估氯吡格雷的个体化用药提供帮助。
【关键词】氯吡格雷;细胞色素氧化酶;CYP2C19;基因多态性;急性冠状动脉综合征【中图分类号】R968 【文献标识码】A 【文章编号】1004—7484(2013)11—0130—02急性冠状动脉综合征(Acute Coronary Syndromes, ACS)是由于冠脉血管壁动脉粥样硬化的不稳定斑块破裂,引起血栓源性阻塞所致严重心肌缺血综合征,包括不稳定型心绞痛(unstable angina pectoris, UAP)、急性非ST段抬高性心肌梗死(NSTEMI)和急性ST段抬高性心肌梗死(STEMI)等一系列进展性临床急症。
ACS因其发病急、病情变化快及死亡率高,已成为人类健康和生存的严重威胁。
本文综述了这一领域的最新进展,以期为临床评估氯吡格雷的个体化用药提供帮助。
1 细胞色素P450酶与CYP2C19细胞色素P450酶(Cytochrome P450,简称CYP450),是一类以还原态与CO结合后在波长450nm处有吸收峰的含血红素的单链蛋白质。
CYP450是含有亚铁血红素的单加氧酶,属于细胞色素B族,为相对分子质量在46kDa~60kDa的一族蛋白质。
目前,在人体内已发现CYP450的1、2、3、4、5、7、8、11、17、19、20、21、24、26、27、39、46、51等共18个家族、42个亚族,超过200多种同工酶,其中与药物代谢相关的,主要是CYP1、2、3家族中的1A、2A、2B、2C、2D、2E、3A,共 7个亚型。

细胞色素p450分类细胞色素P450是存在于细胞内的一类酶,它在生物体内起着重要的代谢作用。
本文将从分类的角度介绍细胞色素P450的主要类型。
一、分类概述细胞色素P450根据它们在基因序列和氨基酸序列上的差异进行分类。
根据这些差异,细胞色素P450被分为CYP1、CYP2、CYP3等家族。
其中,CYP3家族是最大的一个家族,包含了多个亚家族。
二、CYP1家族CYP1家族是细胞色素P450家族中的第一个发现的家族,它在肝脏中的表达量较低。
CYP1家族的主要功能是代谢外源性化合物,如药物、致癌物等。
在药物代谢中,CYP1家族酶能够将药物转化为更容易排出体外的代谢产物,起到解毒作用。
此外,CYP1家族酶还参与了一些内源性化合物的代谢,如雌激素和维生素D。
三、CYP2家族CYP2家族是细胞色素P450家族中最大的一个家族,它在肝脏中的表达量较高。
CYP2家族酶的代谢功能非常广泛,参与了许多内源性和外源性化合物的代谢。
在药物代谢中,CYP2家族酶是最重要的代谢酶之一,约占药物代谢的70%以上。
CYP2家族酶的代谢能力和个体差异较大,这也是药物在不同个体中作用差异较大的原因之一。
四、CYP3家族CYP3家族是细胞色素P450家族中最大的一个亚家族,它在肝脏中的表达量非常高。
CYP3家族酶参与了大量药物的代谢,尤其是一些临床常用的药物。
CYP3家族酶的代谢能力较强,能够将大部分药物转化为更容易排出体外的代谢产物。
因此,CYP3家族酶在药物治疗中的作用非常重要。
五、其他家族除了CYP1、CYP2、CYP3家族外,细胞色素P450还有其他一些家族,如CYP4、CYP7等家族。
这些家族的功能和代谢作用相对较少研究,但也在一些特定的代谢过程中发挥着重要的作用。
六、结语细胞色素P450是一类重要的代谢酶,它在生物体内起着重要的代谢作用。
根据基因序列和氨基酸序列的差异,细胞色素P450被分为CYP1、CYP2、CYP3等家族。


细胞色素P450酶与癌症治疗的生物学基础和应用细胞色素P450酶(cytochrome P450,简称CYP)是一类关键性酶,它们主要存在于肝脏和肠道上皮等组织,负责药物代谢和身体内许多生物化合物的代谢转化。
然而,近年来发现了许多CYP在某些形式的癌症中的异常表达和活性增强,这种情况在某些致癌物暴露的人群中特别明显。
因此,CYP在癌症发生和治疗中的作用引起了广泛的研究兴趣。
CYP在癌症中的异常表达CYP是一类酶系,包括数十种亚型,每种亚型具有不同的底物特异性和代谢路径。
在正常情况下,细胞内CYP被维持在适当的表达水平和活性,以支持正常的生物代谢过程。
然而,在癌症细胞中,CYP的表达水平和活性可能发生变化,导致它们在药物代谢和毒性处理中的作用异常。
一些CYP亚型在肿瘤中经常出现异常表达。
例如,CYP1A1和CYP1B1在多种癌症中表达异常,包括子宫内膜癌、卵巢癌、乳腺癌、肺癌和黑色素瘤等。
CYP3A4在肝癌和结肠癌等多种癌症中表达上调。
CYP2E1在肝癌和乳腺癌中表达异常增强。
这些异常表达可能是许多癌症的成因之一。
CYP在肿瘤药物代谢中的作用化疗是癌症治疗的重要手段之一,目前常用的肿瘤化疗药物分为不同的类别,如DNA碱基拓扑异构酶抑制剂、鸟嘌呤合成酶抑制剂、微管蛋白抑制剂和多肽酶抑制剂等。
然而,这些治疗药物往往存在代谢失调的问题,因为它们不仅被癌症细胞代谢,还被正常细胞代谢。
CYP作为肝脏代谢其他物质的主要酶系,也被认为是体内某些化疗药物的主要代谢途径。
因此,肝脏中CYP的异常表达和活性增强会显著影响化疗药物的代谢,从而导致药物的疗效和毒副作用发生变化。
以肝癌药物索拉非尼为例,它是一种口服多靶点酪氨酸激酶抑制剂。
据报道,肝癌患者中CYP3A的表达水平与索拉非尼治疗的性能相关。
索拉非尼主要经CYP3A代谢,而CYP3A表达水平的提高会加快其代谢,从而降低血浆中药物浓度。
此时,降低药物浓度会导致索拉非尼的治疗效果下降。

cyp基因的分类与功能
CYP基因是指编码细胞色素P450酶的基因家族。
细胞色素P450酶是一类重要的酶,参与许多生物化学反应,包括药物代谢、激素合成、脂肪代谢等。
CYP基因可以根据DNA序列的相似性和功能进行分类。
CYP基因家族在人类中有多个亚家族,其中最重要的是CYP1、CYP2、CYP3、CYP4、CYP7和CYP19家族。
每个亚家族又包含多个基因成员,如CYP1A1、CYP1A2、CYP2C9、CYP2D6等。
不同的CYP基因在机体中具有不同的功能和表达模式。
它们参与药物的代谢和解毒过程,可以将外源化合物转化为更容易排泄的代谢产物。
此外,CYP基因也参与内源性物质(如激素和脂肪酸)的合成和代谢调节。
不同的CYP基因在不同组织和器官中的表达水平也有差异,这使得个体对于药物的反应和药物代谢能力存在个体差异。
需要注意的是,CYP基因的多态性(即基因的变异)对个体的药物反应和代谢能力也产生影响。
某些CYP基因的变异可以导致酶活性降低或消失,从而影响药物的代谢速率。
这些个体差异可能导致药物的疗效和安全性出现变异,因此在临床医学中,对于某些药物的使用剂量需要根据患者的基因型进行个体化调整,以达到最佳的治疗效果。
总结而言,CYP基因是编码细胞色素P450酶的基因家族,参与药物代谢、激素合成和脂肪代谢等多种生物化学反应。
不同的CYP基因具有不同的功能和表达模式,在个体间存在差异,这些差异可能对药物的疗效和安全性产生影响。
因此,在临床应用中需要考虑个体的
基因型,以便进行个体化的药物治疗。
1.1细胞色素P450研究进展1.1.1细胞色素P450细胞色素P450(cytochrome P450或CYP,简称P450)是一个古老的以血红素为辅基的B族细胞色素蛋白酶基因超家族,广泛存在于细菌、真菌、植物以及动物等各种生物体内[1],通常与质体、线粒体、内质网、高尔基体等细胞器膜结合。
还原态P450与CO结合后在450nm处能检测到最大吸收峰,故命名为P450。
因其能使疏水性分子插入一个氧原子而变得更具有亲水性或者活性,因此又称之为单加氧酶(mixed-function oxidase,简称MFO)[2]。
P450酶系作为自然界中生物催化剂,它所催化的反应类型多样,最典型的反应是把分子氧还原为水的同时,将其中一个氧原子转移至底物形成产物,催化反应为[3]:RH+O2+NADPH+H+ROH+H2O+NADP+1958年,在大鼠肝微粒体中第一次发现P450。
D.S Frear于1969年首次在棉花(Gossypium hirsutum L.)中发现了它的存在[4]。
此后,大量的研究表明在拟南芥(Arabidopsis thaliana L.)[5]、小麦(Triticum aestivum L.)[6]、苜蓿(Medicago sativa L.)[7]、蓖麻(Ricinus communis L.)[8]等许多植物中也均有P450存在。
P450酶系在植物中参与多种代谢反应,发挥重要的催化作用。
[1]Omura T(1999).Forty years of cytochrome P450.Biochem BiophysRes Commun,266(3):690~698.[2]Nelson D R,Kaymans L,Kamataki T,et al.P450superfamily:updateon new sequence,gene mapping,accession numbers andnomenclature[J].Pharmacogenetics,1996,6:1-42.[3]Ortiz de Montellano PR.Cytochrome P450:structure,mechanism,and biochemistry[M],3rd ed.Kluwer Academic/Plenum Press,New York,2005,183-245.[4]Frear DS,Swanson HR,Tanaka FS.N-Demethylation of substituted3-(phenyl)-1-methylureas:isolation and characterization of a microsomal mixed function oxidase from cotton.Phytochemistry, 1969,8(11):2157–2169.[5]Paquette SM,Bak S,Feyereisen R.Intron-exon organization andphylogeny in a large superfamily,the paralogous cytochrome P450 genes of Arabidopsis thaliana.DNA Cell Biol,2000,19(5): 307–317.[6]Murphy PJ,West CA.The role of mixed function oxidases in kaurenemetabolism in Echinocystis macrocarpa Greene endosperm.Arch Biochem Biophys,1969,133(2):395–407.[7]Li LY,Cheng H,Gai JY,Yu DY.Genome-wide identifycation andcharacterization of putative cytochrome P450genes in the model legume Medicago truncatula.Planta,2007,226(1):109–123. [8]Lew FL,West CA.(-)-kaur-16-en-7β-ol-19-oic acid,an intermediatein gibberellin biosynthesis.Phytochemistry,1971,10(9): 2065–2076.1.1.2细胞色素P450结构特征在细胞色素P450超基因家族中,不同成员之间在氨基酸序列上具有高度的变异性,但其空间结构上却保持较高的相似性,P450蛋白三级结构主要由C端的α-螺旋结构和N端的β-折叠结构组成[1,2]。
血小板功能检测在抗血小板治疗中的应用朱青贤【摘要】双联抗血小板治疗可显著改善急性冠状动脉综合征患者的预后,但在治疗过程中,仍有一定比例的患者发生血栓或者出血事件.这些个体化差异,提醒在临床工作中有必要进行血小板功能检测,用于评估患者对抗血小板药物的反应性,以进一步指导治疗方案的调整.现有的血小板聚集功能检测方法多种多样,需要从中选择适合可在临床推广应用的检测方法.本文对目前临床使用的血小板功能的检测方法做一简单介绍,并简要分析其检测结果对临床抗血小板治疗个体化的指导意义.【期刊名称】《医学理论与实践》【年(卷),期】2018(031)012【总页数】3页(P1747-1749)【关键词】血小板功能检测方法;个体化差异治疗;检测方法选择【作者】朱青贤【作者单位】湖北省襄阳市襄州区人民医院 441100【正文语种】中文【中图分类】R446.11抗血小板治疗急性冠状动脉综合征(ACS)疾病和经皮冠状动脉介入治疗(PCI)术后预防血栓事件的治疗中扮演着关键的角色,尤其阿司匹林联合ADP受体(P2Y12)抑制剂(如氯吡格雷等)在临床广泛应用。
然而不同个体对抗血小板药物表现出个体化多样性差异,这些差异与再发血栓或出血等不良事件的发生显著相关。
基于血小板功能检测指导下的个体化抗血小板治疗在临床上已经被应用,近年来大量的临床研究也得出了循证医学的证据。
另外,2011年《美国心脏病学会基金会(ACCF)/美国心脏协会(AHA)/美国心血管造影和介入治疗学会(SCAI)PCI指南》也对其适应证给出了具体的指导意见。
血小板功能检测可以了解个体对抗血小板药物的反应性,帮助临床制定抗血小板治疗策略,提高治疗的疗效和安全性。
由于血小板功能检测方法众多且标准不一,目前国内还没有专门的指南(共识)来规范血小板功能检测,且临床医生和实验室人员对血小板功能检测的认识参差不齐,结合实际情况,共同探讨血小板功能检测在抗血小板治疗中的应用及个体化差异治疗方案。
・444・氯吡格雷抵抗研究新进展王佳旺综述刘凡审校【关键词】氯吡格雷抵抗;基因多态性;细胞色素氯吡格雷是新型抗血小板药物,通过阻断血小板腺苷二磷酸(adenosinediphosphate,ADP)受体途径抑制血小板聚集,可减少急性冠状动脉综合征(acutecoronarysyndrome,ACS)和经皮冠状动脉介入术(percutaneouscoronaryinterventions,PCi)患者的心血管事件。
但在临床中发现,一些应用氯吡格雷的患者在用药后未能阻止血小板的聚集,发生氯吡格雷抵抗现象。
氯吡格雷抵抗是近年临床与基础研究的热点,涉及基因多态性、酶活性、药物间的相互作用、相关疾病影响以及患者自身的特性等多个因素。
复习近年国内外文献,对氯吡格雷抵抗有关研究进行综述。
一、氯吡格雷药代动力学氯吡格雷(elopidogrel)是一种新型噻吩吡啶类衍生物,本身无药效作用,口服后经肠道吸收受到P2糖蛋白(P2glycoprotein,P2GP)的调控,即由多药耐药基因(multi-drugresistancegene1,MDRl)编码的一种转运蛋白,85%被酯酶水解为无活性的羧酸诱导剂,其余-11,部分被细胞色素P450(CYP)单加氧酶系转换为有活性的巯基化合物。
氯吡格雷的活化需要两步完成,第一步主要由CYP2C19(约45%)、CYPIA2(约36%)、CYP2116(约19%)等基因编码的CYP450酶系介导,第二步主要由CYP3A4(约40%)、CYP286(约33%)、CYP2C19(约20%)、CYP2C9(约7%)等基因编码的CYP450酶系介导…,从而产生有活性的物质不可逆的与血小板膜表面的ADP受体(P2Y12)结合,使与此受体相偶联的血小板膜糖蛋白Ⅱh/Ⅲa(GPIIb/Ⅲa)受体的纤维蛋白原结合点不能暴露,导致血小板不能进一步相互聚集,从而起到抗血小板聚集作用胆,。
二、氯吡格雷临床应用目前,阿司匹林和氯吡格雷联合应用已是治疗ACS的常规治疗方法,在降低心血管事件再发及改善远期预后方面起到重要作用。