2023届高三化学高考备考二轮复习专题三 氧化还原反应 离子反应课件
- 格式:pptx
- 大小:7.97 MB
- 文档页数:99

专题能力训练三 氧化还原反应 离子反应
(时间:45分钟 满分:100分)
一、选择题(共7小题,每小题6分,共42分。每小题只有1个选项符合题意)
1.(2020黑龙江哈三中期末)下列各组离子能在指定溶液中大量共存的是( )
①无色溶液中:K+、Cl-、N、Al、S
②常温下,pH=14的溶液中:C、Na+、S2-、Al
③室温下水电离的c(H+)=10-13 mol·L-1的溶液:K+、HC、Br-、Ba2+
④加入Mg能放出H2的溶液中:N、Cl-、Na+、S
⑤使甲基橙变红的溶液中:Mn、N、Na+、Fe3+
⑥室温下=1012的溶液中:Fe2+、Al3+、N、I-
A.①③⑥ B.①②⑤
C.②④⑤ D.①③④
2.(2020福建泉州一月质检)下列反应的离子方程式正确的是( )
A.往NaAlO2溶液中通入过量CO2:2Al+CO2+3H2O2Al(OH)3↓+C
B.Na2SiO3溶液与稀醋酸混合:Si+2H+H2SiO3↓
C.钠与CuSO4溶液反应:2Na+Cu2+Cu+2Na+
D.往Na2SO3溶液中滴加双氧水:H2O2+SS+H2O
3.(2020安徽黄山一模)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变黄的溶液中:Na+、K+、S、Al3+
B.pH=2的溶液中:Na+、ClO-、N、S
C.某透明澄清的溶液中:N、Cu2+、N、Cl-
D.0.1 mol·L-1 NaHCO3溶液中:K+、Ba2+、OH-、Cl-
4.(2020河南焦作一模)某溶液中可能含有H+、Na+、N、Mg2+、Fe3+、Al3+、S、C等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示,下列说法中正确的是(
)
A.原溶液中含有的阳离子是H+、N、Mg2+、Al3+
B.原溶液中一定含有S和Na+

专题03 离子反应
考点热度
★★★★★
【化学素养要求】
【考纲导向】
1.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
2.了解电解质的概念,了解强电解质与弱电解质的概念。
3.理解电解质在水中的电离以及电解质溶液的导电性。
4.能正确书写离子方程式,或结合具体反应对所给离子方程式进行正误判断。
【命题分析】
离子方程式的书写及正误判断、溶液中的离子共存是每年高考的热点,高考再现率为100%。在高考试题中,大多以选择题形式呈现,但增加了限制条件和隐含条件,基本每一个选项都会有干扰,并且加大氧化还原反应的考察。选择题常以离子方程式正误判断的形式呈现,非选择题常与氧化还原反应理论、化学工艺流程、实验滴定(沉淀滴定、氧化还原滴定)相结合,书写相关反应的离子方程式。氧化还原型离子方程式的书写是近几年全国卷命题的热点内容。离子共存类选择题主要为限定条件下离子能否大量共存的判断。
离子推断类试题Ⅰ卷、Ⅱ卷均有考查,主要利用离子的特征反应,通过定性、定量分析,确定离子存在情况,进而推断物质。
核心考点一 离子方程式的书写与正误判断
离子方程式中物质的拆分原则
(1)强酸、强碱和可溶性盐写成离子形式。
(2)弱酸、弱碱、难溶盐、单质、氧化物、气体用化学式表示。
(3)多元弱酸的酸式盐的酸根离子(如HCO-3、HSO-3等)在离子方程式中不能拆开写,多元强酸的酸式盐的酸根离子(如HSO-4)在离子方程式中拆开写。
(4)微溶物的处理情况:
①当反应物是微溶物的澄清稀溶液时(如澄清石灰水),微溶物应写成离子形式。 ②当反应物是微溶物的浊液或固态时(如石灰乳),微溶物应写化学式。
③生成物中的微溶物按难溶物处理,应写化学式。
(5)固体之间的反应(如消石灰与NH4Cl),固体与特定溶液(如Cu与浓硫酸)的反应不能用离子方程式表示。
离子方程式正误判断要注意4个两
【核心考法】

专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应高考调研
明晰考向专题三离子反应核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写
物质K
a1K
a2
H
2SO
3
H
2CO
31.3×10-26.3×10-8
4.2×10-75.6×10-11核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写核心整合
热点突破考点一离子方程式书写
注意反应环境
注意操作顺序审清题意
注意反应物之间量的关系
易溶强电解质拆,弱电解质、难溶物不拆
微溶物清拆浊不拆化学式
拆写单质、氧化物不拆
浓硫酸不拆,浓盐酸、浓硝酸拆
分析量不同时的产物
分析是否漏掉同步反应
分析变价元素的产物
原子是否守恒反应产物
方程式三
守恒电荷是否守恒
电子转移是否守恒核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点二离子共存核心整合
热点突破考点三离子检验核心整合
热点突破考点三离子检验核心整合
热点突破考点三离子检验核心整合
热点突破考点三离子检验核心整合
热点突破考点三离子检验核心整合
热点突破考点三离子检验核心整合
热点突破考点三离子检验课堂练习
规范解答专题三离子反应课堂练习
规范解答专题三离子反应课堂练习
规范解答专题三离子反应课堂练习
规范解答专题三离子反应

高考化学二轮专题复习
1 专题三 氧化还原反应 离子反应
一、选择题(本题包括7小题,每小题6分,共42分)
1.(2018陕西汉中一检)含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6ClF3 6CoF3+3Cl2+4X。下列有关该反应的说法正确的是( )
A.X是还原产物
B.ClF3中氯元素为-3价
C.反应生成3 mol Cl2时转移18 mol电子
D.Co3O4在反应中作氧化剂
2.(2018北京朝阳二模)下列变化中,未涉及电子转移的是( )
A.H2C2O4使酸性KMnO4溶液褪色
B.C2H5OH使酸性K2Cr2O7溶液变绿
C.CO2使苯酚钠溶液变浑浊
D.H2O2使酸化的KI溶液变黄
3.下列离子方程式不正确...的是( )
A.澄清石灰水中通入过量的二氧化碳:CO2+OH- HCO3-
B.金属钠和水反应:2Na+2H2O 2Na++2OH-+H2↑
C.酸性氯化亚铁溶液中加入双氧水:2Fe2++H2O2 2Fe3++O2↑+2H+
D.三氧化硫与氯化钡溶液生成沉淀的反应:SO3+Ba2++H2O BaSO4↓+2H+
4.(2017江苏单科,9)常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B.𝑐(H+)𝑐(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
C.c(Fe2+)=1 mol·L-1的溶液中:K+、NH4+、MnO4-、SO42-
D.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
5.(2018河南濮阳三模)大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法正确的是( ) 高考化学二轮专题复习
2
A.丙烯发生氧化反应生成甲醛和乙醛
B.生成O3的反应属于氧化还原反应
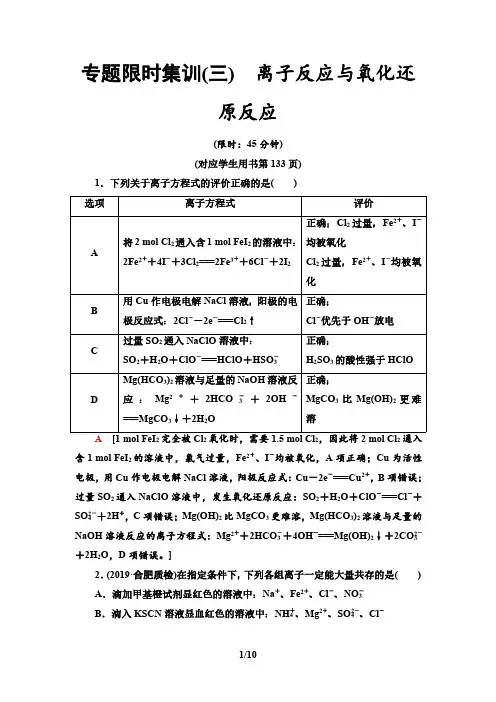
专题限时集训(三)离子反应与氧化还
原反应
(限时:45分钟)
(对应学生用书第133页)
1.下列关于离子方程式的评价正确的是()选项离子方程式评价
A将2molCl2通入含1molFeI
2的溶液中:
2Fe2++4I-+3Cl2===2Fe3++6Cl-+2I2正确;Cl2过量,Fe2+、I-
均被氧化
Cl
2过量,Fe2+、I-均被氧
化
B用Cu作电极电解NaCl溶液,阳极的电
极反应式:2Cl--2e-===Cl
2↑正确;
Cl-优先于OH-放电
C过量SO2通入NaClO溶液中:
SO
2+H
2O+ClO-===HClO+HSO-3正确;
H
2SO
3的酸性强于HClO
DMg(HCO
3)
2溶液与足量的NaOH溶液反
应:Mg2++2HCO-3+2OH-
===MgCO
3↓+2H
2O正确;
MgCO
3比Mg(OH)
2更难
溶
A[1molFeI
2完全被Cl
2氧化时,需要1.5molCl
2,因此将2molCl
2通入
含1molFeI2的溶液中,氯气过量,Fe2+、I-均被氧化,A项正确;Cu为活性
电极,用Cu作电极电解NaCl溶液,阳极反应式:Cu-2e-===Cu2+,B项错误;
过量SO2通入NaClO溶液中,发生氧化还原反应:SO
2+H
2O+ClO-===Cl-+
SO2-4+2H+,C项错误;Mg(OH)2比MgCO
3更难溶,Mg(HCO
3)
2溶液与足量的
NaOH溶液反应的离子方程式:Mg2++2HCO-3+4OH-===Mg(OH)
2↓+2CO2-3
+2H2O,D项错误。]
2.(2019·合肥质检)在指定条件下,下列各组离子一定能大量共存的是()
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO-3
B.滴入KSCN溶液显血红色的溶液中:NH+4、Mg2+、SO2-4、Cl-

2020年高考化学二轮专题复习3:离子反应和氧化还原反应(附解析)
考纲指导
1.了解离子反应的概念及离子反应发生的条件。
2.掌握常见离子的检验方法。
3.能正确书写离子方程式,并能进行有关计算。
4.了解氧化还原反应的本质,了解常见的氧化还原反应。
5.掌握常见氧化还原反应方程式的配平和相关计算。
Ⅰ.客观题
(1)考查限定条件的离子能否大量共存的判断、离子方程式的正误判断。
(2)考查通过实验操作、离子检验,推断电解质溶液中存在的离子。
(3)考查氧化还原反应的概念辨析及氧化性、还原性的强弱比较。
(4)结合阿伏加德罗常数考查电子转移数目的计算。
Ⅱ.主观题
(1)结合无机化工流程及实验考查离子方程式的书写。
(2)考查离子检验方法和操作步骤的描述。
(3)通常以典型物质或工业生产流程为载体,考查氧化还原反应方程式的配平,以及运用守恒规律的应用。
知识梳理
一、电解质及其电离
1.电解质和非电解质 (1)电解质是在水溶液中或熔融状态下能够导电的化合物。
(2)非电解质是在水溶液中和熔融状态下都不能导电的化合物。
2.强电解质和弱电解质
在水溶液中完全电离的电解质叫强电解质。在水溶液中部分电离的电解质叫弱电解质。
3.记忆常见强弱电解质
强电解质:强酸、强碱、大多数的盐;弱电解质:弱酸、弱碱、水、少数盐
强酸:HCl、HI、HClO4、H2SO4、HNO3等; 弱酸:H2CO3、CH3COOH、HF、HClO等。
强碱:NaOH、KOH、Ba(OH)2等; 弱碱:NH3·H2O、Fe(OH)3、Cu(OH)2、Al(OH)3等。
绝大多数盐:BaSO4、CaCO3、BaCl2等; 少部分盐:(CH3COO)2Pb等。
二、离子反应
1.概念:有离子参加或有离子生成的反应统称为离子反应。
2.离子反应的条件:①生成难溶的物质;②生成难电离的物质;③生成易挥发的物质;④发生氧化还原反应。