巨噬细胞与癌症
- 格式:doc
- 大小:37.00 KB
- 文档页数:3

细胞自噬与癌症治疗细胞自噬是一种细胞内的重要代谢过程,通过将细胞内部的有害物质进行降解和回收再利用,起到维持细胞稳态和抵抗环境应激的作用。
然而,当细胞自噬功能失调时,会导致多种疾病的发生,包括癌症。
近年来的研究表明,细胞自噬在癌症治疗中具有重要的潜力和应用前景。
本文将就细胞自噬与癌症治疗的关系展开论述。
一、细胞自噬与癌症的关系细胞自噬在正常细胞中起到维持细胞内稳态的作用,通过清除受损蛋白和细胞器,维持正常细胞功能的完整性。
然而,在癌细胞中,细胞自噬的功能常常发生异常改变。
研究显示,某些癌细胞的自噬功能过度活跃,导致细胞的早期凋亡失调和抗癌药物耐药性的产生。
另一方面,部分癌细胞则失去了自噬的功能,导致细胞内的有害物质无法及时清除而滋养癌细胞的生长和扩散。
因此,细胞自噬与癌症的发生和发展密切相关。
二、细胞自噬在癌症治疗中的应用潜力近年来,科学家们对细胞自噬与癌症治疗的关系进行了广泛的研究,并发现细胞自噬在癌症治疗中具有重要的潜力。
一方面,调节细胞自噬的活性可以增强化疗药物对癌细胞的杀伤效果。
通过抑制过度活跃的细胞自噬,可以促进癌细胞的凋亡,并增强化疗药物的疗效。
另一方面,激活自噬过程可以降低癌细胞对外界环境的依赖性,从而减少其生长和扩散的能力。
因此,在癌症治疗中利用细胞自噬的调控机制,可以开发新的治疗策略和药物靶点。
三、细胞自噬调控的癌症治疗策略针对细胞自噬与癌症治疗的关系,科学家们提出了多种治疗策略和药物靶点。
一种常用的策略是通过抑制过度活跃的自噬过程来提高化疗药物的疗效。
例如,通过针对细胞自噬的关键酶类蛋白进行抑制,如ATG5、ATG7等,可以降低癌细胞对化疗药物的耐药性,增加其灭活作用。
另一种策略是激活细胞自噬来减缓癌细胞的生长和扩散能力。
通过针对自噬相关的信号通路和蛋白进行激活,如mTOR、AMPK等,可以抑制癌细胞的代谢活性,达到治疗的效果。
四、细胞自噬与免疫治疗的结合除了化疗药物的应用,细胞自噬还可以与免疫治疗相结合,共同发挥抗癌作用。
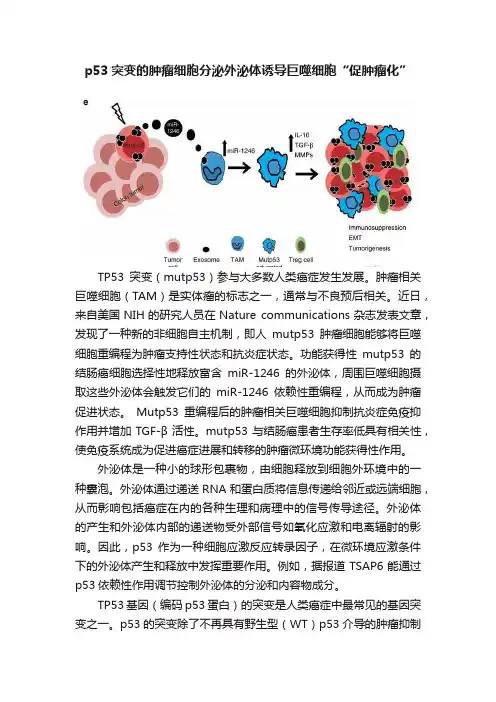
p53突变的肿瘤细胞分泌外泌体诱导巨噬细胞“促肿瘤化”TP53突变(mutp53)参与大多数人类癌症发生发展。
肿瘤相关巨噬细胞(TAM)是实体瘤的标志之一,通常与不良预后相关。
近日,来自美国NIH的研究人员在Nature communications杂志发表文章,发现了一种新的非细胞自主机制,即人mutp53肿瘤细胞能够将巨噬细胞重编程为肿瘤支持性状态和抗炎症状态。
功能获得性mutp53的结肠癌细胞选择性地释放富含miR-1246的外泌体,周围巨噬细胞摄取这些外泌体会触发它们的miR-1246依赖性重编程,从而成为肿瘤促进状态。
Mutp53重编程后的肿瘤相关巨噬细胞抑制抗炎症免疫抑作用并增加TGF-β活性。
mutp53与结肠癌患者生存率低具有相关性,使免疫系统成为促进癌症进展和转移的肿瘤微环境功能获得性作用。
外泌体是一种小的球形包裹物,由细胞释放到细胞外环境中的一种囊泡。
外泌体通过递送RNA和蛋白质将信息传递给邻近或远端细胞,从而影响包括癌症在内的各种生理和病理中的信号传导途径。
外泌体的产生和外泌体内部的递送物受外部信号如氧化应激和电离辐射的影响。
因此,p53作为一种细胞应激反应转录因子,在微环境应激条件下的外泌体产生和释放中发挥重要作用。
例如,据报道TSAP6能通过p53依赖性作用调节控制外泌体的分泌和内容物成分。
TP53基因(编码p53蛋白)的突变是人类癌症中最常见的基因突变之一。
p53的突变除了不再具有野生型(WT)p53介导的肿瘤抑制作用之外,这种错义突变还会具有功能获得性(gain-of-function )的新型活性的突变型p53(mutp53)蛋白。
这种功能获得性活性主要通过它们与其他细胞蛋白质的相互作用以及癌细胞转录程序的调控而显著改变肿瘤细胞特征。
在细胞水平上,mutp53蛋白稳定性的增加导致癌细胞中大量细胞内mutp53蓄积,进一步破坏细胞内稳态并产生致癌应激。
因此,癌细胞能够维持着高水平的mutp53蛋白水平以保证其生存和致癌性。

免疫组化巨噬细胞浸润评分【免疫组化:探索巨噬细胞浸润评分】引言:免疫组化是一种在组织切片中检测特定蛋白质表达的方法,通过使用抗体来特异性地标记目标蛋白质,从而揭示细胞类型、状态以及相互作用的信息。
巨噬细胞是免疫系统中非常重要的免疫细胞,其浸润程度与肿瘤的预后密切相关。
本文将深入探讨免疫组化中的巨噬细胞浸润评分,在理论和实践中为读者提供全面的了解。
一、免疫组化简介:免疫组化是通过利用抗原-抗体反应来检测组织切片中目标分子的存在和分布。
它可以精确地检测细胞内和细胞外的蛋白质表达情况,并通过染色的强弱来定量目标蛋白的表达水平。
免疫组化广泛应用于医学研究中,特别是癌症领域,它可以揭示肿瘤微环境中不同细胞类型的分布和相互作用。
二、巨噬细胞的重要性:巨噬细胞是免疫系统中的关键成员,具有吞噬、抗原递呈和分泌炎症因子等功能。
研究发现,巨噬细胞在肿瘤的发生、发展和治疗中起着重要作用。
巨噬细胞的浸润程度被认为是肿瘤预后的一个重要指标,高浸润程度通常与较好的预后相关。
三、巨噬细胞浸润评分的建立:巨噬细胞浸润评分是通过对免疫组化染色结果进行定量分析,来反映巨噬细胞在肿瘤组织中的分布和数量。
它通常从以下方面进行评估:1. 巨噬细胞的定位:巨噬细胞主要分布在肿瘤组织的边缘区域,特别是炎症灶附近。
通过标记CD68等巨噬细胞特异性表面抗原,可以明确巨噬细胞的位置。
2. 巨噬细胞的密度:通过计算巨噬细胞的数量和肿瘤组织的面积,可以得到巨噬细胞的密度。
高密度的巨噬细胞浸润通常与较好的预后相关。
3. 巨噬细胞的活性:巨噬细胞的活性可以通过免疫组化标记M2型巨噬细胞的特异性标记物来评估。
M2型巨噬细胞通常与肿瘤的恶性程度和预后相关。
四、巨噬细胞浸润评分的应用:巨噬细胞浸润评分可以在临床研究和诊断中提供宝贵的信息。
通过对肿瘤组织标本进行免疫组化染色,并根据巨噬细胞定位、密度和活性进行评分,可以预测患者的预后和对治疗的反应。
巨噬细胞浸润评分还可以用于评估新药的疗效和机制研究。

肿瘤相关巨噬细胞代谢重编程-概述说明以及解释1.引言1.1 概述概述:肿瘤相关巨噬细胞代谢重编程是肿瘤微环境中一个备受关注的研究领域。
巨噬细胞是一类重要的免疫细胞,在肿瘤微环境中扮演着重要的角色。
随着研究的深入,科学家们发现肿瘤相关巨噬细胞在代谢上具有明显的特点,与正常巨噬细胞有所不同。
这种代谢重编程不仅影响着巨噬细胞自身的功能和活性,还对肿瘤微环境的形成和发展产生重要影响。
因此,深入了解肿瘤相关巨噬细胞的代谢特点和调控机制,对于揭示肿瘤发生、发展的机制,并寻找新的肿瘤治疗策略具有重要意义。
本文将对肿瘤相关巨噬细胞代谢重编程的相关内容进行介绍和讨论。
1.2 文章结构文章结构部分的内容包括了对整篇文章的框架和组织方式进行介绍。
在这一部分,我们将会详细讨论本文的整体结构,包括各个章节的内容和重点,以及它们之间的逻辑关系。
具体来说,我们将会首先介绍文章的第一部分——引言部分,包括概述、文章结构和目的,旨在引导读者对本文的主题有一个整体的了解。
然后会进入第二部分——正文部分,分别对肿瘤相关巨噬细胞的代谢特点、在肿瘤微环境中的作用以及代谢重编程的调控机制进行详细的阐述。
最后,我们会在结论部分总结本文的主要内容,并探讨其对肿瘤治疗的意义以及未来研究的展望。
通过本文的结构,读者可以清晰地了解到本文的逻辑脉络和重点内容,以便更好地把握文章的主题和思路。
1.3 目的在本文中,我们的主要目的是探讨肿瘤相关巨噬细胞的代谢重编程,以及其在肿瘤微环境中的作用。
我们将深入分析巨噬细胞代谢特点,并探讨肿瘤相关巨噬细胞代谢重编程的调控机制。
通过对这些内容的深入了解,我们旨在为肿瘤治疗和未来研究提供新的理论基础和思路。
我们希望通过本文的研究,促进对肿瘤治疗的深入理解,并为未来的治疗方法和策略提出有益的建议和展望。
2.正文2.1 肿瘤相关巨噬细胞的代谢特点肿瘤相关巨噬细胞的代谢特点是指在肿瘤微环境中,巨噬细胞的代谢活动发生了明显的改变。

中性粒细胞胞外诱捕网通过诱导巨噬细胞M2型极化促进非小细胞肺癌增殖和侵袭①苏莹 马丽丽 柳江 韩忠诚 (新疆维吾尔自治区人民医院肿瘤科,乌鲁木齐830000)中图分类号 R734.2 文献标志码 A 文章编号 1000-484X (2023)03-0472-06[摘要] 目的:探究中性粒细胞胞外诱捕网(NETs )诱导巨噬细胞极化在非小细胞肺癌(NSCLC )增殖和侵袭中的作用及其相关机制。
方法:采集28例NSCLC 患者肿瘤组织及其癌旁组织,通过免疫组化检测PAD4和Arg -1表达水平。
采用PMA/LPS 和PMA/IL -4极化THP -1细胞为M1和M2型巨噬细胞的过程中加入NETs 共孵育,qRT -PCR 检测巨噬细胞iNOS 、IL -6、TNF -α、Arg -1、IL -10和TGF -β表达水平。
将各组M2型巨噬细胞与A549细胞共孵育,CCK8检测A549细胞增殖变化,Transwell 检测细胞侵袭能力变化,qRT -PCR 和Western blot 检测细胞VEGF 表达水平变化。
结果:与癌旁组织比较,NSCLC 患者肿瘤组织PAD4和Arg -1表达水平升高。
在向M1型巨噬细胞极化过程中,加入NETs 后巨噬细胞iNOS 、IL -6、TNF -α表达水平降低,Arg -1、 IL -10、TGF -β表达水平升高。
在向M2型巨噬细胞极化过程中,加入NETs 后巨噬细胞Arg -1、IL -10、TGF -β表达水平升高。
与Control 组比较,M2组A549细胞增殖、侵袭能力和VEGF 表达水平升高。
与M2组比较,M2+NETs 组A549细胞增殖、侵袭能力和VEGF 表达水平升高。
结论:NETs 通过诱导巨噬细胞向M2型极化,促进NSCLC 增殖和侵袭。
[关键词] 非小细胞肺癌;中性粒细胞胞外诱捕网;巨噬细胞;M2型极化Neutrophil extracellular traps promote proliferation and invasion of NSCLC byinducing M2-type polarization of macrophagesSU Ying , MA Lili , LIU Jiang , HAN Zhongcheng. Department of Oncology , People's Hospital of Xinjiang Uygur Autonomous Region , Urumqi 830000, China[Abstract ] Objective :To investigate the role of neutrophil extracellular trap (NETs ) induced macrophage polarization in pro⁃liferation and invasion of non -small cell lung cancer (NSCLC ) and its related mechanisms. Methods :Tumor tissues and adjacent tis⁃sues of 28 NSCLC patients were collected and the expression levels of PAD4 and ARG -1 were detected by immunohistochemistry. The expression levels of iNOS , IL -6, TNF -α, ARG -1, IL -10 and TGF -β in macrophages were detected by qRT -PCR when PMA/LPS and PMA/IL -4-polarized THP -1 cells were incubated with NETs. M2 macrophages in each group were co -incubated with A549 cells. Prolife -ration of A549 cells were detected by CCK8, invasion ability of A549 cells were detected by Transwell , and expression level of VEGFwas detected by qRT -PCR and Western blot. Results :Compared with adjacent tissues , the expression levels of PAD4 and ARG -1 intumor tissues of NSCLC patients were increased. During the polarization to M1-type macrophages , the expression levels of iNOS , IL -6 and TNF -α in macrophages were decreased after co -incubation with NETs , while the expression levels of ARG -1, IL -10 and TGF -β were increased. During the polarization of M2-type macrophages , the expression levels of ARG -1, IL -10 and TGF -β in macrophages increased after co -incubation with NETs. Compared with Control group , the proliferation , invasion and VEGF expression levels of A549 cells in M2 group were increased. Compared with M2 group , proliferation , invasion and VEGF expression levels of A549 cells inM2+NETs group were increased. Conclusion :NETs promote proliferation and invasion of NSCLC by inducing macrophage polarization to M2 type.[Key words ] Non -small cell lung cancer ;Neutrophil extracellular trap ;Macrophage ;M2 type polarization世界卫生组织国际癌症研究机构(International Agency for Research on Cancer ,IARC )发布的2020年全球癌症数据显示,肺癌是目前威胁全球人类生命健康的第二大癌症[1]。

肝癌中肝Kupffer细胞的作用肝癌是一种对人类健康构成严重威胁的肿瘤疾病,因其发展快速且难以治愈,常常被称为“癌症之王”。
肝Kupffer细胞是肝脏中最常见的巨噬细胞,它们在肝癌发展中扮演着重要的作用。
本文将介绍肝Kupffer细胞的作用和相关的治疗手段,分析它们在肝癌治愈中的潜力。
一、Kupffer细胞的基本概述Kupffer细胞主要位于肝脏内窦壁和肝淋巴组织中,它们是一种主动的、有吞噬作用的巨噬细胞,具有清除体内病原体和异物等功能。
Kupffer细胞能够通过吞噬和分解血液中过多的细胞碎片和垃圾,在清除体内有害物质方面发挥了重要作用。
二、Kupffer细胞在肝癌中扮演的角色在肝癌发展过程中,Kupffer细胞可以发挥重要的抗癌作用。
Kupffer细胞能够分泌多种细胞因子如TNF-α、IL-1和IL-6等,这些细胞因子能够刺激免疫细胞的活性,从而发挥抗肿瘤的作用。
Kupffer细胞还能够通过与其他免疫细胞的相互作用,控制肝癌的发展。
在肝癌诱导期间,它们可以产生多种因子分子如MIP-2、CCL5和MCP-1,吸引其他免疫细胞的积极参与阻止肝癌细胞的扩散和增殖。
Kupffer细胞还可以识别并攻击病毒性感染细胞。
研究发现,在病毒感染的肝脏中,Kupffer细胞的数量会增加,从而带动免疫系统,抵抗病毒侵袭,从而降低肝癌几率。
三、Kupffer细胞和肝癌治疗针对Kupffer细胞在肝癌中重要的作用,人们发展了一系列利用Kupffer细胞治疗肝癌的策略。
比如,研究人员在实验室中体外培养Kupffer细胞,并注射到肝癌患者体内,发现能够明显地抑制肝癌的增殖和扩散。
此外,人们还尝试了利用Kupffer细胞作为细胞靶向治疗肝癌的手段。
例如,在人工实验中,研究人员成功制造了一种能够特异性地将Kupffer细胞标记的诊断靶向药物,可以提高治疗的精确性和效果,从而取得经济与社会效益的双重提升。
虽然Kupffer细胞在肝癌治疗中有重要作用,但考虑到Kupffer细胞的数量少、质量不足,尚不成熟的科技难度等问题,Kupffer细胞在治愈肝癌中的现实应用还需要进一步探究,异步协同才能达到最佳肝癌治疗效果。

桑黄因含有多糖类、锗等对身体健康有益的成分,所以可以称之为对抗癌症的英勇战士。
众所周知,要消灭侵入人体内的细菌,病毒,首先是白血球挺身而出对抗强敌,然后是淋巴细胞出来参战。
如果仍不见效,就轮到巨噬细胞出场了。
巨噬细胞能够破坏癌细胞的细胞膜,迅速消灭癌症。
桑黄所含的多糖体就可以迅速地唤醒巨噬细胞,促使它提前参战,进而消灭癌细胞。
巨噬细胞在人体免疫机构中发挥重要作用。
它能将细胞或异物吞噬,也可以直接杀死或损伤癌细胞。
为什么巨噬细胞具有这种功能呢?因为当病毒进入机体时,由巨噬细胞或淋巴球等与免疫机能有关的细胞会制作出一种叫干扰素的新物质,干扰素可直接损伤癌细胞,刺激免疫系统,或间接损伤癌细胞。
同时,它还可以改变体内癌细胞的生活环境,使癌细胞失去生存的土壤而无法存活。
因此,干扰素既具有提高免疫功能的作用,同时也具有强大的抗病毒作用和对癌细胞的抑制作用。
事实上,干扰素直接杀死癌细胞的功能较低,它的主要作用是刺激免疫系统,间接杀伤癌细胞及改变体内癌细胞的生活环境。
桑黄中含有的多糖体,可迅速唤醒巨噬细胞产生干扰素。
所以说,桑黄对癌症的治疗及预防都十分有效。
此外,癌症的复发也是一个很令人头痛的问题。
如前所述,如果自身的免疫力增强了,就可以抑制癌细胞的增殖。
因此,体内是否具有不宜癌细胞增长的环境十分重要。
单独服用以多糖类为代表的灵芝能提高免疫力,并足以产生不适合癌细胞繁殖的状态,从而降低癌症复发的几率。
此外,癌细胞的繁殖与复发也和患者的性格及精神面貌有关。
要防止癌症复发,还必须注意养成良好的日常生活习惯1、生活习惯一定要和自己的生理时钟一致。
2、生活的步调与规律应和家人一致,不要因自己有病而任意改变。
3、饮食要多样化,保持营养均衡充足。
4、多吃水果,蔬菜,豆制品,食物尽量以清淡为主。
5、经常参加适量的体能锻炼,但不要运动过多造成疲劳感,最好坚持多走路。
6、尽量寻找生活中有趣的事物,保持心情开朗。
7、和医生积极配合,不要讳疾忌医,要有战胜疾病的信心和勇气。

巨噬细胞在炎症反应中的作用巨噬细胞,在免疫系统中起到了至关重要的作用。
当身体遭受外来的伤害或感染时,会引起局部的炎症反应。
而巨噬细胞则是在这个过程中表现出特别的作用。
本文将介绍巨噬细胞在炎症反应中的作用,并指出巨噬细胞在人体免疫防御中的重要性。
一、炎症反应简介炎症反应是人体对于外来病原体侵入或细胞组织受损的一种反应。
在炎症反应中,身体通过一系列的细胞和分子,向受损或感染的部位迅速引导各种免疫细胞,如中性粒细胞、单核细胞和巨噬细胞等。
其目的在于将细胞和分子引向病菌增殖或伤害部位,将外来的细胞或细胞碎片进行吞噬和清除,并加速炎症反应的结束,达到维持身体健康的目的。
不过,炎症反应也是一把双刃剑。
如果机体无法控制炎症反应,通常情况下,这些细胞和分子可能会导致一些疾病,如风湿性关节炎、也有可能导致炎症性肠病等自身免疫疾病。
因此,影响炎症反应过程的调节细胞和分子变得尤为重要。
二、巨噬细胞的功能1、吞噬和清除功能巨噬细胞是一种以吞噬和清除细胞垃圾为主要生理功能的免疫细胞。
这意味着,当身体遭受到感染或损伤时,巨噬细胞可以主动向病原体或受损组织发起吞噬反应,将其包裹在自己的体内,并进行消化和清除。
这一过程是维护人体健康的重要手段。
2、免疫调节功能除了吞噬和清除外,巨噬细胞还具有重要的免疫调节功能。
巨噬细胞可以通过分泌各种生长因子、趋化因子等分子,吸引到其他免疫细胞进入受损或感染的部位参与免疫应答,同时也可以通过分泌炎症反应分子,如细胞因子、趋化因子等,调控体内的炎症反应。
3、抗肿瘤作用近年来,研究表明巨噬细胞还具有抗肿瘤作用。
在体内的一些肿瘤小鼠模型中发现,激活巨噬细胞可以减缓肿瘤的生长,并促进癌细胞的死亡。
这也意味着,巨噬细胞有在癌症免疫治疗中的潜在用途。
三、巨噬细胞在炎症反应中的作用1、起始炎症反应在身体遭受感染或损伤后,巨噬细胞就会起始炎症反应,引导其他免疫细胞进入病灶,进行紧急处理。
2、调控炎症反应巨噬细胞能够分泌多种介质,来控制身体的炎症反应。

肿瘤相关巨噬细胞与肿瘤赵雯祺;王玉丽(综述);周清华(审校)【摘要】Tumor associated macrophages are the main inflammatory cells in the tumor microenvironment. A variety of evidence shows that TAMs promotes tumorigenesis, growth, invasion and metastasis, influence tumor metabolism. Therefore, TAMs is a potential target for cancer therapy. This paper summarizes the research progress of TAMs in recent years, provides new idea for the study of the mechanism of tumor development and treatment.%肿瘤相关巨噬细胞(Tumor associated macrophages, TAMs)是肿瘤微环境中的主要炎性细胞群,多种证据表明TAMs促使肿瘤发生、生长、侵袭和转移,影响肿瘤代谢。
因此, TAMs是癌症治疗的潜在目标。
本文总结近年来有关TAMs的研究进展,为研究肿瘤的发生发展机制及治疗提供思路。
【期刊名称】《药品评价》【年(卷),期】2016(013)018【总页数】6页(P49-54)【关键词】肿瘤相关巨噬细胞;肿瘤微环境;肿瘤转移;肿瘤代谢【作者】赵雯祺;王玉丽(综述);周清华(审校)【作者单位】天津医科大学总医院,天津市肺癌研究所,天津市肺癌转移与肿瘤微环境重点实验室,中国天津 300000;天津医科大学总医院,天津市肺癌研究所,天津市肺癌转移与肿瘤微环境重点实验室,中国天津 300000;天津医科大学总医院,天津市肺癌研究所,天津市肺癌转移与肿瘤微环境重点实验室,中国天津300000【正文语种】中文【中图分类】R979.1巨噬细胞是人体免疫系统中的重要组成部分。

肿瘤相关巨噬细胞研究进展0.引言巨噬细胞是人体免疫系统中重要的组成部分。
既往人们曾认为,巨噬细胞在抗肿瘤的免疫调节过程中起到重要作用。
但近来研究表明,巨噬细胞具有很强的可塑性。
暴露于肿瘤微环境中的肿瘤相关巨噬细胞(tumor associated macrophages,TAM)并非发挥抗肿瘤作用,而是在调节肿瘤进展中的各个关键步骤中发挥效用,进而起到促进肿瘤生长、转移等作用,目前有临床证据显示TAM与恶性肿瘤的不良预后相关。
1.肿瘤相关巨噬细胞概述巨噬细胞来源于人体血液循环中成熟的单核细胞。
血液循环中的单核细胞穿过毛细血管内皮,进而迁移到不同的组织中分化成为组织特异性的巨噬细胞。
在单核细胞分化成为巨噬细胞的过程中,细胞的形态和功能发生了很大的改变。
目前我们将这一分化过程分为如下几类:(1)M1型巨噬细胞,又称经典活化途径的巨噬细胞(classically activatedmacrophage)M1巨噬细胞的产生需要IFN-γ和细菌或其分解产物(e.g., LPS)的双信号诱导,它的表型特征为IL-12high、IL-23 high、IL-10 low。
这类巨噬细胞能高水平地表达杀伤分子(e.g., NO, ROI etc.),分泌多种细胞因子(e.g., TNF, IL-1β, IL-6 etc.),表达细胞因子受体(e.g., IL-7R,IL-15R),分泌趋化因子(e.g., CCL2, CCL5, CXCL8)以及共刺激分子(e.g., CD80, CD86)。
M1型巨噬细胞在Thl型免疫应答中分泌大量的细胞因子,激活人体免疫反应,作为诱导细胞和效应细胞参与杀伤病原体和肿瘤细胞。
(2)M2型巨噬细胞,又称替代活化途径的巨噬细胞(alternatively activatedmacrophage)M2型巨噬细胞在不同的诱导信号下将分化为不同的亚型,这包括:由IL-4与IL-13诱导的M2a型,由免疫复合物/TLR配体诱导的M2b型,由IL-10和糖皮质激素诱导的M2c 型。

肿瘤相关巨噬细胞研究进展肿瘤微环境中,免疫细胞的浸润活化是大多数肿瘤恶化的标志之一。
肿瘤相关巨噬细胞(Tumor-Associated Macrophages,TAMs)作为众多肿瘤浸润免疫细胞中最重要的亚群之一,在免疫系统和肿瘤细胞的相互作用过程中发挥着至关重要的作用。
肿瘤相关巨噬细胞是实体肿瘤中大量存在的一种免疫细胞,在大多数人类肿瘤中,肿瘤相关巨噬细胞的浸润及其相关基因的表达上调严重影响肿瘤的预后和治疗效果。
本文将对肿瘤相关巨噬细胞的促肿瘤功能、肿瘤相关巨噬细胞功能的调控以及针对肿瘤相关巨噬细胞的肿瘤免疫治疗进展加以综述。
1. 肿瘤相关巨噬细胞的促肿瘤功能:有研究表明,巨噬细胞吞噬了凋亡的肿瘤细胞之后,肿瘤细胞DNA 被并入巨噬细胞的细胞核中,这些巨噬细胞会受到肿瘤细胞DNA 的影响,并转变成具有致瘤能力的类似于肿瘤干细胞的细胞,但在这类细胞的表面,仍含有巨噬细胞标记。
研究人员把这类受到肿瘤细胞DNA影响而获得肿瘤干细胞样特性的巨噬细胞,称之为Tumacrophage4。
肿瘤相关巨噬细胞可以大量分泌促血管新生因子,如血管内皮生长因子 VEGF,后者促进肿瘤的血管生成和血源性细胞转移过程,从而可以通过免疫和非免疫过程促进肿瘤的生长。
此外,肿瘤相关巨噬细胞可以通过抑制抗肿瘤免疫反应达到促进肿瘤发生、发展的效果。
如肿瘤相关巨噬细胞产生免疫抑制因子IL-10、TGFβ、PGE2 等,其中 IL-10 通过抑制化疗药物的抗肿瘤免疫反应从而显著降低抗肿瘤治疗效果。
在前列腺癌中,较高的肿瘤相关巨噬细胞浸润预测总体生存率较差,但无生化复发或无复发生存;相反,巨噬细胞清道夫受体 1 的水平升高与无复发生存率更高有关。
华盛顿大学的研究者发现,在胰腺癌小鼠模型肿瘤相关巨噬细胞来源于单核细胞和胚胎巨噬细胞。
肿瘤相关巨噬细胞分型与血液中的单核细胞并无相关性;损伤血液中的单核细胞并不会影响胰腺癌的进展。
胚胎来源的巨噬细胞在胰腺癌进展过程中不断扩增;这种扩增是在肿瘤间质内进行的,会影响间质重塑的蛋白质,且胰腺癌组织内的 TAM 与胚胎来源的巨噬细胞更为相像。
综㊀㊀述㊀基金项目:国家自然科学基金项目(面上项目㊁重点项目㊁重大项目)(No.82002971)作者简介:顾佳丹ꎬ女ꎬ硕士生ꎬ研究方向:药理ꎬE-mail:gujiadan@163.com通信作者:戴蓓英ꎬ女ꎬ博士ꎬ特聘副研究员ꎬ硕士生导师ꎬ研究方向:肿瘤药理学ꎬTel:198****9146ꎬE -mail:1620184503@cpu.edu.cn基于巨噬细胞极化的肿瘤治疗顾佳丹ꎬ戴蓓英(中国药科大学新药安全评价与研究中心ꎬ江苏南京211198)摘要:巨噬细胞的高度可塑性能够影响肿瘤进展和治疗耐药ꎬ目前针对肿瘤相关巨噬细胞(tumor-associatedmacrophagesꎬTAMs)开发出了多种治疗手段ꎬ包括对其进行再极化等ꎮ利用化合物阻断巨噬细胞向M2型极化或促进其向M1型极化ꎬ利用纳米粒子靶向巨噬细胞递送刺激因子等都是常用的重编程手段ꎮ靶向TAMs有望成为一种潜在的抗肿瘤治疗手段ꎮ本文主要聚焦于通过对TAMs进行重编程以使其重新获得抗肿瘤能力的免疫疗法ꎮ关键词:肿瘤相关巨噬细胞ꎻ极化ꎻ纳米粒子中图分类号:R730.51㊀文献标志码:A㊀文章编号:2095-5375(2023)11-0909-007doi:10.13506/j.cnki.jpr.2023.11.011Anti-tumortherapiesbasedonmacrophagesᶄrepolarizationGUJiadanꎬDAIBeiying(CenterforNewDrugSafetyEvaluationandResearchꎬChinaPharmaceuticalUniversityꎬNanjing211198ꎬChina)Abstract:Thehighplasticityofmacrophagescaninfluencetumorprogressionandtreatmentresistance.Variousthera ̄peuticapproacheshavebeendevelopedfortumor-associatedmacrophages(TAMs)ꎬincludingtheirrepolarization.TheuseofcompoundstoblockthepolarizationofmacrophagestoM2typeortopromotetheirpolarizationtoM1typeꎬandtheuseofnanoparticlestotargetmacrophagestodeliverstimulatoryfactorsareallcommonlyusedreprogrammingmethods.TargetingTAMsisexpectedtobeapotentialanti-tumortherapy.ThispapermainlyfocusedonimmunotherapybyreprogrammingTAMstoregainanti-tumorability.Keywords:Tumor-associatedmacrophagesꎻPolarizationꎻNanoparticles㊀㊀巨噬细胞从骨髓中的祖细胞而来ꎬ随后进入外周血在内环境稳态㊁炎症反应及肿瘤免疫中发挥作用[1]ꎮ巨噬细胞具有高度可塑性ꎬ能够依据不同微环境的刺激在不同表型之间转换ꎬ这种转换被称为 极化 [2]ꎮ肿瘤微环境中的巨噬细胞又称为肿瘤相关巨噬细胞(tumor-associatedmacrophagesꎬTAMs)ꎬ与肿瘤的发生发展有着密切的关系ꎬ能够影响肿瘤的进展及治疗的耐药ꎬ因此有望成为抗癌药物的新靶点[3]ꎮ目前基于TAMs的各类亚型和功能出现了四类TAMs相关的免疫疗法ꎬ包括直接清除TAMsꎬ限制TAMs的募集与肿瘤定位ꎬ对TAMs进行再极化或重编程以及利用巨噬细胞靶向肿瘤给药[4]ꎮ本文主要聚焦于通过对TAMs进行重编程以使其重新获得抗肿瘤能力的免疫疗法ꎮ1㊀巨噬细胞的极化目前巨噬细胞被主要分为两种具有不同功能的亚型ꎬ包括经典激活的M1型(classicallyactivatedmacrophageꎬCAMs)ꎬ又称炎症型ꎬ以及替代性激活的M2型(alternativelyactivatedmacrophageꎬAAMs)ꎬ又称抗炎型[5]ꎮ人外周血单核细胞用粒细胞巨噬细胞集落刺激因子(granulocytemacrophage-colonystimulatingfactorꎬGM-CSF)刺激时会向M1型极化ꎬ而与巨噬细胞集落刺激因子(macrophagecolony-stimulatingfactorꎬM-CSF)则会向M2型极化[6]ꎮM1型巨噬细胞是正常免疫反应的主要表型ꎬ通常由γ干扰素(interferon-γꎬIFN-γ)或脂多糖(li ̄popolysaccharideꎬLPS)激活[7]ꎬ参与针对不同病原体的I型辅助性T细胞(Thelpertype1cellsꎬTh1)的免疫反应ꎬ并产生能够杀伤癌细胞和微生物的促炎细胞因子[6ꎬ8]ꎬ如TNF-α(tumornecrosisfactor-α)㊁IL-1β(interleukin-1β)及低水平的IL-10[5ꎬ9]ꎮ而M1型巨噬细胞产生的活性氧成分(reactiveoxygenspeciesꎬROS)虽然能够参与病原体的清除[5]ꎬ但也会导致DNA损伤[10]ꎮ由于促炎反应会损伤DNAꎬ因此M2型巨噬细胞介导的抗炎反应就十分重要ꎮM2型巨噬细胞通常由IL-4㊁IL-13㊁IL-10激活ꎬ能够诱导免疫抑制㊁肿瘤形成ꎬ并参与寄生虫的清除及伤口修复[11]ꎮM2型巨噬细胞根据功能可分为3个亚型:①有助于组织修复及伤口愈合的M2a和M2c型ꎻ②有助于抗炎和免疫调节的M2b型ꎻ③有助于血管生成和肿瘤进展的M2d型[12-13]ꎮM2a型主要由肥大细胞分泌的IL-4㊁IL-13以及Th2细胞和嗜碱性粒细胞诱导[12]ꎬM2c型由TGF-β(transforminggrowthfactor-β)㊁IL-10和糖皮质激素诱导[14]ꎬM2b型由LPS或IL-1R配体与免疫复合物的相互左右诱导[15]ꎬM2d型则由肿瘤相关因子诱导产生ꎬ同时也是肿瘤微环境(tumormicroenvi ̄ronmentꎬTME)中TAMs的主要组成部分[16]ꎮ机制上来说ꎬSTAT1和STAT3/STAT6激活通路间的平衡决定了巨噬细胞的极化和功能[17]ꎮNF-κB和STAT1的表达增加促进了巨噬细胞向M1型极化ꎬSTAT3和STAT6介导了巨噬细胞向M2型极化[18]ꎬ此外ꎬ过氧化物酶体增殖物激活受体(peroxi ̄someproliferator-activatedreceptorsꎬPPAR)如PPARγ和PPARδ同样参与了M2型巨噬细胞的激活与氧化代谢[12]ꎮ转录因子KLF4协同STAT6ꎬ通过阻断NF-κB共激活因子促进M2型相关基因如ARG-1㊁MRC1㊁FIZZ1㊁PPARγ的表达ꎬ抑制M1型相关基因如TNFα㊁COX-2㊁CCL5㊁iNOS的表达ꎮ与KLF4同家族的KLF2则通过抑制NF-κB/HIF-1α的激活调控巨噬细胞活化[19]ꎮIL-4一方面通过诱导c-Myc激活M2型巨噬细胞[18]ꎬ另一方面通过诱导M2型极化的Jmjd3-IRF4轴抑制IRF5介导的M1型极化ꎮ此外ꎬIL-10能通过诱导c-Maf㊁STAT3和p50NF-κB同源二聚体活性促进M2型极化[17]ꎮ2㊀肿瘤相关巨噬细胞与肿瘤微环境TME由免疫细胞㊁基质细胞及非细胞成分构成ꎬ免疫细胞包括T细胞㊁B细胞㊁TAMs等ꎬ基质细胞包括肿瘤干细胞㊁肿瘤相关成纤维细胞及肿瘤相关脂肪细胞等[20]ꎬ非细胞成分包括细胞外基质(ex ̄tracellularmatrixꎬECM)蛋白㊁生长因子㊁细胞因子及代谢物[21]ꎮTME的稳态和演变离不开所有细胞密切的细胞间串扰[3]ꎬ其构成成分也会随着癌症种类的不同而变化[22]ꎮTAMs构成了TME中一群具有可塑性和异质性的细胞ꎬ在某些实体瘤中占比可达50%[3]ꎬ并且在抑制免疫反应㊁促进组织重塑㊁癌症转移和耐药方面发挥着重要作用[23]ꎮ最新研究表明ꎬTAMs与正常巨噬细胞类似ꎬ具有中间激活态ꎬ能够适应复杂的TME[24]ꎬ并且在TME中表型和功能各不相同的TAMs亚型都表达M1和M2的标记物[25]ꎮ然而只有在肿瘤发生非常早期的阶段会产生促炎因子ꎬ促进M1型TAMs的募集和极化ꎬM1型TAMs则通过产生细胞毒性因子㊁吞噬并摧毁肿瘤细胞以及释放促炎因子发挥抗癌效果[26]ꎮ随着M1型TAMs长期存在导致的慢性炎症ꎬ癌细胞会将TAMs重编程为M2型[27]ꎬM2型TAMs通过分泌生长因子㊁促血管生成因子㊁免疫抑制因子以及重塑蛋白水解酶发挥促肿瘤作用[28]ꎮ因此基于TAMs的各类亚型和功能出现了4类TAMs相关的免疫疗法ꎬ包括直接清除TAMsꎬ限制TAMs的募集与肿瘤定位ꎬ对TAMs进行再极化或重编程以及利用巨噬细胞靶向肿瘤给药[4]ꎮ3㊀重编程TAMs治疗癌症的研究进展有研究证明巨噬细胞是化疗和免疫治疗所必需的[29]ꎬ并且考虑到TAMs的可塑性及不同亚型的功能ꎬ利用环境刺激促癌的M2型TAMs重编程为抗癌的M1型TAMs是一种可能的肿瘤治疗策略[4]ꎮ目前重编程TAMs的方法多种多样ꎬ包括抑制TAMs极化相关基因调控极化ꎬ利用化合物等直接诱导TAMs再极化ꎬ通过纳米颗粒递送系统诱导极化以及利用机械高强度聚焦超声等技术诱导TAMs极化ꎮ3.1㊀直接抑制TAMs极化相关基因调控极化㊀通过基因调控TAMs主要分为两条途径ꎬ一是重新激活STAT1通路ꎬ使TAMs向M1型极化ꎬ二是抑制STAT3/STAT6信号通路ꎬ抑制TAMs向M2型极化ꎮ目前两条通路相关的基因均有文献报道ꎮRIP1是一种丝氨酸/苏氨酸蛋白激酶ꎬ在部分癌症中能够促进癌细胞死亡[30]ꎬ但巨噬细胞中的RIP1信号会导致胰腺导管癌抵抗免疫治疗ꎮ抑制巨噬细胞的RIP1能够激活STAT1信号通路ꎬ使TAMs重编程为MHCIIhiTNFα+IFNγ+的肿瘤杀伤型ꎬ从而导致细胞毒性T细胞激活和辅助性T细胞向混合Th1/Th17表型分化ꎮ因此ꎬ巨噬细胞RIP1可能作为控制肿瘤免疫的检查点激酶发挥作用[31]ꎮATP作为在实体瘤中高表达的物质可能与肿瘤增殖和免疫细胞通讯有关[32]ꎬ细胞外ATP的功能主要由P2X7介导ꎬ该受体广泛表达于大多数肿瘤细胞和免疫细胞如TAMs上[33]ꎮTAMs上的P2X7能通过激活STAT6/IRF4轴促进肺肿瘤细胞增殖㊁血管生成和T细胞免疫抑制ꎬ从而促进TAMS的M2极化ꎮ抑制或敲除P2X7可抑制TAMs向M2型极化ꎬ并显著抑制体内肺癌的进展ꎮ此外抑制P2X7克服了肺癌对免疫治疗和化疗的耐药性ꎬ是一种潜在的治疗复发及难治性肺癌的手段[34]ꎮTGR5(又称GPBAR1)是细胞膜G蛋白偶联的胆汁酸受体ꎬ表达与单核细胞和巨噬细胞上ꎬ在调节炎症反应中发挥重要作用[35]ꎮTGR5通过激活cAMP-STAT3/STAT6信号ꎬ是TAMs向M2型极化所必需的ꎮTGR5缺失能够恢复TAMs导致的CD8+T细胞的抑制ꎬ从而恢复非小细胞肺癌(non-smallcelllungcancerꎬNSCLC)的抗肿瘤免疫反应ꎮTGR5是NSCLC针对TAMs的抗肿瘤免疫治疗的一个有潜力的药物靶点ꎬ可能使免疫检查点阻断疗法无效的患者受益[36]ꎮERK5是丝裂原激活蛋白激酶(mitogen-activatedproteinkinaseꎬMAPKs)家族的一员ꎬ能够将胞外信号转化为各种细胞反应[37]ꎮSTAT3磷酸化依赖于ERK5ꎬERK5缺失导致骨髓来源巨噬细胞(bonemarrow-derivedmacrophageꎬBMDMs)表达低水平的M2型相关基因ꎬ并减少TGF-β及IL-10的产生ꎬ从而阻止免疫抑制微环境的形成ꎮ因此ꎬ通过阻断ERK5重编程TAMs将成为一种潜在的治疗手段[38]ꎮ此外ꎬ也有文献报道部分临床用药如卡巴他赛㊁卡非佐米等能够重编程TAMsꎬ这就意味着这些药物具有与免疫疗法联用从而发挥更好的抗肿瘤效果的潜力ꎮ卡巴他赛是治疗前列腺癌的二线用药ꎬ通过稳定微管中的微管蛋白以抑制细胞分裂来发挥细胞毒性[39]ꎮ但在三阴性乳腺癌(triple-negativebreastcancerꎬTNBC)中ꎬ卡巴他赛并非直接发挥细胞毒性作用ꎬ而是诱导巨噬细胞向M1型极化ꎬ从而通过TLR/NF-κB通路的激活和促炎细胞因子的表达从而发挥抗肿瘤作用[40]ꎮ此外ꎬ紫杉醇已被证明是一种TLR4配体ꎬ它直接与髓样分化蛋白2(myeloiddifferentiationprotein-2ꎬMD-2)结合ꎬ并激活下游信号传导[41]ꎮ因此除了卡巴他赛外其他的紫杉醇衍生物也可能具有重编程TAMs的能力ꎮ卡非佐米作为不可逆的蛋白酶体抑制剂ꎬ能够破坏细胞蛋白质的稳定[42]ꎬ常用于复发/难治性多发性骨髓瘤的治疗ꎮ高通量筛选发现卡非佐米还能在M2型巨噬细胞中诱导未折叠蛋白反应(unfoldedproteinresponseꎬUPR)ꎬ激活IRE1a来募集TRAF2ꎬ并激活NF-κB转录M1型巨噬细胞相关基因ꎬ从而诱导M2型巨噬细胞表达M1型巨噬细胞因子ꎬ发挥吞噬肿瘤细胞以及将抗原递呈给T细胞的功能ꎮ此外ꎬ卡菲佐米与PD-1抗体有协同作用ꎬ可能成为PD-1抑制剂联合治疗的优秀药物[43]ꎮ3.2㊀利用纳米材料重编程TAMs㊀相较于传统药物递送系统ꎬ纳米递送技术利用细胞特异性靶向定位㊁分子转运到特定细胞器等手段克服了诸多局限ꎬ包括生物体分布和细胞内运输等[44]ꎬ纳米粒子还能够提高封装内容物的溶解度和稳定性ꎬ促进跨膜运输并延长循环时间以提高安全性和有效性[45]ꎮ随着技术进步ꎬ纳米粒子的受控合成利用复杂架构的合并㊁生物响应部分以及靶向剂提高递送能力[46]ꎮ目前纳米粒子根据材料主要分为3类ꎬ包括脂质体纳米粒子㊁聚合物纳米粒子及无机材料纳米粒子[44]ꎬ利用这3类材料对TAMs重编程均有文献报道ꎮ脂质纳米粒子(lipid-basedNPsꎬLNPs)通常由4个部分组成ꎬ与带负电的遗传物质结合并有助于核内逃逸的阳离子或可电离脂质ꎬ形成粒子结构的磷脂ꎬ有助于稳定和膜融合的胆固醇以及改善稳定性和循环的聚乙二醇化的脂质ꎮDLin-MC3-DMA(MC3LNPs)是一种高效的siRNA运输载体ꎬ将能够同时编码CCL2和CCL5的双特异性单结构域抗体BisCCL2/5i的mRNA包裹其中ꎬ可以形成一种肝归巢生物材料ꎬ诱导TAMs向M1型极化ꎬ并减少肿瘤微环境中的免疫抑制ꎮ此外ꎬ该脂质纳米粒子与PD-L1联合使用ꎬ能够延长原发性肝癌及结直肠癌和胰腺癌肝转移模型的小鼠生存期[47]ꎮ甘露糖磺酸酯脂质体(Man-PEG-Lipo)也被开发运用到了TAMs的靶向递送中ꎬ在其中包裹绿原酸(chlorogenicacidꎬCHA)的脂质体具有较好的粒径和稳定性ꎬ并能有效改善CHA在体内快速清除和肿瘤蓄积较少的情况ꎮ甘露糖受体介导的TAMs靶向作用能够使该脂质体优先蓄积在肿瘤中ꎬ释放出的CHA能够使M2型TAMs重编程为M1型ꎬ从而抑制胶质瘤的生长[48]ꎮ此外ꎬLNPs还能够包裹C6-神经酰胺(LipC6)ꎬ注射LipC6一方面能够抑制肿瘤细胞的增殖和AKT的磷酸化ꎬ增加肿瘤细胞的凋亡ꎬ另一方面能够诱导TAMs极化为M1型ꎬ减少免疫抑制ꎬ增加CD8+T细胞的活性ꎬ从而减缓肝癌生长[49]ꎮ尽管LNPs能够靶向递送并提高了内容物的稳定性ꎬ但其也存在载药量低㊁肝脏和脾脏高摄取等不足[50]ꎮ相较于LNPsꎬ聚合物纳米粒子具有更多变的结构与特性ꎬ也就产生了可变的药物递送能力ꎬ治疗药物可以封装在纳米粒子核心内㊁包埋在聚合物基质中㊁化学结合到聚合物上或结合到纳米粒子表面ꎬ因此聚合物纳米粒子能够承载多种类型的药物ꎬ是理想的递送载体[51]ꎮPLGA(Lactic-co-glycolicacid)是常用的一种聚合物纳米粒子载体ꎮ可以在其中包裹Toll样受体7/8(toll-likereceptor7/8ꎬTLR7/8)激动剂瑞喹莫德(R848)ꎬ再将PLGA-R848通过静电吸附到大肠杆菌MG1655上ꎬ可以实现肿瘤靶向ꎬ并将TAMs重编程为M1型[52]ꎮPLGA还能包裹小分子黄芩苷和蛋白黑色素瘤抗原Hgp肽片段ꎬPLGA表面还可以缀合M2pep和α-pepꎬ使其对M2型巨噬细胞有更高的亲和力ꎬPLGA纳米粒子外部还能够再包裹一层聚多巴胺(polydopamineꎬpD)ꎬ使单链DNA片段CpG-ODN能够吸附在pD上ꎮM2型TAMs能有效地摄取纳米复合体ꎬ酸性溶酶体环境导致pD从纳米粒子表面解体ꎬ释放CpG将TAMs重编程为M1型ꎬ纳米粒子内部的黄芩苷则具有免疫调节和选择性细胞毒性的双重功能ꎮ该纳米复合体实现了高亲和力靶向递送系统以及较好的免疫调节㊁肿瘤杀伤功能ꎬ再次证明了聚合物纳米粒子有较好的应用前景[53]ꎮ除了PLGAꎬ功能化两亲性多肽(functionalizedamphiphilicpeptideꎬPCP)也能够聚合形成纳米粒子ꎬ与PD1㊁PD-L1组成纳米粒子骨架ꎬ并在其中包裹阿霉素(doxorubicinꎬDOX)和R848ꎬ就可形成多药前药ꎮPCP中包含成纤维细胞激活蛋白-α(fibroblastactivationprotein-αꎬFAP-α)反应底物片段ꎬ在到达肿瘤部位时骨架结构能够解离释放出内容物ꎬ使DOX和R848触发免疫原性细胞死亡(immunogeniccelldeathꎬICD)ꎬ并对TAMs进行重新编程ꎬ从而实现抗肿瘤免疫[54]ꎮ聚合物纳米粒子的骨架可修饰性及内容物的多样性使其在癌症医学㊁基因治疗和诊断中发挥重要作用ꎬ但也存在粒子聚集和毒性的风险[55]ꎮ无机物纳米粒子在TAMs重编程方面也有所应用ꎮ层状双氢氧化物作为常用的纳米材料本身具有上调促炎细胞因子和共刺激分子的能力[56]ꎬ在携带了miR155后表现出TAMs特异性递送能力ꎬ并能降低肿瘤组织中TAMs和髓系来源的抑制细胞(myeloid-derivedsuppressorcellsꎬMDSCs)的比例ꎬ提高CD4+和CD8+T细胞的浸润率和活性[57]ꎮ无机物纳米粒子还能够与聚合物纳米粒子结合使用ꎮPLGA纳米粒子作为骨架包裹Fe3O4纳米粒子和TLR7激动剂咪喹莫特(R837)ꎬ随后表面涂覆经LPS处理的巨噬细胞膜来靶向TAMsꎬFe3O4纳米粒子通过铁离子激活IRF5信号通路ꎬR837通过活性氧诱导的NF-κB信号通路协同极化TAMs为M1型ꎬ以增强免疫治疗[58]ꎮ3.3㊀其他手段重编程TAMs㊀目前大多数方法都是从极化信号通路的角度重编程TAMsꎬ但也能从巨噬细胞能量代谢的角度入手ꎮM1型巨噬细胞利用糖酵解满足快速的能量代谢需求ꎬM2型巨噬细胞则更倾向于利用脂肪酸氧化ꎬ而TME中恰好富含脂肪酸[59]ꎮ研究表明ꎬ富含不饱和脂肪酸的环境会影响骨髓细胞的成熟ꎬ不论是阻断脂滴的合成还是降解脂滴都能够抑制髓系细胞的成熟㊁线粒体呼吸及免疫抑制功能[60]ꎮ除了化学方法ꎬ机械手段也可能影响巨噬细胞的极化ꎮ高强度聚焦超声(highintensityfocusedul ̄trasoundꎬHIFU)消融疗法通过HIFU将焦点组织温度提高到60ħ以上从而使组织消融ꎬ一方面由高温引起的组织坏死造成ꎬ另一方面由水和超声波相互作用导致内部空化引起[61]ꎮ但传统HIFU(T-HIFU)不适用于较大的肿瘤ꎬ由此出现了利用高压爆破产生声空化的新型治疗手段 机械性高强度聚焦超声(mechanicalhigh-intensityfocusedultra ̄soundꎬM-HIFU)ꎮM-HIFU治疗后增加了TME中树突状细胞的积累ꎬT细胞的浸润ꎬ还能将TAMs重编程为M1型ꎬ并增加了PD-L1的表达ꎮ研究表明与单一治疗手段相比ꎬM-HIFU与抗PD-L1单抗联用能够增强全身抗肿瘤疗效ꎬ并有助于减少晚期复发和转移[62]ꎮ4㊀总结TAMs是TME的重要组成部分ꎬ在肿瘤发生发展中起重要作用ꎬTAMs能够通过多种途径创造免疫抑制微环境ꎬ包括触发T细胞免疫检查点的阻断ꎬ因此靶向TAMs不失为一种改善抗肿瘤免疫治疗的新方法[28]ꎮ目前针对TAMs及其功能介质为直接靶点已经开发出多种治疗策略ꎬ包括耗竭TAMsꎬ阻断单核细胞/巨噬细胞的募集ꎬ对TAMs重编程以及利用TAMs靶向肿瘤递送药物ꎮ尽管大多数治疗策略都处于临床前研究阶段ꎬ但也有部分耗竭TAMs的拮抗剂已进入实体瘤的临床测试ꎬ而与免疫检查点阻断联合治疗用有望改进现有的免疫疗法ꎮ然而TAMs的靶向治疗仍有许多问题需要解决ꎬ例如靶向TAMs针对的信号通路在体内是否存在机制上的重叠或协同ꎬ将巨噬细胞复极化为促炎状态有怎样的长期后果ꎬ哪些巨噬细胞转录因子对促进肿瘤免疫抑制和免疫激活至关重要以及靶向靶向TAMs可能会在TME中引发怎样的连锁反应等等ꎮ但不可否认ꎬ靶向TAMs不仅可以抑制肿瘤发生发展的 种子 ꎬ还可以改造肿瘤生长的 土壤 ꎬ构建抑癌微环境ꎬ从而将促进肿瘤进展的敌人变成抑制肿瘤发展的朋友ꎮTAMs靶向策略本身以及其与其他疗法协同使用都有益于癌症的治疗[4]ꎮ参考文献:[1]㊀EPELMANSꎬLAVINEKJꎬRANDOLPHGJ.Originandfunctionsoftissuemacrophages[J].Immunityꎬ2014ꎬ41(1):21-35.[2]DENARDODGꎬRUFFELLB.Macrophagesasregulatorsoftumourimmunityandimmunotherapy[J].NatRevIm ̄munolꎬ2019ꎬ19(6):369-382.[3]VITALEIꎬMANICGꎬCOUSSENSLMꎬetal.MacrophagesandMetabolismintheTumorMicroenvironment[J].CellMetabꎬ2019ꎬ30(1):36-50.[4]LIXꎬLIURꎬSUXꎬetal.Harnessingtumor-associatedmacrophagesasaidsforcancerimmunotherapy[J].MolCancerꎬ2019ꎬ18(1):177.[5]SHAPOURI-MOGHADDAMAꎬMOHAMMADIANSꎬVAZINIHꎬetal.Macrophageplasticityꎬpolarizationꎬandfunctioninhealthanddisease[J].JCellPhysiolꎬ2018ꎬ233(9):6425-6440.[6]TARIQUEAAꎬLOGANJꎬTHOMASEꎬetal.Phenotypicꎬfunctionalꎬandplasticityfeaturesofclassicalandalterna ̄tivelyactivatedhumanmacrophages[J].AmJRespirCellMolBiolꎬ2015ꎬ53(5):676-688.[7]GORDONSꎬMARTINEZFO.Alternativeactivationofmacrophages:mechanismandfunctions[J].Immunityꎬ2010ꎬ32(5):593-604.[8]SOYSALSDꎬTZANKOVAꎬMUENSTSE.RoleoftheTumorMicroenvironmentinBreastCancer[J].Pathobiolo ̄gyꎬ2015ꎬ82(3-4):142-152.[9]MEDZHITOVRꎬSCHNEIDERDSꎬSOARESMP.Diseasetoleranceasadefensestrategy[J].Scienceꎬ2012ꎬ335(6071):936-941.[10]CAMERONAMꎬCASTOLDIAꎬSANINDEꎬetal.Inflam ̄matorymacrophagedependenceonNAD+salvageisaconsequenceofreactiveoxygenspecies-mediatedDNAdamage[J].NatImmunolꎬ2019ꎬ20(4):420-432. [11]ESSANDOHKꎬLIYꎬHUOJꎬetal.MiRNA-MediatedMacrophagePolarizationanditsPotentialRoleintheRegulationofInflammatoryResponse[J].Shockꎬ2016ꎬ46(2):122-131.[12]ARORASꎬDEVKꎬAGARWALBꎬetal.Macrophages:Theirroleꎬactivationandpolarizationinpulmonarydiseases[J].Immunobiologyꎬ2018ꎬ223(4-5):383-396. [13]ORECCHIONIMꎬGHOSHEHYꎬPRAMODABꎬetal.MacrophagePolarization:DifferentGeneSignaturesinM1(LPS+)vs.ClassicallyandM2(LPS-)vs.AlternativelyActivatedMacrophages[J].FrontImmunolꎬ2019(10):1084.[14]ZIZZOGꎬHILLIARDBAꎬMONESTIERMꎬetal.EfficientClearanceofEarlyApoptoticCellsbyHumanMacrophagesRequiresM2cPolarizationandMerTKIn ̄duction[J].JImmunolꎬ2012ꎬ189(7):3508-3520. [15]ANDERSONCFꎬMOSSERDM.Anovelphenotypeforanactivatedmacrophagethetype2activatedmacrophage[J].JLeukocBiolꎬ2002ꎬ72(1):101-106.[16]WANGHWꎬJOYCEJA.Alternativeactivationoftumor-associatedmacrophagesbyIL-4:primingforprotumoralfunctions[J].CellCycleꎬ2010ꎬ9(24):4824-4835. [17]SICAAꎬMANTOVANIA.Macrophageplasticityandpo ̄larization:invivoveritas[J].JClinInvestꎬ2012ꎬ122(3):787-795.[18]PELLOOMꎬDEPIZZOLMꎬMIROLOMꎬetal.Roleofc-MYCinalternativeactivationofhumanmacrophagesandtumor-associatedmacrophagebiology[J].Bloodꎬ2012ꎬ119(2):411-421.[19]MAHABELESHWARGHꎬKAWANAMIDꎬSHARMANꎬetal.ThemyeloidtranscriptionfactorKLF2regulatesthehostresponsetopolymicrobialinfectionandendotoxicshock[J].Immunityꎬ2011ꎬ34(5):715-728.[20]BEJARANOLꎬJORDAOMJCꎬJOYCEJA.TherapeuticTargetingoftheTumorMicroenvironment[J].CancerDis ̄covꎬ2021ꎬ11(4):933-959.[21]LINYHꎬWUMHꎬYEHCTꎬetal.LongNon-CodingRNAsasMediatorsofTumorMicroenvironmentandLiverCancerCellCommunication[J].IntJMolSciꎬ2018ꎬ19(12):3742.[22]MOHAPATRASꎬPIOPPINICꎬOZPOLATBꎬetal.Non-codingRNAsregulationofmacrophagepolarizationincancer[J].MolCancerꎬ2021ꎬ20(1):24.[23]SOLINASGꎬGERMANOGꎬMANTOVANIAꎬetal.Tumor-associatedmacrophages(TAM)asmajorplayersofthecancer-relatedinflammation[J].JLeukocBiolꎬ2009ꎬ86(5):1065-1073.[24]CASSETTALꎬPOLLARDJW.Targetingmacrophages:therapeuticapproachesincancer[J].NatRevDrugDiscovꎬ2018ꎬ17(12):887-904.[25]CHEVRIERSꎬLEVINEJHꎬZANOTELLIVRTꎬetal.AnImmuneAtlasofClearCellRenalCellCarcinoma[J].Cellꎬ2017ꎬ169(4):736-749.[26]CRUSZSMꎬBALKWILLFR.Inflammationandcancer:advancesandnewagents[J].NatRevClinOncolꎬ2015ꎬ12(10):584-596.[27]CANLIOꎬNICOLASAMꎬGUPTAJꎬetal.MyeloidCell-DerivedReactiveOxygenSpeciesInduceEpithelialMuta ̄genesis[J].CancerCellꎬ2017ꎬ32(6):869-883.[28]MANTOVANIAꎬMARCHESIFꎬMALESCIAꎬetal.Tumour-associatedmacrophagesastreatmenttargetsinoncology[J].NatRevClinOncolꎬ2017ꎬ14(7):399-416. [29]GULNꎬBABESLꎬSIEGMUNDKꎬetal.Macrophagese ̄liminatecirculatingtumorcellsaftermonoclonalantibodytherapy[J].JClinInvestꎬ2014ꎬ124(2):812-823. [30]WEGNERKWꎬSALEHDꎬDEGTEREVA.ComplexPathologicRolesofRIPK1andRIPK3:MovingBeyondNec ̄roptosis[J].TrendsPharmacolSciꎬ2017ꎬ38(3):202-225. [31]WANGWꎬMARINISJMꎬBEALAMꎬetal.RIP1KinaseDrivesMacrophage-MediatedAdaptiveImmuneToleranceinPancreaticCancer[J].CancerCellꎬ2018ꎬ34(5):757-774. [32]DIVIRGILIOFꎬSARTIACꎬFALZONISꎬetal.ExtracellularATPandP2purinergicsignallinginthetumourmicroenvi ̄ronment[J].NatRevCancerꎬ2018ꎬ18(10):601-618. [33]SAVIOLEBꎬDEANDRADEMELLOPꎬDASILVACGꎬetal.TheP2X7ReceptorinInflammatoryDiseases:AngelorDemon?[J].FrontPharmacolꎬ2018ꎬ(9):52. [34]QINJꎬZHANGXꎬTANBꎬetal.BlockingP2X7-MediatedMacrophagePolarizationOvercomesTreatmentResistanceinLungCancer[J].CancerImmunolResꎬ2020ꎬ8(11):1426-1439.[35]KAWAMATAYꎬFUJIIRꎬHOSOYAMꎬetal.AGprotein-coupledreceptorresponsivetobileacids[J].JBiolChemꎬ2003ꎬ278(11):9435-9440.[36]ZHAOLꎬZHANGHꎬLIUXꎬetal.TGR5deficiencyacti ̄vatesantitumorimmunityinnon-smallcelllungcancerviarestrainingM2macrophagepolarization[J].ActaPharmSinBꎬ2022ꎬ12(2):787-800.[37]SIMOESAEꎬRODRIGUESCMꎬBORRALHOPM.TheMEK5/ERK5signallingpathwayincancer:apromisingnoveltherapeutictarget[J].DrugDiscovTodayꎬ2016ꎬ21(10):1654-1663.[38]GIURISATOEꎬXUQꎬLONARDISꎬetal.MyeloidERK5deficiencysuppressestumorgrowthbyblockingprotumormacrophagepolarizationviaSTAT3inhibition[J].ProcNatlAcadSciUSAꎬ2018ꎬ115(12):E2801-E2810. [39]TSAOCKꎬCUTTINGEꎬMARTINJꎬetal.Theroleofcabazi ̄taxelinthetreatmentofmetastaticcastration-resistantpros ̄tatecancer[J].TherAdvUrolꎬ2014ꎬ6(3):97-104.[40]CAOXꎬLIBꎬCHENJꎬetal.Effectofcabazitaxelonmac ̄rophagesimprovesCD47-targetedimmunotherapyfortriple-negativebreastcancer[J].JImmunotherCancerꎬ2021ꎬ9(3):e002022.[41]ZIMMERSMꎬLIUJꎬCLAYTONJLꎬetal.PaclitaxelbindingtohumanandmurineMD-2[J].JBiolChemꎬ2008ꎬ283(41):27916-27926.[42]KUHNDJꎬCHENQꎬVOORHEESPMꎬetal.Potentactivityofcarfilzomibꎬanovelꎬirreversibleinhibitoroftheubiquitin-proteasomepathwayꎬagainstpreclinicalmodelsofmultiplemyeloma[J].Bloodꎬ2007ꎬ110(9):3281-3290.[43]ZHOUQꎬLIANGJꎬYANGTꎬetal.Carfilzomibmodulatestumormicroenvironmenttopotentiateimmunecheckpointtherapyforcancer[J].EMBOMolMedꎬ2022ꎬ14(1):e14502.[44]MITCHELLMJꎬBILLINGSLEYMMꎬHALEYRMꎬetal.Engineeringprecisionnanoparticlesfordrugdelivery[J].NatRevDrugDiscovꎬ2021ꎬ20(2):101-124. [45]KOULꎬBHUTIAYDꎬYAOQꎬetal.Transporter-GuidedDeliveryofNanoparticlestoImproveDrugPermeationacrossCellularBarriersandDrugExposuretoSelectiveCellTypes[J].FrontPharmacolꎬ2018(9):27.[46]CHENGQꎬWEITꎬFARBIAKLꎬetal.Selectiveorgantar ̄geting(SORT)nanoparticlesfortissue-specificmRNAdeliveryandCRISPR-Casgeneediting[J].NatNanotech ̄nolꎬ2020ꎬ15(4):313-320.[47]WANGYꎬTIRUTHANIKꎬLISꎬetal.mRNADeliveryofaBispecificSingle-DomainAntibodytoPolarizeTumor-AssociatedMacrophagesandSynergizeImmunotherapya ̄gainstLiverMalignancies[J].AdvMaterꎬ2021ꎬ33(23):e2007603.[48]YEJꎬYANGYꎬJINJꎬetal.TargeteddeliveryofchlorogenicacidbymannosylatedliposomestoeffectivelypromotethepolarizationofTAMsforthetreatmentofglio ̄blastoma[J].BioactMaterꎬ2020ꎬ5(3):694-708.[49]LIGꎬLIUDꎬKIMCHIETꎬetal.NanoliposomeC6-Ce ̄ramideIncreasestheAnti-tumorImmuneResponseandSlowsGrowthofLiverTumorsinMice[J].Gastroenterolo ̄gyꎬ2018ꎬ154(4):1024-1036.(下转第920页)[42]FULLANAMNꎬRUIZ-BRONCHALEꎬFERRÉS-COYAꎬetal.Regionallyselectiveknockdownofastroglialgluta ̄matetransportersininfralimbiccortexinducesadepressivephenotypeinmice[J].Gliaꎬ2019ꎬ67(6):1122-1137.[43]CHANDLEYMJꎬSZEBENIKꎬSZEBENIAꎬetal.Geneexpressiondeficitsinpontinelocuscoeruleusastrocytesinmenwithmajordepressivedisorder[J].JPsychiatryNeu ̄rosciꎬ2013ꎬ38(4):276-284.[44]WANGYꎬLUSꎬCHENYꎬetal.Smoothenedisathera ̄peutictargetforreducingglutamatetoxicityinischemicstroke[J].SciTranslMedꎬ2021ꎬ13(610):eaba3444. [45]JOHNCSꎬSYPEKEIꎬCARLEZONWAꎬetal.BlockadeoftheGLT-1TransporterintheCentralNucleusoftheAmygdalaInducesbothAnxietyandDepressive-LikeSymptoms[J].Neuropsychopharmacologyꎬ2015ꎬ40(7):1700-1708.[46]蔡娲.卒中后抑郁症的电针临床效应及基于Shh-Gli1信号通路的机制研究[D].上海:上海中医药大学ꎬ2019.[47]张小印ꎬ周鑫ꎬ殷晴ꎬ等.S100A9通过增加小鼠星形胶质细胞的谷氨酸分泌促进神经元损伤[J].神经解剖学杂志ꎬ2023ꎬ39(2):201-208.[48]ROTHSTEINJDꎬPATELSꎬREGANMRꎬetal.Beta-lactamantibioticsofferneuroprotectionbyincreasingglu ̄tamatetransporterexpression[J].Natureꎬ2005ꎬ433(7021):73-77.[49]CHUKꎬLEESTꎬSINNDIꎬetal.Pharmacologicalinduc ̄tionofischemictolerancebyglutamatetransporter-1(EAAT2)upregulation[J].Strokeꎬ2007ꎬ38(1):177-182.[50]吴顶锋.柴胡加龙骨牡蛎汤治疗脑卒中后抑郁的临床研究[J].陕西中医ꎬ2016ꎬ37(3):261-263.(收稿日期:2023-09-07)(上接第914页)[50]FENTONOSꎬOLAFSONKNꎬPILLAIPSꎬetal.AdvancesinBiomaterialsforDrugDelivery[J].AdvMa ̄terꎬ2018ꎬ30(29):e1705328.[51]AFSHARZADEHMꎬHASHEMIMꎬMOKHTARZADEHAꎬetal.Recentadvancesinco-deliverysystemsbasedonpolymericnanoparticleforcancertreatment[J].ArtifCellsNanomedBiotechnolꎬ2018ꎬ46(6):1095-1110. [52]WEIBꎬPANJꎬYUANRꎬetal.PolarizationofTumor-AssociatedMacrophagesbyNanoparticle-LoadedEsche ̄richiacoliCombinedwithImmunogenicCellDeathforCancerImmunotherapy[J].NanoLettꎬ2021ꎬ21(10):4231-4240.[53]HANSꎬWANGWꎬWANGSꎬetal.Tumormicroenviron ̄mentremodelingandtumortherapybasedonM2-liketumorassociatedmacrophage-targetingnano-complexes[J].Theranosticsꎬ2021ꎬ11(6):2892-2916.[54]SUNMꎬYAOSꎬFANLꎬetal.FibroblastActivationProtein-alphaResponsivePeptideAssemblingProdrugNanoparticlesforRemodelingtheImmunosuppressiveMi ̄croenvironmentandBoostingCancerImmunotherapy[J].Smallꎬ2022ꎬ18(9):e2106296.[55]ANSELMOACꎬMITRAGOTRIS.Nanoparticlesintheclinic:Anupdate[J].BioengTranslMedꎬ2019ꎬ4(3):e10143.[56]LIAꎬQINLꎬZHUDꎬetal.Signallingpathwaysinvolvedintheactivationofdendriticcellsbylayereddoublehy ̄droxidenanoparticles[J].Biomaterialsꎬ2010ꎬ31(4):748-756.[57]YANGLꎬSUNJꎬLIUQꎬetal.SynergeticFunctionalNanocompositesEnhanceImmunotherapyinSolidTumorsbyRemodelingtheImmunoenvironment[J].AdvSci(Weinh)ꎬ2019ꎬ6(8):1802012.[58]LIULꎬWANGYꎬGUOXꎬetal.ABiomimeticPolymerMagneticNanocarrierPolarizingTumor-AssociatedMac ̄rophagesforPotentiatingImmunotherapy[J].Smallꎬ2020ꎬ16(38):e2003543.[59]BISWASSKꎬMANTOVANIA.Orchestrationofmetabolismbymacrophages[J].CellMetabꎬ2012ꎬ15(4):432-437.[60]WUHꎬHANYꎬRODRIGUEZSILLKEYꎬetal.Lipiddroplet-dependentfattyacidmetabolismcontrolstheim ̄munesuppressivephenotypeoftumor-associatedmacro ̄phages[J].EMBOMolMedꎬ2019ꎬ11(11):e10698. [61]VALERIOMꎬCERANTOLAYꎬEGGENERSEꎬetal.NewandEstablishedTechnologyinFocalAblationoftheProstate:ASystematicReview[J].EurUrolꎬ2017ꎬ71(1):17-34.[62]ABESꎬNAGATAHꎬCROSBYEJꎬetal.Combinationofultrasound-basedmechanicaldisruptionoftumorwithimmunecheckpointblockademodifiestumormicroenvi ̄ronmentandaugmentssystemicantitumorimmunity[J].JImmunotherCancerꎬ2022ꎬ10(1):e003717.(收稿日期:2023-02-02)。
巨噬细胞与癌症作业读后感
-----药剂1005班11号薛胜爽
1人类单核细胞系包含哪些细胞?各自特点是什么?
单核吞噬细胞系统的细胞,有骨髓中的定向干细胞、原单核细胞、幼单核细胞,血液内的单
核细胞和多种器官中的巨噬细胞。后者包括结缔组织的巨噬细胞,肝的Kupffer细胞,肺的
尘细胞,淋巴结和脾的巨噬细胞,胸膜腔和腹膜的巨噬细胞,神经组织的小胶质细胞以及骨
组织的破骨细胞等。它们的特点是均来源于血中的单核细胞,细胞核为单个,细胞膜表面具
有抗体和补体的受体,有活跃的吞噬作用等。
单核吞噬细胞系统的功能,除吞噬、清除异物和衰老伤亡的细胞外,巨噬细胞在免疫应答中
还具有重要作用:它是主要的抗原呈递细胞,在免疫应答的起始阶段,巨噬细胞能捕获和处
理抗原,巨噬细胞能把抗原最具特征性的分子基因(抗原决定基)予以保留,并与巨噬细胞自
身的MHC-II类分子结合,形成抗原肽-MHC分子复合物,将抗原肽呈递给T细胞,促进免
疫应答,故巨噬细胞是抗原呈递细胞(antigen presenting cell, APC);在免疫应答的效应阶
段,它又能聚集于病灶周围,成为破环靶细胞和吞噬细菌的重要成分。此外,此系统还具有
分泌多种生物活性物质(如溶菌酶、补体、肿瘤生长抑制因子)等功能。
2什么是M1,M2型巨噬细胞?这两类细胞对肿瘤细胞的作用分别是
什么?
M1型巨噬细胞诱导性一氧化氮合酶(inducible nitric oxide )表达和活性水平较未刺激组明显
升高,IL-12产生显著增加,CD16/32表达上调;而M2型巨噬细胞I型精氨酸酶(Arg-1)的表达
水平和酶活性较未刺激巨噬细胞显著提高,IL-10分泌轻度增加,并且表达高水平的CD206和
DECTIN-1。巨噬细胞主要可分为M1型即经典活化的巨噬细胞和M2型即替代性活化的巨
噬细胞在体外培养条件下,通过IFN-γ及脂多糖诱导产生M1型巨噬细胞和通过Th2型细胞
因子(如IL-4、IL-13等)诱导产生M2型巨噬细胞,具有与体内极化的巨噬细胞相似的表型和
功能,已成为研究巨噬细胞异质性的重要手段。在机体不同生理和疾病状态下,巨噬细胞表现
出不同的类型,通过表型分析鉴定巨噬细胞类型已成为研究巨噬细胞功能多样性的主要方
法。已有文献主要从精氨酸代谢途径[5,6]、细胞因子分泌[7,8]和表面分子的表达[9,10]等方
面区分M1型与M2型巨噬细胞。然而,到目前为止,关于M1和M2型巨噬细胞的表型特征
尚未统一。为了评价各种表型指标及其意义,我们参照公认的经典的方法在体外诱(M2巨噬
细胞是如何促进肿瘤发展的这已在体内模型中得到验证,依靠体外仿真模仿TAM促进肿瘤
进展的模型,,MDM分化成M1型巨噬细胞后显现出更强的肿瘤杀伤活性,M2型巨噬细胞
促进肿瘤的作用要在有血清培养条件下MDM分化后才能获得。此外,在无血清条件下MDM
吞噬活性评价结果相比,M2的吞噬活性强于M1型巨噬细胞。因此,研究数据证实M2型
巨噬细胞在体外具有肿瘤促进作用,提示开发靶向TAM的癌症治疗手段是有依据的
3CSF-1与巨噬细胞的分化有什么关系?对肿瘤育后有什么影响?
可转染非分裂细胞的腺病毒将与MΦ功能密切的巨噬细胞集落刺激因子(M-CSF)和γ型干扰
素(IFN-γ)基因转入其中, M-CSF除了维持巨噬祖细胞的存活、增殖、分化外,对成熟MΦ
的功能具有调节作用;IFN-γ是目前知道的活性最强的MΦ活化因子(MAF)。我们曾将M-CSF
和IFN-γ基因单独或联合转入MΦ,结果显示联合基因转染组的效应功能和抗原提呈功能较
单基因转染组显著增强。为了探讨联合转染的MΦ的抗肿瘤作用,本研究中,我们选用肿
瘤抗原触发的M-CSF和IFN-γ基因转染的MΦ治疗实验性肺转移黑色素瘤小鼠,观察了其
体内疗效并检测了经治疗后荷瘤小鼠CTL活性变化。
GM-CSF对某些实体瘤细胞具有杀伤作用已被许多实验证实[8,9]。本研究结果显示不同浓度
的GM-CSF对A549细胞均有杀伤作用,并呈剂量依赖性方式。尽管其杀伤效力不及化疗
药物VP16,但作为细胞因子仍具有十分重要的临床价,GM-CSF对肿瘤细胞杀伤效应除细
胞溶解[10]、增殖抑制[11]作用外,还可能与诱导凋亡有关。
巨噬细胞杀肿瘤的重要方式是分泌NO、TNF、H2O2等多种细胞毒效应分子。H2O2
的形成必需SOD催化,因此,检测肺癌患者AM产生NO、TNF、SOD活性高低在一定程
度上反映肺癌患者抗肿瘤免疫功能的强弱。本研究显示,肺癌患者AM经GM-CSF刺激后
iNOS表达增强,其培养上清液中NO、TNFα水平明显升高,说明AM抗肿瘤活性可被
GM-CSF刺激而增强;SOD活性升高无统计学意义,提示GM-CSF刺激AM产生各种效
应分子的能力具有不均一性GM-CSF对某些实体瘤细胞具有杀伤作用已被许多实验证实
[8
,
9]
。本研究结果显示不同浓度的GM-CSF对A549细胞均有杀伤作用,并呈剂量依赖性方式。
尽管其杀伤效力不及化疗药物VP16,但作为细胞因子仍具有十分重要的临床价值。GM-CSF
对肿瘤的杀伤机制目前尚不甚清楚。我们在研究中发现,经GM-CSF处理的A549细胞出
现典型的细胞凋亡形态改变,进一步研究与之相应的生化基础,显示有DNA梯状物形成,
提示GM-CSF对A549细胞有诱导凋亡之作用。由此推测,GM-CSF对肿瘤细胞杀伤效应
除细胞溶解[10]、增殖抑制[11]作用外,还可能与诱导凋亡有关。
4NF-kb与iNos-TNFα关系是什么?
NF-k与TNF抗前列腺癌作用的关系。方法:合成全硫代修饰的双链寡核苷酸BNF-kB
抑制剂;培养人前列腺癌细胞PC-3和成纤维细胞L929,休外分析,NF-kB抑制剂对TNF
细胞毒作用的影响。制作PC-3细胞裸鼠动物模型,瘤块直径达4mm时,肌注含有94个
氨基酸的前列腺分泌蛋白(PSP94)和肿瘤坏死因子衍生物11a融合基因的
pcDNA-PSP94-TNFαD11a真核表达质粒DNA,50μg/只,给药一次;肌注NF-kB抑制剂
5μmol/只,连续给药10d。设生理盐水和环磷酰胺对照组、pcDNA-PSP94和
pcDNA-PSP94-TNF αD11a质粒DNA组、NF-kB抑制剂组。结果以PC-3及L929为靶
细胞、NF-kB抑制剂TNF的细胞毒作用无明显影响。动物实验结果显示,
pcDNA-PSP94-TNF αD11a和NF-kB抑制剂联合 组抑瘤率为36%,是
pcDNA-PSP94-TNFαD11a组的1.8倍,pcDNA-PSP94组与pcDNA-PSP94NF-kB抑
制剂组、NF-kB抑制剂组与生理盐水组肿瘤大小均无明显差别。结论NF-kB抑制剂在体
内可明显增强TNF的抗前列腺癌作用。
5巨噬细胞是如何影响肿瘤细胞生成的?
.肿瘤组织中的巨噬细胞,即肿瘤相关巨噬细胞的关系以及在肿瘤中发挥的多种功能正被深
入的研究.肿瘤相关巨噬细胞不同的活化状态决定了其在肿瘤中是发挥抗肿瘤作用或促肿瘤
作用.一方面,TAM可以通过吞噬、杀伤肿瘤细胞以及递呈肿瘤相关抗原发挥免疫监视和抗肿
瘤作用;另一方面,TAM可以通过释放许多趋化因促进肿瘤生长和血管生成,并且可以降解基
质促进肿瘤侵袭和转移. 巨噬细胞至少可以被分为两种类型:M1型,即经典活化的巨噬细胞
和M2型,即替代性活化的巨噬细胞(Alternatively activated macrophage).M1型巨噬细胞在
细菌或其产物脂多糖,可能是癌细胞产生iNos促进血管新生,诱导TAMS浸润,TAMS也
产生iNOS促进肿瘤生长。
上次交的作业写错了一个问题,这次改过来了。
对于巨噬细胞与癌症这个话题,我有点摸不着头绪的感觉,不知从哪儿开始说起,这
个问题太专业了。真的是无从下手。
巨噬细胞与癌症,我发表不了什么专业评论,知识尚浅啊。这个读后感真不好写,我
就写这些吧?!