泛素蛋白酶体途径[课件参考]
- 格式:ppt
- 大小:1.78 MB
- 文档页数:40

泛素-蛋白酶体途径的组成和功能嘿,同学们!今天咱就来讲讲泛素-蛋白酶体途径,这可是个超级重要的知识点哦!泛素-蛋白酶体途径主要由泛素、泛素活化酶、泛素结合酶、泛素连接酶以及蛋白酶体这些家伙组成。
泛素就像是个小标签,活化酶把它激活,结合酶和连接酶再接力把这个标签贴到要被处理的蛋白质上,而蛋白酶体呢,就像是个强大的粉碎机,专门把被贴上标签的蛋白质给降解掉。
它的功能那可太重要啦!就好比一个公司里的清理部门,把那些没用的或者有问题的东西清理掉,保持公司的正常运转。
泛素-蛋白酶体途径可以调节蛋白质的水平和活性呀。
比如说,一些细胞周期相关的蛋白质,通过这个途径来精确控制它们的存在时间和数量,确保细胞分裂等过程有条不紊地进行,要是这个途径出了问题,那细胞不就乱套啦?这就好像一部精密的机器,每个零件都得在合适的时间和位置发挥作用。
再比如,一些受损的或者错误折叠的蛋白质,如果不及时清理掉,那不是会引发各种问题吗?就像家里的垃圾不及时扔掉,会滋生细菌、散发异味一样。
我给你们讲个真实的例子啊,在某些疾病中,比如癌症,这个途径可能就会出现异常。
癌细胞有时候会利用这个途径来逃避身体的监管,让自己能疯狂生长。
所以啊,研究这个途径对于理解疾病的发生机制和寻找治疗方法可太重要啦!想象一下,如果没有泛素-蛋白酶体途径,那细胞里的蛋白质不就乱成一团啦?就像没有交通规则的马路,到处都是混乱和拥堵。
所以说,这个途径真的是维持细胞内环境稳定的关键之一呀!同学们,明白了吗?可别小瞧了它哦!总之,泛素-蛋白酶体途径是细胞内一个至关重要的调节机制,它的作用广泛而深远,对于细胞的正常生理功能和疾病的发生发展都有着举足轻重的影响。
咱可得好好记住它呀!怎么样,是不是觉得很有意思呀?。

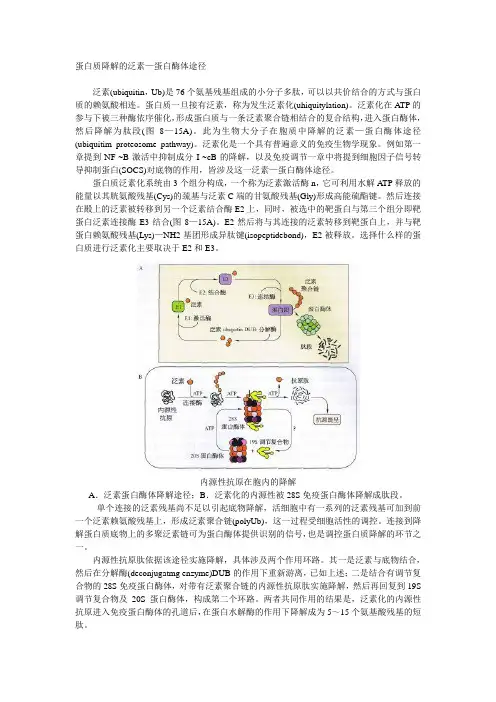
蛋白质降解的泛素—蛋白酶体途径泛素(ubiquitin,Ub)是76个氨基残基组成的小分子多肽,可以以共价结合的方式与蛋白质的赖氨酸相连。
蛋白质一旦接有泛素,称为发生泛素化(uhiquitylation)。
泛素化在A TP的参与下被三种酶依序催化,形成蛋白质与一条泛素聚合链相结合的复合结构,进入蛋白酶体,然后降解为肽段(图8—15A)。
此为生物大分子在胞质中降解的泛素—蛋白酶体途径(ubiquitim proteosome pathway)。
泛素化是一个具有普遍意义的免疫生物学现象。
例如第一章提到NF-~B激活中抑制成分I-~cB的降解,以及免疫调节一章中将提到细胞因子信号转导抑制蛋白(SOCS)对底物的作用,皆涉及这一泛素—蛋白酶体途径。
蛋白质泛素化系统由3个组分构成,一个称为泛素激活酶n,它可利用水解A TP释放的能量以其胱氨酸残基(Cys)的巯基与泛素C端的甘氨酸残基(Gly)形成高能硫酯键。
然后连接在殿上的泛素被转移到另一个泛素结合酶E2上,同时,被选中的靶蛋白与第三个组分即靶蛋白泛素连接酶E3结合(图8—15A)。
E2然后将与其连接的泛素转移到靶蛋白上,并与靶蛋白赖氨酸残基(Lys)—NH2基团形成异肽键(isopeptidebond),E2被释放。
选择什么样的蛋白质进行泛素化主要取决于E2和E3。
内源性抗原在胞内的降解A.泛素蛋白酶体降解途径;B.泛素化的内源性被28S免疫蛋白酶体降解成肽段。
单个连接的泛素残基尚不足以引起底物降解,活细胞中有一系列的泛素残基可加到前一个泛素赖氨酸残基上,形成泛素聚合链(polyUb),这一过程受细胞活性的调控。
连接到降解蛋白质底物上的多聚泛素链可为蛋白酶体提供识别的信号,也是调控蛋白质降解的环节之一。
内源性抗原肽依据该途径实施降解,具体涉及两个作用环路。
其一是泛素与底物结合,然后在分解酶(deconjugatmg enzyme)DUB的作用下重新游离,已如上述;二是结合有调节复合物的28S免疫蛋白酶体,对带有泛素聚合链的内源性抗原肽实施降解,然后再回复到19S 调节复合物及20S蛋白酶体,构成第二个环路。

泛素化蛋白酶体降解途径
泛素化蛋白酶体降解途径是一种重要的蛋白质降解途径,它能够将细胞内的蛋白质分解成小分子,以维持细胞内环境的稳定性。
本文将从泛素化蛋白酶体的结构、功能和调控等方面进行介绍。
泛素化蛋白酶体是一种由多个蛋白质组成的复合体,其中最重要的成分是泛素和泛素连接酶。
泛素是一种小分子蛋白质,它能够与目标蛋白质结合,形成泛素化的复合物。
泛素连接酶则是将泛素与目标蛋白质连接的酶。
泛素化的复合物会被识别并送入泛素化蛋白酶体中,经过一系列的酶解反应,最终被分解成小分子。
泛素化蛋白酶体的功能非常重要,它能够清除细胞内的异常蛋白质,维持细胞内环境的稳定性。
例如,当细胞内的蛋白质发生异常折叠或者氧化损伤时,泛素化蛋白酶体能够将其分解成小分子,以避免对细胞造成损伤。
此外,泛素化蛋白酶体还能够参与细胞周期的调控、免疫应答等生物学过程。
泛素化蛋白酶体的调控非常复杂,它受到多种信号通路的调控。
例如,热休克蛋白70(Hsp70)能够与泛素连接酶结合,促进泛素化蛋白酶体的形成。
另外,一些激素和细胞因子也能够调控泛素化蛋白酶体的活性。
此外,泛素化蛋白酶体的活性还受到细胞内钙离子浓度的影响。
泛素化蛋白酶体降解途径是一种非常重要的蛋白质降解途径,它能
够清除细胞内的异常蛋白质,维持细胞内环境的稳定性。
泛素化蛋白酶体的结构、功能和调控等方面都非常复杂,需要进一步的研究来深入了解其机制。


泛素化蛋白酶体降解途径一、引言泛素化蛋白酶体降解途径(Ubiquitin-Proteasome Pathway,UPP)是细胞内最主要的蛋白质降解途径之一。
它通过将泛素分子连接到待降解的蛋白质上,使其成为泛素化废弃物,然后被酶体中的泛素化蛋白酶体(Ubiquitin-Proteasome System,UPS)降解。
二、泛素化过程1. 泛素结构泛素是一种由76个氨基酸残基组成的小分子蛋白质。
它具有高度保守性,在不同物种中都存在。
2. 泛素连接酶(E1、E2、E3)在泛素化过程中,需要三种不同的酶来完成:泛素连接酶E1、泛素转移酶E2和泛素连接酶E3。
(1)E1:将游离状态下的泛素与ATP结合形成活性复合物,并将其转移至E2上。
(2)E2:接受来自E1的活性复合物,并将其传递给目标蛋白上的特定氨基酸残基。
(3)E3:通过与目标蛋白特定部位上的氨基酸残基结合,帮助E2将泛素转移至目标蛋白上。
3. 泛素化过程泛素化过程分为三个步骤:激活、转移和连接。
(1)激活:E1酶将游离状态下的泛素与ATP结合,形成活性复合物。
(2)转移:E2酶接受来自E1的活性复合物,并将其传递给目标蛋白上的特定氨基酸残基。
(3)连接:E3酶通过与目标蛋白特定部位上的氨基酸残基结合,帮助E2将泛素转移至目标蛋白上。
4. 泛素链泛素可以连接成不同长度和拓扑结构的链。
单一链和混合链都可以被识别和降解。
不同类型的泛素链会影响降解速率和选择性。
三、蛋白质降解1. UPS系统UPS系统是细胞内最主要的蛋白质降解途径之一。
它由两个主要部分组成:泛素化和蛋白酶体系统。
2. 蛋白酶体蛋白酶体是一个由多种酶和蛋白质组成的大分子复合物,它是细胞内最主要的蛋白质降解系统之一。
蛋白酶体中含有一个中空的核心结构,由多个亚基组成。
3. 泛素化蛋白酶体降解途径泛素化蛋白酶体降解途径是通过将泛素分子连接到待降解的蛋白质上,使其成为泛素化废弃物,然后被酶体中的泛素化蛋白酶体(UPS)降解。


提示泛素蛋白酶体途径泛素蛋白酶体途径,是细胞内一种重要的蛋白质降解途径,广泛参与调节细胞内蛋白质的稳态与代谢平衡。
在这一途径中,泛素蛋白酶体通过将泛素蛋白连接在靶蛋白上,然后将其降解成短的多肽片段,从而实现对细胞内蛋白质的调控。
泛素蛋白酶体途径在细胞生物学领域中具有非常重要的地位,对于维持细胞内环境的稳态以及适应生物体内外环境的变化起着至关重要的作用。
泛素蛋白酶体途径的发现和研究历程可以追溯到上世纪70年代。
通过对大肠杆菌中存在的一种叫做ubiH的蛋白进行研究,科学家们发现了这种蛋白可以被一个叫做特异的蛋白质分解酶降解,进而引发了对泛素蛋白酶体途径的兴趣和研究。
随着研究的不断深入,科学家们发现泛素蛋白酶体途径在许多生理和病理过程中都发挥着关键作用,包括细胞凋亡、免疫应答、细胞周期调控等。
泛素蛋白酶体途径的主要机制包括泛素化、蛋白降解和泛素蛋白酶体的功能调控。
在细胞内,泛素是一种小分子蛋白,在其结构域上具有七个连环环。
泛素连接到靶蛋白上的过程被称为泛素化,这是通过泛素激活酶、泛素结合酶和泛素连接酶协同完成的。
一旦靶蛋白被泛素化,其会被送往泛素蛋白酶体中进行降解。
泛素蛋白酶体内含有多种蛋白酶,其中最重要的是蛋白酶体蛋白酶,其对泛素化的靶蛋白进行降解。
此外,泛素蛋白酶体的功能也受到一系列调控蛋白的影响,例如ubiquilin,它在泛素化过程的识别和传递中起着关键作用。
研究发现,泛素蛋白酶体途径在许多疾病的发生和发展中发挥着重要作用。
例如,神经退行性疾病中,异常的泛素蛋白酶体途径会导致神经元的蛋白质积累和突触功能紊乱,从而引发神经退行性变化。
另外,在癌症的发生和发展过程中,泛素蛋白酶体途径的异常也常常被观察到,从而导致细胞内重要调控蛋白的累积,进而促进肿瘤的发展。
因此,对泛素蛋白酶体途径的深入研究不仅可以提供重要的细胞生物学基础知识,还可以为相关疾病的治疗提供新的靶点和策略。
在泛素蛋白酶体途径的研究中,有一些关键问题一直备受关注。

泛素—蛋白酶体途径代谢异常与2型糖尿病发生的关系随着社会的进步发展,人们生活水平的提高,糖尿病(diabetes mellitus,DM) 的发病率逐年增高。
据统计2011年全球糖尿病患者总数约 3.66 亿[1],到2030 年患病人数预计将达到 5.52 亿,这其中 85%~90%为 2 型糖尿病(type 2 diabetes mellitus,T2DM),而中国、印度和美国为世界糖尿病三大国[2]。
T2DM以及其相应带来的并发症已成为严重威胁人类机体健康的主要慢性病之一,不仅给患者身心带来巨大困扰,而且增加了患者家庭乃至社会的医疗负担。
T2DM主要表现为胰岛素抵抗和胰岛素分泌缺陷而非胰岛B细胞自身免疫破坏。
然而其确切发病机制尚未明确。
近年来,人们发现在肥胖、糖尿病等众多机体代谢紊乱情况下,胰岛素靶器官中泛素-蛋白酶体系统(Ubiquitin-Proteasome System, UPS)活性明显上调,并且表现出相应的病理表现[3],UPS在T2DM及其并发症的发生、发展过程中起了重要作用。
现将其机制作一综述。
1. 泛素—蛋白酶体系统的组成UPS由泛素(ubiquitin, Ub)、泛素活化酶(ubiquitin—activating enzyme, E1 )、泛素结合酶(ubiquitin—conjugating enzyme, E2)、泛素蛋白连接酶(ubiquitin—protein ligase, E3 )、蛋白酶体及其底物(蛋白质)构成,其对靶蛋白的降解是一种三级酶联反应过程。
通过UPS,细胞几乎可以对其内在的任何一种蛋白质进行高度特异性的降解,整个过程由底物蛋白的泛素化和蛋白酶体降解两个部分组成[4]【4】。
泛素化是对特异的靶蛋白进行泛素修饰的过程,泛素化修饰涉及泛素激活酶 E1、泛素结合酶 E2 和泛素连接酶 E3 的一系列反应。
首先在 ATP 供能的情况下,泛素分子 C 端的 Gly 残基与 E1 激活酶上的 Cys 残基结合,将泛素激活;接着,激活酶将活化的泛素分子通过转酰基作用转移到 E2 结合酶的 Cys 残基上,二者以硫酯键连接;之后,随着泛素连接酶识别靶蛋白,E3 连接酶分别结合着携带着泛素分子的 E2 结合酶和待泛素化修饰的底物蛋白,在连接酶的作用下,泛素分子从结合酶上转移到底物蛋白上,完成泛素化修饰。

细胞内蛋白质降解途径细胞内蛋白质降解途径是维持细胞内蛋白质稳态的重要过程。
细胞内蛋白质在其生命周期内会经历合成、折叠、功能发挥和降解等多个环节,其中降解是维持细胞内蛋白质稳态的关键环节。
本文将介绍细胞内蛋白质降解的三个主要途径:泛素-蛋白酶体途径、泛素-溶酶体途径和自噬途径,并探讨它们在维持细胞内蛋白质稳态中的作用和调控机制。
一、泛素-蛋白酶体途径泛素-蛋白酶体途径是细胞内最主要的蛋白质降解途径之一。
该途径主要通过降解已被泛素化的蛋白质。
泛素是一种小分子蛋白质,可以通过泛素激活酶、泛素结合酶和泛素连接酶的协同作用与目标蛋白质结合,形成泛素化的复合物。
这些泛素化的蛋白质复合物会被蛋白酶体识别并降解。
蛋白酶体是一种含有多种蛋白酶的细胞器,能够降解具有不同结构和功能的泛素化蛋白质。
这种途径在调控细胞周期、应激反应和免疫应答等生理过程中起到重要作用。
二、泛素-溶酶体途径泛素-溶酶体途径是另一种重要的蛋白质降解途径。
与泛素-蛋白酶体途径不同,该途径主要通过降解溶酶体中的蛋白质来维持细胞内蛋白质稳态。
在这个过程中,目标蛋白质被泛素化,并通过蛋白质糖基化修饰与溶酶体膜相结合,形成泛素化的溶酶体。
这些泛素化的溶酶体会进一步与内质网相关蛋白质一起进入溶酶体内部,并被溶酶体中的酸性酶降解。
泛素-溶酶体途径在细胞内维持蛋白质质量控制和细胞应激反应中发挥重要作用。
三、自噬途径自噬途径是一种通过溶酶体降解细胞内器官、蛋白质聚集体和异常蛋白质等的过程。
自噬途径主要通过形成自噬体来实现降解目标物质。
自噬体是由自噬囊膜包裹的膜囊结构,它能够将目标物质包裹并输送到溶酶体内部进行降解。
自噬途径在细胞发育、维持细胞内营养平衡和清除异常蛋白质等方面发挥重要作用。
此外,自噬途径还与多种疾病的发生和发展密切相关,如癌症、神经退行性疾病等。
细胞内蛋白质降解途径的调控机制非常复杂。
泛素-蛋白酶体途径和泛素-溶酶体途径都需要泛素连接酶家族的参与,而自噬途径则需要自噬相关基因的参与。