泛素 蛋白酶体系统PPT精选文档
- 格式:ppt
- 大小:2.98 MB
- 文档页数:31


泛素化和泛素蛋白酶体泛素化是一种重要的细胞调控机制,它通过将小分子泛素与目标蛋白结合,参与调控蛋白的降解、定位、激活等过程。
而泛素蛋白酶体则是负责泛素化蛋白降解的细胞器。
本文将从泛素化的机制、泛素蛋白酶体的结构和功能以及其在细胞调控中的重要作用等方面进行阐述。
一、泛素化的机制泛素化是一种通过泛素连接目标蛋白的调控机制。
泛素是一种由76个氨基酸组成的小分子蛋白质,它通过泛素连接酶(E1)、泛素转移酶(E2)和泛素连接酶(E3)等酶系统与目标蛋白结合。
这个过程被称为泛素化,也被称为泛素连接。
具体而言,泛素连接酶(E1)首先将泛素激活为泛素腺苷二磷酸(Ub-AMP),然后将泛素转移给泛素转移酶(E2)。
接着,泛素连接酶(E3)将泛素从泛素转移酶(E2)转移到目标蛋白上,形成泛素化的目标蛋白。
这个过程可以重复多次,形成多个泛素连接在一起的链状结构。
不同类型的泛素链状结构会导致不同的信号传递通路,从而调节蛋白的功能。
二、泛素蛋白酶体的结构和功能泛素蛋白酶体是一种细胞器,主要负责降解泛素化的蛋白。
它是由多个亚基组成的大分子复合物,其中最重要的亚基是泛素结合酶(Rpn)和20S核心粒子。
泛素结合酶(Rpn)负责识别和结合泛素化的蛋白,将其引导到20S核心粒子中进行降解。
20S核心粒子是泛素蛋白酶体的核心结构,它由多个蛋白亚基组成,形成一个中空的圆柱状结构。
这个结构中有多个降解酶活性位点,可以降解泛素化的蛋白。
泛素化的蛋白通过泛素结合酶(Rpn)引导进入20S核心粒子中,被降解酶降解为小片段,最终释放出氨基酸,供细胞重建新的蛋白。
三、泛素化和泛素蛋白酶体在细胞调控中的重要作用泛素化和泛素蛋白酶体在细胞调控中起着重要的作用。
首先,泛素化可以调控蛋白的降解。
通过连接不同类型的泛素链,可以选择性地将蛋白送入泛素蛋白酶体进行降解,从而维持细胞内蛋白的动态平衡。
其次,泛素化还可以调控蛋白的定位。
通过连接特定的泛素链,可以将蛋白定位到细胞的特定位置,实现其特定功能。

泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解。
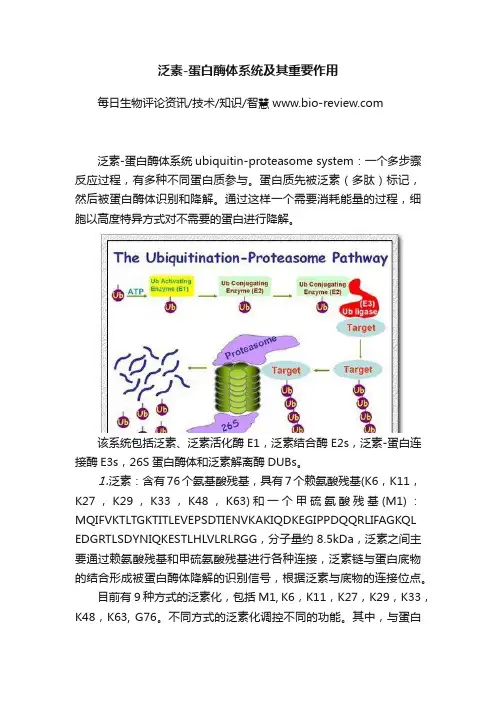
泛素-蛋白酶体系统ubiquitin-proteasome system:一个多步骤反应过程,有多种不同蛋白质参与。
蛋白质先被泛素(多肽)标记,然后被蛋白酶体识别和降解。
通过这样一个需要消耗能量的过程,细胞以高度特异方式对不需要的蛋白进行降解。
该系统包括泛素、泛素活化酶E1,泛素结合酶E2s,泛素-蛋白连接酶E3s,26S蛋白酶体和泛素解离酶DUBs。
UPS是细胞内一系列生命进程的重要调节方式,与疾病的发生发展关系密切。
研究证实泛素-蛋白酶体系统在心血管疾病中具有重要的病理生理学意义,可调节动脉粥样硬化、缺血后再灌注损伤、家族性心肌病、心肌肥厚和心脏衰竭等重要疾病的发生和发展。
另外,最新的研究表明,UPS的重要作用还在于其被充分利用后,可以代谢诸如毒素、脂肪、癌细胞在内的人体垃圾,另外代谢产生的能量可刺激细胞进行自我复制以完成人体的自我代谢修复功能。
泛素-蛋白酶体系统及其重要作用每日生物评论资讯/技术/知识/智慧泛素-蛋白酶体系统ubiquitin-proteasome system:一个多步骤反应过程,有多种不同蛋白质参与。
蛋白质先被泛素(多肽)标记,然后被蛋白酶体识别和降解。
通过这样一个需要消耗能量的过程,细胞以高度特异方式对不需要的蛋白进行降解。
该系统包括泛素、泛素活化酶E1,泛素结合酶E2s,泛素-蛋白连接酶E3s,26S蛋白酶体和泛素解离酶DUBs。
⒈泛素:含有76个氨基酸残基,具有7个赖氨酸残基(K6,K11,K27,K29,K33,K48,K63)和一个甲硫氨酸残基(M1):MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQL EDGRTLSDYNIQKESTLHLVLRLRGG,分子量约8.5kDa,泛素之间主要通过赖氨酸残基和甲硫氨酸残基进行各种连接,泛素链与蛋白底物的结合形成被蛋白酶体降解的识别信号,根据泛素与底物的连接位点。
目前有9种方式的泛素化,包括M1, K6,K11,K27,K29,K33,K48,K63, G76。
不同方式的泛素化调控不同的功能。
其中,与蛋白酶体降解相关的泛素化为K48。
⒉泛素活化酶E1:通过半胱氨酸残基与泛素C端活化的甘氨酸残基形成硫酯键,E1-泛素中间体中的泛素可以转移给数个E2。
⒊泛素结合酶E2:以泛素结合酶方式起作用,活性部位为半胱氨酸,E1将活化后的泛素转移到E2半胱氨酸的巯基上。
⒋泛素连接酶E3:为泛素-蛋白酶体系统选择性降解机制的关键因素,识别被降解的蛋白并将泛素连接到底物上。
⒌蛋白酶体(2.5MDa):由2个19S和1个20S亚单位组成的桶状结构,19S为调节亚单位,位于桶状结构的两端,识别多聚泛素化蛋白并使其去折叠。
19S亚单位上还具有一种去泛素化的同功肽酶,使底物去泛素化。
20S为催化亚单位,位于两个19S亚单位的中间,其活性部位处于桶状结构的内表面,可避免细胞环境的影响。


泛素—蛋白酶体途径代谢异常与2型糖尿病发生的关系随着社会的进步发展,人们生活水平的提高,糖尿病(diabetes mellitus,DM) 的发病率逐年增高。
据统计2011年全球糖尿病患者总数约 3.66 亿[1],到2030 年患病人数预计将达到 5.52 亿,这其中 85%~90%为 2 型糖尿病(type 2 diabetes mellitus,T2DM),而中国、印度和美国为世界糖尿病三大国[2]。
T2DM以及其相应带来的并发症已成为严重威胁人类机体健康的主要慢性病之一,不仅给患者身心带来巨大困扰,而且增加了患者家庭乃至社会的医疗负担。
T2DM主要表现为胰岛素抵抗和胰岛素分泌缺陷而非胰岛B细胞自身免疫破坏。
然而其确切发病机制尚未明确。
近年来,人们发现在肥胖、糖尿病等众多机体代谢紊乱情况下,胰岛素靶器官中泛素-蛋白酶体系统(Ubiquitin-Proteasome System, UPS)活性明显上调,并且表现出相应的病理表现[3],UPS在T2DM及其并发症的发生、发展过程中起了重要作用。
现将其机制作一综述。
1. 泛素—蛋白酶体系统的组成UPS由泛素(ubiquitin, Ub)、泛素活化酶(ubiquitin—activating enzyme, E1 )、泛素结合酶(ubiquitin—conjugating enzyme, E2)、泛素蛋白连接酶(ubiquitin—protein ligase, E3 )、蛋白酶体及其底物(蛋白质)构成,其对靶蛋白的降解是一种三级酶联反应过程。
通过UPS,细胞几乎可以对其内在的任何一种蛋白质进行高度特异性的降解,整个过程由底物蛋白的泛素化和蛋白酶体降解两个部分组成[4]【4】。
泛素化是对特异的靶蛋白进行泛素修饰的过程,泛素化修饰涉及泛素激活酶 E1、泛素结合酶 E2 和泛素连接酶 E3 的一系列反应。
首先在 ATP 供能的情况下,泛素分子 C 端的 Gly 残基与 E1 激活酶上的 Cys 残基结合,将泛素激活;接着,激活酶将活化的泛素分子通过转酰基作用转移到 E2 结合酶的 Cys 残基上,二者以硫酯键连接;之后,随着泛素连接酶识别靶蛋白,E3 连接酶分别结合着携带着泛素分子的 E2 结合酶和待泛素化修饰的底物蛋白,在连接酶的作用下,泛素分子从结合酶上转移到底物蛋白上,完成泛素化修饰。

蛋白酶体蛋白酶体是在真核生物和古菌中普遍存在的,在一些原核生物中也存在的一种巨型蛋白质复合物。
在真核生物中,蛋白酶体位于细胞核和细胞质中。
蛋白酶体的主要作用是降解细胞不需要的或受到损伤的蛋白质,这一作用是通过打断肽键的化学反应来实现。
能够发挥这一作用的酶被称为蛋白酶。
蛋白酶体是细胞用来调控特定蛋白质和除去错误折叠蛋白质的主要机制。
经过蛋白酶体的降解,蛋白质被切割为约7-8个氨基酸长的肽段;这些肽段可以被进一步降解为单个氨基酸分子,然后被用于合成新的蛋白质。
需要被降解的蛋白质会先被一个称为泛素的小型蛋白质所标记(即连接上)。
这一标记反应是被泛素连接酶所催化。
一旦一个蛋白质被标记上一个泛素分子,就会引发其它连接酶加上更多的泛素分子;这就形成了可以与蛋白酶体结合的“多泛素链”,从而将蛋白酶体带到这一标记的蛋白质上,开始其降解过程。
从结构上看,蛋白酶体是一个桶状的复合物,包括一个由四个堆积在一起的环所组成的“核心”(右图中蓝色部分),核心中空,形成一个空腔。
其中,每一个环由七个蛋白质分子组成。
中间的两个环各由七个β亚基组成,并含有六个蛋白酶的活性位点。
这些位点位于环的内表面,所以蛋白质必须进入到蛋白酶体的“空腔”中才能够被降解。
外部的两个环各含有七个α亚基,可以发挥“门”的作用,是蛋白质进入“空腔”中的必由之路。
这些α亚基,或者说“门”,是由结合在它们上的“帽”状结构(即调节颗粒,右图中红色部分)进行控制;调节颗粒可以识别连接在蛋白质上的多泛素链标签,并启动降解过程。
包括泛素化和蛋白酶体降解的整个系统被称为“泛素-蛋白酶体系统”。
蛋白酶体降解途径对于许多细胞进程,包括细胞周期、基因表达的调控、氧化应激反应等,都是必不可少的。
2004年诺贝尔化学奖的获奖主题就是蛋白质酶解在细胞中的重要性和泛素在酶解途径的作用,而三位获奖者为阿龙〃切哈诺沃、阿夫拉姆〃赫什科和欧文〃罗斯。
发现在发现泛素-蛋白酶体系统之前,细胞中的蛋白质降解被认为主要依赖于溶酶体,一种膜包裹的囊状细胞器,内部为酸性环境且充满了蛋白酶,可以降解并回收外源蛋白质以及衰老或损伤的细胞器。

泛素蛋白酶水解系统泛素蛋白酶水解系统是细胞中重要的降解途径,它参与调控蛋白质降解、调节细胞周期、维持细胞稳态等多种生物学过程。
本文将从泛素蛋白酶的结构与功能、泛素化作用的调控、泛素蛋白酶的分类与功能等方面对泛素蛋白酶水解系统进行介绍。
一、泛素蛋白酶的结构与功能泛素蛋白酶是一类能够降解泛素化蛋白的酶,它由泛素结合酶(E1)、泛素转移酶(E2)和泛素连接酶(E3)组成。
其中,泛素结合酶负责将游离泛素与ATP结合形成泛素-AMP化物,再将泛素从泛素-AMP化物中释放出来。
泛素转移酶接受泛素结合酶转移过来的泛素,并将其与目标蛋白连接。
泛素连接酶是决定泛素化靶蛋白的种类和位置的关键酶,它通过与泛素转移酶和靶蛋白相互作用,催化泛素的连接反应。
泛素蛋白酶通过这一复杂的酶系统,将泛素与靶蛋白连接,从而标记靶蛋白以供降解。
泛素蛋白酶水解系统在细胞内起着至关重要的作用。
它参与调控细胞周期、修复DNA损伤、调节转录和翻译、维持细胞稳态等多个生物学过程。
此外,泛素蛋白酶还参与调控细胞凋亡、抗原表位呈递、免疫应答等。
二、泛素化作用的调控泛素化作用是泛素蛋白酶水解系统的关键步骤之一,其调控对维持细胞内蛋白质平衡至关重要。
泛素化作用的调控主要涉及到三个环节:泛素结合酶、泛素转移酶和泛素连接酶。
1. 泛素结合酶的调控:泛素结合酶的活性受到多种因素的调控,如磷酸化、乙酰化、泛素结合辅因子的参与等。
这些调控机制能够调节泛素结合酶与泛素结合的亲和力,从而影响泛素化的效率和特异性。
2. 泛素转移酶的调控:泛素转移酶的活性主要受到泛素连接酶和底物蛋白的调控。
泛素连接酶可以通过与泛素转移酶结合,促进泛素转移酶的活性。
底物蛋白则可以与泛素转移酶相互作用,促进泛素转移酶与底物蛋白之间的结合。
3. 泛素连接酶的调控:泛素连接酶的调控主要包括底物特异性和底物识别。
泛素连接酶通过与底物蛋白相互作用,将泛素转移到底物蛋白上。
底物特异性是指泛素连接酶对不同底物的选择性,底物识别是指泛素连接酶通过与底物蛋白的结合来调控泛素连接的位置。



ReviewThe involvement of the ubiquitin proteasome system in human skeletal muscle remodelling and atrophyA.J.Murton ⁎,D.Constantin,P.L.GreenhaffCentre for Integrated Systems Biology and Medicine,School of Biomedical Sciences,The University of Nottingham,Queen's Medical Centre,Nottingham,UKa b s t r a c ta r t i c l e i n f o Article history:Received 14May 2008Received in revised form 23October 2008Accepted 24October 2008Available online 29October 2008Keywords:ExerciseSkeletal muscle AtrophyIn flammationUbiquitin proteasome system HumanSkeletal muscle exhibits great plasticity in response to altered activity levels,ultimately resulting in tissue remodelling and substantial changes in mass.Animal research would suggest that the ubiquitin proteasome system,in particular the ubiquitin ligases MAFbx/atrogin-1and MuRF1,are instrumental to the processes underlying these changes.This review article therefore examines the role of proteasomal-mediated protein degradation in human skeletal muscle in health and disease.Speci fically,the effects of exercise,disuse and in flammatory disease states on the ubiquitin proteasome system in human skeletal muscle are examined.The article also identi fies several inconsistencies between published human studies and data obtained from animal models of muscle atrophy,highlighting the need for a more comprehensive examination of the molecular events responsible for modulating muscle mass in humans.©2008Elsevier B.V.All rights reserved.1.IntroductionThe dynamic adaptation of skeletal muscle to changing require-ments has been acknowledged for decades,but the molecular events underpinning these adaptations have only just started to become clearer.Intricately regulated anabolic and catabolic pathways are responsible for the maintenance of muscle protein content,which represents the bulk of skeletal muscle mass,and imbalance between these pathways results in a change in muscle mass that can sometimes be rapid.Classically,increases in skeletal muscle mass have been associated with individuals partaking in resistance exercise programs [1]or after the administration of anabolic agents,such as testosterone [2,3].Conversely,a loss of muscle mass has been observed following disuse [4–6]and a number of disease states,including but not limited to;sepsis [7],cancer cachexia [8,9],AIDS [8],diabetes mellitus [9,10]and renal failure [11,12],with sometimes rapid onset and profound consequences.In eukaryotic cells,four main mechanisms are responsible for the majority of cellular protein degradation,mediated via the actions of either cysteine-dependent aspartate speci fic proteases (caspases)[13,14],cathepsins [15],calcium-dependent calpains [16,17],or the ubiquitin proteasome system (UPS)[18,19].A substantial body of evidence has accumulated implicating the UPS as the principal regulator of skeletal muscle atrophy [20].This has led many researchers to focus on both the components and regulators of the UPS in skeletal muscle,with the hopes ofproviding a greater understanding of the mechanisms responsible for increased skeletal muscle protein degradation,and identifying clinically relevant therapeutic targets to ablate disease-induced muscle atrophy.To date,the vast majority of the information about the mechanisms responsible for muscle atrophy has been obtained from cell line and small mammal (primarily rodents)based research,with limited information coming to light concerning the molecular mechanisms modulating skeletal muscle mass in humans.Whilst the similarity in organ systems,systemic physiology and genes between the rodent and human species is useful,the validity of information obtained from non-human studies needs to be questioned when considering their direct relevance to human situations of muscle hypertrophy/atrophy.Indeed,several reported observations give rise to this stance.Firstly,most studies utilise animals that are immature and still growing,where high rates of muscle protein synthesis,low metabolic stability (i.e.a weak capacity to maintain homeostasis)and a comparatively high basal metabolic rate are commonly observed [21].In contrast,most human studies involve subjects of adult age where,in the absence of pathological events,display body weights that are effectively stable for months at a time,experience high metabolic stability,and have much lower speci fic metabolic rates that include lower rates of muscle protein turnover.Speci fic to skeletal muscle,the response of the processes governing muscle protein synthesis to insulin differs between rodents and humans,notably where insulin,even at supraphysiological doses,fails to augment muscle protein synthesis in humans without prior amino acid administration [22,23].These observations,in conjunction with the discrepancies of both the stress response to experimental procedures and the general severityBiochimica et Biophysica Acta 1782(2008)730–743⁎Corresponding author.Tel.:+4401158230154;fax:+4401158230142.E-mail address:andrew.murton@ (A.J.Murton).0925-4439/$–see front matter ©2008Elsevier B.V.All rights reserved.doi:10.1016/j.bbadis.2008.10.011Contents lists available at ScienceDirectBiochimica et Biophysica Actaj ou r n a l h o me pa g e :ww w.e l s ev i e r.c o m/l o c a t e /b ba di sof the atrophy inducing conditions between animal models and studies conducted in informed,consenting,human adults,provides some cause for concern when translating cell-line/animal data to the human situation.Nevertheless,findings from cell line,animal and human based research,has consistently pointed to the UPS as a pivotal component to the instigation and regulation of muscle protein breakdown.However,to date,a comprehensive examination of the literature pertaining to the regulation of the UPS in modulating human skeletal muscle mass,particularly in regard to the effects of exercise and disease,has not been undertaken.In this review article therefore,we will first outline the proposed involvement of the UPS in muscle atrophy,as discovered in cell lines and small animals.This will be followed by a detailed examination of published studies investigating the effects of exercise on the UPS pathways in human skeletal muscle.Subsequently,conditions that favour muscle atrophy will be examined and discussed,including the use of exercise to modulate the atrophic response of catabolic disease states.2.The muscle atrophy ‘program ’The increased expression of UPS constituents,including compo-nents of the 26S proteasome itself,and the prevention of increased proteolysis in atrophic conditions via the use of proteasome inhibitors [24–26],has led many to conclude that the UPS is intrinsically linked to the degradation of myo fibril proteins in skeletal muscle [27].Of note,it has been shown that the UPS is unable to degrade intact myo fibrils [28],suggesting that an alternative system is responsible for initial myo fibril disruption,possibly the result of increased caspase-3[13]or calpain activity [29].The UPS is an ATP-dependent proteolytic system that involves the degradation of target proteins,with substrates identi fied for degradation by the addition of ubiquitin (Ub)molecules,a process itself coordinated via the activity of a triplet of enzymes [30].Ubiquitin transfer to targeted proteins represents a robust method for the speci fic targeting of protein families.In brief,Ub is first bound to the Ub-activating enzyme (E1)via a high-energy thioester bond in an ATP-dependent process (Fig.1).Ubiquitin is subsequentlytransferredFig.1.UPS mediated protein degradation.Diagrammatical representation of the UPS detailing the activation and conjugation of free Ub onto Ub-ligase targeted proteins.Addition of four Ub monomers in a chain,covalently attached by lysine 76,is suf ficient for entry into,and subsequent degradation by,the 26S proteasome.Ubiquitin chains are subsequently recycled via the action of the deubiquitinating enzymes.731A.J.Murton et al./Biochimica et Biophysica Acta 1782(2008)730–743from the Ub-activating enzyme to the Ub-conjugating enzyme (E2)via the formation of a new thioester linkage between Ub and a cysteine residue of the E2enzyme.Generally,albeit with a few notable exceptions [31,32],the Ub monomer,catalysed by the action of an Ub-ligase enzyme (E3),is conjugated to the target protein via an isopeptide bond between the ɛ-amino group of a lysine residue in the target protein and the carboxy-terminal glycine residue 76in Ub (for a review see [30]).The process is repeated until a minimum of four Ub monomers are covalently attached via lysine residue 48of Ub to the target protein,the classical formation that is recognised by the 26S proteasome as a signal to degrade the target protein [33].In eukaryotic cells,only one Ub-activating enzyme has been characterised and,observed in relatively high abundance,it meets the somewhat-divergent demands placed upon it by the UPS [34,35].Indeed,even under normal physiological conditions,the UPS is constantly degrading damaged or malformed proteins [36],so as to maintain normal cell function.In humans,several dozens of Ub-conjugating enzymes are also present,in addition to hundreds of Ub-ligases [37],through which target speci ficity is established.Following successful ubiquitination,and only once the criterion for recognition by the 26S proteasome has been met,proteins are unfolded and fed into the proteasome in an ATP-dependent process [19].The 26S proteasome consists of a 20S catalytic core and 19S regulatory caps.Structurally,the 20S proteasome consists of four heptameric rings,formed from alpha subunits providing structural support [38],and the beta subunits responsible for the chymotrypsin-like,trypsin-like and caspase-like activities (for a comprehensive review see [39]).The proteasome cleaves tagged proteins into short oligonucleotides,after which the activity of tripeptidyl-peptidase II and exopeptidases result in almost complete degradation of the original protein [40].In 2001,the mRNAs for two muscle-speci fic Ub-ligases were found to be elevated in the atrophied muscles of food-deprived mice [41]and limb immobilised rats [42].These two Ub-ligases,MAFbx/atrogin-1and MuRF1,were collectively termed ‘atrogins ’and increased mRNA levels for both were subsequently observed in various animal models of muscle atrophy,including but not limited to;burn injury [43],uremia [44],diabetes mellitus [44],denervation [42],unweighting [4,44],dexamethasone administration [45,46]and sepsis [49,50].Moreover,when knocked out,MAFbx/atrogin-1−/−and MuRF1−/−mice appeared resistant to the effects of denervation-induced muscle atrophy,with a 56%and 36%respective sparing of muscle loss,compared to littermate controls [42].Consistent with these findings,it was suggested that MAFbx/atrogin-1and MuRF1may,in part,be responsible for the UPS mediated muscle protein degradation observed during muscle atrophy conditions [47].Fig.2.AKT regulated signalling events.Representation of the effects of anabolic stimuli on AKT mediated signalling events in skeletal muscle.Blue and red colouring highlights pathways and events that are increased and decreased,respectively,following AKT activation (phosphorylation).732 A.J.Murton et al./Biochimica et Biophysica Acta 1782(2008)730–743Recent evidence has suggested that the transcriptional regulation of MAFbx/atrogin-1and MuRF1Ub-ligases are intrinsically linked to both cellular metabolic status and inflammatory state via a coordinated pathway of signalling events.Li and colleagues discovered that both H2O2and the catabolic cytokine tumor necrosis factor-alpha(TNFα), were competent inducers of MAFbx/atrogin-1mRNA expression in ske-letal muscle[48].Moreover,they observed that TNFαinduced ex-pression of MAFbx/atrogin-1mRNA was blunted by the p38MAPK inhibitors SB203580and curcumin,suggesting that TNFαworks via a p38MAPK dependent mechanism to stimulate MAFbx/atrogin-1 expression[49].At about the same time,Cai and colleagues,with the use of constitutively active IκK mice(termed MIKK mice),showed an activation of NF-κB leads to an elevation in MuRF1,but not MAFbx/ atrogin-1,mRNA[50].Additionally,in the tibialis anterior of MIKK mice, bothfibre diameter andfibre cross sectional area were reduced to56% and32%respectively,compared to control mice[50].Moreover,MIKK mice crossed with MuRF1−/−mice experienced a50%rescue of protein degradation[50],thus demonstrating that NF-κB mediated protein degradation is heavily dependent on the upregulation of the MuRF1Ub-ligase.Collectively,thesefindings highlight that the transcriptional regulation of MAFbx/atrogin-1and MuRF1are sensitive to local inflammatory mediators(TNFα)and the NF-κB inflammatory pathway itself.Furthermore,they show MAFbx/atrogin-1and MuRF1to be able to function independently of each other.Transcription of the MAFbx/atrogin-1and MuRF1genes also appear under the control of the forkhead Foxo family of transcription factors.It had been known for some time that transgenic over-expression of Foxo1resulted in an atrophic phenotype[51].Likewise, elevations in the forkhead transcription factors have been observed in muscle of animals subjected to starvation,glucocorticoid administra-tion,diabetes,uremia and cancer[44,52].The Foxo family of transcription factors are rendered inactive as a result of phosphoryla-tion by AKT(also known as protein kinaseB)which results in the removal of the transcription factors from the nucleus where they are subsequently sequestered in the cytoplasm[53].AKT represents an important mediator of the protein synthesis initiation pathway and is responsible for regulating the formation of the43S preinitiation complex via GSK3βinhibition,synthesis of ribosomal proteins,and binding of the terminal7-methylguanosine mRNA cap to the eIF4F complex via mTOR activation(Fig.2;for a comprehensive review see [54]).Consequently,as the Foxo1transcription factor is also known to increase the transcription of pyruvate dehydrogenase kinase isoform4 [52,55],a reversible inhibitor of the pyruvate dehydrogenase complex [56],and thus a regulator of the decarboxylation of pyruvate to acetyl-CoA in the TCA cycle,the regulation of MAFbx/atrogin-1and MuRF1 mRNA expression by Foxo forkhead transcription factors appears intrinsically linked to the rate of muscle protein synthesis and cellular oxidative metabolism.In support,our group has recently shown lipopolysaccharide-induced endotoxaemia to result in the coordi-nated reductions of AKT protein levels and cytosolic phosphorylation of Foxo1and Foxo3.These observations were accompanied by significant increases in MAFbx/atrogin-1and PDK4protein levels and significant reductions in muscle protein content and pyruvate dehydrogenase complex activity in rodent fast-twitch muscle leading to an impairment of carbohydrate oxidation[57].To clarify,during times of increased muscle protein synthesis,it would be hypothesised that MAFbx/atrogin-1and MuRF1mRNA expression would be suppressed,and vice versa.However,as discussed in detail later,in humans this relationship is not consistently observed.3.Exercise and the UPS in human skeletal muscle3.1.Eccentric contraction induced muscle“damage”and remodellingExercise,an essential component of a healthy and balanced lifestyle,elicits substantial metabolic and functional demands upon skeletal muscle in humans.The nature of these demands depends greatly upon the mode,intensity and duration of the exercise[58].A number of human studies have examined the role of the UPS in skeletal muscle hypertrophy/remodelling following eccentric and concentric contractions and,to a lesser degree,endurance exercise. While either unaccustomed eccentric or concentric exercise elevates levels of both fractional protein synthesis rates and fractional protein breakdown rates[59],the cellular and subsequent morphological changes in response to the two exercise stimuli appear somewhat divergent.Unaccustomed or intense eccentric exercise has been associated with significant muscle damage,characterised by localised muscular pain,inflammation[60],extensive sarcomere disruption,z-disk streaming[61,62]and increased serum creatine kinase activity [63]and troponin I levels[64,65].Concomitant with a rise in myofibrillar damage and inflammation/pain,muscle strength can be reduced by50%,with a gradual recovery over the5–10day period post-exercise[66,67].Conversely,whilst a single bout of concentric resistance exercise in untrained subjects can also induce myofibrillar disruption,the degree of damage is far more limited than that of eccentric exercise[67].However,it should be noted that mild eccentric and concentric exercise displays only limited damage and, moreover,evidence suggests that eccentric loading is important for maximising the hypertrophic response to resistance training[68,69].Biopsies obtained form the vastus lateralis of healthy male subjects 24h after completing an intense eccentric exercise protocol show increased proportions of myofibrillar disruption compared to samples taken immediately post exercise[70].Thus,a progression of the exercise induced muscle damage is dependent not only on the initial mechanical stress,but also on post-exercise events[70].Consistent with this suggestion,an elevation in the mRNA and protein expression of free Ub and components of the20S proteasome in skeletal muscles of subjects following a single bout of eccentric exercise,in addition to increased levels of Ub conjugated proteins48h post exercise(Table1), strongly suggest that the UPS may play a part in eccentric contraction induced muscle damage.A sole report demonstrating no change in the amount of Ub-conjugated proteins following eccentric exercise was potentially due to an insufficient period of time between the exercise intervention and the period of measurement(24h;[71]).The induction of the UPS during eccentric contraction induced muscle damage appears instrumental in the remodelling of the skeletal muscle myofilaments;tentatively instigated to limit skeletal muscle damage from future eccentric bouts.Indeed,the degree of muscle damage associated with the original bout of eccentric exercise is attenuated following a second bout performed several weeks after thefirst[72,73].Thus,adaptations must have occurred to limit the musclefibre susceptibility to mechanical stress[67].Suggested remodelling events include the addition of sarcomeres in series, resulting in shorter average sarcomere length,altered motor until recruitment patterns[74],and an increase in desmin protein levels resulting in a putative enhancement of z-disk stability[70].Moreover, elevated levels of skeletal muscle heat shock protein's HSP27and HSP72have been observed following eccentric exercise[70,75,76]. The heat shock proteins represent a family of molecular chaperones; being expressed at times of cellular stress,they are responsible for both the maintenance of protein structure and orchestrating the repair of malformed/damaged proteins.As a consequence,heat shock proteins are considered to have anti-proteolytic and anti-apoptotic effects[77].Collectively,this appears tantamount to the skeletal muscle cell trying to preserve function during a period of increased damage/remodelling elicited by exercise,which is dependent upon intensity[78].The role of the UPS in the initiation of the‘protective repeated bout effect’is less clear.While it had been hypothesised that a reduction in UPS mediated proteolysis of myofibrillar proteins would be expected following subsequent bouts of eccentric exercise performed several weeks apart,presumably because sarcomeric remodelling had already733A.J.Murton et al./Biochimica et Biophysica Acta1782(2008)730–743occurred,contrasting observations have thus far been reported.For example,Willoughby et al.[64]showed greater increases in muscle Ub protein content in healthy volunteers following thefirst,rather than a second eccentric exercise bout conducted3weeks apart. Conversely,increased Ub-conjugation in skeletal muscle samples of the vastus lateralis have been observed on the second of two exercise sessions(involving eccentric leg press and knee extension exercises) separated by N5weeks[71].Thus,further work is required to rationalise these two observations and determine the involvement of the UPS in this adaptive response.It also seems that to provide meaningful information these experiments need to be performed in conjunction with measurements of muscle protein turnover.The signal(s)responsible for instigating increased skeletal muscle UPS-mediated proteolysis following eccentric exercise are currently unknown,but the cytokines have garnered much attention.Exercise induced muscle damage is known to stimulate an acute phase inflammatory response resulting in the infiltration of neutrophils and macrophages into skeletal muscle[60].Indeed,a single bout of eccentric exercise is known to increase macrophage counts per surface unit of tissue in skeletal muscle compared to controls[71].Moreover, downhill running,which requires extensive eccentric contractions of the vastus lateralis muscle,results in localised elevations of TNFαand interleukin-6(IL-6)mRNA and induces substantial muscle damage [79].Interestingly,contracting skeletal muscle is one of the major sites of IL-6production[70],however,the source of the elevated TNFαis less clear but is most likely to be macrophage-derived.Given that both TNFαand IL-6are capable of inducing muscle atrophy[49,80–83]and of activating the UPS[49,84,85],it is tempting to suggest that they may be involved in the instigation of the remodelling process following eccentric damage.However,no evidence in humans yet exists to confirm these postulations.Moreover,given that eccentric exercise contractions often result in only a small percentage of severely damagedfibres and yet global reduced rates of glucose uptake to the order of20–30%are observed,a systemic factor may be responsible for the events that follow eccentric-induced muscle damage[86–88].3.2.Resistance training induced muscle mass gainsHeavy resistance training can induce substantial increases in muscle mass,predominantly the result of increases infibre cross-sectional area (hypertrophy)as opposed tofibre number(hyperplasia).Moreover, resistance training can increase the cross-sectional area of all three majorfibre types(I,IIa and IIb),with a20-week training program sufficient to increase the cross-sectional areas of type IIab and IIbfibres by47%,type IIa by39%and type I by17%[89].The hypertrophic response to strength training appears predominantly the result of enhanced rates of muscle protein synthesis simultaneous to increases in muscle protein breakdown,albeit the change in the latter being of smaller magnitude than the former thus leading to an overall positive accumulation of muscle protein content[90].Two groups have reported an elevation of MuRF1mRNA levels up to24h[91–94],and MAFbx/ atrogin-1mRNA levels up to4h[91,95],following the induction of an acute bout of resistance exercise(Table1).However,mRNA quantifica-tion of the atrogenes a few hours subsequent to these measurements have shown either reduced or basal levels[91–98].Collectively,theseTable1Exercise and the UPSMeasured component Time point(s)measured Intervention Study Eccentric exercise Ubiquitin↑Ub mRNA and protein6and24h KE—7sets×10reps at150%of1-RM[64]↑Ub mRNA and protein48h KE—7sets×10reps at150%of1-RM[76]↑Ub48h Dynamoter—5sets×53reps[168]↔Ub-conjugated proteins24h LP—3sets×12reps at120%of1-RM[71]KE—10sets×10reps at120%of1-RM↑Ub-conjugated proteins48h Dynamoter—5sets×53reps[168]20S proteasome↑20S mRNA and protein48h KE—7sets×10reps at150%of1-RM[76]↑HC2and HC3mRNA6and24h KE—7sets×10reps at150%of1-RM[64]↑20S protein24h KE—7sets×10reps at150%of1-RM[64]Ub-conjugating enzymes↑E2mRNA and protein6and24h KE—7sets×10reps at150%of1-RM[64]↑E2mRNA and protein48h KE—7sets×10reps at150%of1-RM[76]Ub-ligase↓MAFbx/atrogin-13,6and24h0.55m step down every2s for12min[97] Resistance exercise Ub-ligases↑MuRF1mRNA1–4h KE—3sets×10reps at70%of1-RM⁎[91]↑MuRF1mRNA2h LP—4sets×10reps at80%of1-RM[94]↑MuRF1mRNA4h KE—3sets×10reps at70%of1-RM[93]↑MuRF1mRNA4h KE—3sets×10reps at65%of1-RM[92]↑MuRF1mRNA24h KE—3sets×10reps at70%of1-RM⁎[91]↔MuRF1mRNA24h KE—3sets×10reps at65%of1-RM[92]↔MuRF1mRNA48h LP—4sets×10reps at80%of1-RM[94]↑MAFbx/atrogin-1mRNA Immediately LE—10sets×10reps at80%of1-RM[95]↑MAFbx/atrogin-1mRNA1–4h KE—3sets×10reps at70%of1-RM⁎[91]↓MAFbx/atrogin-1mRNA3h LP—8sets×5reps at80%of1-RM[98]↔MAFbx/atrogin-1mRNA3h LE—8sets×5reps at maximal effort[96]↔MAFbx/atrogin-1mRNA4h KE—3sets×10reps at70%of1-RM[93]↔MAFbx/atrogin-1mRNA4h KE—3sets×10reps at65%of1-RM[92]↓MAFbx/atrogin-1mRNA6h0.55m step up every2s for12min[97]↔MAFbx/atrogin-1mRNA8–24h KE—3sets×10reps at70%of1-RM⁎[91]↔MAFbx/atrogin-1mRNA24h KE—3sets×10reps at65%of1-RM[92]↓MAFbx/atrogin-1mRNA24h LE—10sets×10reps at80%of1-RM[95]↓MAFbx/atrogin-1mRNA48h LP—4sets×10reps at80%of1-RM[94]↔MAFbx/atrogin-1mRNA72h LE—10sets×10reps at80%of1-RM[95]Data obtained from human studies investigating changes in skeletal muscle UPS components following acute eccentric or acute resistance exercise bouts in non-previously resistance trained individuals.Time denotes period(s)elapsed from completion of exercise bout and recorded measurement.KE=Knee extension,LE=Leg extension,LP=Leg press,1-RM=1-Rep max.⁎=previously endurance trained.734 A.J.Murton et al./Biochimica et Biophysica Acta1782(2008)730–743observations are in accordance withfindings of a31%increase in the fractional breakdown rate of skeletal muscle proteins3h post-resistance exercise,declining to an18%increase by24h,and a return to resting values by48h[59].The transient elevation of the fractional breakdown rate concomitant to an increase in MuRF1and MAFbx/ atrogin-1mRNA levels is consistent with the suggestion that the enhanced leg proteolysis observed is in part MAFbx/atrogin-1and MuRF1dependent.However,measurements of the protein expression for the two atrogins are currently lacking and would represent a necessary prerequisite,in conjunction with the simultaneous determi-nation of muscle protein breakdown,in confirming this hypothesis.The abovefindings are largely based on studies involving a single bout of resistance exercise in previously untrained,recreationally active individuals.The response to a regular and progressive resistance exercise protocol is likely to differ.Chronic resistance exercise is known to elicit a significant increase in the proportion of type IIafibres[89].Moreover,greatest increases in MAFbx/atrogin-1 mRNA levels appear to occur in slow-twitchfibres following resistance exercise in humans(4h and24h post-exercise;[92]), suggesting that the purported rise in MAFbx/atrogin-1and MuRF1 mediated protein breakdown following resistance exercise represents a remodelling stimulus driving a change infibre-type expression to that of a faster phenotype.Despite the extensive remodelling that occurs following a chronic resistance exercise regime,levels of MAFbx/atrogin-1protein and MuRF1mRNA remain elevated[99]. The consequences of the sustained elevation of the atrogins in response to chronic resistance exercise remains unknown,although suggestions levied of an increased basal rate of protein breakdown in the context of increased protein turnover remain speculative in the absence of measures of muscle protein turnover itself.Increases in muscle protein synthesis are observed hours after a bout of resistance exercise paralleled by increases in the phosphor-ylation state of key components of the insulin-signalling pathway,in most cases including AKT[100].However,two recent reports have suggested that the association between factors of translation initiation and muscle protein synthesis in the human may be complex,where changes in phosphorylation state of key members of translation initiation,including AKT,GSK3βand mTOR,appear not to mirror changes in leg protein synthesis[101,102],reinforcing the requirement of measures of muscle protein turnover in study designs.What is also not clear is the impact of Foxo inhibition(phosphorylation)by AKT on MAFbx/atrogin-1and MuRF1transcription in human skeletal muscle under conditions of resistance exercise.While reports in animals and C2C12myotubes would suggest a pivotal role for this pathway in the control of MAFbx/atrogin-1and MuRF1expression[103,104],and by association,muscle protein breakdown in the initial hours following resistance exercise,its role in humans would appear modest.Indeed, given the discord reported between the mRNA levels of the two atrogenes[91–94]and the independent but contradictory reports of transient increases in expression of both Ub-ligases in the face of AKT activation following resistance exercise,other regulatory mechanisms are likely to dominate in human skeletal muscle.Intriguingly,an early increase in p38MAPK by resistance exercise has been observed[95] which,in conjunction with localised muscle inflammation and NF-κB activation[105],could represent the primary elements responsible for exercise-induced expression of the atrogenes and thus,the early protein breakdown component of exercise.However,skeletal muscle contraction also induces a marked ele-vation in plasma IL-6[106].Moreover,the degree of IL-6expression is dependent on the intensity,duration and mode of the exercise[107] and appears muscle derived[108].Interestingly,exercise also results in increased circulating levels of anti-inflammatory cytokines and the inflammatory cytokine inhibitors,IL-1receptor antagonist and soluble TNFαreceptors[106,109,110];only very intense exercise stimulates TNFαexpression[111].In addition,IL-6is typically the first cytokine to appear in the circulation during exercise and shows the most marked expression amongst the elevated cytokines.Intrigu-ingly,treatment of cachectic murine colon adenocarcinoma with anti-mouse IL-6antibody was successful at ablating the skeletal muscle atrophy commonly observed[112].Furthermore,in C2C12myotubes, IL-6shortens the half-life of long-lived proteins[113].Concordantly, transgenic mice overexpressing IL-6experience profound muscle atrophy and elevated Ub gene expression,which is preventable by the administration of an IL-6receptor antagonist[85].Therefore,the exercise-induced expression of IL-6could,tentatively,represent an alternative stimulus following resistance exercise for the early elevation in the UPS.4.UPS in muscle atrophy conditions in humansSkeletal muscle comprises∼40%of the total body mass of an average adult human and has energy requirements even at rest. Moreover,the inherent structure of skeletal muscle represents a substantial reservoir of protein that can be utilised by hepatic tissue during times of stress[114].During periods of prolonged inactivity or disease,a substantial reduction in muscle mass is commonly observed,reducing total muscular energy requirements and,during disease,providing substrates for hepatic gluconeogenesis and acute phase protein production[114].Despite these beneficial features,a dramatic loss of skeletal muscle mass can be debilitating,resulting in prolonged times to recovery,increased risk of subsequent injury and a severe burden on health care provisions.Pathological and environ-mental states that can induce skeletal muscle atrophy can be broadly divided into those with and without an inflammatory stimulus. Examples of the former include bed rest/immobilisation,spinal cord injury and fasting;whilst states with an inflammatory element include cancer,AIDS,sepsis and perhaps sarcopenia in the frail elderly.Despite both cohorts experiencing skeletal muscle atrophy, the mechanistic events between groups most likely differ and are examined in detail below.4.1.Non-inflammatory skeletal muscle atrophyMuscle disuse through limb immobilisation,bed rest or spinal cord injury represent the majority of non-inflammatory related atrophy seen in the clinical setting,and the degree of muscle loss can be appreciably large.Indeed,two weeks of leg-immobilisation has been shown to result in an almost5%reduction in quadriceps lean mass and a27%fall in isometric strength[4].Likewise,a20% reduction in type I musclefibre cross sectional area and a30% reduction in type IIfibre area,has been observed following60-days bed rest[115].While elements of the UPS,notably levels of ubiquitinated proteins[116]and HC6mRNA[4],appear elevated during disuse,a consistent elevation of MAFbx/atrogin-1and MuRF1 mRNA has not been observed in human skeletal muscle in the studies performed to date(Table2).While some reports have detailed an increase in MAFbx/atrogin-1[4,116,117]mRNA to disuse stimuli in humans,a number have reported no change or a reduction in the mRNA levels of MAFbx/atrogin-1[6]or MuRF1[4,6,115,116].In comparison,a classical elevation of the atrogenes has been observed in animals following denervation[42],hind limb suspension[42],or space-flight[118].Numerous explanations exist for the disparity between animal models of disuse,where large and consistent elevations in expression of the atrogenes have been observed,and humans,where variablefindings in regard to MAFbx/atrogin-1and MuRF1levels have thus far been reported.Most notable is the generally greater severity of the procedures performed on animals to induce muscle disuse compared to that employed in human volunteers/patients.Furthermore,with the desire to limit invasive procedures in humans,the number of muscle biopsies performed to obtain tissue is usually minimised;as a consequence,a comprehen-sive examination of the temporal expression of the atrogins in735A.J.Murton et al./Biochimica et Biophysica Acta1782(2008)730–743。