肿瘤侵袭和转移的恶性生物行为及分子干预
- 格式:doc
- 大小:2.66 MB
- 文档页数:23

肿瘤转移的分子机制及抑制策略在肿瘤治疗领域,防止癌症的转移一直是学者们关注的焦点之一。
癌症转移是指肿瘤细胞从原发病灶脱离,进入体液或血液循环系统,在身体的其他部位形成次生肿瘤。
这种过程与许多分子机制相关。
因此,深入了解肿瘤转移的分子机制,并研制出有效的抑制策略,可以减缓或预防癌症的转移。
在本文中,我们将介绍肿瘤转移的分子机制及抑制策略。
一、肿瘤转移的分子机制1.细胞黏附细胞黏附是肿瘤细胞侵袭、转移的第一步,它涉及细胞表面分子间的相互作用。
细胞黏附分子包括整合素家族、选择素家族等。
当肿瘤细胞表面的整合素和细胞外基质结合时,形成一个在细胞表面的“桥梁”,这促进了肿瘤细胞有选择性的黏附和浸润。
选择素是内皮细胞表面的一类受体蛋白,它们可以通过结合肿瘤细胞表面的配体,在血管内壁上诱导肿瘤细胞黏附。
黏附相关的分子机制被广泛研究,并成为治疗肿瘤转移的热点。
2.肿瘤细胞迁移肿瘤细胞迁移是癌症转移中的一个关键步骤。
针对这一步骤设计的抑制策略包括锁定肿瘤细胞自体转化素、阻断细胞骨架蛋白、改变胞外微环境和通过其他途径调控肿瘤细胞迁移。
因此,肿瘤细胞的迁移是必须被关注的,而且许多研究者均侧重于发现相关分子机制、潜在靶点。
3.细胞外微环境细胞外微环境是肿瘤转移的一个主要因素,包括生长因子、细胞外基质、炎性因子等。
它们通过对癌细胞激活细胞信号通路、促进细胞黏附、增强细胞的侵袭、改变肿瘤细胞的蛋白质表达等途径,参与了癌症发生和转移的进程。
现代肿瘤治疗中一些抗肿瘤药物的治疗效果,就与肿瘤细胞与其微环境靶向结合而产生的细胞信号传导有关。
二、肿瘤转移抑制策略1.锁定肿瘤细胞自体转化素自体转化素是一个可以激活细胞迁移的信号蛋白,其中的RhoGTP酶家族可以调控肿瘤细胞形态学、迁移能力。
因此,这些靶点是治疗癌症转移的有意义的药物靶点。
研究人员提出了各种针对Rho酶的抑制剂,如西格玛-2 RhoGTP酶抑制剂。
在临床试验中,这类化合物已被证明对癌症有抑制转移的效果。

恶性肿瘤中侵袭性细胞的分子机制随着现代医学技术的不断进步,恶性肿瘤的治疗已经取得了许多重大突破。
然而,恶性肿瘤的侵袭性细胞却是目前尚未得到有效控制的难题之一。
这些侵袭性细胞会通过各种途径,如侵入血管、淋巴管等,从而形成远处的转移灶,严重影响了患者的治疗和生存质量。
那么,这些侵袭性细胞的分子机制是什么呢?一、基质金属蛋白酶(MMPs)基质金属蛋白酶是一组可以降解细胞外基质的酶,包括胶原酶、凝血酶原酶、明胶酶等。
在肿瘤细胞侵袭过程中,MMPs能够获得增强的活性,并且以高水平存在于所有肿瘤转移的过程中。
MMPs主要通过两种方式发挥作用:一种是将基质蛋白水解并解除对细胞的阻碍;另一种则是通过释放生物活性分子,如细胞凋亡物质、生长因子等,从而促进癌细胞的侵袭和转移。
二、血小板源生长因子(PDGF)PDGF是一种由血小板分泌的生长因子,能够刺激紧密连接细胞之间的信息传递,从而促进细胞的迁移和增殖。
通过与其受体结合,PDGF能够激活细胞中一系列的信号转导途径,如PI3K和Akt信号通路等,从而加强肿瘤细胞的侵袭和转移能力。
同时,PDGF也与TGF-β、VEGF等其他细胞因子共同作用,相互影响,促进肿瘤侵袭的过程。
三、整合素抗体整合素是一种由细胞中介分泌的膜外蛋白质,能够与基质蛋白结合,形成牢固的结合。
在肿瘤侵袭的过程中,整合素抗体可以干扰整合素与基质蛋白的结合,从而防止肿瘤细胞的迁移和侵袭。
其中,针对整合素αvβ3的抗体是治疗骨转移非常有效的药物之一。
这类药物可以阻止肿瘤细胞与骨骼组织特定的基质蛋白结合,减少骨转移的发生。
四、细胞骨架蛋白肿瘤细胞的侵袭性受细胞骨架蛋白调控。
细胞骨架蛋白的主要成分包括微丝、微管和中间纤维。
在肿瘤侵袭过程中,肿瘤细胞的膜流动性增强、细胞粘附增强,主要受到微丝的调控。
微丝的形态和网络结构变化都能够影响细胞粘附和金属蛋白酶等内容物的分布和活性。
因此,微丝骨架的调控对于癌细胞的侵袭至关重要。

肿瘤恶性转移的分子机理及其肿瘤治疗新进展肿瘤是一种具有很高致死率的疾病,恶性肿瘤是其最为危险的类型。
肿瘤的致死主要源于其癌细胞恶性转移,即癌细胞从原发灶脱离并向远处器官和组织转移扎根,导致多种系统宕机,严重威胁患者的健康和生命。
目前,肿瘤恶性转移的分子机理正在日益明朗化,众多治疗新进展正在涌现,使人们对于肿瘤的治疗和防控增强了信心。
肿瘤恶性转移的分子机理,是指肿瘤细胞在侵入周围组织后可能进入循环系统,随血液或淋巴循环到体内的其他组织和器官,进行扩散和侵袭,并最终扎根。
恶性转移的机制十分复杂,不同肿瘤可采用不同的扩散机制,但大多数肿瘤细胞在其恶性转移的过程中都会经过以下步骤:第一,原发灶癌细胞经过异质性选择,脱离原发灶,并穿过本地基质,进入血管或淋巴管。
在这一过程中,癌细胞需要获得适当的因素进行诱导或刺激,如血管生成因子(VEGF)、血管紧张素等。
第二,癌细胞穿过血管壁或淋巴管壁,进入循环系统。
在这个过程中,其侵袭性和比表面积显著增加,因为癌细胞需要与内皮细胞、纤维蛋白和其他血液成分相互作用,逃避免疫监视。
过程中,癌细胞还需要适应情况,对外界压力有所回应,如抗缺血和低氧、抗缺糖等激素。
第三,在循环系统中,癌细胞可以在全身不同的器官和组织中形成微转移灶(单个或少量癌细胞),或形成晚期转移灶(大量癌细胞和附带微环境)。
这个过程将发生异质性选择,是由多种分子驱动的。
如整体性增强转移抑制蛋白(dt-rdis),抗炎细胞因子TNF-α,和攻击癌细胞的NK/T细胞。
第四,癌细胞在晚期转移灶扎根,随后进入生长期和稳定期。
在其生命周期中,癌细胞通过表达多种分子来操纵和利用周围细胞(如免疫细胞、间充质细胞、内皮细胞等),以逃避被免疫监视以及刺激周围良性细胞为其提供环境便利。
这些分子包括表观遗传转录因子、激素、氧化应激、微RNA等。
肿瘤恶性转移的分子机理研究在各种手段的帮助下,如高通量药物筛选、生物信息学、基因编辑技术等方面已取得了一些成功。

肿瘤细胞的侵袭和转移机制是肿瘤学领域研究的重点。
肿瘤的侵袭和转移是恶性肿瘤的关键性问题,这是因为只有侵袭和转移的肿瘤才具有严重的生命威胁。
了解,对我们治疗恶性肿瘤具有重要的指导意义。
一、是复杂的过程,涉及到多种分子的参与和调控。
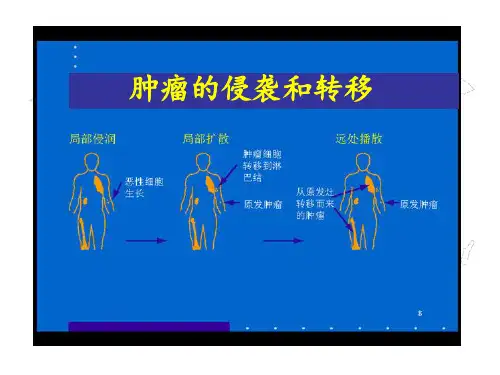
在进展的恶性肿瘤中,肿瘤细胞会从原发灶侵入周围组织,侵袭到周围的结构和组织,最终进入到淋巴系统或者血液循环系统中,形成远处转移。
肿瘤细胞的侵袭和转移过程可以分为以下几步:1. 肿瘤细胞入侵肿瘤细胞的入侵是指肿瘤细胞从原发灶侵入周围组织的过程。
肿瘤细胞的入侵是一个复杂的过程,涉及到多个分子的参与和调控。
首先,肿瘤细胞会与周围的基质和细胞结构发生粘附。
然后,肿瘤细胞通过吞噬和分解周围基质的方式,破坏周围的结构,向外移动。
2. 肿瘤细胞血管生成血管生成是肿瘤细胞进入血液循环系统的关键步骤。
肿瘤细胞通过刺激周围的内皮细胞,促进血管的生长和形成,增加血液循环系统与肿瘤细胞的接触面积。
3. 肿瘤细胞进入血液循环在未侵入淋巴系统的情况下,肿瘤细胞可以通过血液循环系统进行远距离扩散。
肿瘤细胞在血液中的存活和侵入远端器官的能力是依赖于多种因素的,这些因素包括肿瘤细胞的大小、形态、表面特征和扩散过程中血液流的力学参数等等。
4. 肿瘤细胞移植肿瘤细胞的移植是指肿瘤细胞从原发灶到远处器官的转移过程。
肿瘤细胞的移植是一个非常复杂的过程,涉及到多个分子的参与和调控。
首先,肿瘤细胞会进入到周围组织,并与周围的细胞结构发生粘附。
然后,肿瘤细胞通过吞噬和分解周围基质的方式,破坏周围的结构,向外移动。
最后,肿瘤细胞穿过血管壁,进入到周围组织,并继续繁殖和生长。
二、肿瘤细胞侵袭和转移的调控机制肿瘤细胞侵袭和转移的调控机制非常复杂,涉及到多种分子的参与和调控。
肿瘤细胞的侵袭和转移主要是由肿瘤细胞本身以及周围微环境的相互作用所调节的。
1. 肿瘤细胞相关的调控因素(1)细胞粘附分子细胞粘附分子(CAMs)是调节肿瘤细胞粘附和迁移的关键分子。


肿瘤细胞转移的分子机制引言:肿瘤是当今世界面临的重大健康挑战之一。
其中,肿瘤细胞的转移是导致癌症死亡的主要原因之一。
了解肿瘤细胞转移的分子机制对于开发新型抗癌治疗策略具有重要意义。
本文将探讨肿瘤细胞转移过程中所涉及的关键分子机制,并介绍相关研究进展。
一、上皮-间质转化(EMT)上皮-间质转化(Epithelial-mesenchymal transition, EMT)是导致肿瘤细胞侵袭和转移的重要步骤。
在EMT过程中,上皮性肿瘤细胞失去其极性特征,获得间质性特征,从而增强了其迁移和侵袭能力。
多种信号通路参与调控EMT过程,其中包括Wnt、TGF-β和Notch等。
1. Wnt信号通路Wnt信号通路在胚胎发育和恶性肿瘤进展中起到关键作用。
该通路通过调控β-catenin蛋白的稳定性影响细胞命运决策。
在肿瘤中,活化的Wnt信号通路可以促进肿瘤细胞EMT的发生,并增强转移能力。
2. TGF-β信号通路TGF-β信号通路是EMT过程中的另一个重要参与者。
TGF-β通过Smad依赖和非Smad依赖途径调控肿瘤细胞的EMT。
它被证明可以抑制上皮细胞标志物(如E-钙粘蛋白)的表达,同时促进间质细胞标志物(如N-钙粘蛋白)的表达,从而导致肿瘤细胞转移到其他部位。
3. Notch信号通路Notch信号通路广泛参与多种生物学过程,包括肿瘤发生和发展。
激活的Notch信号通路在肿瘤中被发现与EMT相关。
它可以介导转录因子Snail、Slug和Twist等的表达,并促进肿瘤细胞向间质状态转化。
二、基质金属蛋白酶(MMPs)基质金属蛋白酶(Matrix metalloproteinases, MMPs)在肿瘤细胞转移中发挥着重要的作用。
MMPs能够解除细胞外基质的组织结构,从而促进肿瘤细胞进入血管和淋巴系统。
1. MMP-2和MMP-9MMP-2和MMP-9是最常研究的两种MMPs。
它们被广泛表达于多种肿瘤类型中,并与肿瘤侵袭和转移相关。

恶性肿瘤研究解码肿瘤侵袭与转移的关键因素恶性肿瘤是一种危害人类健康的严重疾病,侵袭性和转移性是其最主要的特点。
镜下观察肿瘤组织可以发现,肿瘤细胞在侵袭与转移过程中表现出许多异常的生物学行为,这些行为通常受到多种关键因素的调控。
针对这些关键因素的研究对于深入理解肿瘤侵袭与转移机制,并寻找有效的治疗方案具有重要意义。
一、基因突变和异常表达恶性肿瘤的发生发展与基因突变与异常表达密切相关。
一些关键的肿瘤抑制基因(如TP53)的突变会导致细胞凋亡的抑制和肿瘤发生。
同时,肿瘤相关基因(如KRAS、EGFR等)的异常表达也能够促进肿瘤细胞的侵袭和转移能力。
因此,深入研究基因突变和异常表达对于揭示肿瘤侵袭与转移的机制具有重要意义。
二、细胞外基质的重塑与降解肿瘤细胞在侵袭与转移过程中需要通过破坏细胞外基质(ECM)来获得更多的空间和营养物质。
鉴于此,一些研究表明,肿瘤细胞分泌的降解性蛋白酶(如基质金属蛋白酶)能够降解基质蛋白,破坏细胞外基质的完整性,进而促进肿瘤细胞的侵袭。
此外,肿瘤细胞还能通过与细胞外基质的相互作用,诱导细胞外基质的重塑,以适应肿瘤细胞的侵袭性需求。
因此,细胞外基质的重塑与降解在肿瘤侵袭与转移过程中是一个重要的关键因素。
三、上皮-间质转化(EMT)上皮-间质转化是肿瘤细胞侵袭和转移的关键步骤之一。
正常上皮细胞通过转化为间质细胞,失去上皮细胞的架构和功能,获得一系列侵袭性的表型特征。
EMT过程中,一些转录因子(如Snail、Twist等)的表达上调,调控细胞间质转化。
同时,上皮细胞间质转化还促进了细胞骨架的重塑,使细胞形态发生变化,进而增强肿瘤细胞的侵袭和转移能力。
四、肿瘤相关炎症炎症反应是肿瘤侵袭与转移过程中的重要环节。
许多炎性细胞和炎性因子参与了肿瘤相关炎症的调控。
炎症细胞能够分泌各种生物活性物质,如细胞因子、化学因子等,刺激肿瘤细胞的增殖、侵袭和转移。
另外,炎症反应还可以诱导血管生成,为肿瘤细胞提供更多的营养物质和氧气,进一步促进肿瘤的侵袭和转移。

肿瘤的转移与侵袭机制肿瘤是一个复杂的多因素疾病,其核心是细胞增殖与分化的异常,这些细胞对生长因子的反应过于强烈并不断地增殖、累积,随着时间的推移,肿瘤体积逐渐增大。
但是,最令人担忧的是,肿瘤往往不会固定于一个部位,而是通过血管或淋巴系统“漂流”,侵入其他组织器官,这种现象被称为转移与侵袭。
转移与侵袭机制非常复杂,需要从多个方面进行探究。
首先是肿瘤细胞的侵袭能力。
许多研究发现,肿瘤细胞具有复杂的信号传导网络和多种功能分子调控机制,从而增强自身的黏附和运动能力。
当肿瘤细胞从原位开始运动,它们首先使用各种黏附分子和细胞外基质进行粘附,如整合素和蛋白酶等。
然后,肿瘤细胞通过释放一系列的外泌体(例如外泌体、微小RNA和信号蛋白等)来进一步激活基质金属蛋白酶。
这些蛋白酶能够切割其周围的纤维素和胶原蛋白等,从而出现通称为“自动导向运动”的现象。
这意味着肿瘤细胞可以安全地通过所有染色体区域,迅速侵入传输系统。
同时,表面上看上去,这些肿瘤细胞的粘附能力也得到了极强的提高。
这对于肿瘤细胞侵袭行为的成功实施非常关键。
其次是肿瘤细胞的穿透能力。
如果肿瘤细胞想要在传输系统中锁定特定的区域,那么它们必须具备穿透和跨越细生物膜的能力。
针对这点,肿瘤细胞表面上的铁蛋白和铁黏附蛋白(Ferritin and Ferritin-binding protein)等已经证实可以很好地协助肿瘤细胞进行修补和切割,并由此获得穿透力,令其更容易进入血管中。
另外,表达丰富的钙蛋白也能够促进肿瘤细胞的穿透和移动效率,提高肿瘤细胞的侵袭性。
在钙信号通路中,多元功能蛋白(Multi-functional proteins)也被证明可以调节肿瘤细胞的侵袭能力和血管内皮细胞的血管新生。
其表达的活化酶型环化腺苷酸酶纤维蛋白酶原活化物受体-1(PAR-1)同样也是调节肿瘤细胞转移的重要因子之一。
最后是肿瘤细胞与宿主体内环境的相互作用。
肿瘤细胞寻找理想的生长环境,从血液或淋巴流通过程中获得各种有益的因子,例如营养物质、生长因子和信号分子等。
项目名称:肿瘤侵袭和转移的恶性生物行为及分子干预首席科学家:詹启敏中国医学科学院肿瘤医院肿瘤研究所起止年限:2009.1至2013.8依托部门:教育部一、研究内容1.细胞周期调控异常与肿瘤恶性增殖、侵袭相关分子机理肿瘤是一种“细胞转导通路异常”性疾病,我们将通过分子生物学、细胞生物学、和动物模型相结合的研究技术,重点研究抑癌基因p53、BRCA1、Gadd45介导的信号通路与细胞周期蛋白Aurora-A、Cyclin B1、Plk1的相互作用,以及在细胞周期调控和肿瘤恶性表型形成中的生物学功能和分子机制。
从而揭示细胞增殖失调与肿瘤侵袭转移的内在联系。
2.细胞凋亡和分化异常与肿瘤侵袭性生长的关系细胞凋亡调控机制的异常与侵袭特性生长密切相关。
促进细胞死亡的机制失活和抑制凋亡的分子的大量表达使癌症细胞存活延长,使基因突变的积累和癌变机会的增加,同时凋亡机制的异常导致肿瘤细胞具有抗药性。
通过对细胞死亡新机制、肿瘤干细胞凋亡相关研究、细胞信号转导与凋亡调控等研究,深入探讨侵袭性生长的机制。
3.肿瘤干细胞和肿瘤微环境与肿瘤转移的内在关系以恶性肿瘤干细胞特异性表型为突破口,从白血病干细胞延伸至实体瘤干细胞,研究其自我更新和分化的特性,探讨肿瘤转移的起始因素和关键分子生物学性质,认别恶性肿瘤干细胞与微环境或肿瘤“基质”间的相互作用机制,从而为特异性打击肿瘤干细胞作为彻底消除肿瘤转移潜能的一种新策略提供重要的理论基础。
4. 肿瘤血管和淋巴管新生介导的肿瘤转移机制已鉴定肿瘤组织中血管表达Tim-3和淋巴管表达Sema4c等是沉默抗肿瘤免疫的重要活性分子,能通过与淋巴细胞的对话,诱导机体对肿瘤的免疫耐受,是新发现的肿瘤免疫逃避机制。
在本项目中我们拟进一步研究血管和淋巴管促肿瘤转移的动力学,应用切片流式细胞仪等最新一代高通量组织和细胞分析平台,确定血管和淋巴管中预示早期肿瘤转移的始动免疫分子和对其进行靶向干预策略的有效性。
5. 肿瘤转移标记物与肿瘤转移靶向识别将在前期工作的基础上,开展肿瘤标志物的应用及相关机制研究,着重围绕针对肿瘤转移病灶的标志物及对肿瘤细胞恶性生物行为影响的分子机制进行研究;将以与肿瘤转移密切相关的酪氨酸磷酸酶PRL-3和促干细胞生长因子Hiwi 为切入点,深入研究PRL-3的促肿瘤转移机制;并通过活体成像标记达到准确识别微转移病灶的目的。
6. 肿瘤转移潜伏细胞和微转移病灶的早期诊断及清除将利用针对亚临床微小转移病灶的靶向多肽,与促凋亡蛋白TRAIL、白喉毒素及化疗药物与其融合,制备一批针对亚临床微小转移病灶的导向生物治疗制剂,实现对肿瘤微小转移病灶的靶向杀伤作用。
并通过调控免疫应答,筛选肿瘤细胞抗原肽特异性亲和配体,增强抗原提呈,促进导向生物制剂有效清除微小肿瘤病灶。
7.恶性肿瘤增殖拮抗阻遏研究研究作用于多环节阻遏肿瘤转移的新型制剂是治疗肿瘤的发展方向。
以肿瘤相关基因、信号转导分子等为靶点,采用转基因、RNA干扰技术和小分子药物设计等手段,阐明肿瘤增殖阻遏分子作用机制。
研究针对肿瘤增殖与转移作用的生物治疗剂和小分子物质,并建立实时观察肿瘤生成与转移的示踪方法,观察体内的抗肿瘤生长与转移的效果,为新型肿瘤增殖阻遏剂的研究提供理论基础。
8.肿瘤侵袭、转移分子靶向干预在前期研究中,我们已经筛选出一批肿瘤转移肿瘤相关基因和调节因子,包括LASS2、BACP、HPO、Mag、Ceap、BPY2IP1、DACT1、LOC374946、4OF7、Sema4C和Tim3等,我们将深入研究其生物性状并筛选或合成相应小分子拮抗剂,应用模式生物进行验证。
同时致力于改造新一代靶向载体,为肿瘤转移靶向分子干预提供有利条件。
二、预期目标总体目标本项目将以建立阻断肿瘤转移有效方法、改善肿瘤患者预后、保障人类健康为目标,分析肿瘤恶性生物学行为的基本生物要素和演化过程,揭示肿瘤恶性增殖和侵袭表型与肿瘤转移潜能的内在联系。
以严重危害我国人民生命健康的1~2种肿瘤(如食管癌、肝癌)为主要对象,从肿瘤侵袭、转移多元调节机制研究入手,提出肿瘤转移分子干预的新思路和新途径,建立阻遏肿瘤转移的有效手段。
本项目重点放在研究肿瘤细胞恶性生物行为和肿瘤转移分子干预,瞄准国际发展前沿的基础上,密切结合我国实际情况,争取获得一批具有我国自主知识产权的肿瘤转移相关靶基因、关键靶分子;对前期工作基础中发现的肿瘤转移新的机制在更大规模、更多肿瘤病种中加以研究;引入新的分子治疗手段,使我国在分子治疗上逐步形成自主创新的能力。
经过5年项目实施,预期在控制肿瘤侵袭、阻断肿瘤转移专项研究中获得若干突破,最终使我国在控制肿瘤侵袭转移的基础和应用研究方面与国际前沿接轨并在国际同领域研究中占据重要地位,加速我国抗肿瘤生物高科技产业的建立和发展。
五年目标1.明确肿瘤干细胞的转移表型:自我更新是所有干细胞的主要特性之一。
对于肿瘤干细胞来说,这一特性尤为重要。
肿瘤干细胞自我更新和成瘤的分子机制目前还不清楚。
我们拟研究在肿瘤干细胞中具有特异表达的分子,观察这些特异性分子和肿瘤克隆与肿瘤转移潜能的内在联系,从干细胞的自我更新的角度为寻找特异遏制肿瘤转移的方法提供理论基础和前期实验数据。
2.确定细胞恶性生物行为与肿瘤侵袭性生长、转移潜能的分子分型:肿瘤是一种“细胞转导通路异常”性疾病, 根据前期“ 973”筛选出的关键分子,将转移性肿瘤的分子划分成若干“细胞转导通路异常”亚型。
在每种亚型中确定若干反映该通路功能状况的“检测分子”和逆转功能异常的“药靶分子”。
通过新一代高通量细胞分析仪确定新的信号传导通路和调节位点。
3.明确促进肿瘤转移生物行为形成的微环境机制:揭示肿瘤细胞与肿瘤微环境相互作用中关键的肿瘤免疫逃逸机制,肿瘤“基质”在肿瘤转移中的重要作用;并重点研究肿瘤血管内皮细胞,淋巴管内皮细胞与生理性血管和淋巴管生成机制的差异,确定可能的肿瘤转移干扰阻断靶点。
4.进行肿瘤标志物、靶向肽、特异性抗体和小分子拮抗剂等针对微小潜伏肿瘤病灶或残留肿瘤细胞的分子药靶的筛选、鉴定或合成,建立旨在彻底清除微小潜伏肿瘤病灶或残留肿瘤细胞的有效方法。
5.建立多种分子模型和模式动物学模型,改进完善用于本项目分子机理研究(如细胞增殖、凋亡和分化)的技术体系,建立我国肿瘤转移相关基因文库,创建新的一批分析系统和技术支撑平台。
筛选肿瘤转移的特异性拮抗剂,验证可能作为阻断肿瘤侵袭、转移药靶的有效性和临床实用性,从功能效应的角度出发,在分子、细胞、组织和整体水平设置验证分析体系。
6.培养一批在国际肿瘤学界有竞争力的中青年科学家,造就我国肿瘤侵袭、转移研究领域学术群体强势,集中我国专家的攻关能力,取得若干重大突破,建立我国发展抗肿瘤生物高科技产业的技术平台和试验基地。
7.通过组织和集中我国专家的攻关能力,使该项目取得若干重大突破,大大提升我国在该领域的研究水平,确立在国际上的先进地位。
研究成果主要以研究论文和独立开发的技术成果(专利)形式公布,计划在国内外发表学术论文300篇左右,着重在国外核心刊物发表学术论文60篇左右,力争在Science 或Nature发表1~2篇论文,申报专利10项。
并将研究成果有计划纳入国家863新技术和新药开发进程。
三、研究方案(一)总体学术思路本项目以探索肿瘤侵袭转移的基本规律,并建立较为有效的阻遏方法为基本出发点,提出新的研究思路:(1)从细胞周期调控、细胞分化、细胞凋亡、肿瘤干细胞、血管生成、肿瘤微环境等方面深入研究肿瘤侵袭、转移的恶性生物学行为,建立干预肿瘤转移的有效措施,使潜伏在肿瘤患者体内的残留癌细胞的增殖分化与凋亡达到动态平衡,肿瘤患者处于健康状态下的带瘤细胞生存;(2)通过肿瘤标志物、靶向肽、特异性抗体和小分子拮抗剂等针对微小潜伏肿瘤病灶或残留肿瘤细胞的分子药靶的筛选、鉴定或合成,建立旨在彻底清除微小潜伏肿瘤病灶或残留肿瘤细胞的有效方法,从而最大限度减少肿瘤复发转移的可能性。
通过功能效应和临床整体验证的角度来检验分子干预的有效性和实用性,真正做到有效控制肿瘤复发转移,保护患者健康。
(二)技术路线(三) 创新点与特色1.从多层次和多学科交叉入手,围绕恶性肿瘤恶性生物学行为对细胞增殖、转移的影响这一肿瘤研究的关键问题,结合我国已有的研究积累和基础,探索恶性肿瘤相关基因、功能蛋白、信号分子等可能的分子干预机制。
2.在遵循肿瘤侵袭转移的生物规律,建立有效的分子干预方法的基本观点上,提出在保持肿瘤患者健康状态下的带瘤细胞生存的新思路,作为控制肿瘤复发转移的基本要素。
3.恶性肿瘤复发转移是在临床治疗达到痊愈后以潜伏肿瘤病灶或残留瘤细胞复燃为基础,因此,通过特异性靶向识别和清除微小潜伏肿瘤病灶或残留肿瘤细胞,清除肿瘤复发转移的可能性为本项目长远目标或最终目的。
4.将研究以肿瘤干细胞特异性表型为突破口,研究恶性肿瘤干细胞分化和自我更新的生物学基础,为识别肿瘤转移的起始因素和关键细胞生物学性质、建立特异性清除肿瘤干细胞提供重要的理论基础。
5.从探索血管生成、新生淋巴管介导的肿瘤转移机制为切入点,建立有效的抗血管生成和阻碍新生淋巴管措施,阐明肿瘤新生血管、淋巴管组成部分参与局部免疫调节的机理及建立可能的干预手段。
6.新型研究平台及模式生物学的应用,结合新的分子抑制剂筛选或合成,强调整体和体内功能效应验证是本项目的独特之处。
(四) 可行性分析本项目重点放在研究肿瘤细胞恶性生物行为和肿瘤转移分子干预,实现遏制肿瘤侵袭和转移的战略目标。
项目总体方案切实可行,首先,在人才队伍方面,承担本项目研究工作的中坚力量和骨干分别是我国肿瘤生物学、细胞生物学、分子生物学、肿瘤免疫学、分子药理学等领域的青年一代学科带头人和技术骨干。
本研究队伍主要以中、青年科学家组成,有6名国家杰出青年基金获得者,研究成绩斐然(项目成员发表SCI文章560篇,总影响因子共为1400,SCI引用率超过10000次),通过前一个“973”计划的执行,已取得阶段性进展,为该项目打下坚实基础,也是确保项目顺利实施和取得成功的最基本和最重要的要素。
其次,本项目提出的主要科学问题和完成的研究目标都具有理论和实际依据,我们已经发现了一些与肿瘤增殖与转移相关的新基因、信号分子和相应阻遏剂,所建立的相关实验细胞库、组织库和动物模型库日趋完备,有可能成为研究抗肿瘤侵袭和转移的新的突破口。
第三,本项目整合了多个国家重点实验室的科研资源,包括分子肿瘤学国家重点实验室、癌基因和相关基因国家重点实验室、生物膜与膜生物工程国家重点实验室、蛋白质组学国家重点实验室以及教育部重点学科相关实验室,通过资源和技术共享、人员交流等前期合作的可取模式,将为研究目标的实现提供有力保障。
(五)课题设计思路、各课题之间的联系及与项目总体目标的关系根据上述研究思路,本项目设置八个相对独立又有密切关联的课题:(1)细胞周期调控异常与肿瘤恶性增殖、侵袭相关分子机理:主要研究内容:A.抑癌基因p53介导的ncRNA在细胞周期检测点中的功能和分子机制ncRNA是非编码蛋白质RNA的总称,是基因组中极其重要的一部分,哺乳动物基因组中大约有将近98%的序列都由非编码蛋白的RNA基因组成。