从锂离子二次电池正极废料——铝钴膜中回收钴的工艺研究
- 格式:pdf
- 大小:239.01 KB
- 文档页数:8

常考题空6 工艺流程中Ksp 的相关计算溶度积常数反映了难溶电解质在水中的溶解能力,高考试题中溶度积常数的考查常结合化工流程题,在化工流程题中考查溶度积常数是近年高考的热点,化工流程中常常需要控制条件进行离子的分离或除杂,通过溶度积常数计算溶液中金属离子的浓度、离子完全沉淀时的pH 、判断废水排放是否符合标准、沉淀完全转化时所需离子浓度。
常见题型有:一、计算难溶电解质的Ksp 以“Am B n (s)m A n +(aq)+n B m -(aq)”为例:K sp (A m B n )=c m (A n +)·c n (B m -),式中的浓度都是平衡浓度【对点训练1】1.溴酸镉[Cd(BrO 3)2]常用作分析试剂、生产荧光粉等。
以镉铁矿(成分为 CdO 2、Fe 2O 3、FeO 及少量的Al 2O 3 和SiO 2)为原料制备[Cd(BrO 3)2]的工艺流程如下:已知:Cd(SO 4)2 溶于水实际工业生产中,有时还采用阳离子交换树脂法来测定沉镉后溶液中 Cd 2+的含量,其原理:Cd 2++ 2NaR===2Na ++ CdR 2 ,其中NaR 为阳离子交换树脂。
常温下,将沉镉后的溶液(此时溶液 pH =6)经过阳离子交换树脂后,测得溶液中的 Na +比交换前增加了 0.055 2 g·L -1,则该条件下Cd(OH)2 的K sp 值为_________2.从化工厂铬渣中提取硫酸钠的工艺如下:已知:①铬渣含有Na 2SO 4及少量Cr 2O 2-7、Fe 3+②Fe 3+、Cr 3+完全沉淀(c ≤1.0×10-5mol·L -1)时pH 分别为3.6和5Cr(OH)3的溶度积常数K sp [Cr(OH)3]=____________二、计算沉淀转化反应的平衡常数及其完全转化时所需浓度依据沉淀的转化反应和K sp ,计算该反应的平衡常数,K 值越大,转化反应越易进行,转化程度越大如:对于反应Cu 2+(aq)+ZnS(s)CuS(s)+Zn 2+(aq)该反应的平衡常数K =)()(22++Cu c Zn c =)()()()(2222-+-+∙∙S c Cu c S c Zn c =K sp (ZnS )K sp (CuS )【对点训练2】1.某科研课题小组研究利用含H +、Na +、Zn 2+、Mn 2+、Fe 2+、Fe 3+、SO 2-4的工业废电解质溶液,制备高纯的ZnO 、MnO 2、Fe 2O 3,设计实验流程如下:已知常温下,K sp (MnS)=3.0×10-14,K sp (ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn 2+(aq)ZnS(s)+Mn 2+(aq),其平衡常数K =____________2.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O 的流程如下:已知:①部分金属阳离子完全沉淀时的pH如下表金属阳离子Fe3+Al3+Mn2+Mg2+完全沉淀时的pH 3.2 5.210.412.4②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
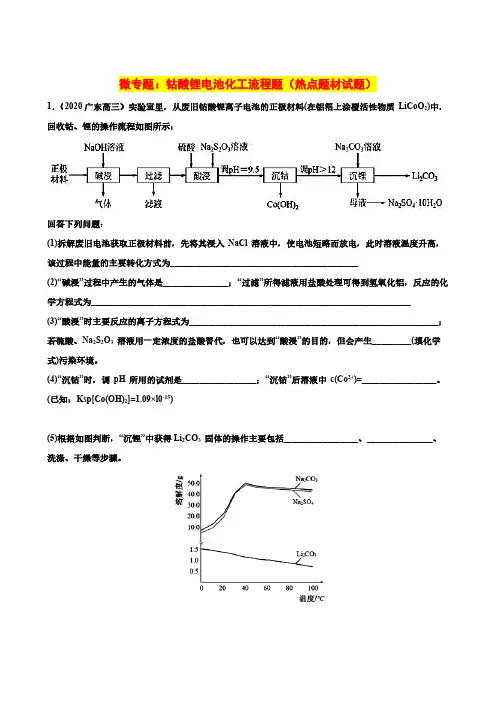
微专题:钴酸锂电池化工流程题(热点题材试题)1.(2020广东高三)实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质LiCoO2)中,回收钴、锂的操作流程如图所示:回答下列问题:(1)拆解废旧电池获取正极材料前,先将其浸入NaCl 溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为___________________________________________(2)“碱浸”过程中产生的气体是_______________;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为_________________________________________________________________________(3)“酸浸”时主要反应的离子方程式为_________________________________________________________;若硫酸、Na2S2O3溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生_________(填化学式)污染环境。
(4)“沉钴”时,调pH 所用的试剂是_________________;“沉钴”后溶液中c(Co2+)=_________________。
(已知:Ksp[Co(OH)2]=1.09×l0-15)(5)根据如图判断,“沉锂”中获得Li2CO3固体的操作主要包括_________________、_______________、洗涤、干燥等步骤。
2.(2020安徽高三)已知某钴酸锂(LiCoO2)电池中含有少量的铝、铁、碳等单质。
为实现绿色环保,某化学兴趣小组在实验室尝试对废旧钴酸锂电池进行回收再利用,实验流程如下:已知:Fe3+和C2O42-结合生成较稳定的[Fe(C2O4)3]3-;在强酸性条件下,[Fe(C2O4)3]3-分解生成Fe3+。
回答下列问题:(l)操作①中使用的主要玻璃仪器有_______________________________________________(2)溶液①到固体②的离子方程式为_______________________________________________(3)已知溶液③中含有CoCl2、LiCl等溶质,则LiCoO2和盐酸反应的化学方程式为______________________________________________________________________________(4)向溶液③中加入草酸铵得到CoC2O4.2H2O固体的实验操作为______________、_______________、过滤、洗涤、干燥。

第48卷第6期2019年6月应 用 化 工AppliedChemicalIndustryVol.48No.6Jun.2019收稿日期:2018 09 18 修改稿日期:2018 10 22基金项目:贵州省科学技术基金(黔科合区域[2014]7002号);瓮福集团资助项目(WF 001 2016 JS 00010)作者简介:邹海凤(1979-),女,贵州贵阳人,贵州师范大学实验师,硕士,主要从事金属的提取与分离方面的研究。
电话:13984307094,E-mail:linxiaolei79@126.com通讯联系人:胡长刚(1975-),教授,E-mail:hcg1975@gznu.edu.cn废旧锂离子电池正极材料中有价金属的浸出回收工艺邹海凤,程琥,王雪,陈卓,胡长刚(贵州师范大学化学与材料科学学院贵州省功能材料化学重点实验室,贵州贵阳 550001)摘 要:采用SO2还原浸出工艺回收废旧锂离子电池正极材料中的有价金属。
结果表明,最佳工艺条件为:原料液固比为50∶1(mL/g),SO2气体流速为0.4L/min,双氧水添加量为0.1g/g原料,反应温度为80℃,反应时间为60min,此时Li、Ni、Co、Mn浸出率分别为98.10%,98.04%,97.81%,98.05%。
浸出液经氧化、沉淀、过滤、静置等除杂过程后,得到的镍钴锰回收产品符合锂离子电池正极材料制备的要求。
关键词:废旧锂离子电池;正极材料;二氧化硫;浸出中图分类号:TQ09;TM912.9;X78 文献标识码:A 文章编号:1671-3206(2019)06-1366-04Leachingandrecoveryprocessofvaluablemetalsfromcathodematerialsinspentlithium ionbatteriesZOUHai feng,CHENGHu,WANGXue,CHENZhuo,HUChang gang(KeyLaboratoryofFunctionalMaterialsChemistryofGuizhouProvince,SchoolofChemistryandMaterialsScience,GuizhouNormalUniversity,Guiyang550001,China)Abstract:Valuablemetalswererecoveredfromcathodematerialsinspentlithium ionbatteriesbySO2reduction leachingprocess.Theresultshowedthattheoptimumprocessconditionwereasfollows:withliquid solidratioof50∶1(mL/g),SO2gasflowrateof0.4L/min,H2O2contentof0.1g/g,reactiontem peratureof80℃,reactiontimeof60min,theleachingrateofLi,Ni,CoandMnwere98.10%,98.04%,97.81%and98.05%,respectively.Qualityoftherecoveredproductsobtainedmeettherequirementsforthepreparationofcathodematerialsforlithium ionbatteriesafterbeingoxidated,precipi tated,filtrated,rested.Keywords:spentlithium ionbattery;cathodematerial;SO2;leach 能源短缺和环境污染问题的加剧,推动我国新能源汽车产业的快速发展,必将带动动力型锂离子电池的大规模使用,其结果是废旧锂离子电池的数量不断增多[1 4]。

绵阳市高中2017级第一次诊断性考试理科综合能力测试(化学)可能用到的相对原子质量:H 1 C 12 O 16 F 19 Cl 35.5 Na 23 Ca 40 Co 597. 化学与生产、生活、社会密切相关。
下列叙述错误的是A. 还原铁粉能用作食品抗氧化剂B. 夜空中光柱的形成属于丁达尔效应C. 浸泡过KMnO4溶液的硅土可作水果保鲜剂D. 燃煤中加入CaO可减少温室气体的排放8. 下列关于有机物的说法错误的是A. 植物油分子结构中含有碳碳双键B. 乙醇与钠反应生成乙醇钠和氢气,属于取代反应C. 同温同压下,等质量的乙炔和苯完全燃烧耗氧量相同D. 分子式为C3H6BrCl的有机物不考虑立体异构共5种9. N A为阿伏加德罗常数的值。
下列说法正确的是A. 19 g羟基(-18OH)所含中子数为10N AB. 标准状况下,44.8 L HF含有2N A个极性键C. 1 mol NaHSO4晶体含有的离子数为3N AD. 0.1 mol • L-1 KAl(SO4)2溶液中SO2-4的数目为0.2N A10. 下列实验操作或方法正确的是A. 检验某溶液中是否含有Fe2+时,先加入少量H2O2,再滴加KSCN溶液B. 配制100 mL 1 mol/L NaCl溶液时,用托盘天平称取5.85 g NaCl固体C. 将FeCl3饱和溶液煮沸制备Fe(OH)3胶体D. 用紫色石蕊溶液鉴别乙醇、乙酸和苯11. 下列离子方程式书写正确的是A. 食醋除水垢:2H++CaCO3==Ca2++CO2↑+H2OB. 稀硝酸中加入少量亚硫酸钠:2H++SO2-3 ==SO2↑+H2OC. 处理工业废水时Cr(Ⅵ)的转化:Cr2O2-7+3SO2-3+8H+==3SO2-4+2Cr3++4H2OD. 用酸性KMnO4测定草酸溶液浓度:5C2O2-4+2MnO-4+16H+==2Mn2++10CO2↑+8H2O12. 短周期主族元素X、Y、Z、W原子序数依次增大,原子序数之和为42,X原子的核外电子总数等于Y的最外层电子数,Z原子最外层只有1个电子,W能形成酸性最强的含氧酸。

动⼒锂电池回收利⽤技术分析1 技术路线总述对于退役的动⼒电池,⽬前主要有两种可⾏的处理⽅法:其⼀是梯级利⽤,即将退役的动⼒锂电池⽤在储能等领域作为电能的载体使⽤,从⽽充分发挥剩余价值;其⼆是拆解回收,即将退役电池进⾏放电和拆解,提炼原材料,从⽽实现循环利⽤。
⽬前仅有磷酸铁锂电池可以通过梯级利⽤发挥剩余价值,三元材料的电池仍以拆解回收为主。
废旧锂电池的回收流程1.1 物理分选法研究进展⾦泳勋等采⽤⽴式剪碎机、等级风⼒摇床和振动筛分级、破碎和分选的⽅法处理废旧锂离⼦电池,最终得到了附加值较⾼的轻烯烃产品、⾦属产品及电极材料。
正极材料的混合粉末经马弗炉⾼温处理,然后⽤浮选法进⾏分离。
浮选法的优点主要是不会增加新的污染,能量消耗少,⽽且外壳也可以循环利⽤,但也存在⼀些缺点,例如新合成电池的充放电性能明显降低。
Daniel提出以物理分选法为基础的喷动床淘洗技术,其过程主要分为两步:⾸先根据每⼀种⾦属的质量以及它的化学组成对废旧锂离⼦电池进⾏分类;其次,使⽤机械⽅法(研磨、过筛、淘洗)来分离不同的⾦属物质,⾦属回收率可以达到80%,回收也存在⾦属混杂情况,即该⽅法对不同⾦属的分辨率稍差。
⽬前在废旧锂离⼦电池回收分离不同⾦属物质⽅⾯,喷动床淘洗技术是⼀种相对简单、成本低廉的选择。
1.2 ⽕法冶⾦法研究进展欧秀琴等采⽤⽕法冶⾦回收了废旧锂离⼦电池中的有价⾦属,具体⼯艺流程为:剥去废旧锂离⼦电池外壳,回收壳体材料中的有价⾦属,将电池内芯与焦炭、⽯灰⽯混合,经还原焙烧,得到⾦属铜、钴、镍等组合成含碳合⾦,然后继续进⾏深加⼯处理,整个过程在⾼温下完成。
⽇本的索尼/住友公司对废旧锂离⼦电池的⽕法冶⾦处理进⾏了系统研究,结果表明,在低于1000℃下对未处理、未拆解的废旧锂电池直接进⾏焚烧,电池可以实现⾃我解离,焚烧后的残余物中有铁、铜、铝等⾦属,再通过筛分、磁选等⽅法使有价⾦属分离开来,回收再利⽤,⾦属元素回收率较⾼,但是⾦属单质回收率有待提⾼。

废锂离子电池回收技术研究进展作者:缪月晴张玉黄澳唐喜芳殷进赵磊来源:《现代盐化工》2021年第01期摘要:近年来,在电子产品数量飞速增长的条件下,废锂离子电池的产生量也在飞速增加。
废锂离子电池中含有大量的贵重金属与有毒物质,所以,在环境保护及社会经济方面,废锂离子电池中贵重金属的回收再利用成为全世界关注的焦点。
综述了将废锂离子电池中贵重金属成分回收再利用的处理技术以及进行高效回收的工艺现状,同时对废锂离子电池回收工艺的发展趋势进行了展望。
关键词:废锂离子电池;金属回收;研究进展锂电池经过长时间的充放电使用后,电池电容量的峰值发生周期性的衰减[1],电极上的活性材料结构会过度收缩或膨胀,导致电极迅速发生阻塞并失活[2],使得锂电池的有效使用电容量降低,导致其使用寿命缩短。
据推测,2021年我国锂离子电池报废量将达25亿只(约产生5.0×105 t的废锂离子电池[3]),主要组分有正负极材料、电解液及易燃有机隔膜。
其中,贵重金属及有机化学品都会对环境安全和人体健康造成严重影响。
废锂离子电池中含有超过1/4的锂酸钴,其中高达20%的钴是国际公认的战略物质,铜和铝的质量分数超过10%,还包含大量的可回收塑料外壳和金属。
因此,对废锂电池进行资源化回收,在获得多方面收益的同时是极有必要的。
1 研究进展现今,锂离子电池在人们的日常生活中必不可少,由于其高污染性和高资源特性,如何回收再利用成为大家探讨的话题。
现有废锂离子电池的回收工艺主要针对贵重金属,研究方法可分为物理法、化学法以及生物法。
1.1 物理法物理法是根据废锂离子电池中各组分所具有的物理性质如密度、溶解度等进行回收,主要包括破碎浮选法、机械研磨法、机械筛分法、联合分选法、超声辅助分离法等。
1.1.1 破碎浮选法浮选法[4]利用废料表面物化性质的不同,借助泡沫的浮力进行颗粒分离。
黄红军等[5]采用了两步法,先进行球磨,然后再低温热处理,将废锂离子电池中电极材料表面的有机物薄膜去除。

废旧锂离子电池正极材料分离方法下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!随着电子产品的普及,废旧锂离子电池的排放量也不断增加。

废旧锂电池中金属钴和铝的回收张旭;金士威【摘要】采用碱溶解铝→低固液比盐酸浸出→P507萃取→碳酸沉锂→结晶回收钴的流程,研究了废旧锂电池中金属铝和钴的回收工艺.探讨了氢氧化钠的浓度和pH值对铝产率的影响;考察了盐酸的浓度、溶解时间以及双氧水加入的量对钴的浸出率的影响.试验表明,当pH值为10,氢氧化铝的浓度为0.1mol/L时铝的回收率可以达到92%;在盐酸的浓度为9%,溶解时间为2.5h的条件下钴的浸出率可以达到90%.【期刊名称】《广州化工》【年(卷),期】2013(041)009【总页数】3页(P118-120)【关键词】废旧锂电池;钴;铝;回收【作者】张旭;金士威【作者单位】新疆化工设计研究院,新疆乌鲁木齐830000;武汉工程大学,湖北武汉430000【正文语种】中文【中图分类】TQ13锂离子二次电池问世以来,凭借其优异的性能迅速占领电池市场,并得到广泛应用。
目前,锂离子二次电池中使用的负极材料多为石墨,正极材料则为嵌锂过渡金属氧化物[1]。
如果手机电池被废弃后不做任何处理,不仅对环境产生污染还会危害人类健康,因此对废旧手机电池科学回收是非常有必要的。
目前对于废旧电池中有利金属的回收设备要求高,操作环境恶劣[2]。
本实验针对电池中铝和钴的回收工艺简单、流程短、成本低、资源回收率和产品纯度高,是一个清洁生产工艺。
1 实验部分1.1 实验原料实验所用原料来自某废旧电池拆解厂,对回收来的锂电池利用自制的拆分设备进行剥皮、去壳、破碎,然后进行分选等预处理过程,将电池拆分,其成分分析见表1。
表1 材料分析Table 1 Materials Analysis?1.2 试剂与仪器盐酸、氨水、氢氧化钠均为化学纯,0.01 mol/L Na2S2O3标准溶液,KI固体,5 g/L淀粉溶液。
自制的拆分电池的设备,高温电炉,恒温水浴装置,抽滤装置,电子天平。
1.3 原理分析原料中的铝以金属形态存在[3-6],它是两性元素,可以与NaOH发生反应,碱浸液中NaAlO2用盐酸中和则铝会以氢氧化铝的形式沉淀下来,反应如下:试验通过改变NaOH的浓度,HCl的浓度以及pH值等条件,找出铝回收的最佳工艺。


环保与节能42 |2019年7月波电流,电解至电极材料从集流体表面脱落后,将集流体、电极材料从电解槽中取出,分离集流体与电极材料,集流体和电极材料回收率分别高达92%和99%[4]。
电解剥离可实现集流体与电极材料的分离,但无法进一步回收电极材料中的金属。
2 电积电积法是在直流电场作用下直接从富含金属的浸出溶液中获得纯金属的技术,一般先采用包括氧化性物质的酸性电解液浸出废旧锂离子电池的电极材料,然后对浸出液直接进行电积或是萃取后再电积。
申勇峰采用硫酸浸出-电积工艺从废锂离子电池中回收钴,将废锂离子电池经硫酸全浸、碳酸钠中和除铁和铝、过滤,用制作的钴始极片为阴极,钛板作阳极,将除杂所得到的过滤溶液直接进行电积,电流密度235A/m 2,电解液温度55~60℃,所得电钴表面平整,钴直收率大于93%[5]。
何汉兵等比较了浸出液和反萃液的电解回收效果,反萃液中钴20g ·L -1、硫酸钠25g ·L -1、硼酸5g ·L -1、十二烷基硫酸钠15g ·L -1,电压3.2V ,pH2.5,50℃,电解1h ,电流密度300~400A ·m -2时,得到完整、光亮、致密、表面形貌好的钴板,其钴含量为99.5%[6]。
Freitas 等人将锂离子电池的电极材料用盐酸和双氧水溶解,化学反应式如下:LiCoO 2(s)+1/2H 2O 2(l)+3HCl(aq)→CoCl 2(aq)+1/2O 2(g)+LiCl(aq)+2H 2O(l)浸出液用氢氧化钠调节pH ,添加硼酸作为缓冲剂,用电化学方法回收锂离子电池中的钴[7]。
之后采用硫酸和双氧水作为溶解溶液,从废弃锂离子电池中电化学沉积回收钴和铜[8]。
Lupi 等将LiCo x Ni 1-x O 2阴极材料用硫酸和双氧水作为溶解溶液,之后通过溶剂萃取将钴镍分离,镍采用电积法回收,最佳工艺参数如下:电流密度250A ·m -2,温度50℃,pH=3~3.2,电解液中包括50g/L 的Ni 和20g/L 的硼酸[9]。

废旧锂电池膜法提锂技术随着科技的不断进步和电子产品的普及,废旧锂电池的处理和回收问题日益突出。
废旧锂电池中含有大量的有害物质和有价值的资源,如锂、镍、钴等。
因此,开发一种高效、环保的废旧锂电池提锂技术具有重要的意义。
废旧锂电池膜法提锂技术是一种利用膜分离原理实现锂离子的提取的新兴技术。
该技术采用了聚合物膜作为离子选择性通道,通过膜的渗透和选择性传输,将废旧锂电池中的锂离子从其他离子和杂质中分离出来,从而实现锂离子的高效提取。
废旧锂电池经过预处理,包括去除外壳和电解液等工序,得到锂电池正负极材料。
然后,将正负极材料以一定比例混合,并加入一定量的溶剂,形成悬浮液。
接下来,将悬浮液通过一系列过滤和分离步骤,除去悬浮液中的固体杂质和颗粒物。
最后,利用膜分离技术,将锂离子从悬浮液中高效提取出来。
废旧锂电池膜法提锂技术具有许多优点。
首先,该技术无需高温高压条件,能够在较温和的条件下实现锂离子的提取,降低了能源消耗和设备成本。
其次,废旧锂电池膜法提锂技术是一种绿色环保的技术,不会产生有害气体和废水,对环境无污染。
再次,该技术具有高选择性和高效率,能够有效地分离锂离子和其他离子,提高提锂效率和纯度。
最后,废旧锂电池膜法提锂技术可以实现连续生产,具有较高的自动化程度,提高了生产效率和经济效益。
虽然废旧锂电池膜法提锂技术具有许多优点,但也存在一些挑战和问题。
首先,膜的选择和设计对技术的实施具有重要影响,需要考虑膜的渗透性、选择性和稳定性等因素。
其次,废旧锂电池中的杂质和固体颗粒物会对膜的性能产生影响,需要进行有效的预处理和过滤。
再次,提锂过程中产生的废液和固体废弃物的处理也是一个重要问题,需要寻找合适的方法进行处理和回收。
废旧锂电池膜法提锂技术是一种高效、环保的废旧锂电池处理和资源回收技术。
该技术利用膜的渗透和选择性传输特性,实现锂离子的高效提取。
废旧锂电池膜法提锂技术具有许多优点,如低能耗、环保、高效率和连续生产等。
废旧锂电池的回收与再利用研究随着锂离子电池的广泛应用,废旧锂电池成为一个值得重视的问题。
废旧锂电池不仅占用资源、浪费能源,还会对环境及人体造成较大的危害。
因此,对于废旧锂电池的回收与再利用研究至关重要。
1. 废旧锂电池的危害废旧锂电池中含有大量的有害物质,如果随意处理将会对环境及人体造成极大的危害。
其主要危害如下:1.1 重金属的污染废旧锂电池中含有大量的有害重金属,如镉、铅、汞等,这些重金属可以渗入土壤、水源,对环境造成污染。
1.2 热化性废旧锂电池失去容量后会出现热化现象,甚至会爆炸,对人身安全造成严重威胁。
1.3 能源的浪费废旧锂电池中含有大量的有用金属和化学物质,如果随意处理将浪费资源,造成经济损失。
目前,废旧锂电池的回收技术主要包括物理方法和化学方法两种。
2.1 物理方法物理方法主要是采用机械破碎、吸附或分离等物理处理过程,将废旧锂电池中的有用成分分离出来。
其中,机械破碎是最常用的方法,通过破碎设备对废旧锂电池进行初步的分离和粉碎处理,将有用成分和废弃部分分离出来。
吸附法则是利用特殊材料吸附废旧锂电池中的有用成分,如正极材料中的锂离子、钴、镍等,通过更换材料、再生材料等方式,实现有用成分的回收和再利用。
分离法则是利用物理分离方法将废旧锂电池中的有用成分分离出来,如使用磁力分离器将废弃部分中的钢铁材料分离出来,通过筛分、重力分离等方式将有用成分分离出来,实现资源的回收和再利用。
化学方法主要是采用化学溶解、浸出等化学处理过程,将废旧锂电池中的有用成分溶解出来。
其中,化学溶解法是最常用的方法,通过酸碱法、高温高压法等方式将废旧锂电池中的有用成分溶解出来,然后再进行过滤、浓缩、还原等后续处理,实现有用成分的回收和再利用。
废旧锂电池中的有用成分主要包括正极材料中的锂离子、钴、镍等,负极材料中的石墨、锡、铜等,以及电解液中的有机溶剂、盐等。
这些有用成分可以被重新制成新的锂离子电池或其他新材料。
3.1 制备新锂离子电池废旧锂电池中的有用成分可以被重新制成新的锂离子电池。
回收处理废旧锂电池的工艺流程是这样的废旧锂电池的回收处理工艺流程涉及多个环节,包括收集、分拣、破碎、分离和再利用等步骤。
下面是一个详细的工艺流程介绍:1.收集:废旧锂电池的回收处理过程从收集废旧电池开始。
这可以通过回收箱、回收站和回收车辆来完成。
回收箱通常被放置在公共场所,如商场、超市和社区内供人们投放废旧电池。
回收站接收并存储废旧电池,而回收车辆则用于在不同地点收集大量的废旧电池。
2.分拣:在废旧锂电池回收站内,工作人员对收集来的废旧电池分类和分拣。
锂电池一般分为锂离子电池、锂聚合物电池和锂锰电池等类别。
根据分类,进一步判断电池的使用寿命和可能存在的残留电量等因素。
3.测试:经过分拣后,废旧电池需要进行测试以确认其实际状况。
测试可以测量电量、电压和内阻等参数,以判断电池是否处于可再利用的状态。
通常,只有具有足够发电能力的电池被认为是可再利用的。
4.破碎:不可再利用的废旧锂电池需要进行破碎处理。
这是一个物理过程,其中电池被粉碎成小颗粒。
破碎的目的是能够方便后续的分离和回收过程。
破碎后的颗粒被收集,并进入下一步分离操作。
5.分离:破碎后的废旧锂电池颗粒通过物理或化学方法进行分离。
其中的主要目标是将有价值的材料,如钴、镍、锂和铝等,从废旧电池中提取出来。
通常使用机械和化学处理(如浸出)来实现材料的分离。
6.再利用:分离出的有价值材料可以被再利用。
例如,回收的钴和镍可以用于新电池的制造,而回收的锂可以用于金属冶炼或其他化工产品中。
此外,回收的铝可以用于铝制品,如铝箔或铝合金等的制造。
7.废物处理:在回收处理过程中产生的废物和残渣需要进行正确的处理。
这可能涉及废物处理设施的利用,如焚烧或填埋。
确保废物处理符合环境标准和法规。
总的来说,废旧锂电池的回收处理工艺流程包括收集、分拣、测试、破碎、分离、再利用和废物处理等步骤。
这些步骤有助于减少环境污染,回收有价值的材料,并将其重新用于生产新电池或其他产品。
化工进展Chemical Industry and Engineering Progress2022年第41卷第6期低共熔溶剂在废旧锂离子电池正极材料回收中的研究进展程明强,汝娟坚,华一新,王丁,耿笑,张文文,黄皓铭,王道祥(昆明理工大学冶金与能源工程学院,云南昆明650093)摘要:大规模储能与电动汽车市场的发展壮大对锂离子电池的需求水涨船高,由此产生的废旧锂离子电池数量也即将迎来爆发式增长。
废旧锂离子电池正极材料蕴含丰富的锂、钴、镍、锰等有价金属元素,回收经济价值高,环境效益显著。
低共熔溶剂(DESs )作为一种绿色溶剂,在废旧锂离子电池有价金属元素回收方面显示出巨大的潜力。
本文在简要介绍DESs 性质及应用的基础上,系统综述了DESs 在废旧锂离子电池正极材料回收链中的研究现状,主要包括正极材料的分离、活性物质的浸出以及有价金属的提取,着重介绍了现阶段回收的方法及工艺流程,比较了不同DESs 浸出正极活性物质的优缺点,探讨了当前DESs 在废旧锂离子电池回收中的共性问题,并展望了未来DESs 回收锂离子电池的发展方向。
关键词:低共熔溶剂;废旧锂离子电池;分离;浸出;回收中图分类号:TF11文献标志码:A文章编号:1000-6613(2022)06-3293-13Progress of deep eutectic solvents in recovery of cathode materials fromspent lithium ion batteriesCHENG Mingqiang ,RU Juanjian ,HUA Yixin ,WANG Ding ,GENG Xiao ,ZHANG Wenwen ,HUANG Haoming ,WANG Daoxiang(Faculty of Metallurgical and Energy Engineering,Kunming University of Science and Technology,Kunming 650093,Yunnan,China)Abstract:With the development of large-scale energy storage and electric vehicle market,the demand for lithium-ion batteries is increasing,resulting in an explosive growth in the number of spent lithium-ion batteries.The cathode materials of spent lithium-ion batteries contain abundant valuable metal elements such as lithium,cobalt,nickel and manganese.The recovery of those metals has high economic value and significant environment benefits.As a green solvent,deep eutectic solvents (DESs)show great potential in the recovery of valuable metal elements from spent lithium-ion batteries.Based on a brief introduction of the properties and applications of DESs,this paper systematically reviews the research status of DESs in the recycling chain of cathode materials from spent lithium-ion batteries,mainly including the separation of cathode material,leaching of active substances and recovery of valuable metal.The current recycling methods and process flow are discussed,and the advantages and disadvantages of different kinds of DESs for leaching cathode active materials are compared as well.Finally,the common problems of the current DESs in the recycling spent lithium-ion batteries are analyzed,and the development direction of DESs recycling of lithium-ion batteries is proposed.Keywords:deep eutectic solvent;spent lithium ions batteries;separation;leaching;recovery综述与专论DOI :10.16085/j.issn.1000-6613.2021-1493收稿日期:2021-07-15;修改稿日期:2021-10-20。
全国高考化学铝及其化合物推断题的综合高考真题分类汇总附答案一、铝及其化合物1.2019年诺贝尔奖授予了在开发锂离子电池方面做出卓越贡献的三位化学家。
锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。
锂离子二次电池正极铝钴膜主要含有LiCoO 2、Al 等,处理该废料的一种工艺如图所示:(1)Li 的原子结构示意图为_____________,LiCoO 2中Co 的化合价为_______。
(2)“碱浸”时Al 溶解的离子方程式为__________________________________。
(3)“酸溶”时加入H 2O 2的目的是______________________________________。
(4)“沉钴”的离子方程式为___________________________________________。
(5)配制100 mL 1.0 mol /L (NH 4)2C 2O 4溶液,需要的玻璃仪器出玻璃棒、烧杯外,还有_____。
(6)取CoC 2O 4固体4.41g 在空气中加热至300 ℃,得到的钴的氧化物2.41g ,则该反应的化学方程式为__________________________________________________________。
【答案】 +3 2Al 2OH -+2222H O 2AlO 3H -+=+↑ 将2LiCoO 中的Co(Ⅲ)还原为2+价 222424Co C O CoC O +-+=↓ 100mL 容量瓶、胶头滴管Δ2423423CoC O 2O Co O 6CO +=+【解析】【分析】铝钴膜主要含有2LiCoO 、Al 等,将废料先用碱液浸泡,将Al 充分溶解,过滤后得到的滤液中含有偏铝酸钠,滤渣为2LiCoO ,将滤渣用双氧水、硫酸处理后生成24Li SO 、4CoSO ,然后加入氨水调节溶液的pH ,生成氢氧化锂沉淀从而除去锂离子,最后对滤液用草酸铵洗涤处理,经过一系列处理得到草酸钴。