5%葡萄糖注射液工艺卡(无水)
- 格式:docx
- 大小:12.50 KB
- 文档页数:3
增加以及基础值设计的。
为满足患者全部的营养需求,应考虑添加微量元素以及维生素。
按患者体重计葡萄糖的最大输注速率为按体重一小时0.25g/kg,氨基酸的输注速率按体重不宜超过一小时0.1g/kg,脂肪按体重则不超过一小时0.15g/kg。
本品输注速率按患者体重不宜超过一小时3.7ml/kg(相当于0.25g葡萄糖、0.09g氨基酸、0.13g脂肪/kg)。
推荐输注时间为12~24小时。
为避免可能发生的静脉炎,建议每日更换输液针刺入的位置。
【不良反应】本品与所有高渗性输液一样,如采用周围静脉输注有可能发生静脉炎。
导致静脉炎的因素很多,包括输液管类型、直径与长度、输注时间长短、液体的pH和渗透压、感染/静脉被穿刺的次数。
因此建议已输注本品的静脉不再用于其它输液或添加剂注射使用,并建议每日更换输液针刺入的位置。
输注英脱利匹特(脂肪乳注射液)可能会引起体温升高(发生率<3%),偶见寒战、恶心/呕吐(发生率<1%)。
另有输注过程中出现肝功能酶一过性升高的报道。
输注英脱利匹特产生其它不良反应更为罕见。
超敏反应(过敏反应、皮疹、荨麻疹)、呼吸症状(如呼吸急促)、高/低血压、溶血、网织红细胞增多、腹痛、头痛、疲倦、阴茎异常勃起少见报道。
脂肪超载综合症:脂肪廓清受损后会出现脂肪超载综合症,脂肪超载综合症也会出现在虽以推荐剂量速率输注,但由于临床情况突然发生改变的患者(如肾功能损伤与感染)。
脂肪超载综合症表现有高脂血症,发热,脂肪浸润,肝肿大,脾肿大,贫血,白细胞减少症,血小板减少症、凝血机制障碍,昏迷。
若停止输注所有症状通常均可逆转。
【禁忌】·对鸡蛋或大豆蛋白或处方中任一成份过敏者·重度高脂血症·严重肝功能不全·严重凝血机制障碍·先天性氨基酸代谢异常·严重肾功能不全且无法进行腹透与血透者·急性休克·高糖血症(胰岛素治疗超过6单位/小时)·血电解质(指本品处方中所含有的)水平出现异常升高·其它一般禁忌(如急性肺水肿,水潴留,失代偿性心功能不全,低渗性脱水)·吞噬血细胞综合症·疾病状态处于非稳定期(如严重创伤后期,失代偿性糖尿病,急性心梗,代谢性酸中毒,严重败血症,高渗性昏迷等)【注意事项】须经常检测脂肪廓清能力。

淀粉糖生产工艺及设备糖,做为人们生活的必须品已有五千年的历史,人类最早开始是用蜂蜜作为甜味剂,以后逐渐用含淀粉的谷物和甘蔗制糖。
从甜菜制糖到目前为止却只有二百多年的历史,随着社会的发展,各行各业都需要大量的糖品,因而,促使淀粉糖业能够得到发展。
利用淀粉为原料生产的糖品称淀粉糖,淀粉糖产品种类多,生产历史悠久。
1811年,德国化学家柯乔夫在寻找能够代替阿拉伯胶用的胶粘剂时,用硫酸处理马铃薯淀粉,但酸用的过度得到一种粘度很低的液体,澄清具有甜味,于是柯乔夫继而研究糖品最后制成一种糖浆,放置一定时间后有结晶析出,用布袋装之、压榨、除去大部分母液,得到固体产品,当时正值拿破伦战争年代,经济封锁,是欧洲不能获得甘蔗糖,于是设立很多这种淀粉糖工厂,1815年战争结束,恢复甘蔗糖进口,工厂也随之停止生产。
1815年,法国化学家沙苏里确定有淀粉制糖的化学反应为水解反应,水解的最终产物为葡萄糖与葡萄果汁中的葡萄糖完全相同。
1801年,朴罗斯特试验成功由葡萄中提取制出葡萄糖,葡萄糖的名称由此而来,一直沿用到现在。
19世纪曾有很多人从事制造洁晶糖的研究,但成就不大,主要是对于葡萄糖几种异构体的化学结构和结晶规律缺乏了解,后沿用蔗糖结晶的方法,效果也不好,大约在1920年,美国的牛柯克发现,含水α-葡萄糖比无水α-葡萄糖容易结晶。
使用25-30%湿晶体的冷却结晶法容易控制,所得结晶产品易于离心机分离,产品质量高,被世界普遍采用,目前工业上基本用此结晶工艺。
1940年,美国采用酸酶合并糖化工艺生产高糖度的糖浆,能避免葡萄糖的复合及分解反应,产品甜味纯正。
1960年日本最新研究出双酶法,用α-淀粉酶液化和葡萄糖淀粉酶糖化的双酶法生产结晶糖工艺,而后各国相继采用双酶法,逐渐淘汰了旧的酸法糖化工艺,这种双酶法所得到的糖化液纯度高、甜味纯正,同时还可省去结晶工序直接制成全糖。
工艺简单,生产成本低,质量虽不及结晶葡萄糖,但适合于食品工业应用,如生产饴糖。
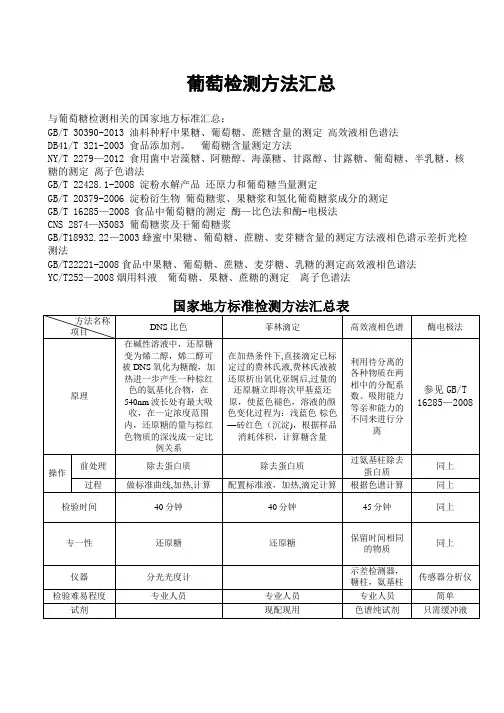
葡萄检测方法汇总与葡萄糖检测相关的国家地方标准汇总:GB/T 30390-2013 油料种籽中果糖、葡萄糖、蔗糖含量的测定高效液相色谱法DB41/T 321-2003 食品添加剂。
葡萄糖含量测定方法NY/T 2279—2012 食用菌中岩藻糖、阿糖醇、海藻糖、甘露醇、甘露糖、葡萄糖、半乳糖、核糖的测定离子色谱法GB/T 22428.1-2008 淀粉水解产品还原力和葡萄糖当量测定GB/T 20379-2006 淀粉衍生物葡萄糖浆、果糖浆和氢化葡萄糖浆成分的测定GB/T 16285—2008 食品中葡萄糖的测定酶—比色法和酶-电极法CNS 2874—N5083 葡萄糖浆及干葡萄糖浆GB/T18932.22—2003蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法液相色谱示差折光检测法GB/T22221-2008食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定高效液相色谱法YC/T252—2008烟用料液葡萄糖、果糖、蔗糖的测定离子色谱法国家地方标准检测方法汇总表葡萄糖的应用范围葡萄糖作为人体的基本元素和最基本的医药原料,其作用和用途十分广泛。
尤其是随着广大人民生活水平的提高,葡萄糖作为蔗糖的替代用糖应用于食品行业,为葡萄糖的应用开拓了更广阔的领域.(一)发酵工业微生物的生长需要合适的碳氮比,葡萄糖作为微生物的碳源,是发酵培养基的主料,如抗生素、味精、维生素、氨基酸、有机酸、酶制剂等都需大量使用葡萄糖,同时也可用作微生物发酵多聚糖和有机溶剂的原料。
1。
抗生素发酵葡萄糖是医药工业的重要原料,尤其是抗生素发酵必不可少的原料,抗生素中最主要的品种是青、链霉素,而这两种抗生素发酵都是以葡萄糖或者高DE值的淀粉水解液(即葡萄糖液)为碳底物。
链霉素发酵以结晶葡萄糖为主,也可用高DE值的淀粉水解液(即葡萄糖液);其他如利福平也以葡萄糖或者高DE值的淀粉水解液(即葡萄糖液)为主要碳源;沽霉素、红霉索、麦迪霉素也是以葡萄糖或者高DE值的淀粉水解液(即葡萄糖液)为底物;卡那霉素、庆大霉素等也需要用葡萄糖或者高DE值的淀粉水解液(即葡萄糖液)为底物.2。

【最新资料,WORD文档,可编辑修改】1.简介脂肪乳氨基酸(17)葡萄糖(11%)注射液,商品名卡文,系由费森尤斯卡比集团公司研制,自2004年起由XX公司进口销售。
经费卡董事会批准XX公司接受费卡公司就该产品的技术转移,在XX公司无锡生产基地建造生产线,产品供应中国市场并出口至亚太地区市场。
项目分为生产线建设和产品注册两个相互影响的部分。
由于国内药品生产注册申请受理前要求必须具备实际的生产线并经验证生产出注册报批样品,在等待审批过程中必然存在生产设备投资的闲置问题。
由于生产设施中自动化制袋/灌装/装外袋的设备投资很大,为求得产品注册进展,项目费用、生产能力和市场需求的最优平衡,决定分两个阶段建设生产设施:第一阶段,2008年实现投资较低的进口成品空袋、半自动灌装,每小时灌装200袋的生产能力,以达到年产100万袋的产能,产品可满足国内市场需求。
但其中配制、灭菌、灯检、装箱等设备和公用工程应能为第二阶段每小时900袋的生产能力配套。
第二阶段,2010年投资一套全自动的制袋/灌装/装外袋的设备,以取代第一阶段的半自动设备,产品除满足国内市场外,还可供应亚太地区。
根据上述项目建设策略,因灌装速度的限制,会存在配制批量、灭菌能力超过第一阶段的灌装能力的问题。
主要表现为:如以1440ml规格的产品计算,脂肪乳注射液最大配制批量2000升生产,灌装时间会达到40小时;以最小批量1000升生产,则需要的灌装时间为20小时。
1920ml规格的产品灌装时间分别低于上述数据。
通常,营养类输液产品灭菌前存放时间超过12小时,应考虑灭菌前微生物繁殖导致的产品无菌保证和细菌内毒素质量的风险,并采取有针对性的措施控制风险。
而就产品的理化质量而言,只要产品灌装前和灌装后具有同样的氮气保护,相对于产品2年以上的稳定性保证,几十小时的灌装时间不会造成特殊的风险。
本文以产品的无菌保证和细菌内毒素质量风险控制为目标,通过分析药液长时间灌装导致微生物繁殖的各种风险因素,说明项目在设备与工艺设计、质量控制策略等方面采用的全面的风险控制策略与方案,并结合相应的验证和试验结果,以评估产品的实际风险控制水平。

医院药讯☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆【合理用药】中药注射剂的合理应用在临床上合理应用中药注射剂,才能更好地发挥其功效。
合理应用要注意以下问题:辨证论治辨证论治是中医药理论的精华,是联系中医基础理论与临床的纽带,是中医临床的重要技术。
辨证论治的核心是“证”与“治”。
《伤寒论》中的“观其脉证,知犯何逆,随证治之”即是对中医临床辨证论治精髓的高度概括。
“辨”是“证”的依据,“论”是“治”的前提。
正如《内经》中所云:“合人形于阴阳四时虚实之应,冥冥之期,其非夫子孰能通之。
”中药注射剂是根据中医药理论组方及精确的工艺提取而生产的,而中医药理论之精髓在于辨证论治。
所以,应用中成药应该以中医药理论为指导,尤其应按辨证施治用药的原则,而不能简单地按药品说明书上的适应症,不经辨证,盲目用药。
如果不辨证施治,有时不仅不能奏效,反使病情加重。
使用中成药时应注意异病同证或同病异证等情况的辨证论治。
对证用药,才能做到中成药的合理应用。
用量中药注射剂的用量应以药物的性质、患者的病情及个体差异等诸多因素,综合分析而定。
适当控制中药注射剂的用量是很有必要的。
如果不了解药物的成分尤其是含有毒性的或不良反应较大的成分,随意增加剂量,不但无法达到治疗目的,反而可能产生严重的不良后果。
中成药与西药的相互作用中西药配伍合用是中西医结合的重要组成部分,也是现代医学研究中的一个正在探索和发展的重要课题。
联用合理,往往会收到很好的甚至意想不到的治疗效果。
而联用不当,则可出现相互削弱药物性能乃至损害人体健康的不良后果等。
所以,联用时一定要慎重,在不了解药物间相互作用的情况下不能盲目合用。
如地高辛是治疗充血性心衰最常用的强心甙类药物。
中药蟾酥结构与地高辛相似,具有洋地黄强心作用。
这两个药合用可导致地高辛样中毒。
地高辛与血栓心脉宁(含蟾酥)合用就可引起地高辛样中毒;地高辛与六神丸(含蟾酥)合用能引起频发性室性早搏。


一、口服葡萄糖的应用一、产品简介口服葡萄糖即结晶葡萄糖,是以淀粉或淀粉质为原料,经液化、糖化所得 的葡萄糖液,再通过精制、浓缩、冷却、结晶、干燥所得的一水葡萄糖产品。
二、生产工艺流程淀粉乳→调浆→液化→pH 调节罐→糖化→除渣过滤→一次中和→一次脱色 过滤→二次中和→阿玛过滤→离交→蒸发→结晶→分离→干燥→包装母液三、产品指标 (一)感官指标项 目要 求外观 结晶性粉末,无肉眼可见杂质气味 无异味滋味 甜味温和、纯正、无异味颜色白色或无色(二)理化指标(口服葡萄糖理化要求)要求项目优级品一级品比旋度 52.0~53.5葡萄糖含量(以干 物质计)/%≥99.5pH 值 4.0~6.5水分/%≤10.0 硫酸灰分/% ≤ 0.25 氯化物/% ≤0.0199.0(三)卫生指标(GB15203)项目指标总砷(以As计)mg/kg≤ 1.0铅(以Pb计)mg/kg≤0.5铜(以Cu计)mg/kg≤ 5.0二氧化硫残留量按GB2760执行菌落总数/(cfu/g)≤大肠菌群/(MPN/100g)≤致病菌(沙门氏菌、志贺氏菌、金300030不得检出黄色葡萄球菌)四、产品特性(一)甜度甜度是糖品的重要性质,葡萄糖对蔗糖的相对甜度及其他糖、糖醇的甜度比较见下表:相对甜度糖类名称相对甜度蔗糖果糖葡萄糖麦芽糖麦芽糖醇山梨醇木糖醇1 1.5 0.7 0.5 0.90.51.0葡萄糖溶液的甜度随浓度增高的程度大于蔗糖,在较低的浓度下,葡萄糖的甜度低于蔗糖,但是随着浓度的增高,差别逐渐减小。
下表是相同甜度的葡萄糖和蔗糖的浓度对照:名称浓度(%)蔗糖 2.0 5.010.015.020.025.030.040.050.0葡萄 3.27.212.717.221.827.531.540.0糖50.0目前,大量的消费者对甜食品的甜度要求下降,有很多过去用蔗糖做甜味配料的食品,如速溶奶粉,规定用糖20%,消费者反映太甜,完全可以用葡萄糖代替蔗糖,使甜度下降。

关于GMP知识的一点复习题文字[p:1]GMP基础知识培训试题一、选择题1、本《规范》是药品 C 的基本准则,适用于药品 E 的全过程及原料药生产中影响B 的各关键工艺。
A、生产B、质量C、生产和质量管理D、制剂E、制剂生产F、成品质量2、药品生产企业必须配备一定数量的与 E 相适应的具有 C 、 D及 A 的各级管理人员和 B 。
A、组织能力B、技术人员C、医药专业知识D、生产经验E、药品生产3、100,000级洁净厂房≥0.5微米的尘埃粒子数应< A /立方米,活微生物数/立方米≤F 。
A、3,500,000B、350,000C、3500D、5E、100F、5004、100,000级洁净厂房一般适于片剂、 C 、丸剂及其它制剂的生产。
A、大输液B、无菌原料药的精、烘、包C、胶囊剂5、洁净区与室外的静压差应大于或等于 A 。
A、10PaB、4.9PaC、15PaD、5Pa6、厂房应按 B 及所要求的 C 进行合理布局。
厂房应能防止 F 、G 、鼠类等动物的进入A、岗位操作法B、生产工艺流程C、洁净级别D、苍蝇E、鸟类F、蚊子G、昆虫7、生产区 B 、 C 和 D 总体布局应合理,不得相互妨碍。
A、操作区B、辅助区C、办公区D、生活区E、行政区F、绿化区8、生产区周围无C ,道路F ,不易产生粉尘。
A、垃圾B、下水道C、污染源D、无裂隙E、无脱落尘粒F、平整9、洁净厂房的 C 、天花板及进入室内的管线、风口、灯罩与墙壁或天花板的连接部位均应B 。
A、下水管B、气密C、窗户D、密闭10、厂房内的固定管线应有表明C 及 D 的醒目标志。
A、编码B、色环C、内容物D、流向11、洁净厂房内安装的 B 不得对药品生产带来污染,地漏必须设有液封或设有防止排水口倒流的有效措施。
A、浴室B、洗手池C、厕所12、仓贮区应D 、F 等工作室,并应有足够的空间,退回的或回收的产品等按秩序合理储存。
能满足原料、辅料、包装材料、中间体、成品、待验品和合格品、不合格品的存放。

目录前言 (3)主要工艺参数的选择 (6)一、工艺计算 (6)〔一〕、发酵罐容积 (6)〔二〕、菌种及发酵车间设计 (7)1、菌种扩大培养流程 (7)2、流加培养流程 (7)〔三〕、物料计算 (8)1、发酵罐耗糖 (8)2、发酵罐耗玉米浆量 (8)3、发酵罐耗氮〔NH4〕2SO4〕量 (9)4、发酵罐耗碱液量 (9)5、发酵罐耗磷量(KH2PO4以P2O5计) (9)6、二级种子罐耗糖量 (10)7、种子培养消耗的计算 (10)〔四〕、热量衡算 (10)1、糖液灭菌耗汽量 (11)2、空罐灭菌 (11)3、冷却用水 (11)〔五〕、种子罐计算 (11)(六〕、二级种子罐的过滤器计算 (13)1、求滤层厚度 (13)2、求压力降 (13)3、求分滤器的直径 (14)4、总过滤器工艺设计 (15)〔七〕、酵母干燥 (16)二、设备选型 (16)三、设计心得 (16)前言我国的酵母工业化生产始于1922 年,由上海大华利卫生食料厂首家生产压榨面包酵母,至今已有80 多年的历史。
〔一〕高活性干酵母产业我国活性干酵母的研究和开发始于20 世纪70 年代。
1974 年上海酵母厂首先试制和生产了面包活性干酵母,改革开放的国策则大大加快了高活性酵母产业的发展速度。
20 世纪80 年代中期,广东率先引进了国外先进的高活性干酵母的生产技术和设备,建成了两家大型的具有当代国际先进水平的高活性干酵母生产企业,即广东丹宝利酵母公司和广东梅山一马利酵母公司。
目前,我国生产高活性干酵母的国有企业主要有湖北安琪酵母公司、广东丹宝利酵母公司,中澳合资的梅山一马利酵母公司和哈尔滨一马利酵母公司等数家。
〔二〕食用酵母抽提物生产从20 世纪70 年代起,我国多家研究机构就开始研究和开发利用活性酵母生产食用酵母抽提物,作为食用营养调味品。
由于我国的饮食习惯和消费结构与欧美国家不同,鲜味剂以味精为主,味精在我国鲜味剂市场上占据绝对的主导地位。

5%葡萄糖注射液工艺卡(无水)
部门:生产部 题目:5%葡萄糖注射液工艺卡(无水) 1/2
文件编号:STP-PC-99009(01)
新订: 替代: 起草:
部门审阅: 审核: 批准:
执行日:
变更记录:
修订人: 批准执行日:
变更原因及目的:
目 的:便于车间对5%葡萄糖注射液生产的工艺、技术的掌握。
适用范围:生产车间各工序
责 任 者:操作员、生产管理人员
内 容:
产品名称
5%葡萄糖注射液(Glucose Injection)
规 格
500ml:25g 250ml:12.5g
处 方
无水葡萄糖 45.45kg
活性炭 0.2g
10%盐酸 适量
注射用水加至 1000L
处方及质量依据 中国药典九五版二部P845 批准文号 川卫药准字(1988)第004672号
半成品质量标准
及检验方法
含量限度:98-102% pH值:3.8-4.2 色泽:无色
葡萄糖测定;量取稀配好的药液100ml,装入20cm测定管中,测定旋光度A,
按下式计算葡萄糖的标示含量:
A×1.0426
×100%
5
pH值:用pH计测定(中国药典九五版附录Ⅵ H)
各
工
序
操
作
方
法
与
制 水
饮用水经电渗析、离子交换及超滤制得去离子水,再蒸馏、过滤,制得注射用水。
冼 瓶 瓶外清洗后,用0.5%NaOH处理,刷洗内壁,再用饮用水清洗,而后用去离子水清洗,最后用注射用水清洗两次。输液瓶洗净后精选剔除不合格瓶,精洗后洗
水经检验不得带有残余洗涤剂且澄明度检查合格,pH5.0-7.0。
胶 塞
用1.2%(g/ml)NaOH液处理,煮沸1小时,用自来水洗净;又用1%(ml/ml)HCl
液煮沸1小时,自来水洗净。最后蒸馏水煮沸1小时,用蒸馏水洗净,再注射
用水清洗至最后的一次洗涤水检查不显氯化物反应,澄明度检查合格,方得进
入下工序。
过 程 隔离膜 先用手工刷去毛边,然后浸泡于0.9%NaCl中12小时,从盐水中捞起,逐张分
散浸泡于95%乙醇中,浸泡时间12小时以上,滤干后,用注射用水漂洗至最后
一次洗涤水澄明度检查应无白块、小白点在2个(包括2个)以下,方得进入
下工序。
5%葡萄糖注射液工艺卡(无水)
部门:生产部 题目:5%葡萄糖注射液工艺卡(无水) 2/2
文件编号:STP-PC-99009(01)
新订: 替代: 起草:
部门审阅: 审核: 批准:
执行日:
变更记录:
修订人: 批准执行日:
变更原因及目的:
配 制 称取按处方计算的葡萄糖,在稀配锅中加入约1/2量的注射用水,搅拌下将葡萄糖投入,待溶解完毕,加入活性炭,搅拌下煮沸15分钟,加注射用水至需要量,继续搅拌10分钟,取样测定含量、pH值合格后,通自来水冷却至60℃,
经钛棒过滤(0.65μm)泵至贮药罐,经微孔滤过滤(0.45μm)泵至灌装室,经终端
过滤(0.22μm)后供灌装。
灌 装 药液经澄明度检查合格后,装入输液瓶中,立即盖膜、放正,然后上塞、翻塞、加盖、轧口。轧口后需进行检查,胶塞损伤、封口不严等及时剔除,进行返工
处理。
灭 菌 采用湿热灭菌法,以温度为依据,汽压为参考,在116℃保温35分钟。灭菌过程采用温度自动调节仪进行温度自控和记录。灭菌时蒸汽应保持畅通,严格控
制操作压力和温度。药液从灌装轧口至灭菌间隔时间不超过2小时。
灯 检
灯检室中,在不反光的黑色背景下进行灯检。光源采用20W日光灯,照度为1000
-1500LX,检品与眼睛距离为20-25cm。检查标准按卫生部WS1-362(B-121)
-91号逐步直立、倒立、平视三步法旋转检视,每瓶检视时间不得少于7秒。
不合格品移交配制工序进行回收处理,合格产品送入下工序。
包 装 按计划领取所需标签、纸箱。逐一盖好批号、负责限期、字迹应清晰、端正无误,不得涂改,剩余和报废标签专人回收处理,瓶签应贴端正,位置适中、贴牢、不皱折、不漏贴、缺角等。贴好瓶签后进行装箱,装好后检查有无漏损,
放入装箱单及合格证,盖上纸板,封箱。经质检员检查后,送入待检库,抽样
送检。
不合格品的处理
1、 不合格的药液,可回收的重新调配,不可回收的报废处理;
2、 橡胶塞可回收的进行清洁消毒处理,不可回收的报废处理;
3、 合格的玻瓶在药液回收后,立即回收使用,不合格作废渣处理。
作用与用途
营养药,能增加人体能量,并且有解毒利尿作用,用于血糖过低,心肌炎和补
充体液等。
用法与用量 静脉滴注,一次5-50g,10-100g。
注意事项
贮存条件 密闭保存 负责期限 18个月
包装要求 500ml,每箱20瓶 250ml,每箱30瓶