碳材料科学-知识点总结
- 格式:docx
- 大小:409.50 KB
- 文档页数:19

有机化合物知识点总结有机化合物是由碳原子和氢原子以及其他原子(如氧、氮、硫等)通过共价键连接而成的化合物。
有机化合物广泛存在于自然界中,包括石油、煤炭、天然气等化石燃料,以及生物体内的蛋白质、核酸、糖类等。
本文将对有机化合物的结构、命名、反应类型及应用进行总结。
一、有机化合物的结构有机化合物的结构主要包括原子、键、分子式和结构式四个方面。
1. 原子:有机化合物主要由碳原子和氢原子构成,其中碳原子的电子结构以及其与其他原子的化学性质决定了有机化合物的特性。
2. 键:有机化合物中的键主要是共价键,共享电子对提供了化合物的稳定性。
常见的有机化合物键包括单键、双键和三键。
3. 分子式:分子式用来表示化合物中各个元素的种类和数量,例如甲烷的分子式为CH4。
4. 结构式:结构式是用来表示有机化合物中碳原子之间以及碳原子与其他原子之间的连接方式的图示表示方法,常见的有线结构式、简化结构式和投影结构式等。
二、有机化合物的命名有机化合物的命名采用命名规则,主要包括命名前缀和命名后缀两部分。
1. 命名前缀:命名前缀用来表示有机化合物中基团或官能团的种类和数量,如甲基、乙基、氯代、羟基等。
2. 命名后缀:命名后缀用来表示有机化合物的主要功能性质和骨架结构,如烃、醇、酮、酸等。
根据命名规则,可以准确命名各种有机化合物,并根据其命名推测其结构和性质。
三、有机化合物的反应类型有机化合物的反应类型主要包括取代反应、加成反应、消除反应、氧化反应和还原反应等。
1. 取代反应:取代反应是指有机化合物中的一个原子或官能团被另一个原子或官能团取代的过程,如烷烃发生卤素取代反应。
2. 加成反应:加成反应是指两个或多个有机物分子结合形成一个新的化合物,如烯烃发生加氢反应。
3. 消除反应:消除反应是指有机化合物中的两个官能团或原子通过共享电子对形成一个新的化合物,如醇分子脱水生成烯烃。
4. 氧化反应和还原反应:氧化反应是指有机化合物失去电子或氧化态增加的过程,还原反应是指有机化合物获得电子或氧化态减少的过程,如醛醇互转。

有机化学的基础知识点归纳总结5篇篇1一、概述有机化学是研究含碳化合物及其衍生物的化学分支。
本篇文章旨在归纳总结有机化学的基础知识点,以帮助读者更好地理解和掌握有机化学的核心内容。
二、基本概念1. 有机化学定义:研究碳基化合物的化学称为有机化学。
2. 有机化合物的特点:主要由碳和氢组成,具有同分异构现象,可发生化学反应等。
三、有机化合物的分类1. 烃类:仅由碳和氢组成的有机化合物。
如:烷烃、烯烃、炔烃、芳香烃等。
2. 醇类:含有羟基(-OH)的有机化合物。
3. 酮类:含有羰基(-CO-)的有机化合物。
4. 羧酸类:含有羧基(-COOH)的有机化合物。
5. 其他类别:包括醚、酯、醛、胺等。
四、共价键与分子结构1. 共价键:原子间通过共用电子对形成的化学键。
2. 分子结构:有机化合物的分子由原子通过共价键连接而成。
3. 立体异构:包括构型异构和构象异构,如异构体的命名和判断。
五、有机反应类型1. 取代反应:原子或原子团替代有机分子中的某些原子或原子团。
2. 加成反应:简单物质与有机化合物中的不饱和键进行加合。
3. 消除反应:从有机化合物中消除某些原子或原子团,生成不饱和键。
4. 氧化与还原反应:涉及有机化合物中电子转移的反应。
六、有机化学反应机制1. 反应速率:描述化学反应快慢的物理量。
2. 反应机理:描述反应如何进行的途径和步骤。
3. 速率定律与活化能:阐述反应速率与反应物浓度之间的关系及反应的活化能要求。
七、光谱分析与结构鉴定1. 光谱分析:利用物质对光的吸收、发射等特性进行物质分析的方法。
2. 结构鉴定:通过光谱数据、化学性质等推断有机化合物的结构。
八、有机合成与设计1. 有机合成:通过有机反应合成有机化合物。
2. 合成设计:根据目标产物设计合适的合成路线和方法。
九、应用与实例1. 医药:药物的设计与合成是有机化学的重要应用领域。
2. 材料科学:高分子材料、功能材料等需要有机化学的知识。
3. 农业:农药、化肥等的设计与合成离不开有机化学。


1、其内部结构包括四个层次:①原子结构;②结合键;③原子的排列方式;④显微组织。
2、结合键的定义:所谓结合键是指由原子结合成分子或固体的方式和结合力的大小。
3、化学键有:离子键、共价键、金属键。
物理键:氢键、分子间力4、共价键具有方向性、饱和性。
金刚石、单质硅、SiC、H2、O2、F2、碳-氢化合物。
5、共价晶体特点:结构稳定,熔点高,质硬脆,一般是绝缘体,其导电性能差。
6、离子键的特点:常温下,电绝缘体;在高温熔融状态时,正负离子在外电场作用下可以自由运动,即呈现离子导电性。
离子键没有方向性、无饱和性。
7、离子晶体的特点:离子键很强,故有高硬度、熔点,强度大,固体下不导电,熔融时才导电。
离子间发生相对位移,电平衡破坏,离子键破坏,脆性材料。
较高熔点(正、负离子间有很强的电的吸引力)8、金属键的定义:由金属正离子和自由电子之间互相作用而结合称为金属键。
9、金属键的特点:金属键无方向性,金属键无饱和性,具有高对称性。
10、金属键型晶体的特征:良好的延展性、良好的导电性、具有正的电阻温度系数、导热性好、金属不透明、具有金属光泽(自由电子可吸收可见光的能量)11、范德瓦尔斯键没有方向性和饱和性。
12、13、晶体的定义:物质的质点(分子、原子或离子)在三维空间作有规律的周期性重复排列所形成的物质叫晶体。
14、非晶体在整体上是无序的;近程有序。
15、晶体的特征:(1)周期性(不论沿晶体的哪个方向看去,总是相隔一定的距离就出现相同的原子或原子集团。
这个距离称为周期)液体和气体都是非晶体。
(2)有固定的凝固点和熔点(3)各向异性(沿着晶体的不同方向所测得的性能通常是不同的:晶体的导电性、导热性、热膨胀性、弹性、强度、光学性质)。
16、晶体与非晶体的区别17、a.根本区别:质点是否在三维空间作有规则的周期性重复排列b.晶体熔化时具有固定的熔点,而非晶体无明显熔点,只存在一个软化温度范围c.晶体具有各向异性,非晶体呈各向同性(多晶体也呈各向同性,称“伪各向同性”)18、点代表原子(分子或离子)的中心,也可是彼此等同的原子群或分子群的中心,各点的周围环境相同。

第一章材料的结构一、概念晶体:物质的质点(分子、原子或离子)在三维空间呈规则的周期性重复排列的物质。
空间点阵:把质点看成空间的几何点,点所形成的空间阵列。
晶格:用假想的空间直线,把这些点连接起来,所构成的三维空间格架。
晶胞:从晶格中取出具有代表性的最小几何单元。
配位数:指晶格中任一原子周围所具有的最近且等距的原子数。
致密度:合金:是指由两种或两种以上元素组成的具有金属特性的物质。
固溶体:指溶质组元溶于溶剂晶格中,并保持溶剂组元晶格类型而形成的均匀固体。
置换固溶体:溶质原子占据溶剂晶格的某些结点位置而形成的固溶体。
间隙固溶体:溶质原子占据溶剂晶格间隙而形成的固溶体。
间隙相:当r非/r金<0.59时,形成具有简单晶格的化合物,称为间隙相。
二、思考题1.在单位立方晶胞中画出(112)和(110)晶面,并求出两晶面交线的晶向指数。
2.已知铜的原子半径为0.127nm,求其晶格常数和致密度各为多少?3.在立方晶胞中画出(112) 晶面和[221],晶向。
第2章晶体缺陷一、概念肖特基缺陷:原子由于热振动脱离正常结点后,跑到晶体表面构成新的一层,这种缺陷称为肖特基缺陷。
弗仑克尔缺陷:原子由于热振动脱离正常结点后,跑到间隙处即产生一个空位的同时,出现一个间隙原子,这种缺陷称为弗仑克尔缺陷。
刃型位错:晶体中已滑移区与未滑移区的边界线(即位错线)若垂直于滑移方向,则会存在一多余半排原子面,它象一把刀刃插入晶体中,使此处上下两部分晶体产生原子错排,这种晶体缺陷称为刃型位错螺型位错:晶体中已滑移区与未滑移区的边界线(即位错线)若平行于滑移方向,则在该处附近原子平面已扭曲为螺旋面,即位错线附近的原子是按螺旋形式排列的,这种晶体缺陷称为螺型位错位错的滑移:在外加切应力作用下,通过位错中心附近的原子沿柏氏矢量方向在滑移面上不断地作少量位移(小于一个原子间距)而逐步实现的。
位错的攀移:构成刃型位错的多余半原子面的扩大或缩小,它是通过物质迁移即原子或空位的扩散来实现的。
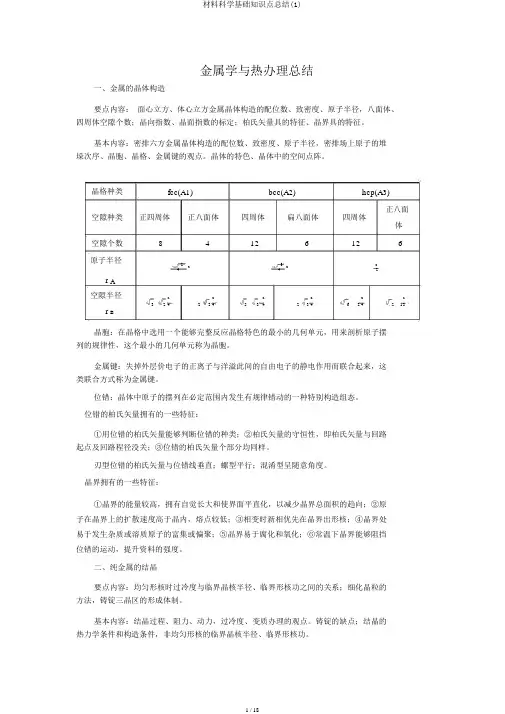
金属学与热办理总结一、金属的晶体构造要点内容:面心立方、体心立方金属晶体构造的配位数、致密度、原子半径,八面体、四周体空隙个数;晶向指数、晶面指数的标定;柏氏矢量具的特征、晶界具的特征。
基本内容:密排六方金属晶体构造的配位数、致密度、原子半径,密排场上原子的堆垛次序、晶胞、晶格、金属键的观点。
晶体的特色、晶体中的空间点阵。
晶格种类fcc(A1)bcc(A2)hcp(A3)空隙种类正四周体正八面体四周体扁八面体四周体正八面体空隙个数84126126原子半径2a3a a442r A空隙半径32a22a53a23a62a21a 444442r B晶胞:在晶格中选用一个能够完整反应晶格特色的最小的几何单元,用来剖析原子摆列的规律性,这个最小的几何单元称为晶胞。
金属键:失掉外层价电子的正离子与洋溢此间的自由电子的静电作用而联合起来,这类联合方式称为金属键。
位错:晶体中原子的摆列在必定范围内发生有规律错动的一种特别构造组态。
位错的柏氏矢量拥有的一些特征:①用位错的柏氏矢量能够判断位错的种类;②柏氏矢量的守恒性,即柏氏矢量与回路起点及回路程径没关;③位错的柏氏矢量个部分均同样。
刃型位错的柏氏矢量与位错线垂直;螺型平行;混淆型呈随意角度。
晶界拥有的一些特征:①晶界的能量较高,拥有自觉长大和使界面平直化,以减少晶界总面积的趋向;②原子在晶界上的扩散速度高于晶内,熔点较低;③相变时新相优先在晶界出形核;④晶界处易于发生杂质或溶质原子的富集或偏聚;⑤晶界易于腐化和氧化;⑥常温下晶界能够阻挡位错的运动,提升资料的强度。
二、纯金属的结晶要点内容:均匀形核时过冷度与临界晶核半径、临界形核功之间的关系;细化晶粒的方法,铸锭三晶区的形成体制。
基本内容:结晶过程、阻力、动力,过冷度、变质办理的观点。
铸锭的缺点;结晶的热力学条件和构造条件,非均匀形核的临界晶核半径、临界形核功。
相起伏:液态金属中,时聚时散,起伏不定,不停变化着的近程规则摆列的原子公司。

【材料科学基础】重点论述题总结(一)一、原子键合1. 简述金属材料的性质与键合的关系金属键结合力主要是正离子和电子云之间的静电库仑力,对晶体结构没有特殊的要求,只要求排列最紧密,这样势能最低,结合最稳定。
金属晶体性质与键合关系:(1)金属内原子面之间相对位移,金属键仍旧保持,故具有良好的延展性;(2)在一定电位差下,自由电子可在金属中定向运动,形成电流,显示出良好的导电性;(3)随温度升高,正离子(或原子)本身振幅增大,阻碍电子通过.使电阻升高,则具有正的电阻温度系数;d)固态金属中,不仅正离子的振动可传递热能,且电子运动也能传递热能,故比非金属具有更好的导热性;(4)金属中的自由电子可吸收可见光的能量,被激发、跃迁到较高能级,因此金属通常不透明;(5)当激发出的电子跳回到原来能级时,将所吸收的能量重新辐射出来,使金属具有金属光泽;(6)金属的结合能比离子晶体和原子晶体要低一些,但过渡金属的结合能则比较大。
2. 依据结合力的本质不同,晶体中的键合作用分为哪几类?特点是什么?晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
3. 结合键对材料物理及力学性能的影响对物理性能的影响(1)熔点:共价键、离子键的最高,高分子材料的最低;(2)密度:金属键的最高,共价键、离子键的较低,高分子材料的最低;(3)导电导热性:金属键最好,共价键、离子键最差。
对力学性能的影响(1)强度:结合键强,则强度也高,但还受组织的影响;(2)塑韧性:金属键最好,共价键、离子键最低;(3)弹性模量:共价键、离子键最高,金属键次之,二次键最低。
二、固体结构1. 置换固溶体溶解度的影响因素(1)晶体结构类型的影响溶质与溶剂晶体结构相同,是形成连续固溶体的必要条件。

一.名词解释塑性韧性强度弹性比功分子键(空间)点阵固溶体间隙固溶体固溶强化位错多晶体单晶体反应扩散柯肯达尔效应二次结晶共晶转变包晶转变共析转变铁素体(非)均匀形核结构起伏成分过冷过冷度加工硬化再结晶淬透性(过)时效回火脆性调幅分解二. 需掌握的知识点1. 延性断裂和脆性断裂的区分标准—断裂前有无明显塑性变形。
2. 原子核外电子分布规律遵循的三个原则。
3. 金属键、离子键、共价键、分子键的特点。
4. 混合键比例计算与电负性差的关系。
5. fcc、bcc、hcp的常见金属、一个晶胞内原子数、配位数、致密度、常见滑移系等。
6. 固态合金相分为两大类:固溶体(间隙固溶体与置换固溶体)和中间相(区别点)。
7.影响固溶体溶解度的因素。
8.间隙相和间隙化合物的区别。
9. 晶体缺陷几何特征分类-点、线、面缺陷。
10. 点缺陷的种类及其区别(肖脱基缺陷和弗兰克尔缺陷)。
11.获得过饱和点缺陷的方法及原因。
12. 各类位错运动方向与柏氏矢量、切应力、位错线的位向关系。
13. 位错的主要运动方式;常温下金属塑性变形的方式。
14. 位错的增殖机制:F-R位错增殖机制、双交滑移增殖机制的主要内容。
15.说明柏氏矢量的确定方法。
掌握利用柏氏矢量和位错线的位向关系来判断位错类型。
16.两根平行的螺型位错相遇时的相互作用情况。
17.刃型位错和螺型位错的不同点。
18. 大小角度晶界的位向差、常见类型、模型描述、能量等。
19. 扩散第一定律、第二定律的数学表达式及其字母的物理含义。
20. 体扩散的主要机制、适用对象、扩散激活能大小等;短路扩散等;反应扩散与原子扩散;多晶材料的三种扩散途径—晶内、晶界、表面扩散。
21.柯肯达尔效应的含义及说明的问题(重要意义)。
22. 上坡扩散:物质由低浓度→高浓度,说明扩散的真正原因是化学势梯度而非浓度梯度。
23. 反应扩散定义、特点、扩散层增厚速度的决定因素。
24. 影响扩散的主要因素简述及分别叙述。

一.名词解释塑性韧性强度弹性比功分子键(空间)点阵固溶体间隙固溶体固溶强化位错多晶体单晶体反应扩散柯肯达尔效应二次结晶共晶转变包晶转变共析转变铁素体(非)均匀形核结构起伏成分过冷过冷度加工硬化再结晶淬透性(过)时效回火脆性调幅分解二. 需掌握的知识点1. 延性断裂和脆性断裂的区分标准—断裂前有无明显塑性变形。
2. 原子核外电子分布规律遵循的三个原则。
3. 金属键、离子键、共价键、分子键的特点。
4. 混合键比例计算与电负性差的关系。
5. fcc、bcc、hcp的常见金属、一个晶胞内原子数、配位数、致密度、常见滑移系等。
6. 固态合金相分为两大类:固溶体(间隙固溶体与置换固溶体)和中间相(区别点)。
7.影响固溶体溶解度的因素。
8.间隙相和间隙化合物的区别。
9. 晶体缺陷几何特征分类-点、线、面缺陷。
10. 点缺陷的种类及其区别(肖脱基缺陷和弗兰克尔缺陷)。
11.获得过饱和点缺陷的方法及原因。
12. 各类位错运动方向与柏氏矢量、切应力、位错线的位向关系。
13. 位错的主要运动方式;常温下金属塑性变形的方式。
14. 位错的增殖机制:F-R位错增殖机制、双交滑移增殖机制的主要内容。
15.说明柏氏矢量的确定方法。
掌握利用柏氏矢量和位错线的位向关系来判断位错类型。
16.两根平行的螺型位错相遇时的相互作用情况。
17.刃型位错和螺型位错的不同点。
18. 大小角度晶界的位向差、常见类型、模型描述、能量等。
19. 扩散第一定律、第二定律的数学表达式及其字母的物理含义。
20. 体扩散的主要机制、适用对象、扩散激活能大小等;短路扩散等;反应扩散与原子扩散;多晶材料的三种扩散途径—晶内、晶界、表面扩散。
21.柯肯达尔效应的含义及说明的问题(重要意义)。
22. 上坡扩散:物质由低浓度→高浓度,说明扩散的真正原因是化学势梯度而非浓度梯度。
23. 反应扩散定义、特点、扩散层增厚速度的决定因素。
24. 影响扩散的主要因素简述及分别叙述。

材料科学基础108个重要知识点1.晶体--原子按一定方式在三维空间内周期性地规则重复排列,有固定熔点、各向异性。
2.中间相--两组元A 和B 组成合金时,除了形成以A 为基或以B 为基的固溶体外,还可能形成晶体结构与A,B 两组元均不相同的新相。
由于它们在二元相图上的位置总是位于中间,故通常把这些相称为中间相。
3.亚稳相--亚稳相指的是热力学上不能稳定存在,但在快速冷却成加热过程中,由于热力学能垒或动力学的因素造成其未能转变为稳定相而暂时稳定存在的一种相。
4.配位数--晶体结构中任一原子周围最近邻且等距离的原子数。
5.再结晶--冷变形后的金属加热到一定温度之后,在原变形组织中重新产生了无畸变的新晶粒,而性能也发生了明显的变化并恢复到变形前的状态,这个过程称为再结晶。
(指出现无畸变的等轴新晶粒逐步取代变形晶粒的过程)6.伪共晶--非平衡凝固条件下,某些亚共晶或过共晶成分的合金也能得到全部的共晶组织,这种由非共晶成分的合金得到的共晶组织称为伪共晶。
7.交滑移--当某一螺型位错在原滑移面上运动受阻时,有可能从原滑移面转移到与之相交的另一滑移面上去继续滑移,这一过程称为交滑移。
8.过时效--铝合金经固溶处理后,在加热保温过程中将先后析出GP 区,θ”,θ’,和θ。
在开始保温阶段,随保温时间延长,硬度强度上升,当保温时间过长,将析出θ’,这时材料的硬度强度将下降,这种现象称为过时效。
9.形变强化--金属经冷塑性变形后,其强度和硬度上升,塑性和韧性下降,这种现象称为形变强化。
10.固溶强化--由于合金元素(杂质)的加入,导致的以金属为基体的合金的强度得到加强的现象。
11.弥散强化--许多材料由两相或多相构成,如果其中一相为细小的颗粒并弥散分布在材料内,则这种材料的强度往往会增加,称为弥散强化。
12.不全位错--柏氏矢量不等于点阵矢量整数倍的位错称为不全位错。
13.扩展位错--通常指一个全位错分解为两个不全位错,中间夹着一个堆垛层错的整个位错形态。

【课题】碳族元素【考纲要求】1、了解碳族元素性质的相似性和递变性2、掌握碳单质及其化合物的性质3、掌握硅单质及其重要化合物的主要性质4、了解硅酸盐工业和无机非金属材料【教学重点】碳、硅单质及其化合物的性质,以及碳、硅单质与化合物之间的转化关系【基础回顾】碳族元素位于周期表的族,包括元素。
原子最外层都是4个电子,在反应中既不容易失去电子,也不容易得到电子,通常形成共用电子对与其他元素结合。
其主要化合价为+2、+4。
碳族元素从上到下原子半径依次增大,非金属性逐渐减弱,金属性逐渐加强。
大多能形成气态氢化物,其稳定性逐渐减弱。
最高价氧化物对应水化物酸性减弱。
【夯实基础】一、知识网络:碳及其化合物的转化关系.硅及其化合物的转化关系考点一:碳族元素(碳族元素的性质递变关系)元素符号及名称主要化合价单质色、态氢化物主要氧化物最高价氧化物对应水化物相似性递变性考点二碳单质及其化合物1、碳的单质(1)同素异形体金刚石石墨60C结构正四面体,空间网状,原子晶体平面层状正六边形笼状(足球烯)分子晶体主要性质熔、沸点高,硬度大,难溶于溶剂,不导电熔点很高,质软有滑腻感,导电可与金属掺杂形成超导体用途钻石、刻刀、装饰品电极、铅笔芯、润滑剂应用于材料科学注意:常见的同素异形体金刚石、石墨、C60O2、O3P4(白磷)、红磷晶体硅、无定形硅(2)化学性质(可燃性、还原性)2、碳的化合物(1)氧化物(CO、CO2)性质一氧化碳CO 二氧化碳CO2物理性质色、态、味无色无味气体无色无味气体毒性有毒无毒,会造成温室效应但不是大气的污染物密度与空气的比较略小大溶解性难溶于水能溶于水化学性质1、可燃性2CO+O2点燃2CO21、不能燃烧,也不能支持燃烧2、还原性2、氧化性C+CO2高温2COCuO+CO△Cu+CO 23、能与澄清的石灰水等碱溶液反应 CO 2+Ca (OH )2= CaCO 3↓+ H 2O4、能与水反应 H 2O+CO 2= H 2CO 32① CO 气体中混有CO 2 (将气体通入装有氢氧化钠溶液的洗气瓶) ② CO2气体中混有CO (将气体通入硬质玻璃管中盛放灼热的CuO) ③ CO2气体中混有O 2 (将气体通入硬质玻璃管中盛放灼热的Cu)④ CO 2气体中混有SO 2 (将气体通入装有碳酸氢钠溶液或酸性高锰酸钾溶液的洗气瓶) ⑤ CO 2气体中混有HCl (将气体通入装有碳酸氢钠溶液的洗气瓶) ⑥ CO 2气体中混有H 2S (将气体通入装有硫酸铜溶液的洗气瓶中) (2)NaHCO 3 、Na 2CO 3(在金属及其化合物中提到故省略) 【例题1】(09广东理综)下列除去杂质的方法正确的是 A .除去CO 2中混有的CO :用澄清石灰水洗气B .除去BaCO 3固体中混有BaSO 4的:加过量盐酸后,过滤、洗涤C .除去FeCl 2溶液中混有的FeCl 3:加入过量铁粉,过滤D .除去Cu 粉中混有的CuO :加适量稀硝酸后,过滤、洗涤 考点三 硅单质及其化合物 1.单质硅(1)主要物理性质单质硅有 晶体硅 和 无定形硅 两种,晶体硅是 灰黑色 、有金属 光泽、 硬 而 脆 的固体。
有机化学的基础知识点归纳总结有机化学是研究碳及其化合物的化学性质和反应规律的科学。
有机化学在各个领域中都有着广泛应用,如生物化学、药物化学、材料化学等。
为了更好地了解有机化学,我们需要掌握有机化学的基础知识点。
下面将对有机化学的基础知识点进行归纳总结。
一、共价键的形成有机化合物是由碳原子与其他元素原子共价键形成的化合物。
共价键的形成受到以下因素的影响:共价键中原子间的距离、原子之间电负性的差异、原子中空壳电子数的多寡。
共价键的形成可以通过杂化理论来解释,即通过轨道重叠形成杂化轨道,从而形成共价键。
二、分子结构的描述有机化学分子结构的描述包括分子共面性、分子对称性和键的方向性。
其中,分子共面性指的是分子中元素原子排列成一定平面,而分子对称性指的是对于不同的立体构型,其分子具有相同的物理化学性质。
键的方向性指的是共价键在空间立体构型中的方向。
三、键能与键长键能与键长是描述分子化学键及其强度的概念。
其中,键能是指能够在分子之间存储的能量,而键长是与键能相对应的键的长度。
在有机化学中,不同的分子之间的键能与键长是不同的。
四、变态键变态键是指在化学键形成中出现的一些特殊情况。
例如,在取代碳原子周围,如果碳原子上存在多个不同的基团,就会形成变态键,其中最为常见的是光电偶极子变态键。
五、环状化合物的性质环状化合物是指含有环状结构的有机化合物,如苯环。
环状化合物具有特殊的性质,例如稳定性高、共振能力强、孪生异构体等。
在环状化合物的研究中,相位规则和环电子亲和势是重要的概念。
六、亲核试剂与电子受体亲核试剂是指具有亲核性质的化合物,可以与电子亏损的离子或分子发生化学反应。
而电子受体则是指具有亲电子性质的化合物,可以与带负电的离子或分子发生化学反应。
在有机化学研究中,亲核试剂和电子受体是不可或缺的概念。
七、有机反应类型有机反应类型包括酸碱反应、加成反应、消除反应、取代反应、重排反应及自由基反应等。
有机反应类型是研究有机化学反应规律的重要内容,对于有机化学的深入理解和应用具有重要意义。
一、概念题马氏体转变:是一种固态镶边,是通过母相宏观切变,原子整体有规律迁移完成的无扩散相变奥氏体的热稳定化:淬火冷却时,因缓慢冷却或在冷却过程中于某一温度停留引起的奥氏体稳定性提高,而使马氏体转变变快的现象奥氏体的反稳定化:在热稳定上线温度Mc一下,热稳定程度随温度的升高而增加,但有些钢某一温度后稳定化程度反而下降的现象形变马氏体:通常将形变诱发马氏体转变所形成的马氏体成为形变马氏体组织遗传:指非平衡组织重新加热淬火后,其奥氏体晶粒大小仍保持原奥氏体晶粒大小的形状的现象相遗传:母相将其晶体学缺陷遗传給新相的现象相变冷作硬化:马氏体型城市的体积效应会引起周围奥氏体产生塑性变形,同时马氏体相变的切变特性,也将在晶体内产生大量微观缺陷,如位错、孪晶、层错等,这些缺陷会在马氏体逆转变过程中会被继承,结果导致强度明显升高而塑韧性下降马氏体异常正方度:新形成的马氏体正方度与碳含量的关系并不符合公式给出的关系的现象位相关系:在固态相变母相与新相之间所保持的晶体学取向关系珠光体晶粒(团):在片状珠光体中,片层排列方向大致相同的区域称为珠光体团TTT曲线:使过冷奥氏体等温转变图,是描述过冷奥氏体等温转变行为,即等温温度等温时间转变产物的综合曲线K—S关系:在固态镶边母相与新相之间,所保持的晶体学位相关系,例如奥氏体向马氏体转变时新旧两项之间就保持这种关系(111)r // (110)α<110>r // <111>α二、符号意义Ms:马氏体点,马氏体转变的开始温度,母相与马氏体两相的体积自由能之差达到相变最小驱动力值得温度。
Mc:奥氏体热稳定化的上限温度,超过此温度奥氏体将出现热稳定化现象Mb:马氏体转变爆发点,在此温度瞬间有大量马氏体形成Md:形变马氏体点,能够形成形变诱发马氏体转变的上限温度Mf:马氏体转变的终了温度,此温度下奥氏体向马氏体转变将不再继续进行As:马氏体逆转变的开始温度,低于此温度马氏体不能像奥氏体转变,即马氏体逆转变的下限温度Sv:高碳片状马氏体显微裂纹敏感度,单位体积马氏体组织中显微裂纹的面积θ:滞后温度间隔度,奥氏体热稳定化程度量度,由于碳、氮原子钉扎位错,而要求提供附加化学驱动力以克服碳氮原子的钉扎力,而获得这个附加的化学驱动力所属的过冷度即为θ值So:片状珠光体的片间距离,即一片铁素体和渗碳体的总厚度,或相邻两片铁素体或渗碳体之间的中心距离三、简答题1.钢中奥氏体的点阵结构,碳原子可能存在的部位奥氏体是碳溶于γ—Fe所形成的固溶体,其为面心立方结构碳原子位于γ—Fe八面体间隙位置中心,即面心立方点阵晶胞的中心或棱边的中心2.合金元素对奥氏体形成的四个阶段有何影响1对奥氏体的形成速度的影响○1通过对碳扩散速度影响奥氏体的形成速度强碳化物形成元素Cr、Mo、W等降低碳在奥氏体中的扩散系数,推迟珠光体转变为奥氏体进程非碳化物形成元素Co,Ni等增大碳在奥氏体中的扩散系数,加快珠光体转变为奥氏体进程Si、Al等对碳在γ—Fe中扩散系数影响不大,因此对奥氏体形成无明显影响○2合金元素通过改变碳化物稳定性影响奥氏体的形成温度,通常是碳化物稳定性提高的元素延缓奥氏体的形成○3对临界点的影响:当温度一定时,临界点的变化相当于热度的变化Ni、Mn、Cu等降低A1温度,Cr、Mo、Ti、Si、Al等升高A1温度○4合金元素通过对原始组织的影响而影响奥氏体形成速度,Ni、Mn等往往使珠光体细化,有利于奥氏体形成2合金钢中奥氏体均匀化,合金钢奥氏体形成后,除了碳的均匀化外,还要进行合金元素的均匀化(比碳慢100~10000倍),且合金元素均匀化所属时间更长3.以渗碳体为领现象说明珠光体团的形成过程,并说明奥氏体向珠光体转变过程中碳的扩散规律(另外一种问法:以共析碳钢为例说明珠光体团的形成过程并分析三相共存时碳的扩散规律)1形成过程,由于能量成分和结构起伏,首先在奥氏体晶界上产生了一小片cem晶核,这种片状珠光体晶核按非共格扩散关系,不仅纵向长大而且横向长大,横向长大时,吸收了两侧的碳原子,而使其两侧的奥氏体含碳量降低,当含碳量降低到足以形成铁素体时,接在cem两侧出现铁素体片,新生成的铁素体出了伴随渗碳体片向纵向长大也横向长大,铁素体横向长大时,必然要向两侧的奥氏体中排出多余的碳,因而增高侧面奥氏体的碳浓度,从而促进另一片cem的形成,出现了新的cem片,如此继续进行下去,就形成了许多F-cem相间的片层。
碳纳米管一维狄拉克材料-概述说明以及解释1.引言1.1 概述概述碳纳米管(Carbon Nanotubes,简称CNTs)是一种具有特殊结构和优异性能的纳米材料,被广泛认为是材料科学领域的研究热点之一。
碳纳米管由碳原子以一定的方式排列而成,形成了空心的管状结构。
其独特的一维结构使其具有许多特殊的物理性质和潜在的应用价值。
在过去几十年中,碳纳米管引起了广泛的关注和研究。
由于其高强度、高导电性和高导热性等优异性能,碳纳米管在材料科学、纳米科技、电子学等领域具有广泛的应用前景。
同时,碳纳米管还具有独特的光学性质和化学反应活性,使其在光电子学和催化剂等领域显示出巨大的潜力。
本文将重点介绍碳纳米管作为一维狄拉克材料的相关内容。
所谓狄拉克材料指的是具有狄拉克费米子(Dirac Fermions)特性的材料。
狄拉克费米子是一种具有质量零点能态的粒子,其行为类似于相对论中的狄拉克粒子。
碳纳米管的特殊结构和电子结构使其具备了类似狄拉克费米子的行为,因此被认为是一维狄拉克材料的代表。
文章的内容将包括碳纳米管的基本概念、制备方法和物理性质等方面。
同时,还将探讨碳纳米管作为一维狄拉克材料的意义,以及在科学研究和应用领域的前景。
此外,本文还将涉及碳纳米管研究所面临的挑战以及未来的发展方向。
通过对碳纳米管一维狄拉克材料的深入研究,我们可以更好地理解其独特的电子行为和物理性质,并且为其在纳米电子学、能源存储、生物传感等领域的应用提供基础。
同时,对于研究者而言,也能够促进对一维狄拉克材料的认识和理解,为材料科学的发展做出贡献。
尽管碳纳米管研究面临一些挑战和困难,但相信在不久的将来,通过持续的努力和研究,碳纳米管作为一维狄拉克材料的应用前景将会得到进一步的拓展和发展。
1.2 文章结构文章结构部分的内容:本文按照以下结构进行撰写和组织。
第一部分为引言,旨在介绍碳纳米管一维狄拉克材料的研究背景、意义和目的。
引言分为三个小节,分别是概述、文章结构和目的。
碳逸出功-概述说明以及解释1.引言1.1 概述碳逸出功是指碳原子或碳分子脱离表面时所需的能量。
在材料科学和化学领域,碳逸出功是一个重要的参数,它能够影响碳材料的表面反应、催化性能、导电性和光学特性等。
而了解碳逸出功的定义和影响因素,对于设计和制备高性能的碳材料具有重要意义。
在本文中,我们将首先进行背景介绍,介绍碳材料在各个领域的广泛应用和重要性。
然后,我们将详细阐述碳逸出功的定义和意义,探讨该参数对碳材料性能的影响。
最后,我们将回顾当前对碳逸出功影响因素的研究成果,包括表面宏观结构、晶面朝向、表面缺陷等因素,并对未来的研究方向和应用进行展望。
通过本文的阐述,我们将全面了解碳逸出功的基本概念和意义,以及其在碳材料科学中的应用前景。
这对于提高碳材料的性能和开发新型碳材料具有重要的指导意义。
在未来,我们可以利用这些知识来设计和制备更高效、更稳定的碳材料,以满足不同领域的需求。
1.2文章结构文章结构部分的内容可以如下编写:1.2 文章结构本文将会按照以下结构进行探讨碳逸出功的相关内容。
首先,在引言部分会进行概述,介绍碳逸出功这一概念以及文章的目的。
通过引言部分的阐述,读者可以对碳逸出功有一个初步的了解,并了解本文的写作意图。
接着,在正文部分,将会对背景进行介绍。
我们将会探索碳逸出功的相关背景知识,包括碳的基本性质和特点,以及碳逸出功的产生原理和定义。
这将为读者提供一个全面的认识,使读者能够更好地理解后续内容。
然后,我们将详细讨论碳逸出功的影响因素。
这包括原子结构和晶格结构对碳逸出功的影响,以及外界条件如温度、压力和环境气体对碳逸出功的影响。
通过对这些影响因素的分析,读者可以了解碳逸出功的多样性,并掌握其变化规律。
最后,在结论部分,我们将总结本文的主要观点。
对碳逸出功的意义和应用进行展望,探讨其在材料科学、电子学和能源领域的潜在应用前景。
最后,我们将给出本文的结论,总结我们的研究成果,并展望未来的研究方向。
化学糖类知识点总结一、基本概念糖是指含有醛基或酮基的碳水化合物。
它们通常是多元醇,也就是含有多个羟基的化合物。
根据碳水化合物的结构特点,糖类可分为单糖、双糖、寡糖和多糖四大类。
1. 单糖单糖是由3-7个碳原子组成的简单碳水化合物,通式为(CH2O)n。
根据其醛基或酮基的位置和数量,单糖又可分为醛糖和酮糖两类。
常见的单糖包括葡萄糖、果糖、半乳糖等。
2. 双糖双糖是由两个单糖分子经由缩合反应形成的碳水化合物,通常由α-1,4-糖苷键或β-1,4-糖苷键连接。
蔗糖、乳糖、麦芽糖等均为常见的双糖。
3. 寡糖寡糖是由3-10个单糖分子经由糖苷键连接而成的碳水化合物,它们具有较复杂的结构和多样的生物活性。
低聚果糖、低聚葡萄糖等都是寡糖的代表。
4. 多糖多糖是由数十至上百个单糖分子经由糖苷键连接而成的碳水化合物,是生物体内最广泛的一类糖类。
淀粉、纤维素、糖原等都属于多糖。
二、分类根据单糖的类型和数量,糖类可分为脱氧糖、醛糖和酮糖三大类。
1. 脱氧糖脱氧糖是指在单糖分子中某些羟基被氢或其他基团所取代,从而形成一种脱氧的糖类。
常见的脱氧糖包括脱氧核糖、脱氧賖和氨基葡萄糖等。
2. 醛糖醛糖是指单糖分子中含有醛基的糖类,通常以醛基为末端。
葡萄糖、半乳糖等都属于醛糖。
3. 酮糖酮糖是指单糖分子中含有酮基的糖类,通常以酮基为末端。
果糖就是一种典型的酮糖。
三、生物学功能糖类在生物体内具有多种重要的生物学功能,主要包括提供能量、构建细胞壁、储存能量和作为通讯信号等。
1. 提供能量糖类是生物体内主要的能量来源之一。
通过细胞代谢途径,单糖分子可以氧化分解成ATP,从而为细胞提供能量。
葡萄糖是最重要的能量来源之一,它在有氧条件下可以完全被氧化分解,释放出大量的能量。
2. 构建细胞壁在植物细胞和真菌细胞中,糖类起着构建细胞壁的重要作用。
纤维素是由葡萄糖分子通过β-1,4-糖苷键连接而成的多糖,在细胞壁中起着支撑和保护细胞的作用。
3. 储存能量动物体内的肝脏和肌肉组织中可以储存糖原,植物体内的叶绿器中可以储存淀粉。
1、炭材料的多样性?(广义和狭义定义) 广义上看:金刚石、石墨、咔宾都属于炭材料,这是一个广义的定义,但由于金刚石和咔宾在自然界存在非常少,结构也单一,不像石墨那样具有众多的过渡态中间结构(如焦炭、CF、煤炭、炭黑、木炭等)。 狭义上看:炭材料一般是指类石墨材料,即以SP 杂化轨道为主构成的炭材料,从无定形炭到石墨晶体的所有中间结构物质(过渡态碳),它是由有机化合物炭化制得的人造炭。 补充:新型炭材料: 根据使用的目的,通过原料和工艺的改变,控制所得材料的功能,开发出新用途的炭及其复合材料。大谷杉郎认为:新型炭材料可大致分为三类。 一是强度在100MPa以上,模量在10GPa以上使用时不必后加工的方法制得的新型炭成型物;二是以炭为主要构成要素,与树脂、陶瓷、金属等组成的各种复合材料;三是基本上利用炭结构的特征,由炭或炭化物形成的各种功能材料。
2、炭材料的基本性质? 和金属一样具有导电性、导热性; 和陶瓷一样耐热、耐腐蚀; 和有机高分子一样质量轻,分子结构多样; 另外,还具有比模量、比强度高,震动衰 减率小,以及生体适应性好,具滑动性和减速中子等性能。这些都是三大固体材料 金属、陶瓷和高分子材料所不具备的。因 此,炭及其复合材料被认为是人类必须的 第四类原材料。
3、炭材料科学的主要研究内容? 研究自然界中(广义)一切增炭化(富碳)物质的形成过程机理,特别是着重于它(包括原料经历部分炭化的中间产物)多层次的微观结构的形成,以及此结构在外界条件 (如温度、压力)影响下的转变。此外,炭科学还研究炭集合体的各种物理与化学性质。 核心内容:自有机物前驱体出发,通过热处理使有机物转化成具有可被控制的微晶排列的炭固体,这一知识乃是炭材料科学的最核心部分。 有机原料中间状态终炭材料 :1、形成过程(机理) 2、各过程中物质的结构与性质(化学、物理)3、外界条件与材料结构性能的关系;
第一部分 碳的结构与性能
1、 碳的结晶形式有哪些,阐述其结构与性能的关系? 结晶形式:金刚石、石墨、咔宾、 富勒烯
金刚石:SP3杂化轨道,四个等同σ共价键,具饱和性和方向性面心立方晶体 特征:1)硬而脆;2)碳中密度最大(3.52g/cm3);3) 1800℃以上转换为石墨;4)电绝缘体和热良导体;5)具四个等同轨道,如果与氢、碳结合就形成典型的脂肪族化合物。
石墨:SP2杂化轨道,2S2Px2Py三个在同一平面内互为120℃角的三个等价的σ键,剩余的2Pz轨道与σ键所在的平面垂直形成π键;π电子属非定域电子,在受到外电磁场作用时可在六元环网上自由运动,形成金属键;π键较弱,易发生断裂; 特性:1)不熔融和极高的化学稳定性,a面内抗拉强度极高;2)导电导热性好;黑色;3)解离性和自润滑性,易形成层间化合物;4)各向异性。
咔宾:SP杂化轨道,2 个σ键,2个π键;两种类型:β 累积烯烃 =C=C=C= α 聚炔 -C=C-C=C-;线状,单元链长10-12C原子,六方晶体;树脂状组织,白色,白碳 特性:具有半导体及超导体性质;生物相容性好;由α 聚炔出发易于转化为金刚石。
富勒烯:当SP2杂化轨道形成的六圆环在一起形成某些五圆环时,它就不再呈平面状而是呈现球状笼形结构;C60:20个六元环、12个五元环,当六元环增加时,则可形成更大的球形分子;最大到C960。 特性:C60为球形分子,可以在有机溶剂中溶解;相等的化学环境,芳香性; C60直径7.1A,分子晶体,有机与无机的交叉点。
2、 碳的相图及其相互转化? 金刚石和石墨的形成及转化条件:C(diamand)C(graphite) ΔH=-2.1KJ/mol石墨低压稳定相、金刚石高压稳定相
3、概念: 炭化,石墨化,可石墨化炭,不可石墨化炭,石墨化性炭,非石墨化性炭 1)Carbonization (炭化) is a process of formation of material with increasing carbon content from organic material, usually by pyrolysis, ending with an almost pure carbon residue at temp. up to 1600K. 2) Graphitization (石墨化) Is a solid state transformation of thermodynamically unstable
A:石墨催化转化为金刚石的 区域 B:石墨自发快速转化为金刚 石的区域 C:金刚石自发快速转化为石 墨的区域 D:石墨自发缓慢转化为金刚 石的区域 T1: 4100K P1: 12GPa T2: 4020±50K P2: 12.25 ±1.47MPa non-graphitic carbon into graphite by thermal activation. The degree of graphitization depends upon the temp. of the heat treatment and the time allowed to anneal structure. 3) Non-graphitizable Carbon(不可石墨化炭) are those which cannot be transformed into graphitic carbon solely by heat treatment up to 3300K under atmospheric or lower pressure. 4) Graphitizable Carbon (可石墨化炭) are those which can be transformed into graphitic carbon by heat treatment up to 3300K under atmospheric or lower pressure. 5) Non-graphitic Carbon(非石墨质炭) are all varieties of substance consisting mainly of the element carbon with two dimensional long range order of the carbon atoms in plannar hexagonal networks, but without any measurable crystallographitic order in the third direction (c-direction) apart from more or less parallel stacking.Many non-graphitic carbon can be converted into graphitic carbons by heat treatment to about 2500K. Such conversion is called graphitization. 6) Graphitic Carbon(石墨质炭) are all varieties of substance consisting of the element carbon in the allotropic form of graphite irrespective of the presence of structural defects.
4、 石墨化度的表征? 石墨化程度的表征/石墨化度:XRD: d002 La Lc Maire and Mering d002=3.354g+3.440(1-g) g=0-1 g=(3.440- d002)/(3.440-3.354) L(hkl)=kλ/βcosθ 5、 炭材料具有优良抗热震性能的原因? 材料在高温下使用并且经受温度剧变而不破坏的 性能,又称耐急冷急热性和热稳定性。 (1 )温度急变导致材料破坏的原因 : 热传导的滞后性,表面和内部产生温度梯度 (2 )炭材料具有优良抗热震性能的原因 A、热导率λ值大和线膨胀系数αl值小; B、模量E值小,缓解热应力的效果好; C、提高材料的抗拉或抗切强度有利于改善抗热震性。
6、 炭材料热膨胀的特点? A、α比金属材料小得多;B、易石墨化炭材料的线膨胀系数随石墨化度提高而减小,难石墨化炭材料则相反度提高而减小,难石墨化炭材料则相反;C、炭材料的线膨胀系数具有各向异性 a方向:<400℃,变化很小,常温达到极小,随后增大,800℃ 1x10-6/K c方向:为正值,(25-30)10-6/K。
7、 炭材料导电的特点? A、电阻率具有明显的各向异性;B、石墨化程度高则电阻率小; C、电阻温度系数不同炭材料的电阻率和电阻温度系数不同,有的随温度升高而减小,有的则增大。 在一定温度下的导电性是在此温度下材料内自由电子热激发和晶格点阵热振动的综合反映。
8、 影响炭材料力学性能(强度和模量)的因素,如何提高CF的力学性能? 基本结构特征:1)多晶多层结构;2)宏观组织特征是含有气孔。因此,炭材料的力学性能受到 气孔率、孔径分布、组织缺陷、晶粒大小、石墨化度等因素的影响。 提高CF强度的主要措施: 细晶化和减少缺陷。