安瓿西林瓶尺寸(新)
- 格式:doc
- 大小:60.50 KB
- 文档页数:5

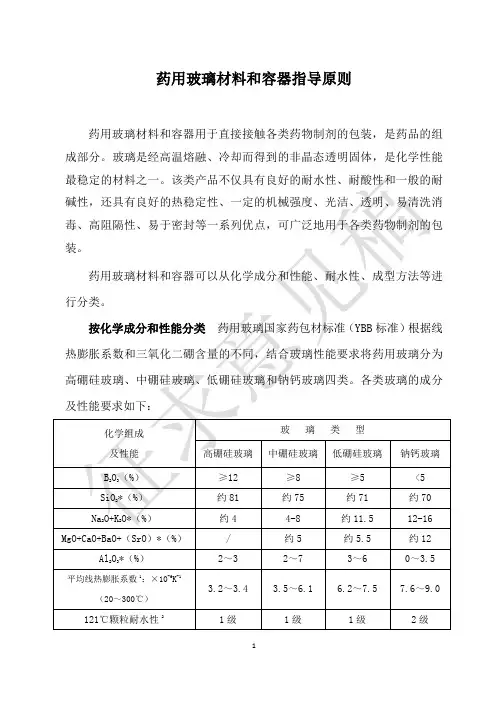
药用玻璃材料和容器指导原则药用玻璃材料和容器用于直接接触各类药物制剂的包装,是药品的组成部分。
玻璃是经高温熔融、冷却而得到的非晶态透明固体,是化学性能瓶的主要品种有小容量注射剂包装用的安瓿、管制注射剂瓶(或称西林瓶)、预灌封注射器玻璃针管、笔式注射器玻璃套筒(或称卡氏瓶),口服制剂包装用的管制口服液体瓶、药瓶等。
不同成型生产工艺对玻璃容器质量的影响不同,管制瓶热加工部位内表面的化学耐受性低于未受热的部位,同一种玻璃管加工成型后的产品质量可能不同。
药用玻璃材料和容器在生产、应用过程中应符合下列基本要求。
药用玻璃材料和容器的成分设计应满足产品性能的要求,生产中应严格控制玻璃配方,保证玻璃成分的稳定,控制有毒有害物质的引入,对生产中必须使用的有毒有害物质应符合国家规定,且不得影响药品的安全性。
药用玻璃材料和容器的生产工艺应与产品的质量要求相一致,不同窑炉、不同生产线生产的产品质量应具有一致性,对玻璃内表面进行处理的产品在提高产品性能的同时不得给药品带来安全隐患,并保证其处理后有效性能的稳定性。
药用玻璃容器应清洁透明,以利于检查药液的可见异物、杂质以及变质情况,一般药物应选用无色玻璃,当药物有避光要求时,可选择棕色透明玻璃,不宜选择其他颜色的玻璃;应具有较好的热稳定性,保证高温灭菌或冷冻干燥中不破裂;应有足够的机械强度,能耐受热压灭菌时产生的较高压力差,并避免在生产、运输和贮存过程中所造成的破损;应具有良好的临床使用性,如安瓿折断力应符合标准规定;应有一定的化学稳定性,不与药品发生影响药品质量的物质交换,如不发生玻璃脱片、不引起药液的pH值变化等。
药品生产企业应根据药物的物理、化学性质以及相容性试验研究结果选择适合的药用玻璃容器。
对生物制品、偏酸偏碱及对pH敏感的注射剂,应选择121℃颗粒法耐水性为1级及内表面耐水性为HC1级的药用玻璃容器或其他适宜的包装材料。
玻璃容器与药物的相容性研究应主要关注玻璃成分中金属离子向药液中的迁移,玻璃容器中有害物质的浸出量不得超过安全值,各种离子的浸出量不得影响药品的质量,如碱金属离子的浸出应不导致药液的pH值变化;药物对玻璃包装的作用应考察玻璃表面的侵蚀程度,以及药液中玻璃屑和玻璃脱片等,评估玻璃脱片及非肉眼可见和肉眼可见玻璃颗粒可能产生的危险程度,玻璃容器应能承受所包装药物的作用,药品贮藏的过程中玻璃容器的内表面结构不被破坏。



粉针剂西林瓶包装密封性优劣的验证方法摘要:粉针剂对水蒸气比较敏感,故良好的密封性能是对粉针剂包装的基本要求之一。
本文以某企业包装粉针剂的西林瓶为例,利用MFY-01兰光密封试验仪测试了其密封性能,并描述了试验的基本过程及设备的试验原理、设备参数等信息,为企业监控西林瓶粉针剂的密封性能提供参考。
关键词:西林瓶、密封性能、密封试验仪、粉针剂、结块、负压法1、意义粉针剂是常见的药物剂型,是用药物与试剂混合后,经消毒干燥形成粉末状药品,然后进行封装,使用前则需加入注射用水或其他试剂使其溶解。
粉针剂按照生产原理的不同,分为无菌粉、冻干粉,常用的包装容器有西林瓶、安瓿瓶、直管瓶等。
粉针剂在使用前应疏松,不能有发黄、结块、药粉粘贴在瓶壁上,更不能出现液化等异常的现象,而上述现象的发生与粉针剂中水分含量增多有关。
粉针剂包装容器的密封性良好是防止粉针剂出现上述问题的有效措施之一,若包装容器的密封性较差,环境中的水蒸气则易渗透到容器内部,引起粉针剂吸潮,出现上述发黄、挂壁、粘连、溶化等现象,甚至发生霉变。
故加强粉针剂包装容器密封性的监测意义深远。
2、检测依据目前,国内尚未出台与粉针剂包装容器密封性能有关的检测标准,本文的检测过程是依据密封性测试常用的负压法原理标准GB/T 15171-1994。
3、检测样品本文检测的样品为粉针剂包装用西林瓶。
西林瓶多是用硼硅玻璃、钠钙玻璃制成,常用于疫苗、生物制剂、粉针剂等药品的包装。
图1 西林瓶常见类型4、试验设备本次验证过程使用的检测设备为兰光MFY-01密封试验仪,该设备常用于软包装件密封性能的测试。
图2 MFY-01密封试验仪4.1 试验原理MFY-01密封试验仪是基于负压法原理研发。
将待测的试样置于密封罐的水中,通过对密封罐内抽真空,使试样的内外产生一定的压力差,若试样的密封不严,其内部的气体则会在压力差的作用下由试样内部向外溢出,表现为试样表面出现连续不断的气泡。
因此通过观察试样表面是否出现连续不断的气泡则可判断试样的密封性。

目录一、主要用途与适用范围二、产品规格及技术参数三、产品结构及工作原理四、结构特点五、吊运安装与连接六、使用与操作七、尺寸更换及调整八、维护和保养九、电气说明十、常见故障及排除方法十一、主要元器外购件及易损件十二、附图⒈结构示意图⒉传动系统图⒊水气管道示意图4.电气明细表5.电气原理图6.程控原理图一、主要用途与适用范围QCLX80型立式超声波洗瓶机主要适用于制药行业中对模制、管制抗生素玻璃瓶、安瓿瓶和口服液瓶的清洗,其容器规格适用于小型玻璃瓶的清洗。
本机由人工上瓶后网带输送、超声波粗洗、绞龙输送、凸轮提升、机械手翻瓶、洗吹(包括两次循环水,一次过滤压缩空气,一次注射水,两次过滤压缩空气共六工位对瓶进行清洗和吹干)、翻瓶、出瓶输送全过程;整个过程自动控制,对瓶清洁程度高,符合GMP质量认证体系要求。
本机即可单机使用,又可以与GMSU系列网带式隧道烘箱或SZAX系列热风循环烘箱、拉丝封口机、灌装加塞机或螺杆分装机联线组成全自动生产线。
二、产品规格及技术参数2.1 型号:QCLX80产品代号:Q—清洗 C—超声波 L—立式 X—旭发2.2 容器规格:瓶子直径按客户提供, 定货时予以确认2.3 生产能力;12000~24000 瓶/小时2.4电源电压:440V/60Hz 三相五线制2.5 总功率:14 kW2.6 耗水量:0.7 M3/h2.7耗气量:60 M3/h2.8 外形尺寸:2322×2134×1257 (mm)2.9 重量:≈2500 kg2.10 产品规格与更换装置对照表:1.安瓿瓶:注:标示“√”表示更换件2.西林瓶:注:标示“√”表示更换件3.说明:进瓶拦板:安瓿瓶及5ml西林瓶使用大尺寸(为便于上瓶,即瓶子进入输送带时不倒瓶);10ml~30ml西林瓶使用中尺寸,50ml~100ml西林瓶使用小尺寸;安瓿瓶更换件:缩针套、密封垫、针体配Φ1.6针管;西林瓶更换件:缩针套、密封垫、针体配Φ4针管;三、产品结构及工作原理(参见结构示意图)首先由人工将瓶放入可调速的输送网带上,瓶子随网带向前输送,过渡到水池中;注水管由上对瓶喷淋加水,同时瓶子经超声波清洗。

河豚毒素(TTX)产品说明书一、产品简介1.英文名:Tetrodotoxin 简称TTX。
2.分子式:C11H17N3O8·1/2H2O3.分子量:319.284.化学结构图:二、可供产品三、化学性质可溶于酸性水或醇溶液。
在强酸或强碱溶液中,其活性易受破坏。
加温至220℃以下不熔,超过220℃以上逐渐变黑并炭化。
四、药理机制专一性阻断神经细胞膜Na+通道,由此阻断神经冲动的传递,产生药理作用。
五、技术指标1.感官指标:无嗅,无味,白色粉末状无定形结晶。
2.纯度指标:HPLC、H-NMR、HR-MS测定,TTX含量≥99%。
3.毒性指标:对小鼠LD50=10±0.5μg / kg(ip)。
六、产品用途在戒毒、镇痛、麻醉等方面具有高效、特异性功能,用于科研及新药研发。
七、保管及保质期存放在具有干燥剂的密封容器中,环境温度0-5℃(或室内常温),避光,保质期五年以上。
注意:保管本品必须具有防盗设施。
八、使用方法含有柠檬酸缓冲剂的TTX,可根据需要直接加入一定量的纯水,就可以溶解和使用。
不含柠檬酸缓冲剂的TTX,可采用柠檬酸或磷酸,或醋酸的水溶剂进行溶解,酸浓度一般为0.1%-1.0%,酸溶液用量一般为每毫克TTX加100μl。
九、声明本品属于剧毒药品,购买、运输、保管必须按照国家相关规定执行。
客户凡从本公司购买的河豚毒素必须妥善保管,要严防失窃,严防儿童接触。
使用时要加强防范,要防止误入口腔、眼睛、鼻腔及皮下组织,如发生事故,责任自负。
客户凡从本公司购买的河豚毒素,只能用于对人类有益的事业,不得用于研制武器或危害人类安全,否则,所产生的一切恶果由买方独自承担。


静脉用药调配与使用操作规范
一、静脉用药需在病区治疗室内进行调配,其他场所不能用于静脉用药的调配。
二、进行静脉用药调配工作的人员需接受岗位专业知识培训并经考核合格,否则不能进行此项工作。
三、静脉用药调配操作程序
(一)按输液卡核对摆放的药物名称、规格、数量、有效期等的准确性和药品完好性,检查输液袋(瓶)有无裂纹,瓶口有无松动、裂缝,输液袋(瓶)内有无沉淀、杂质、絮状物等,确认无误后,方能进行调配。
(二)按操作规程常规消毒处理输液袋(瓶)、西林瓶或安瓿。
(三)选用适宜的一次性注射器或溶药器,拆除外包装,旋转针头连接注射器,确保针尖斜面与注射器刻度处于同一方向。
(四)抽取药液时,注射器针尖斜面应当朝上,紧靠安瓿瓶颈口抽取药液,然后注入输液袋(瓶)中,轻轻摇匀。
(五)溶解粉针剂,用注射器抽取适量静脉注射用溶媒,注入于粉针剂的西林瓶内,必要时可轻轻摇动助溶,全部溶解混匀后,用同一注射器抽出药液,注入输液袋(瓶)内,轻轻摇匀。
(六)分配竣事后,进行检查及核对:
1、再次检查已配药液有无沉淀、变色、异物等。
2、进行挤压试验,观察输液袋有无渗漏现象,尤其是加药处。
3、按医嘱执行单内容逐项核对所用输液和空西林瓶与安瓿的药名、规格、用量等是否相符。
4、核检非整瓶(支)用量的患者的用药剂量和标识是否相符。
5、准确无误后,操作人员和核对人员分别签名,签名需清晰可辨。
6、核查完成后,空安瓿等废弃物按规定进行处理。

贴标机用户需求用户需求审核与批准方案起草签名日期工程设备部年月日方案审核签名日期工程设备部年月日生产部质量部年月日方案批准签名日期总经理年月日目录1. 背景介绍 (4)2. 目的 (4)3. 范围 (4)4. 法规和国家标准 (4)4.1 cGMP 法规 (4)4.2 行业标准 (4)4.3 国家标准 (4)4.4 项目描述 (5)4.5 工艺/流程描述 (5)4.6 产品介绍 (5)5. 用户及系统要求 (6)5.1 URS要求 (6)5.1.1URS01: 产品特性要求 (6)5.1.2URS02:设备工艺或性能要求 (6)5.1.3URS03:安全要求 (6)5.1.4URS04:安装区域及位置要求 (6)5.1.5URS05:安装环境要求 (6)5.1.6URS06:电力要求 (6)5.1.7URS07:设施/公用系统要求 (7)5.1.8URS08:外观要求 (7)5.1.9URS09:连续运转要求 (7)5.1.10URS10:技术要求 (7)5.1.11 URS11:机械要求 (8)5.1.12 URS12:控制系统要求 (9)5.1.13 URS13:仪表要求 (10)5.1.14 URS14:清洁要求 (10)5.1.15 URS15:文件要求 (10)5.1.16 URS16:设备转运要求 (11)5.1.17URS17:服务与维修要求 (11)1.背景介绍根据生产需要,将在针剂生产线增加一台包装贴签机。
2.目的本用户需求文件旨在从项目和系统的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备的工作过程及功能的期望。
主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。
在本URS中用户仅提出基本的技术要求和设备的基本要求,并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。
安瓿、西林瓶外形尺寸(新)安瓿(YBB00332002低硼硅玻璃安瓿)
西林瓶(YBB00302002低硼硅玻璃管制注射剂瓶)
注:括号内为非标尺寸。
YBB药包材标准(1~6辑)目录
第一辑
YBB00012002低密度聚乙烯输液瓶(试行)
YBB00022002聚丙烯输液瓶(试行)
YBB00032002钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005
YBB00042002药用氯化丁基橡胶塞(试行)
YBB00052002药用溴化丁基橡胶塞(试行)
YBB00062002低密度聚乙烯药用滴眼剂瓶(试行)
YBB00072002聚丙烯药用滴眼剂瓶(试行)
YBB00082002口服液体药用聚丙烯瓶(试行)
YBB00092002口服液体药用高密度聚乙烯瓶(试行)
YBB00102002口服液体药用聚酯瓶(试行)
YBB00112002口服固体药用聚丙烯瓶(试行)
YBB00122002口服固体药用高密度聚乙烯瓶(试行)
YBB00132002药品包装用复合膜、袋通则(试行)
YBB00142002药品包装材料与药物相容性试验指导原则(试行)
第二辑
YBB00152002药品包装用铝箔
YBB00162002铝质药用软膏管
YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋
YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋
YBB00192002双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋
YBB00202002聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片
YBB00212002聚氯乙烯固体药用硬片
YBB00222002聚氯乙烯/聚偏二氯乙烯固体药用复合硬片
YBB00232002聚氯乙烯/低密度聚乙烯固体药用复合硬片
YBB00242002聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片
YBB00252002聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005
YBB00262002口服固体药用聚酯瓶
YBB00272002钠钙玻璃药瓶
YBB00282002低硼硅玻璃管制口服液体瓶
YBB00292002硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2
YBB00302002低硼硅玻璃管制注射剂瓶
YBB00312002钠钙玻璃模制注射剂瓶
YBB00322002硼硅玻璃安瓿废止,新标准号YBB00322005-2
YBB00332002低硼硅玻璃安瓿
YBB00342002多层共挤输液用膜、袋通则
第三辑
YBB00012003细胞毒性检查法
YBB00022003热原检查法
YBB00032003溶血检查法
YBB00042003急性全身毒性检查法
YBB00052003皮肤致敏检查法
YBB00062003皮内刺激检查法
YBB00072003原发性皮肤刺激检查法
YBB00082003气体透过量测定法
YBB00092003水蒸气透过量测定法
YBB00102003剥离强度测定法
YBB00112003拉伸性能测定法
YBB00122003热合强度测定法
YBB00132003密度测定法
YBB00142003氯乙烯单体测定法
YBB00152003偏二氯乙烯单体测定法
YBB00162003内应力测定法
YBB00172003耐内压力测定法
YBB00182003热冲击和热冲击强度测定法
YBB00192003垂直轴偏差测定法
YBB00202003平均线热膨胀系数的测定法
YBB00212003线热膨胀系数的测定法
YBB00222003砷、锑、铅浸出量的测定法
YBB00232003三氧化二硼测定法
YBB00242003121℃内表面耐水性测定法和分级
第四辑
YBB00262003硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003低硼硅玻璃药用管
YBB00282003钠钙玻璃药用管
YBB00292003硼硅玻璃输液瓶废止,新标准号YBB00022005-2
YBB00302003低硼硅玻璃模制药瓶
YBB00312003硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2
YBB00322003低硼硅玻璃模制注射剂瓶
YBB00332003钠钙玻璃管制注射剂瓶
YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙玻璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
第五辑
YBB00012004低硼硅玻璃输液瓶
YBB00022004硼硅玻璃管制口服液体瓶
YBB00032004钠钙玻璃管制口服液体瓶
YBB00042004硼硅玻璃管制药瓶
YBB00052004硼硅玻璃模制药瓶
YBB00062004预灌封注射器用硼硅玻璃针管
YBB00072004预灌封注射器用氯化丁基橡胶活塞
YBB00082004预灌封注射器用溴化丁基橡胶活塞
YBB00092004预灌封注射器用不锈钢注射针
YBB00102004预灌封注射器用聚异戊二烯橡胶针头护帽
YBB00112004预灌封注射器组合件(带注射针)
YBB00122004笔式注射器用硼硅玻璃珠
YBB00132004笔式注射器用硼硅玻璃套筒
YBB00142004笔式注射器用铝盖
YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片
YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片
YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖
YBB00182004铝/聚乙烯冷成型固体药用复合硬片
YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004玻璃纸/铝/聚乙烯药品包装用复合膜、袋
YBB00212004药品包装用铝塑封口垫片通则
YBB00222004口服制剂用硅橡胶胶塞、垫片
YBB00232004药用合成聚异戊二烯垫片
YBB00242004塑料输液容器用聚丙烯组合盖
YBB00252004胶囊用明胶
YBB00262004包装材料红外光谱测定法
YBB00272004包装材料不溶性微粒测定法
YBB00282004乙醛测定法
YBB00292004加热伸缩率测定法
YBB00302004挥发性硫化物测定法
YBB00312004包装材料溶剂残留量测定法
YBB00322004注射剂用胶塞、垫片穿刺力测定法
YBB00332004注射剂用胶塞、垫片穿刺落屑测定法
YBB00342004玻璃耐沸腾盐酸浸蚀性的测定法和分级
YBB00352004玻璃耐沸腾混合碱水溶液浸蚀性的测定法和分级
YBB00362004玻璃颗粒在98℃耐水性测定法和分级
YBB00372004砷、锑、铅、镉浸出量测定法
YBB00382004抗机械冲击测定法
YBB00392004直线度测定法
YBB00402004药用陶瓷吸水率测定法
YBB00412004药品包装材料生产厂房洁净室(区)的测试方法
YBB00202005聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片
YBB00212005聚氯乙烯固体药用硬片
YBB00222005聚氯乙烯/聚偏二氯乙烯固体药用复合硬片
YBB00232005聚氯乙烯/低密度聚乙烯固体药用复合硬片
YBB00042005注射液用卤化丁基橡胶塞
YBB00052005注射用无菌粉末用卤化丁基橡胶塞
第六辑
YBB00072005药用低密度聚乙烯膜、袋
YBB00082005注射剂瓶用铝盖
YBB00092005输液瓶用铝盖
YBB00102005三层共挤输液用膜(I)、袋
YBB00112005五层共挤输液用膜(I)、袋
YBB00122005药用固体纸袋装硅胶干燥剂
YBB00132005药用聚酯/铝/聚丙烯封口垫片
YBB00142005药用聚酯/铝/聚酯封口垫片
YBB00152005药用聚酯/铝/聚乙烯封口垫片
YBB00162005药用口服固体陶瓷瓶
YBB00032005钠钙玻璃输液瓶替换YBB00032002
YBB00292005-1高硼硅玻璃管制注射剂瓶替换YBB00292002
YBB00292005-2中性硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00322005-2中性硼硅玻璃安瓿替换YBB00322002
YBB00012005-1药用高硼硅玻璃管替换YBB00262003
YBB00012005-2药用中性硼硅玻璃管替换YBB00262003
YBB00022005-2中性硼硅玻璃输液瓶替换YBB00292003
YBB00062005-2中性硼硅玻璃模制注射剂瓶替换YBB00312003 YBB00252005药用聚乙烯/铝/聚乙烯复合软膏管替换YBB00252002 YBB00172005药用玻璃铅、镉、砷、锑浸出量限度
YBB00182005药用陶瓷容器铅、镉浸出量限度
YBB00192005药用陶瓷容器铅、镉浸出量测定法
YBB00242005环氧乙烷残留量测定法
YBB00262005橡胶灰分的测定法。