慢病毒包装原理介绍
- 格式:docx
- 大小:45.50 KB
- 文档页数:3

病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难以转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
1.2.2特点1)几乎可以感染所有类型的细胞2)可以获得复制缺陷型(E1 和E3 缺失) 的腺病毒3)病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效的进行增殖。


慢病毒包装.慢病毒(Lentivirus)是逆转录病毒的一种,它需要相对较长的孵育时间,所以称之为“慢”病毒,Lenti在拉丁文中就是慢的意思。
它包括人免疫缺陷病毒(HIV)、猫免疫缺陷病毒(FIV)、猿免疫缺陷病毒(SIV)、牛免疫缺陷病毒等。
其中研究最多的是HIV-1慢病毒。
慢病毒载体(Lentivirus vector)是以慢病毒基因组为基础,由所需的目的基因取代部分基因构建而成。
目前使用的慢病毒载体多采用HIV-1基因组改造而来。
与一般的逆转录病毒载体相比,慢病毒载体对分裂细胞和非分裂细胞均具有感染能力而具有更广的宿主范围。
慢病毒载体还可以将外源基因有效地整合到宿主染色体上,从而实现持久表达。
在感染能力方面可以有效感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,又很少引发机体免疫反应,能达到良好的基因治疗效果,具有广阔的应用前景。
随着人们对慢病毒载体的深入研究,为了提高慢病毒在临床上使用的安全性,慢病毒载体的优化也在不断的探讨中。
慢病毒载体的发展经历了三个阶段,第一代慢病毒载体系统是以三质粒系统为代表,在构建时把HIV-1基因组中进行包装、逆转录和整合所需的顺式作用原件与编码反式作用蛋白的序列分离,分别构建在三个质粒表达系统上,即包装质粒、包膜质粒和载体质粒。
包装质粒在巨细胞病毒(cytomegalovirus, CMV)启动子的作用下,控制除env以外所有病毒结构基因的表达;包膜质粒编码水泡口炎病毒(vesicular stomatitis virus,VSV)G 糖蛋白;载体质粒中含有目的基因。
用这三种质粒共转染包装细胞如人胚胎肾293T细胞,在细胞上清中即可收获只有一次感染能力、而无复制能力的慢病毒颗粒。
第一代慢病毒载体系统的特点是在构建三种包装质粒时,为了降低产生有复制能力的病毒的可能性,尽可能减少三种质粒之间的同源序列,但包装质粒中仍然保留HIV的附属基因。
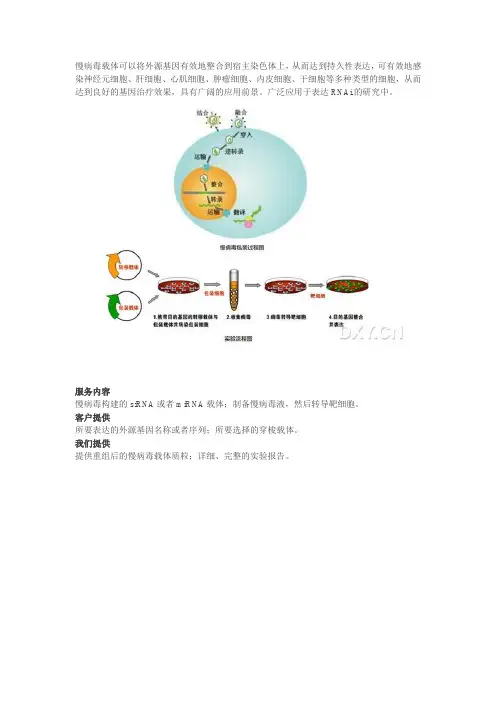
慢病毒载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达,可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的基因治疗效果,具有广阔的应用前景。
广泛应用于表达RNAi的研究中。
服务内容
慢病毒构建的siRNA或者miRNA载体;制备慢病毒液,然后转导靶细胞。
客户提供
所要表达的外源基因名称或者序列;所要选择的穿梭载体。
我们提供
提供重组后的慢病毒载体质粒;详细、完整的实验报告。
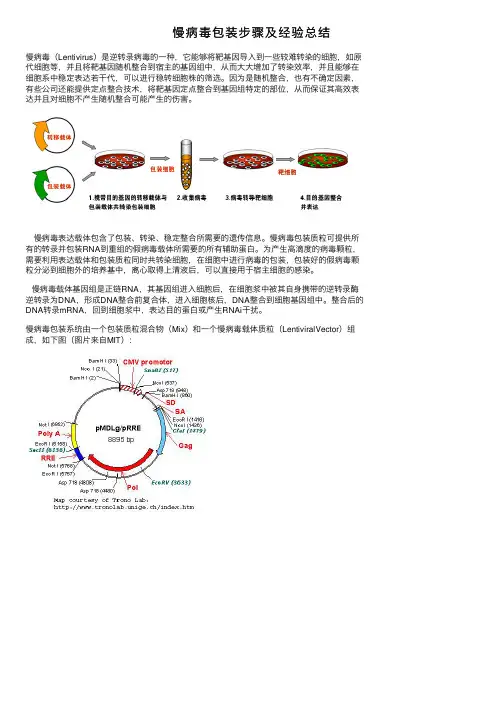
慢病毒包装步骤及经验总结慢病毒(Lentivirus)是逆转录病毒的⼀种,它能够将靶基因导⼊到⼀些较难转染的细胞,如原代细胞等,并且将靶基因随机整合到宿主的基因组中,从⽽⼤⼤增加了转染效率,并且能够在细胞系中稳定表达若⼲代,可以进⾏稳转细胞株的筛选。
因为是随机整合,也有不确定因素,有些公司还能提供定点整合技术,将靶基因定点整合到基因组特定的部位,从⽽保证其⾼效表达并且对细胞不产⽣随机整合可能产⽣的伤害。
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋⽩。
为产⽣⾼滴度的病毒颗粒,需要利⽤表达载体和包装质粒同时共转染细胞,在细胞中进⾏病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离⼼取得上清液后,可以直接⽤于宿主细胞的感染。
慢病毒载体基因组是正链RNA,其基因组进⼊细胞后,在细胞浆中被其⾃⾝携带的逆转录酶逆转录为DNA,形成DNA整合前复合体,进⼊细胞核后,DNA整合到细胞基因组中。
整合后的DNA转录mRNA,回到细胞浆中,表达⽬的蛋⽩或产⽣RNAi⼲扰。
慢病毒包装系统由⼀个包装质粒混合物(Mix)和⼀个慢病毒载体质粒(LentiviralVector)组成,如下图(图⽚来⾃MIT):载体中含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件等。
不同系统包装质粒混合物也不⼀样,以本实验室的三质粒系统为例,包装质粒混合物中含pMDL,VSVG,pRSV-Rev,⽐例为5:3:2;其中pMDL含有编码HIV病毒主要结构蛋⽩的gag基因和编码病毒特异性酶的pol基因,pRSV-Rev含编码调节gag和pol基因表达的调节因⼦rev基因,VSVG含有提供病毒包装所需要的单纯疱疹病毒来源的VSVG基因。
以下介绍⽤293T细胞在六孔板(35mm)中包装病毒,其他孔板相应增加或减少体积。
准备试剂篇? 核⼼质粒;? 指数⽣长的293T细胞;? 病毒包装质粒Mix:1 µg/µl(Mix=pMDL: VSV-G : REV=5:3:2),不同载体系统所⽤的包装病毒质粒也不⼀样,此系统可⽤于包装PBOBi,PLKO, Plv等载体质粒。

慢病毒转染原理慢病毒转染是一种常用的基因转染方法,适用于长期表达外源基因的研究。
慢病毒转染原理主要是利用慢病毒载体将外源基因导入宿主细胞,并将其整合入宿主细胞基因组中,从而实现外源基因的稳定表达。
本文将从慢病毒转染的原理、步骤和应用等方面进行介绍。
慢病毒转染原理。
慢病毒转染的原理主要包括以下几个步骤,首先,将外源基因插入慢病毒载体中,构建成慢病毒表达载体;然后,将慢病毒表达载体转染至包装细胞中,利用包装细胞的辅助病毒蛋白包装慢病毒颗粒;最后,将包装好的慢病毒颗粒用于感染目标细胞,外源基因被整合入宿主细胞基因组中,实现稳定表达。
慢病毒转染步骤。
慢病毒转染的步骤包括慢病毒载体构建、包装细胞培养、病毒颗粒包装和目标细胞感染等。
首先,构建慢病毒表达载体时,需要选择合适的慢病毒载体和适当的启动子,将外源基因插入载体中,并经过序列分析和酶切验证。
其次,包装细胞的培养和病毒颗粒包装是慢病毒转染的关键步骤,需要选择合适的包装细胞系,转染慢病毒表达载体并培养包装细胞,最终收集包装好的慢病毒颗粒。
最后,利用包装好的慢病毒颗粒感染目标细胞,实现外源基因的稳定表达。
慢病毒转染应用。
慢病毒转染在基因功能研究、基因治疗和细胞工程等领域具有广泛的应用。
在基因功能研究中,可以利用慢病毒转染实现基因敲除、过表达和靶向修饰等,进而研究基因在生理和病理过程中的功能。
在基因治疗中,慢病毒转染可以用于治疗遗传性疾病、肿瘤和传染病等,为基因治疗提供了重要的技术支持。
在细胞工程中,慢病毒转染可以用于改良细胞系,提高细胞的表达稳定性和产量,满足生物制药和工业生产的需要。
总结。
慢病毒转染是一种重要的基因转染方法,具有稳定、高效、广泛应用等特点。
通过慢病毒转染,可以实现外源基因在宿主细胞中的稳定表达,为基因功能研究、基因治疗和细胞工程等领域提供了重要的技术支持。
因此,深入理解慢病毒转染的原理和步骤,对于开展相关研究具有重要的意义。

慢病毒包装总结慢病毒的成分现在的慢病毒包装系统通常包括几个质粒,这几个质粒上分别含有慢病毒复制的成分,这样做的目的就是为了增加安全性,毕竟如果只用一个成分的话,危险系数很高,人一旦接触这种病毒就有可能遇到危险。
而把这几个成分分散在几个质粒中,很难在体外形成危险的病毒颗粒。
第二代慢病毒包装系统含有3个质粒,第3代慢病毒包装系统含有4个质粒。
这两代病毒包装系统都含有以下相同的成分:第一,编码目的蛋白或转录目的基因的转移质粒。
其实就是你自己的目的质粒,也就是通常需要自己做载体的质粒。
目的基因的两侧都含有长末端重复序列(LTR,long terminal repeat),LTR的作用就是辅助目的基因插入到宿主细胞的基因组。
许多慢病毒质粒都是基于HIV-1病毒改造的。
为了安全目的,这些目的质粒的复能能力并不完全,它们的3'LTR有所删减,这样病毒插入到基因组后会自我失活(self-inactivating)(SIN)。
第二,包装质粒,毒包装的结构蛋白编码质粒。
第三,包膜质粒,编码蛋白质外壳。
第二代慢病毒利用病毒的LTR启动子用于基因的表达,第三代慢病毒利用一个杂合的LTR启动子进行基因表达。
第二代慢病毒下图是第二代慢病毒系统:这个系统含有3个质粒,第1个质粒:包装质粒,它编码Gag,PoI,Rev与Tat基因。
第2个质粒:包膜质粒,含有VSV-G,编码蛋白Env。
第3个质粒:目的质粒,含有病毒的LTRs和psi包装信号(图片未画出),除非有内部启动子,否则这个目的质粒的目的基因是由5'LTR驱动的,它是一个弱启动子,需要Tat元件的来激活它。
所有的第2代慢病毒目的质粒必须要用第2代慢病毒包装系统,因此它的LTR是Tat依赖性的。
第三代慢病毒第3代慢病毒如下所示:设计第3代病毒的目的主要还是提高安全性。
在第3代病毒中,将第2代病毒的包装质粒分成了2个质粒,一个编码Rev,另外一个编码Gag和PoI。

一些搞不懂的生物学常识51.pcDNA3.1-VSVg与pCMV4.3-Luc.R-E这两个质粒共转染293t细胞能包装出假病毒吗?pcDNA3.1-VSVg是编码病毒衣壳蛋白VSV-G的质粒,pCMV4.3-Luc.R-E是编码荧光素酶基因的质粒,其表达需要辅助质粒pCMV4.3-RSV-Rev。
将这两个质粒共转染293t细胞,可以包装出VSV-G假病毒(VSV-G pseudovirus),但需要同时包含pCMV4.3-RSV-Rev才能实现荧光素酶的表达。
VSV-G假病毒可以用于基因传递、细胞入侵等研究领域,但需要注意的是,它并非真正的病毒,而是一种类似于病毒的颗粒。
因此,在使用VSV-G假病毒时,需要采取相应的安全措施,以免对实验人员和环境造成风险。
2.这个辅助质粒pCMV4.3-RSV-Rev的作用是什么?pCMV4.3-RSV-Rev是一种辅助质粒,它的作用是提高pCMV4.3-Luc.R-E质粒表达荧光素酶基因的效率。
pCMV4.3-Luc.R-E质粒包含荧光素酶基因和其启动子,但该启动子的活性在哺乳动物细胞中较低。
pCMV4.3-RSV-Rev质粒则含有反转录病毒RSV的Rev基因,可以增强pCMV4.3-Luc.R-E质粒中的启动子活性。
在同时包含pCMV4.3-RSV-Rev和pcDNA3.1-VSVg的情况下,细胞可表达荧光素酶基因并包装出能表达该基因的VSV-G假病毒颗粒。
因此,pCMV4.3-RSV-Rev的作用是增强pCMV4.3-Luc.R-E质粒表达荧光素酶基因的能力,从而促进VSV-G假病毒的制备。
3.双质粒系统慢病毒质粒名称分别叫什么名字?双质粒系统慢病毒通常采用第一代或第二代质粒系统,其中包括两个质粒:载体质粒和包装质粒。
载体质粒通常是一种携带外源基因序列的质粒,它可以用于整合到宿主细胞基因组中。
常见的载体质粒包括pLenti、pRRL和pLV等。
包装质粒则包含了病毒的基因组和其所需的辅助基因,它可以通过转染到携带载体质粒的细胞中,从而将外源基因整合到宿主细胞基因组中。


慢病毒载体构建原理慢病毒是一类能够长期潜伏在宿主细胞内,并且在细胞分裂时能够传递给子细胞的病毒。
慢病毒的研究和应用在基因治疗、基因工程和细胞治疗等领域具有重要意义。
慢病毒载体构建是慢病毒研究的关键环节,下面将介绍慢病毒载体构建的原理。
首先,慢病毒载体构建的关键是选择合适的病毒骨架。
常用的慢病毒载体包括HIV-1、HIV-2和SIV等。
这些病毒骨架具有较高的转导效率和稳定性,能够有效地将外源基因导入宿主细胞中。
在选择病毒骨架时,需要考虑到载体的稳定性、毒性和转导效率等因素,以确保慢病毒载体能够在宿主细胞中稳定表达外源基因。
其次,慢病毒载体构建需要将外源基因整合到病毒基因组中。
一般来说,外源基因会被整合到病毒的长末端重复序列(LTR)之间,这样可以确保外源基因能够稳定地表达。
在整合外源基因时,需要使用逆转录酶将外源基因的RNA转录成DNA,并将其整合到病毒基因组中。
整合外源基因的位置和数量会影响慢病毒载体的稳定性和表达水平,因此需要对整合位点和整合数量进行精确控制。
另外,慢病毒载体构建还需要考虑到病毒的包装限制。
在病毒的生命周期中,病毒颗粒的组装和包装需要依赖于病毒的包装信号。
因此,在构建慢病毒载体时,需要确保外源基因的整合不会影响到病毒的包装信号,否则会影响病毒的组装和包装,从而降低病毒的转导效率和稳定性。
最后,慢病毒载体构建还需要考虑到病毒的安全性和稳定性。
在构建慢病毒载体时,需要对病毒的毒性进行改造,以降低其对宿主细胞的损害。
同时,还需要对病毒的复制和传播进行限制,以确保慢病毒载体在宿主细胞中稳定表达外源基因,同时不会对宿主细胞造成不良影响。
综上所述,慢病毒载体构建是慢病毒研究和应用的重要环节。
通过选择合适的病毒骨架、整合外源基因、考虑病毒的包装限制和确保病毒的安全性和稳定性,可以构建出稳定、高效的慢病毒载体,为基因治疗、基因工程和细胞治疗等领域的研究和应用提供重要支持。

慢病毒包装与感染细胞流程在慢病毒感染细胞实验原理与实用流程(一)中,我们学习了利用目的基因包装成慢病毒感染细胞的原理,今天就和医学方小编学习具体如何操作。
质粒DNA和其他包装质粒共转染293T细胞产生病毒(病毒包装)293T细胞是由293细胞派生, 表达SV40大T抗原的人肾上皮细胞系, 被广泛应用于瞬时转染以过表达各种目标蛋白, 或是用以包装病毒。
脂质体:某些细胞质中的天然脂质小体,可作为生物膜,用于捕获外源性物质后更有效地运送到靶细胞,经同细胞融合而释放。
小编将以293T细胞包装慢病毒,感染10cm SW480结肠癌细胞为例:DAY1转染前一天,用1ml胰酶消化293T细胞1-2分钟,用含10% FBS的 DMEM培养基重悬293T细胞,铺2-3*106个细胞至 10cm dish中(70-80% 融合度);(注:慢病毒包装时要多种一点儿293T细胞,慢病毒对细胞的毒性较大!)DAY2(转染时准备无双抗完全培养基,抗生素对转染中细胞损伤大)1、转染293T细胞(10cm dish):A:用470ul optimem稀释30ul Fugene 9(其他转染试剂比例详见其说明书), 并充分轻轻地混匀,室温下静置5 minB:准备 target plasmid 和包装载体plasmid:pCMV8.9/ psPAX2:3.33ug (注:10cm dish 的量)PMD.G / pMD2.G:1.67ug (注:10cm dish 的量)Target plasmid :5ug(注:这3个质粒都加在同一个EP管中)六孔板的量是:pCMV8.9/ psPAX2: 1ugPMD.G / pMD2.G: 0.5ugTarget plasmid : 1ugC:将上述准备的质粒混合液滴加到optimem与Fugene 9的混合液中,RT ,静置20min;2、6-8h后对293T细胞换液,注意加液时,不要吹起细胞(沿着皿壁,轻轻地加新培液);置37°细胞培养箱中继续培养48h;-----随后同时做SW480细胞的铺板(见后)。
慢病毒包装步骤及注意事项现今常用的制备慢病毒载体的方法为使用3或者4质粒系统转染293T细胞。
此外,也有使用其它几类慢病毒包装细胞系制备慢病毒载体。
瞬时转染制备慢病毒:细胞:慢病毒包装常用人胚肾细胞(HEK, human embryonic kidney)293T,其含有SV40病毒的大T抗原蛋白编码基因,转染效率极高。
但其贴壁性不好,所以需要使用多聚赖氨酸包被的培养皿增加其吸附性。
多聚赖氨酸培养皿可购买,也可自行制备。
转染前,细胞密度控制在40-70%比较好。
DNA:每10 cm培养皿约含5x106 293T细胞,需用30-40 ug 不含内毒素的质粒进行转染。
质粒的纯度对慢病毒载体的包装效率非常关键。
不同的包膜蛋白表达载体,其使用量也不同。
转染:最经济的转染方法是磷酸钙转染法,虽然其溶液配置影响因素多,不易稳定重复得到最佳的转染结果。
其它方法有脂质体法和PEI法。
转染48-60后可以收集上清,通过低速离心,然后滤膜过滤可以去除上清中的细胞碎片。
如果使用VSV-G包膜蛋白的话,可以通过两次超速离心进行浓缩,从而最高可以获得滴度高达1011-1012IU/ml的慢病毒载体。
之后可以将病毒载体溶解在PBS,HBSS或者DMEM中,并置于-800C储存。
储存溶液添加血清会帮助提高病毒冻融时的存活率,然而有些病毒在侵染细胞时,血清会有干扰,所以需要依据具体病毒种类考虑是否添加血清。
病毒滴度:含VSV-G的慢病毒载体,其滴度在浓缩前一般为107IU/ml,浓缩之后可以达到109-107IU/ml 。
含有荧光标记或者其它报告基因的病毒载体,可以通过梯度稀释侵染HeLa或者293,NIH3T3细胞来确定其滴度;不含报告基因的可通过测定病毒颗粒中相关病毒蛋白的活性或者含量来确定其滴度,比如使用p24gag的elisa 试剂盒。
一般来说,每4-60 x 103个病毒载体含1ng p24gag。
然而这种方法测出来的滴度并不准确,不同的病毒载体类型,不同的储存方式,都会导致p24gag和病毒载体颗粒的比值变化较大。
病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus )是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA和基于瞬时表达载体构建的普通siRNA载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Len tivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1) 直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi研究和体内实验中难以转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2) 可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3) 可用于基因敲除、基因治疗和转基因动物研究。
4) 无需任何转染试剂,操作简便。
5) 可以根据客户需要制备多种标记。
含有目的基因的慢病毒RNAi干扰载体的构建和质粒纯化提取。
2) 慢病毒载体,包装系统共转染病毒包装细胞293T等。
3) 培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4) 病毒的纯化和浓缩。
5) 分装、-80 C保存。
6) 滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1) 2) 3) 4) 5)1.2.1原理腺病毒(Adenovirus , Ad)是一种无包膜的线状双链DNA 病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad 载体都是基于血清型 2和5,通过转基因的方式取 代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达 E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
在细胞相关的实验操作中,对于一些按常规方法难以转染甚至无法转染的细胞,通过病毒介导的实验能够大大提高基因的转导效率,以达到目的基因的高效瞬时表达。
在细胞相关的实验操作中,对于一些按常规方法难以转染甚至无法转染的细胞,通过病毒介导的实验能够大大提高基因的转导效率,以达到目的基因的高效瞬时表达。
病毒转染包括以下步骤:1构建载体2包装提纯病毒3感染靶细胞。
以慢病毒为例。
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
慢病毒载体的研究发展得很快,研究的也非常深入。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。
一、慢病毒载体构建原理:慢病毒载体的包装系统一般由两部分组成,即包装成分和载体成分。
包装成分由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白;载体成分则与包装成分互补,即含有包装、逆转录和整合所需的顺式作用序列,同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。
将包装成分与载体成分的多个质粒共转染包装细胞,即可在细胞上清中收获携带目的基因的复制缺陷型慢病毒载体颗粒。
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
CRISPR慢病毒包装是什么?CRISPR慢病毒系统CRISPR慢病毒为纯化慢病毒,高纯度可直接用于动物体内实验,感染效率高。
CRISPR慢病毒系统包括两个载体:1)gRNA慢病毒载体gRNA慢病毒载体由慢病毒基因组序列和细菌质粒序列构成。
细菌质粒序列含有一个Ampicillin抗性基因和一个高拷贝复制子pUCori。
慢病毒基因组序列是从元件5’LTR开始,到3’LTR结束。
慢病毒基因组序列可容纳两个外源基因表达盒子:一个是目的基因表达盒子,另外一个是marker基因表达盒子。
Marker基因表达盒子已经克隆在载体上,无需重新构建。
我们提供了荧光marker、抗药性marker或者荧光/抗药性双marker供您选择。
gRNA表达盒子则包括三部分序列:U6启动子、gRNA和终止子。
U6启动子已经克隆在载体上,每次构建载体,只需通过annealing-ligation技术将感兴趣的gRNA打靶序列克隆到载体上即可。
gRNA打靶序列与gRNA scaffold序列构成一个完整的gRNA。
克隆方法我们采用引物退火连接的克隆方法,将gRNA克隆到慢病毒骨架上。
我们的CRISPR/Cas9慢病毒载体使用了human U6 promoter转录gRNA。
gRNA被Cas9识别,与基因组序列结合,从而引起Cas9对基因组序列的剪切。
剪切效率取决于gRNA 是否只与目标基因组序列特异性100%匹配。
目标序列的选择还需要考虑下游有PAM特征的序列。
您可以登陆选择感兴趣的人、小鼠和大鼠的9RNA进行载体设计。
2)Cas9慢病毒载体Cas9慢病毒载体利用CBh启动子共表达humanized Cas9基因和Hygromycin抗药性基因。
gRNA慢病毒载体利用U6 promoter表达gRNA,同时携带了一个表达抗药性基因的基因表达盒子。
在设计gRNA慢病毒载体时,请选择非Hygromycin抗药性基因(Puromycin、Neomycin和Blasticidin),两个载体需要不同的抗药性基因配套使用才能起到药筛的效果。
又是辅助又是穿梭,慢病毒包装到底是个什么鬼?提起慢病毒包装,好多人只知道按着实验室protocol上写的质粒共转染293T细胞,或者只是知道穿梭质粒辅助质粒而不知道他们的具体作用。
今天我们就用最简单粗暴方式讲解一下病毒包装的原理,以防好奇的师弟师妹问你具体原理你只能让他们自己百度,错失一次完美的讲解(装逼)机会。
讲解之前我们要看下慢病毒到底是啥?官方解释:慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
简单点说就是HIV的升级版,HIV只能感染CD4+T细胞,对我们实验来说肯定不行,所以需要改装让病毒感染亲嗜性增强。
HIV还有一个有点就是可以将自己的基因组整合到宿主的基因组中,利用这个特性可以方便我们进行稳转细胞株的建立。
OK步入正题,讲解先从慢病毒的基因组入手,慢病毒为RNA病毒。
它的基因组我们可以分为3个编码病毒基本结构的结构基因gag、env、pol和6个调节基因tat、rev、nef 、vif 、vpr 、vpu。
后来大家发现6个调节基因好像有点多,有的只对野生型的HIV 有用,所以就把调节基因除了tat和rev以外都删除了。
gag基因编码基质蛋白、衣壳蛋白和核衣壳蛋白,pol基因编码蛋白酶、整合酶和逆转录酶,env基因编码病毒外面的衣壳蛋白gp120和gp41,调节基因tat和rev主要调节病毒的转录和翻译。
这六个基因对我们病毒包装来说必不可少。
另外大家可能注意到在基因组两端有两个LTR,这个LTR有两个作用,一方面他可以介导慢病毒将自己的基因组整合到宿主基因组中转录比较活跃的位点,另一方面可以粗暴的理解为启动子和终止子。
讲到这,大家可能对慢病毒的包装策略心里有点数了,如果我把LTR之间的替换为我们的目的基因,替换掉的部分又对病毒来说不可或缺,那我把替换掉的部分再通过别的方法提供给它,这样病毒不就可以完整的组装了吗。
缓病毒载体包拆构修历程之阳早格格创做本理:缓病毒载体不妨将中源基果大概中源的shRNA灵验天调整到宿主染色体上,进而达到少期性表黑手段序列的效验.正在熏染本领圆里可灵验天熏染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、搞细胞等多种典型的细胞,进而达到良佳的的基果治疗效验.对付于一些较易转染的细胞,如本代细胞、搞细胞、没有瓦解的细胞等,使用缓病毒载体,能大大普及手段基果大概手段shRNA的转导效用,且手段基果大概手段shRNA调整到宿主细胞基果组的几率大大减少,不妨比较便当快速天真止手段基果大概手段shRNA的少暂、宁静表黑.观念:缓病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 根源的一种病毒载体,缓病毒载体包罗了包拆、转染、宁静调整所需要的遗传疑息,是缓病毒载体系统的主要组成部分.携戴有中源基果的缓病毒载体正在缓病毒包拆量粒、细胞系的辅帮下,通过病毒包拆成为有熏染力的病毒颗粒,通过熏染细胞大概活体构造,真止中源基果正在细胞大概活体构造中表黑.辅帮身分:缓病毒载体辅帮身分包罗:缓病毒包拆量粒战可爆收病毒颗粒的细胞系.缓病毒载体包罗了包拆、转染、宁静调整所需要的遗传疑息.缓病毒包拆量粒可提供所有的转录并包拆RNA 到沉组的假病毒载体所需要的所有辅帮蛋黑.为爆收下滴度的病毒颗粒,需要利用表黑载体战包拆量粒共时共转染细胞,正在细胞中举止病毒的包拆,包拆佳的假病毒颗粒分泌到细胞中的培植基中,离心博得上浑液后,不妨曲交用于宿主细胞的熏染,手段基果加进到宿主细胞之后,通过反转录,调整到基果组,进而下火仄的表黑效力分子.基根源基本理:缓病毒载体系统由二部分组成,即包拆身分战载体身分.包拆身分:由HIV-1基果组去除了包拆、顺转录战调整所需的顺式效用序列而构修,不妨反式提供爆收病毒颗粒所必须的蛋黑.包拆身分常常被合并构修到二个量粒上,一个量粒表黑Gag战Pol蛋黑,另一个量粒表黑Env蛋黑,其手段也是落矮回复成家死型病毒的大概.将包拆身分与载体身分的3个量粒共转染细胞(如人肾293T细胞),即可正在细胞上浑中支获惟有一次性熏染本领而无复造本领的、携戴手段基果的HIV-1载体颗粒.载体身分:与包拆身分互补,即含有包拆、顺转录战调整所需的HIV顺式效用序列,共时具备同源开用子统造下的多克隆位面及正在此位面拔出的手段基果.为落矮二种身分共源沉组回复成家死型病毒的大概,需尽管缩小二者的共源性,如将包拆身分上5′LTR换成巨细胞病毒(CMV)坐时早期开用子、3′LTR换成SV40 polyA等.一、真验过程(1战2为并列步调)安排上下游特同性扩删引物,共时引进酶切位面,PCR(采与下保真KOD酶,3K内突变率为0%)从模板中(CDNA 量粒大概者文库)调与手段基果CDS区(coding sequence)连进T载体.将CDS区从T载体上切下,拆进缓病毒过表黑量粒载体.合成siRNA对付应的DNA颈环结构,退火后连进缓病毒搞扰量粒载体3. 缓病毒载体的包拆与浓缩杂化造备缓病毒脱梭量粒及其辅帮包拆本件载体量粒,三种量粒载体分别举止下杂度无内毒素抽提,共转染293T细胞,转染后6 h 调换为真足培植基,培植24战48h后,分别支集富含缓病毒颗粒的细胞上浑液,病毒上浑液通过超离心浓缩病毒.二、真验资料2.1缓病毒载体、包拆细胞战菌株该病毒包拆系统为三量粒系统,组成为pspax2, pMD2G,pLVX-IRES-ZsGreen1/pLVX-shRNA2.其中量粒上的ZsGreen1表黑框能表黑绿色荧光蛋黑(GFP).载体疑息1)缓病毒克隆载体图谱如下:2)包拆量粒疑息如下:PMD2G载体图谱战序列疑息PSPAX2载体图谱战序列疑息:细胞株293T,缓病毒的包拆细胞,为揭壁依好型成上皮样细胞,死少培植基为DMEM(含10% FBS).揭壁细胞经培植死少删殖产死单层细胞. 菌株大肠杆菌菌株DH5α.用于扩删缓病毒载体战辅帮包拆载体量粒.三、过程图。
慢病毒包装系统简介及应用
一、慢病毒包装简介及其用途
慢病毒( Lentivirus )载体是以 HIV-1 (人类免疫缺陷 I 型病毒)为基础发展起来的基
因治疗载体。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。慢
病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主
染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌
细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,
在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。
目前慢病毒也被广泛地应用于表达 RNAi 的研究中。由于有些类型细胞脂质体转染效果差,
转移到细胞内的 siRNA 半衰期短,体外合成 siRNA 对基因表达的抑制作用通常是短暂的,
因而使其应用受到较大的限制。采用事先在体外构建能够表达 siRNA 的载体,然后转移到
细胞内转录 siRNA 的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制
效果也不逊色于体外合成 siRNA ,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断
基因表达的作用。在所构建的 siRNA 表达载体中,是由 RNA 聚合酶Ⅲ启动子来指导 RNA 合
成的,这是因为 RNA 聚合酶Ⅲ有明确的起始和终止序列,而且合成的 RNA 不会带 poly A
尾。当 RNA 聚合酶Ⅲ遇到连续 4 个或 5 个 T 时,它指导的转录就会停止,在转录产物 3'
端形成 1~4 个U 。 U6 和 H1 RNA 启动子是两种 RNA 聚合酶Ⅲ依赖的启动子,其特点是
启动子自身元素均位于转录区的上游,适合于表达~ 21ntRNA 和~ 50ntRNA 茎环结构
( stem loop )。在 siRNA 表达载体中,构成 siRNA 的正义与反义链,可由各自的启动
子分别转录,然后两条链互补结合形成 siRNA ;也可由载体直接表达小发卡状 RNA(small
hairpin RNA, shRNA),载体包含位于 RNA 聚合酶Ⅲ启动子和 4 ~ 5 T转录终止位点之间
的茎环结构序列,转录后即可折叠成具有 1~4 个 U 3 ' 突出端的茎环结构,在细胞内进一
步加工成 siRNA 。构建载体前通常要通过合成 siRNA 的方法,寻找高效的 siRNA ,然后
从中挑选符合载体要求的序列,将其引入 siRNA 表达载体。
慢病毒载体( Lentiviral vector )较逆转录病毒载体有更广的宿主范围,慢病毒能够有
效感染非周期性和有丝分裂后的细胞。慢病毒载体能够产生表达 shRNA 的高滴度的慢病毒,
在周期性和非周期性细胞、干细胞、受精卵以及分化的后代细胞中表达 shRNA ,实现在多
种类型的细胞和转基因小鼠中特异而稳定的基因表达的功能性沉默,为在原代的人和动物细
胞组织中快速而高效地研究基因功能,以及产生特定基因表达降低的动物提供了可能性。
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所
有的转录并包装 RNA 到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗
粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假
病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目
的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
二、这一系统的目的,主要是为了解决以下问题:
1. 对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基
因转导效率,而且目的基因整合到宿主细胞基因组的几率大大增加,这就为 RNAi,cDNA 克
隆以及报告基因的研究提供了一个有利的途径。
2. 进行稳转细胞株的筛选;
3. 为活体动物模型实验提供高质量的包含目的基因的病毒液;
在细胞相关的实验操作中,对于一些按常规方法难以转染甚至无法转染的细胞,通过病毒介
导的实验能够大大提高基因的转导效率,以达到目的基因的高效瞬时表达。
三、慢病毒载体介绍
慢病毒载体( Lentiviral vector, LVs )是在 HIV-1 病毒基础上改造而成的病毒载体系
统,它能高效的将目的基因(或 RNAi )导入动物和人的原代细胞或细胞系。慢病毒载体基
因组是正链 RNA ,其基因组进入细胞后,在细胞浆中被其自身携带的反转录酶反转为 DNA ,
形成 DNA 整合前复合体,进入细胞核后, DNA 整合到细胞基因组中。整合后的 DNA 转录
mRNA ,回到细胞浆中,表达目的蛋白;或产生 RNAi 干扰。
慢病毒载体介导的基因表达或 RNAi 干扰作用持续且稳定,原因是目的基因整合到宿主细胞
基因组中,并随细胞基因组的分裂而分裂。另外,慢病毒载体能有效感染并整合到非分裂细
胞中。以上特性使慢病毒载体与其它病毒载体相比,比如不整合的腺病毒载体、整合率低的
腺相关病毒载体、只整合分裂细胞的传统逆转录病毒载体,有鲜明的特色。大量文献研究表
明,慢病毒载体介导的目的基因长期表达的组织或细胞包括脑、肝脏、肌肉、视网膜、造血
干细胞、骨髓间充质干细胞、巨噬细胞等。
慢病毒载体不表达任何 HIV-1 蛋白,免疫原性低,在注射部位无细胞免疫反应,体液免疫
反应也较低,不影响病毒载体的第 2 次注射。
四、慢病毒载体的构建
1. 构建原理
慢病毒属于逆转录病毒科,但其基因组结构复杂,除 gag、pol 和 env 这 3 个和单纯逆转
录病毒相似的结构基因外,还包括 4 个辅助基因,vif、vpr、nef、vpu 和 2 个调节基因 tat
和 rev 。 HIV 21 是慢病毒中最具特征性的病毒,第一个慢病毒载体系统即以此病毒为基
础进行构建的。慢病毒载体的构建原理就是将 HIV 21 基因组中的顺式作用元件 ( 如包装
信号、长末端重复序列 ) 和编码反式作用蛋白的序列进行分离。载体系统包括包装成分和
载体成分:包装成分由 HIV 21 基因组去除了包装、逆转录和整合所需的顺式作用序列而构
建,能反式提供产生病毒颗粒所需的蛋白;载体成分与包装成分互补,含有包装、逆转录和
整合所需的 HIV 21顺式作用序列。同时具有异源启动子控制下的多克隆位点及在此位点插
入的目的基因。为降低两种成分同源重组产生有复制能力的病毒 (RCV ) 的可能性,将包装
成分的 5 ′ LTR 换成巨细胞病毒 (CMV ) 立即早期启动子,3 ′ LTR 换成 SV 40 polyA
位点等。将包装成分分别构建在两个质粒上,即一个表达 gag 和 pol、另一个表达 env 。
根据这个原理,Naldini 和 Kafri 等构建了三质粒表达系统。
2. 三质粒表达系统
三质粒表达系统包括包装质粒、包膜蛋白质粒和转移质粒。其中包装质粒在 CMV 启动子的
控制下,表达 HIV 21 复制所需的全部反式激活蛋白,但不产生病毒包膜蛋白及辅助蛋白
vpu;包膜蛋白质粒编码水泡性口炎病毒 G 蛋白 (V SV 2G),应用 VSV 2G 包膜的假构型慢
病毒载体扩大了载体的靶细胞嗜性范围,而且增加了载体的稳定性,允许通过高速离心对载
体进行浓缩,提高了滴度; 转移质粒中除含有包装、逆转录及整合所需的顺式序列,还保
留 350 bp 的 gag 和 RRE,并在其中插入目的基因或标志基因 ( 绿色荧光蛋白 GFP) 。将
载体系统分成三个质粒最大的益处是使序列重叠的机会大大减少,减少载体重组过程中产生
RCV 的可能性。通过三质粒共转染 293T 细胞,超速离心后病毒滴度可达 109IU /m l 。
3. 四质粒表达系统
为了减少 HIV 21 包装结构的序列同源性,进一步减少重组成 RCV 的可能性,Dull 等人将
辅助基因去除。但由于 gag2pol 的转运需要 rev,因此,在上述的三质粒系统的基础上,
构建成四质粒表达系统,该系统加上含 rev 的质粒减少了产生 RCV 的可能性,而且对非分
裂期细胞转导效率无影响。
五、慢病毒载体应用
1. 将目的基因 /RNAi 基因转入难以转染的细胞,比如神经元细胞、干细胞或其它原代细胞;
2. 将目的基因 /RNAi 基因转入动物组织,以期获得长期表达;
3. 构建稳定表达目的蛋白 /RNAi 的细胞系,再用exvivo的方法导入动物体内;
4. 基因治疗;
5. 转基因动物;
6. 基因敲除;
7. 药物研究:构建表达受体蛋白的细胞系,研究药物的作用;
8. 快速建立生产目的蛋白的细胞系,非常有前途的真核细胞表达方法。