2020届高三高考化学(广东专版)专题复习卷:物质结构与性质专题
- 格式:doc
- 大小:786.50 KB
- 文档页数:5
2020高考化学物质的结构与性质考点专练1.下列对晶体类型判断正确的是( )2.下列化学用语的表述正确的是( )C.CO2的分子示意图:D.次氯酸的结构式:H—Cl—O3.下列有关离子晶体的数据大小比较不正确的是( )A.熔点:NaF>MgF2>AlF3B.晶格能:NaF>NaCl>NaBrC.阴离子的配位数:CsCl>NaCl>CaF2D.硬度:MgO>CaO>BaO4.下列说法正确的是( )A.钛和钾都采取图1的堆积方式B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个D.图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果5.通常情况下,NCl是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙3述正确的是( )A.分子中N—Cl键键长与CCl4分子中C—Cl键键长相等B.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为C.NCl3分子是非极性分子D.NBr3比NCl3易挥发6.下列推论正确的是( )A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3B.NH+4为正四面体结构,可推测PH+4也为正四面体结构C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子7.设X、Y、Z代表元素周期表中前四周期的三种元素,已知X+和Y-具有相同的电子层结构;Z元素的原子核内质子数比Y元素的原子核内质子数少9;Y和Z两种元素可形成含4个原子核、42个电子的负一价阴离子。
下列说法不正确的是( )A.元素Z的气态氢化物分子中含有10个电子B.元素Y的气态氢化物分子中含有18个电子C.元素Z与元素X形成的化合物X2Z中离子都达到稳定结构D.元素Y、Z组成的化合物属于离子化合物8.下列推断正确的是( )A.BF3是三角锥形分子B.NH+4的电子式:[,离子呈平面形结构C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键9.下列有关电子排布图的表述正确的是( )A.可表示单核10电子粒子基态时电子排布B.此图错误,违背了泡利原理C.表示基态N原子的价电子排布D.表示处于激发态的B的电子排布图10.下列各项叙述中,正确的是( )A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素C.所有原子任一电子层的s电子云轮廓图都是球形,但球的半径大小不同D.24Cr原子的电子排布式是1s22s22p63s23p63d44s211.下列化学粒子的中心原子是以sp2杂化的是( )A.BCl3 B.NH3 C.CH4 D.BeCl212.高温下,超氧化钾晶体(KO2)呈立方体结构。
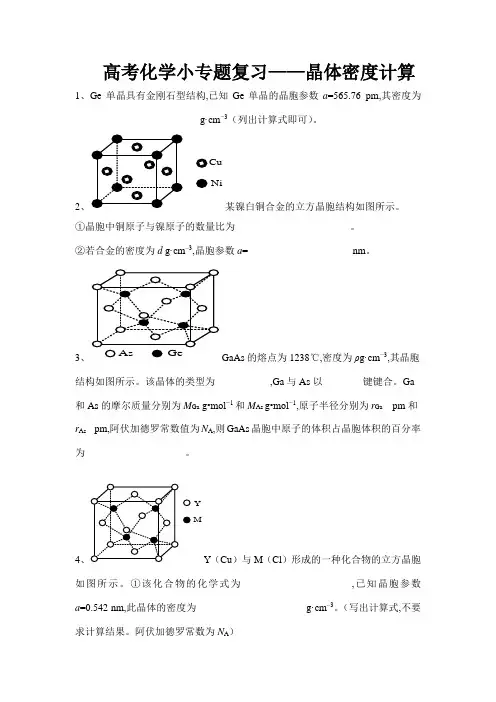
高考化学小专题复习——晶体密度计算1、Ge单晶具有金刚石型结构,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_________________________g·cm−3(列出计算式即可)。
2CuNi某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_______________________。
②若合金的密度为d g·cm–3,晶胞参数a=_____________________nm。
3、GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。
该晶体的类型为___________,Ga与As以________键键合。
Ga 和As的摩尔质量分别为M Ga g•mol−1和M As g•mol−1,原子半径分别为r Ga pm和r As pm,阿伏加德罗常数值为N A,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
4YMY(Cu)与M(Cl)形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为______________________g·cm–3。
(写出计算式,不要求计算结果。
阿伏加德罗常数为N A)5、(O)和B(Na)能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为____________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g·c m¯3)___________________________________。
6、Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_________,列式表示Al单质的密度为________________________g·cm¯3(不必计算出结果)7、金刚石晶胞含有_______个碳原子。

常见非金属及其化合物1.下列各项叙述Ⅰ、Ⅱ都正确且二者的原理最相似的是( )答案:D2.单质Z 是一种常见的半导体材料,可由X 通过如下图所示的路线制备,其中X 为Z 的氧化物,Y 为氢化物,分子结构与甲烷相似。
X ――→Mg 加热Mg 2Z ――→盐酸Y ――→加热Z 下列说法正确的是( )A .X 为酸性氧化物,能与碱反应,不能与酸反应B .Y 的化学式为SiH 4C .X 、Z 都含有非极性共价键D .X 与Mg 在加热条件下反应的化学方程式为SiO 2+2Mg=====△2MgO +Si 答案:B3.(2018·深圳模拟)合成氨及其相关工业中,部分物质间的转化关系如下:下列说法不正确的是( )A .反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应B .上述转化中包含了氨气、硝酸、硝酸铵、小苏打、纯碱的工业生产方法C .反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用D .反应Ⅴ是先向饱和氯化钠溶液中通CO 2至饱和再通NH 3 答案:D4.党的十九大报告指出:“坚持人与自然和谐共生,坚定走生态良好的文明发展道路,建设美丽中国,为人民创造良好的生活环境”。
下列行为与该主题不相吻合的是( )A .发展农村沼气,将废弃的农作物秸秆转化为清洁高效的能源B .实施矿物燃料的脱硫脱硝技术,可以减少SO 2、NO 2的排放C .在推广乙醇汽油的同时,研究开发太阳能电池和氢燃料电池汽车D .开着大排量的家用汽车开直播声讨雾霾天气 答案:D5.下列有关物质性质与用途具有对应关系的是( )A .NaHCO 3受热易分解,可用于制胃酸中和剂B .SiO 2熔点高硬度大,可用于制光导纤维C .Al 2O 3是两性氧化物,可用作耐高温材料D .CaO 能与水反应,可用作食品干燥剂 答案:D6.在给定的条件下,下列选项所示的物质间转化均能实现的是( ) A .H 2SiO 3――→△SiO 2――→盐酸SiCl 4 B .浓HCl ――→二氧化锰△Cl 2――→石灰乳漂白粉 C .Fe ――→水蒸气△Fe 2O 3――→盐酸FeCl 3 D .Mg(OH)2――→盐酸MgCl 2(aq)――→蒸发无水MgCl 2 答案:B7.工业上常用如下的方法从海水中提溴:浓缩海水――→氯气①粗产品溴――→通空气和水蒸气②溴蒸气――→SO 2③物质X ――→氯气④ 产品溴。

绝密★启用前2020年高考化学二轮物质结构与性质专项训练本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分分卷I一、单选题(共10小题,每小题2.0分,共20分)1.下列物质中,中心原子的杂化类型为sp3杂化的是()A. C2H6B. C2H2C. BF3D. C2H4【答案】A【解析】2.下列现象与原子核外电子跃迁无关的是()A.激光B.焰火C.核辐射D.霓虹灯光【答案】C【解析】3.下列变化中,吸收的热量用于克服分子间作用力的是()A.加热金属铝使之融化B.液氨受热蒸发C.加热碘化氢气体使之分解D.加热硅晶体使之融化【答案】B【解析】铝属于金属晶体,熔化时克服金属键,故A错误;液氨属于分子晶体,受热蒸发时只发生物理变化,破坏分子间作用力,故B正确;加热HI破坏化学键,故C错误;硅属于原子晶体,熔化时克服共价键,故D错误。
4.氮化硅是一种超硬、耐磨、耐高温的结构材料。
下列各组物质熔化时,与氮化硅熔化所克服的粒子间的作用相同的是()A.硝石(NaNO3)和金刚石B.晶体硅和水晶C.重晶石(BaSO4)和萤石(CaF2)D.冰和干冰【答案】B【解析】5.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性,因这三种元素都是常见元素,从而引起广泛关注。
该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为()A. Mg2CNi3B. MgCNi3C. MgCNi2D. MgC2Ni【答案】B【解析】6.下列叙述中,正确的是()A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高D.如果某一基态3p能级上仅有2个电子,它们自旋方向必然相反【答案】C【解析】在一个基态多电子的原子中,不可能有两个运动状态完全相同的电子,选项A不正确;处在同一能级中的电子,其能量是相同的,B不正确;根据核外电子的运动特点可知,选项C正确;D不正确,违背的应该是洪特规则7.下列各项比较中前者高于(或大于或强于)后者的是()A. CCl4和SiCl4的熔点B.邻羟基苯甲醛()和对羟基苯甲醛()的沸点C. SO2和CO2在水中的溶解度D. H2SO3和H2SO4的酸性【答案】C【解析】8.下列说法正确的是()A.离子晶体中可能含有共价键,一定含有金属元素B.分子晶体中可能不含共价键C.非极性分子中一定存在非极性键D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高【答案】B【解析】9.干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子,实验测得-25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)()A.B.C.D.【答案】D【解析】干冰晶胞是面心立方晶胞,所以每个晶胞中含有二氧化碳分子个数=8×1/8+6×1/8=4,晶胞边长为acm,则体积为a3cm3,晶胞密度=g/cm3,故选D。

xx 届高三化学物质结构与性质专题训练题班别: 姓名: 成绩:1、由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl 4是常用的氯化剂。
如:Na 2O +Cl 2=2NaCl +O 2 CaO +Cl 2=CaCl 2+O 2 SiO 2+2CCl 4=2COCl 2 Cr 2O 3+3CCl 4=2CrCl 3+3COCl 2 请回答下列问题: (1)Cr 2O3、CrCl 3中Cr 均为+3价,写出Cr 3+的基态电子排布式;(2)CCl 4分子中C 原子采取 杂化成键。
(3)COCl 2俗称光气,分子中C 原子采取sp 2杂化成键。
光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):a .2个σ键b .2个π键c .1个σ键、1个π键(4)CaO 晶胞如右上图所示,CaO 晶体中Ca 2+的配位数为 。
CaO 晶体和NaCl 晶体中离子排列方式相同,其晶格能分别为:CaO -3 401kJ •mol -1、NaCl -786kJ •mol -1。
导致两者晶格能差异的主要原因是。
元素编号元素性质 ①② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩原子半径(10-10m ) 1.52 2.27 0.74 1.43 0.77 1.10 0.99 1.86 0.75 0.71最高价态 +1 +1 - +3 +4 +5 +7 +1 +5 - 最低价态---2--4-3-1--3-1试回答下列问题:(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 __(填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)___________________________。
某元素R 的原子半径为1.02×10-10m ,该元素在周期表中位于__________________ ;若物质Na 2R 3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。

2020年广东省高考化学试卷(新课标Ⅰ)(总18页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2020年广东省高考化学试卷(新课标Ⅰ)一、选择题:本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CC3CCCCC)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是()3CC2CC能与水互溶CCC通过氧化灭活病毒C.过氧乙酸相对分子质量为76D.氯仿的化学名称是四氯化碳【答案】D【考点】相对分子质量及其计算电子式、化学式或化学符号及名称的综合【解析】C.CC3CC2CC与水分子间能形成氢键,并且都是极性分子;C.CCCCC具有强氧化性;C.过氧乙酸的结构简式为CC3CCCCC;C.氯仿的化学名称是三氯甲烷。
【解答】C.CC3CC2CC与水分子间能形成氢键,并且都是极性分子,所以CC3CC2CC能与水以任意比互溶,故C正确;C.CCCCC具有强氧化性,通过氧化能灭活病毒,故C正确;C.过氧乙酸的结构简式为CC3CCCCC,相对分子质量为12×2+4+ 16×3=76,故C正确;C.氯仿的化学名称是三氯甲烷,不是四氯化碳,故C错误;2. 紫花前胡醇()可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是()A.分子式为C14C14C4B.不能使酸性重铬酸钾溶液变色C.能够发生水解反应D.能够发生消去反应生成双键【答案】B【考点】有机物的结构和性质【解析】A、分子中14个碳原子,不饱和度为8;B、分子中含有碳碳双键和羟基直接相连碳上有氢原子;C、分子中含有酯基,能发生水解;D、与−OH相连的C的邻位C上有一种H可发生消去反应;【解答】A、分子的不饱和度为8,则氢原子个数为:14×2+2−8×2=14,四个氧原子,所以分子式为:C14H14O4,故A正确;B、分子中含有碳碳双键和羟基直接相连碳上有氢原子,所以能使酸性重铬酸钾溶液变色,故B错误;C、分子中含有能发生水解酯基,则紫花前胡醇能水解,故C正确;D、与−OH相连的C的邻位C上有一种H可发生消去反应,生成双键,故D正确;3. 下列气体去除杂质的方法中,不能实现目的的是()D.D【答案】A【考点】物质的分离、提纯和除杂的基本方法选择与应用【解析】除杂的原则是不引入新的杂质,不减少要提纯的物质,操作简单,绿色环保。

有机物的结构与性质1.(2020·广东执信中学高三月考)企鹅酮()可作为分子机器的原材料。
下列关于企鹅酮的说法错误的是()A.能使酸性高锰酸钾溶液褪色B.可发生取代反应C.1mol企鹅酮转化为C10H21OH需消耗3molH2D.所有碳原子一定不可能共平面【答案】C【解析】A. 企鹅酮中含碳碳双键,能使酸性高锰酸钾溶液褪色,A正确;B. 含有单键碳原子上可发生取代反应,B正确;C. 1mol企鹅酮含2摩尔碳碳双键和1摩尔羰基,都能和H2加成,加成产物为C10H19OH,需消耗3molH2,C错误;D. 环上有一个碳原子连有两个甲基,这个碳原子以碳碳单键和四个碳原子相连,所有碳原子一定不可能共平面,D正确;答案选C。
【点睛】B容易出错。
同学往往注意到官能团的性质,而忽略了单键碳上可以发生取代反应。
2.(2020·曲靖市陆良县教育局高二期末)咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:关于咖啡鞣酸的下列叙述正确的是 ( )A.分子式为C16H13O9B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键D.与浓溴水能发生两种类型的反应【答案】D【解析】A项,分子式应为C16H18O9,A错误;B项,能与氢氧化钠反应的是羧基、酚、酯基。
而醇不能与氢氧化钠反应。
该物质的结构中,含有一个羧基,一个酯基,两个酚,所以1 mol咖啡鞣酸可与含4 mol NaOH的溶液反应,B错误;C项,醇—OH、酚—OH均可被酸性KMnO4溶液氧化,C错误;D项,苯酚能与溴水发生取代反应,含碳碳双键能与溴水发生加成反应,所以该物质能与浓溴水发生加成反应和取代反应,D正确答案选D。
3.(2020·山东章丘四中高二月考)对如图所示的两种化合物的结构或性质描述正确的是()A.均能与溴水发生加成反应B.分子中肯定共平面的碳原子数相同C.二者互为同分异构体D.可以用红外光谱区分,但不能用核磁共振氢谱区分【答案】C【解析】A.左边的物质中含有酚羟基,能和溴水发生取代反应,右边物质中的碳碳双键能和溴水发生加成反应,醛基能和溴发生氧化还原反应生成羧基,选项A 错误;B.左边物质中肯定共平面的碳原子数是8个,右边物质中不含有苯环,肯定共平面的碳原子数为4个,所以二者分子中肯定共平面的碳原子数不相同,选项B错误;C.二者分子式相同,都是C10H14O,且二者的结构不同,所以是同分异构体,选项C正确;D.红外光谱用于区分化学键或原子团,核磁共振氢谱可以区分氢原子种类及不同种类氢原子的个数,这两种物质中氢原子种类不同,所以可以用核磁共振氢谱区分,选项D错误;答案选C。

2020届高三化学轮复习物质结构与性质(选考)(测试题)一、选择题(本题包括7小题,每小题4分,共28分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.下列元素中,基态原子的价电子排布式、电子排布式或价电子排布图不正确的是()A.Al3s23p1B.As[Ar]4s24p3C.Ar3s23p6D.答案 B解析B项应为[Ar]3d104s24p3。
2.下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ·mol-1)。
下列关于元素R的判断中一定正确的是()①R的最高正价为+3②R元素位于元素周期表中第ⅡA族③R元素第一电离能大于同周期相邻元素④R元素基态原子的电子排布式为1s22s2A.①②B.②③C.③④D.①④答案 B解析由表中数据可知,R元素的第三电离能与第二电离能的差距最大,故最外层有两个电子,最高正价为+2,位于第ⅡA族,可能为Be或者Mg元素,因此①不正确,②正确,④不正确;短周期第ⅡA族(n s2n p0)的元素,因s轨道处于全充满状态,比较稳定,所以其第一电离能大于同周期相邻元素,③正确。
3.CH+3、—CH3、CH-3都是重要的有机反应中间体,有关它们的说法正确的是()A.它们互为等电子体,碳原子均采取sp2杂化B.CH-3与NH3、H3O+互为等电子体,立体构型均为正四面体形C.CH+3中的碳原子采取sp2杂化,所有原子均共面D.CH+3与OH-形成的化合物中含有离子键答案 C解析A项,CH+3含8e-,—CH3含9e-,CH-3含10e-;B项,三者均为三角锥形;C项,CH+3中C的价电子对数为3,为sp 2杂化,平面三角形;D 项,CH 3OH 中不含离子键。
4.第ⅤA 族元素的原子R 与A 原子结合形成RA 3气态分子,其立体结构呈三角锥形。
RCl 5在气态和液态时,分子结构如图所示,下列关于RCl 5分子的说法中不正确的是( )A .分子中5个R —Cl 键的键能不都相同B .键角(Cl —R —Cl)有90°、120°、180°几种C .RCl 5受热后会分解生成分子立体结构呈三角锥形的RCl 3D .每个原子都达到8电子稳定结构 答案 D解析 A 项,由图知5个R —Cl 键的键长不都相同,所以键能不同,正确;B 项,上下两个顶点与中心R 原子形成的键角为180°,中间为平面三角形,平面三角形中两个Cl 原子与中心原子构成的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl —R —Cl)有90°、120°、180°几种,正确;C 项,RCl 5=====△RCl 3+Cl 2↑,则RCl 5受热后会分解生成分子立体结构呈三角锥形的RCl 3,正确;D 项,R 原子最外层有5个电子,形成5个共用电子对,所以RCl 5中R 的最外层电子数为10,不满足8电子稳定结构,错误。

绝密★启用前2020届高三高考化学一轮复习小题狂练《物质结构与性质(选考)》1.有X,Y,Z,W,M五种短周期元素,其中X,Y,Z,W同周期,Z,M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高,硬度大,是一种重要的半导体材料。
下列说法中,正确的是( )A. X,M两种元素只能形成X2M型化合物B.由于W,Z,M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低C.元素Y,Z,W的单质晶体属于同种类型的晶体D.元素W和M的某些单质可作为水处理中的消毒剂2.下列物质中,均直接由原子构成的是:①干冰晶体;②二氧化硅;③铁蒸气;④金刚石;⑤单晶硅;⑥白磷;⑦硫磺;⑧液氨;⑨钠;⑩氖晶体()A.②③④⑤B.②③④⑤⑨⑩C.②④⑤⑩D.②④⑤⑥⑦⑨⑩3.在硼酸(B(OH)3)分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是()A. sp,范德华力B. sp2,范德华力C. sp2,氢键D. sp3,氢键4.下列物质熔沸点高低的比较,正确的是()A. HF>HIB. CCl4<CF4C. SiO2<CO2D. NaCl<KCl5.用价层电子对互斥理论预测H2O和BF3的立体结构,两个结论都正确的是( ) A.直线形,三角锥形B. V形,三角锥形C.直线形,正四面体形D. V形,平面三角形6.下列各基态原子或离子的电子排布式正确的是()A. O2-1s22s22p4B. Ca [Ar]3d2C. Fe [Ar]3d54s3D. Si 1s22s22p63s23p27.下面叙述正确的是()A.共价化合物中没有离子键B.离子化合物中没有共价键C.正四面体构型的分子,键角均为109°28'D.直线型分子中的键角均为180°8.下列说法中错误的是()A. CO2、SO3都是极性分子B. KF是离子化合物,HF为共价化合物C.在NH4+和[Cu(NH3)4]2+中都存在配位键D. PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构9.下列叙述中,正确的是()A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高10.下列变化需克服相同类型作用力的是( )A.碘和干冰的升华B.硅和C60的熔化C.氯化氢和氯化钾的溶解D.溴和汞的气化11.下列基态原子的电子排布式中,其未成对电子数最多的是()A. 1s22s22p63s23p63d54s1B. 1s22s22p63s23p3C. 1s22s22p63s23p63d64s2D. 1s22s22p63s23p63d74s212.某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为() A. 1B. 3C. 4D. 613.在乙烯分子中有5个σ键和1个π键,它们分别是()A. sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B. sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C. C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键D. C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键14.在乙烯分子中有5个σ键和1个π键,它们分别是()A. sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B. sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C. C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键D. C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键15.下列说法正确的是()A. CHCl3是正四面体形B. H2O分子中氧原子为sp2杂化,其分子几何构型为V形C.二氧化碳中碳原子为sp杂化,为直线形分子D. NH是三角锥形16.根据等电子原理,下列分子或离子与其他选项不属于同一类的是()A. PFB. SiOC. SOD. SiH417.电子数相等的粒子叫做等电子体,下列各组粒子属于等电子体是()A. NO和NO2B. CO和CO2C. CO2和SO2D. CH4和NH318.由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2-中,中心原子铂的化合价是()A.都是+8B.都是+6C.都是+4D.都是+219.向盛有硝酸银水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到无色的透明溶液,下列对此现象的说法正确的是()A.反应前后Ag+的浓度不变B.沉淀溶解后,生成[Ag (NH3)2] OH难电离C.配合离子[Ag (NH3)2]+存在离子键和共价键D.配合离子[Ag (NH3)2]+中,Ag+提供空轨道,NH3给出孤对电子20.在乙烯分子中有5个σ键、1个π键,它们分别是( )A. sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B. sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C. C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键D. C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键21.只有阳离子而没有阴离子的晶体是()A.金属晶体B.原子晶体C.离子晶体D.分子晶体22.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5。

有机化学基础1.由化合物A 等为原料合成蒽环酮的中间体G 的合成路线如下:已知以下信息:①B 中含有五元环状结构;④(CH 3CO)2O 或CH 3COOC 2H 5――→LiAlH 42CH 3CH 2OH 。
回答下列问题:(1)A 的化学名称是________。
(2)由B 生成D 和F 生成G 的反应类型分别是________、________。
(3)D 的结构简式为________________。
(4)由E 生成F 的化学方程式为____________________________ _____________________________________________________。
(5)芳香化合物X 是D 的同分异构体,X 分子中除苯环外不含其他环状结构,X 能与Na 2CO 3溶液反应,其核磁共振氢谱有4组峰,峰面积之比为1∶1∶2∶2。
写出1种符合要求的X 的结构简式:______________________________________________________。
(6)写出以环戊烯()和丙烯酸乙酯()为原料制备化合物的合成路线:______________________________________________________________ (其他试剂任选)。
答案:(1) 正丁烷 (2)加成反应 消去反应 (3)(4)(5) (或其他合理答案)(6)2.化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:已知以下信息:①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:(1)A的结构简式为________________。
(2)B的化学名称为________________。
(3)C与D反应生成E的化学方程式为____________________________________________________________________________。

物质构造与性质(时间 90 分钟 ,满分 100 分 )一、选择题 (每题 5 分 ,共 70 分。
每题有 1 个选项切合题意)1.融化时 ,一定损坏非极性共价键的是()A.冰B.金刚石C.铁D.二氧化硅分析 :融化时一定损坏共价键的必定是原子晶体,非极性共价键只存在于非金属单质中。
只管二氧化硅也是原子晶体,但 Si— O 共价键是极性键。
答案 :B2.以下物质中,难溶于CCl 4的是 ()A. 碘单质B. 水C.苯D. 甲烷分析 :CCl 4、CH 4都是正四周体形分子CCl 4、 CH 4、 I 2、苯是非极性分子而,I 2是直线形分子,H2 O 是 V 形分子 ,苯为平面形分子H2O 是极性分子。
依据相像相溶原理知选B。
,所以答案 :B3.以下有机化合物分子中含有手性碳原子的是()A.CH 3CH(CH 3)2B.CH 3CH2OHC.CH 3CHClCH 2CH 3D.CH 3CHO解析 : 连接四个不同的原子或基团的碳原子称为手性碳原子。
观察所给选项 , 只有CH3CHClCH 2CH 3中第二个碳原子分别连结—CH3、—H、—Cl、—CH2CH3四个不一样的原子或基团。
答案 :C4.若不停地高升温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。
在变化的各阶段被损坏的微粒间的主要互相作用挨次是()A. 氢键 ;氢键和范德华力;极性键B. 氢键 ;氢键 ;非极性键C.氢键 ;极性键 ;分子间作使劲D. 分子间作使劲 ;氢键 ;非极性键分析 :雪花水水蒸气氢气、氧气答案 :A5.H 2O 与 H 2S 构造相像 ,都是 V 形的极性分子 ,可是 H2O 的沸点是100 ℃ ,H 2S 的沸点是 -60.7 ℃。
惹起这类差别的主要原由是()A.范德华力B.共价键C.氢键D.相对分子质量分析 :氢键的作用使水的沸点比同族元素的氢化物高。
答案 :C6.以下物质中含有非极性键的是()A.MgF 2B.H 2O2C.CO2D.HF分析 :A×MgF 2是由Mg2+和F-构成的离子化合物,只含离子键。
2020届高考化学二轮复习考点专项突破练习专题十一物质结构与性质(9)1、[化学—选修3:物质结构与性质]砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答下列问题:(1)写出基态As原子的核外电子排布式________________。
(2)根据元素周期律,原子半径Ga____As,第一电离能Ga_____As。
(填“大于”或“小于”)(3)AsCl3分子的立体构型为_____________,其中As的杂化轨道类型为_______。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是__________________________。
(5)GaAs的熔点为1238℃,密度为ρ g·cm-3,其晶胞结构如图所示。
该晶体的类型为__________,Ga与As以______键键合。
Ga和As的摩尔质量分别为M Ga g·mol-1和M As g·mol-1,原子半径分别为r Ga pm和r As pm,阿伏伽德罗常数值为N A,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______。
2、W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,YX、不在同一周期,且Y原子核外p电子比s电子多5个。
(1)基态原子的核外电子排布式为。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯()裂化生成苯和丙烯。
①1mol丙烯分子中含有键与π键数目之比为。
②苯分子中碳原子轨道的杂化类型为。
③Z 的一种氧化物5ZO 中,Z 的化合价为+6,则其中过氧键的数目为 个。
(3)W 、X 、Y 三种元素的电负性由小到大顺序为 (请用元素符号回答) (4)3ZY 熔点为1152℃,熔融状态下能够导电据此可判断3ZY 晶体属于 (填晶体类型)。
物质结构与性质1.据媒体报道,法国一家公司Tiamat 日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。
该电池的负极材料为Na 2Co 2TeO 6(制备原料为Na 2CO 3、Co 3O 4和TeO 2),电解液为NaClO 4的碳酸丙烯酯溶液。
回答下列问题:(1)Te 属于元素周期表中________区元素,其基态原子的价电子排布式为________。
(2)基态Na 原子中,核外电子占据的原子轨道总数为________,最高能层电子云轮廓图形状为________。
(3)结合题中信息判断:C 、O 、Cl 的电负性由大到小的顺序为 _____________________________________ (用元素符号表示)。
(4)CO 2-3的几何构型为________;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为________,1 mol 碳酸丙烯酯中键的数目为________。
(5)[Co(H 2O)6]3+的几何构型为正八面体形,配体是________,该配离子包含的作用力为__________(填字母)。
A .离子键 B .极性键 C .配位键 D .氢键 E .金属键(6)Na 和O 形成的离子化合物的晶胞结构如图所示,晶胞中O 的配位数为________,该晶胞的密度为ρ g·cm-3,阿伏加德罗常数的值为N A ,则Na 与O 之间的最短距离为________cm(用含ρ、N A 的代数式表示)。
答案: (1)p 5s 25p 4(2)6 球形 (3)O>Cl>C (4)平面三角形 sp 2sp 313N A (或13×6.02×1023) (5)H 2O BC (6)8 34×3248ρN A2.原子序数依次增大的四种元素A 、B 、C 、D 分别处于第一至第四周期。
自然界中存在多种A 的化合物,B 原子核外电子有6 种不同的运动状态,B 与C 可形成正四面体形分子。
D 的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:(1)这四种元素中电负性最大的元素.其基态原子的价电子排布图为________,第一电离能最小的元素是________(填元素符号)。
(2)C 所在主族的前四种元素分别与A 形成的化合物,沸点由高到低的顺序是________(填化学式),呈现如此递变规律的原因是_____________________________________________________。
(3)B 元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________、另一种的晶胞如图二所示,若此晶胞中的棱长为356.6 pm ,则此晶胞的密度为________g·cm -3(保留两位有效数字)。
(3=1.732)(4)D 元素形成的单质,其晶体的堆积模型为__________,D 的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键答案:(1) Cu(2)HF >HI >HBr >HCl HF 分子之间形成氢键使其熔沸点较高,HI 、HBr 、HCl 分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高(3)sp 23.5 (4)面心立方最密堆积 ①②③3.锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题: (1)Zn 原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn 和Cu 组成。
第一电离能I 1(Zn)________I 1(Cu)(填“大于”或“小于”)。
原因是_____________________________________________________。
(3)ZnF 2具有较高的熔点(872 ℃),其化学键类型是________;ZnF 2不溶于有机溶剂而ZnCl 2、ZnBr 2、ZnI 2能够溶于乙醇、乙醚等有机溶剂,原因是________________________________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO 3)入药,可用于治疗皮肤炎症或表面创伤。
ZnCO 3中,阴离子空间构型为________,C 原子的杂化形式为________。
(5)金属Zn 晶体中的原子堆积方式如图所示,这种堆积方式称为______________。
六棱柱底边边长为a cm ,高为c cm ,阿伏加德罗常数的值为N A ,Zn 的密度为________g·cm -3(列出计算式)。
答案:(1)[Ar]3d 104s 2(2)大于 Zn 核外电子排布为全满稳定结构,较难失电子(3)离子键 ZnF 2为离子化合物,ZnCl 2、ZnBr 2、ZnI 2的化学键以共价键为主、极性较小 (4)平面三角形 sp 2 (5)六方最密堆积(A 3型)65×6N A ×6×34×a 2c4.硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。
回答下列问题: (1)基态钒原子的外围电子轨道表达式为_________________。
钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是______________,VO 3-4的几何构型为__________。
(2)2巯基烟酸氧钒配合物(图1) 是副作用较小的有效调节血糖的新型药物。
①该药物中S 原子的杂化方式是____________,所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2巯基烟酸(图2)水溶性优于2疏基烟酸氧钒配合物的原因是 _____________________________________________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p 轨道,则p 电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A .SO 2B .SO 2-4 C .H 2S D .CS 2(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为_______。
图4 为该晶胞的俯视图,该晶胞的密度为_____ g·cm -3(列出计算式即可)。
答案:(1)+5 正四面体(2)①sp 3N>O>C ②2巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大 (3)AD (4) VS ρ=2(32+51)a 2bN A ×32×10-21g·cm -35.Ⅰ.下列叙述正确的有 。
(填序号)A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点Ⅱ.ⅣA 族元素及其化合物在材料等方面有重要用途。
回答下列问题:(1)碳的一种单质的结构如图(a )所示。
该单质的晶体类型为 ,原子间存在的共价键类型有 ,碳原子的杂化轨道类型为 。
(2)SiCl4分子的中心原子的价层电子对数为,分子的立体构型为,属于分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是__________________________________________________________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性、共价性(填“增强”“不变”或“减弱”)。
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。
K位于立方体的棱上和立方体的内部,此化合物的化学式为____________________________________________;其晶胞参数为1.4 nm,晶体密度为g·cm-3。
答案:Ⅰ.ADⅡ.(1)混合型晶体σ键、π键sp2(2)4 正四面体非极性(3)①均为分子晶体,范德华力随分子相对质量增大而增大,即熔沸点升高②减弱增强(4)K3C60 2.06.钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:请回答下列问题:(1)基态钛原子的价层电子排布图为__________,其原子核外共有________种运动状态不同的电子,Ti形成的+4价化合物最稳定,原因是__________________________________________________。
金属钛晶胞如图1所示,为________(填堆积方式)堆积。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37 ℃,沸点为136 ℃,可知TiCl4为________晶体。
用TiCl4的HCl溶液,后经不同处理可得到两种不同的TiCl3·6H2O晶体:[Ti(H2O)6]Cl3(紫色)、[TiCl(H2O)5]Cl2·H2O(绿色)。
两者配位数________(填“相同”或“不同”),绿色晶体中的配体是________。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2所示。
化合物乙的沸点明显高于化合物甲的,主要原因是______。
化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________________。
图2(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示。
该阳离子为______________。
图3(5)钙钛矿晶体的结构如图4所示。
钛离子位于立方晶胞的顶点,被________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________个氧离子包围。
钙钛矿晶体的化学式为_____。
答案:(1)22 最外层达到8电子稳定结构六方最密(2)分子相同H2O、Cl-(3)化合物乙分子间形成氢键N>O>C(4)TiO2+(或[TiO]2n+n)(5)6 12 CaTiO3。