初中化学专题金属和金属材料知识点讲解学习
- 格式:doc
- 大小:195.01 KB
- 文档页数:7


中考化学专题三 金属和金属材料
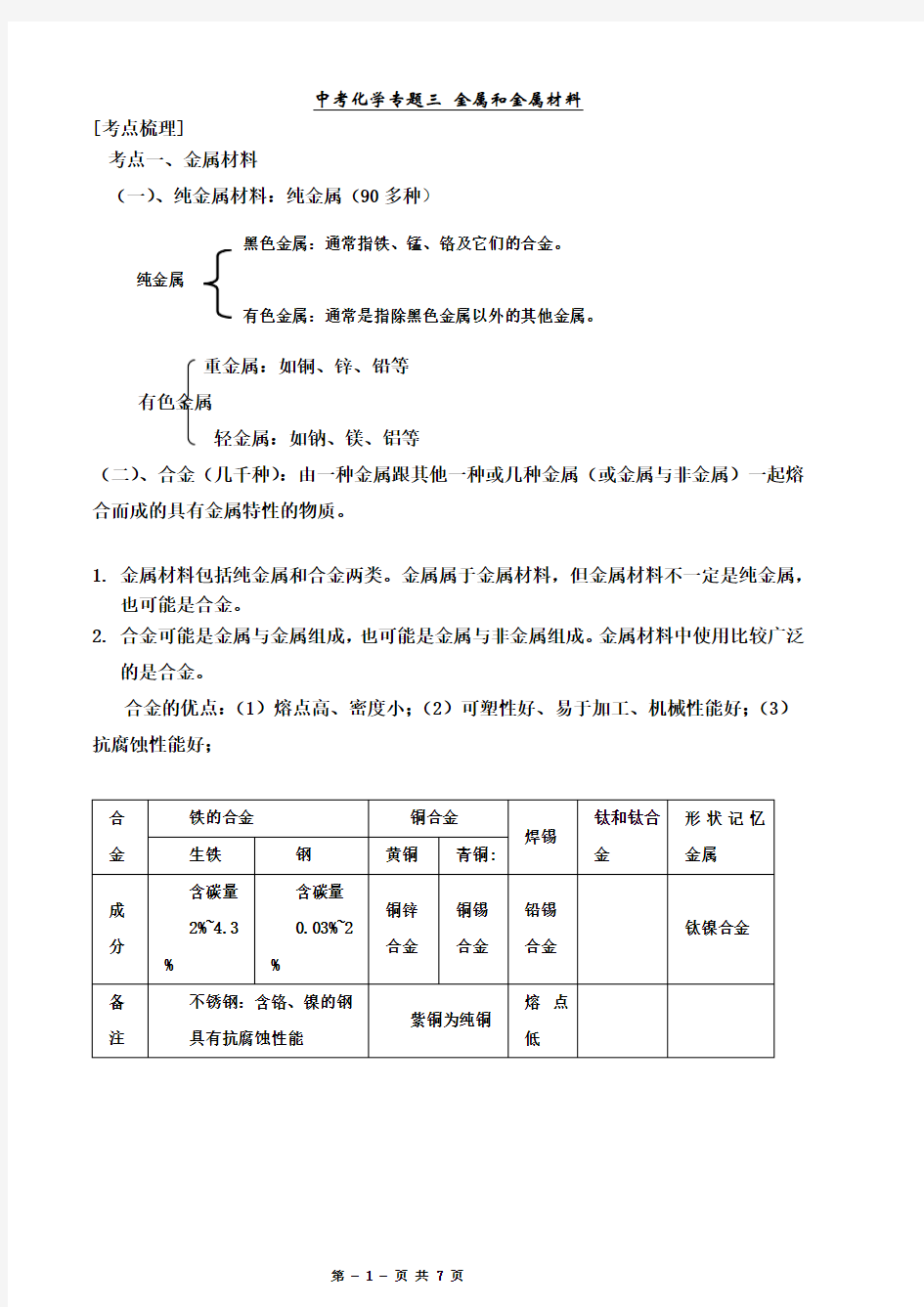
[考点梳理] 考点一、金属材料
(一)、纯金属材料:纯金属(90多种)
重金属:如铜、锌、铅等
有色金属
轻金属:如钠、镁、铝等
(二)、合金(几千种):由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
1. 金属材料包括纯金属和合金两类。金属属于金属材料,但金属材料不一定是纯金属,
也可能是合金。
2. 合金可能是金属与金属组成,也可能是金属与非金属组成。金属材料中使用比较广泛
的是合金。
合金的优点:(1)熔点高、密度小;(2)可塑性好、易于加工、机械性能好;(3)抗腐蚀性能好;
有色金属:通常是指除黑色金属以外的其他金属。
黑色金属:通常指铁、锰、铬及它们的合金。
纯金属
钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。钛合金的优点:①熔点高、密度小;②可塑性好、易于加工、机械性能好;③抗腐蚀性能好
钛镍合金具有“记忆”能力,可记住某个特定温度下的形状,只要复回这个温度,就会恢复到这个温度下的形状,又被称为“记忆金属”。此外,钛还可制取超导材料,美国生产的超导材料中的90%是用钛铌合金制造的。
3.注意:(1)合金是金属与金属或金属与非金属的混合物。
(2)合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。
(3)日常使用的金属材料,大多数为合金。
(4)金属在熔合了其它金属和非金属后,不仅组成上发生了变化,其内部组成结构也发生了改变,从而引起性质的变化。
4.2.合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成
合金时)。
5.青铜是人类历史上使用最早的合金;生铁和钢是人类利用最广泛的合金.
6.合金都属于混合物。
考点2金属的物理性质
(1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
(4)密度和硬度较大,熔沸点较高。
注:金属的物理性质是只所有金属都有的共同性质,而不是指某一金属的特有性质。
考点3 金属之最
(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素(3)铁:目前世界年产量最多的金属(铁>铝>铜)
(4)银:导电、导热性最好的金属(银>铜>金>铝)
(5)铬:硬度最高的金属(6)钨:熔点最高的金属
(7)汞:熔点最低的金属(8)锇:密度最大的金属
(9)锂:密度最小的金属
考点 7 置换反应
置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应叫做置换反应。
考点8 金属活动性顺序
四、常见金属活动性顺序:
1、常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
2、意义:①H代表酸中的氢元素;②金属的位置越靠前,它的活动性就越强;③在
金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸);④位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na)
3、应用:①用于判断金属是否与酸发生置换反应;②用于判断金属与酸发生化学反
应的剧烈程度;③用于判断金属与盐能否发生置换反应。
注意:
1、金属与盐的反应必须在“盐溶液”中进行,否则不能反应,如:Cu可以与AgNO
3溶液反应置换出Ag,但不能与AgCl反应。
2、也可根据反应是否发生及反应剧烈程度来判断金属的活动性强弱。
3、K、Ca、Na三种金属的活动性太强,除与酸反应外,还能与水在常温下发生置换反应
(如2Na+2H
2O=2NaOH+H
2
↑),其余金属则不能
考点9矿石
1.金属资源的存在方式:地球上的金属资源广泛存在于地壳和海洋中,大多数金属
化合物性质较活泼,所以它们以化合物的形式存在;只有少数金属化学性质很不活泼,如金、银等以单质形式存在。
2.矿石:工业上把能提炼金属的矿物叫矿石。
名称赤铁矿黄铁
矿菱铁
矿
磁铁
矿
铝土
矿
黄铜
矿
辉铜
矿
主要成分Fe
2
O
3
FeS
2
FeCO
3
Fe
3
O
4
Al
2
O
3
CuFeS
2
Cu
2
S
考点10一氧化碳还原氧化铁
1、炼铁的基本原理是:在高温条件下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。3CO + Fe 2O 3高温2Fe + 3CO 2
2、炼铁的原料:铁矿石[常见的铁矿石有磁铁矿(主要成分是Fe 3O 4)和赤铁矿(主要成分是Fe 2O 3)]、焦炭、石灰石和空气,主要设备是高炉。
(1)仪器:铁架台(2个)、硬质玻璃管、单孔橡皮赛(2个)、酒精灯、试管、酒精喷灯、
双孔橡皮赛、导气管。
(2)药品:氧化铁粉末、澄清石灰水、一氧化碳气体 (3
(4)步骤:①检验装置的气密性;②装入药品并固定;③向玻璃管内通入一氧化碳气体;
④给氧化铁加热;
⑤停止加热;⑥停止通入一氧化碳。
(5)现象:红色粉末逐渐变成黑色,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。 高温 点燃
(6)化学方程式:3CO+Fe 2O 3====2Fe+3CO 2 2CO+O 2=====2CO 2 Ca(OH)2+CO 2=CaCO 3↓+H 2O
(7)注意事项:与CO 还原氧化铜的实验操作顺序一样,即先通入CO 再加热,实验完毕,停止加热,继续通入CO 至试管冷却。
②、实验主要现象:红色粉末变为黑色时,澄清的石灰水变浑浊,尾气点燃产生淡蓝色火焰。
③实验注意事项:先能后点,先撤后停。
(8)尾气处理:因CO 有毒,不能随意排放在空气中,处理的原则是将CO 燃烧掉转化为
无毒的CO 2或收集备用。 考点11工业炼铁
(1)原理:在高温下,利用焦炭与氧气反应生成的还原剂(CO )将铁从铁矿石里还原出