2011-09-化工期中考试卷答案
- 格式:doc
- 大小:179.50 KB
- 文档页数:6

班级(学生填写): 姓名: 学号: 命题: 审题: 审批: ----------------------------------------------- 密 ---------------------------- 封 --------------------------- 线 ------------------------------------------------------- (答题不能超出密封线))CH 2CH 2(CH 3)2C CHCH 3(CH 3)2C C(CH 3)2CH 2CHBr(1)(2)(3)(4)A 、(1)>(4)>(2)>(3)B 、(2)>(1)>(4)>(3)C 、(4)>(3)>(2)>(1)D 、(4)>(1)>(3)>(2) 5、下列反应属于( )。
BCH 3CH CH 2HBrROORCH 3CH 2CH 2BrA 、自由基取代反应B 、自由基加成反应C 、亲电加成反应D 、亲核加成反应6、丁烷构象中,按稳定性由大到小的排列顺序为( )。
D(1) (2)(3) (4)A 、(1)>(3)>(4)>(2)B 、(2)>(1)>(4)>(3)C 、(3)>(4)>(1)>(2)D 、(3)>(4)>(2)>(1)中 Ha 、Hb 、 Hc 化学位移值由大到小排列的次序为( D )。
7、化合物A. δa > δb > δcB. δc > δb > δaC. δb > δc > δaD. δb > δa > δc 8、下列化合物的构象,按稳定性由大到小的排列顺序为( )。
DCH 3C(CH 3)3CH 3C(CH 3)3H 3CC(CH 3)H 3CC(CH 3)3(1)(4)(3)(2)A 、(1)>(4)>(3)>(2)B 、(4)>(3)>(1)>(2)C 、(1)>(2)>(3)>(4)D 、(4)>(1)>(3)>(2) 9、下列化合物为内消旋体的是( )。

2012-2013年第一学期期中考试化工制图试卷_________部班级姓名得分一.选择题(2分每个.共40分)1.按被测组分含量来分,分析方法中常量组分分析指含量()(A)<0.1%(B)>0.1%(C)<1%(D)>1%2.偶然误差具有()(A)可测性(B)重复性(C)非单向性(D)可校正性3.分析工作中实际能够测量到的数字称为()(A)精密数字(B)准确数字(C)可靠数字(D)有效数字4.定量分析中,精密度与准确度之间的关系是( )(A)精密度高,准确度必然高(B)准确度高,精密度也就高(C)精密度是保证准确度的前提(D)准确度是保证精密度的前提5.下列各项定义中不正确的是( )(A)绝对误差是测定值和真值之差(B)相对误差是绝对误差在真值中所占的百分率(C)偏差是指测定值与平均值之差(D)总体平均值就是真值6.在进行样品称量时,由于汽车经过天平室附近引起天平震动是属于()(A)系统误差(B)偶然误差(C)过失误差(D)操作误差7.比较两组测定结果的精密度()甲组:0.19%,0.19%,0.20%,0.21%,0.21%乙组:0.18%,0.20%,0.20%,0.21%,0.22%(A)甲、乙两组相同(B)甲组比乙组高(C)乙组比甲组高(D)无法判别8.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
这一点称为()(A)化学计量点(B)滴定误差(C)滴定终点(D)滴定分析9.滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积()mL(A)10 (B)20 (C)30 (D)4010.欲配制1000mL 0.1mol/L HCl溶液,应取浓盐酸(12mol/L HCl) ()mL。
(A) 0.84mL (B)8.4mL (C)1.2mL;(D)12mL11.共轭酸碱对的K a与K b的关系是()(A)K a K b = 1 (B)K a K b =K w (C)K a/K b =K w (D)K b /K a =K w12.H2PO4-的共轭碱是()(A)H3PO4 (B)HPO42-(C)PO43-(D)OH-13.按质子理论,Na2HPO4是()(A)中性物质(B)酸性物质(C)碱性物质(D)两性物质14.浓度为0.1 mol/L HAc(pKa=4.74)溶液的pH是()(A)4.87 (B)3.87 (C)2.87 (D)1.87 15.浓度为0.10 mol/LNH4Cl (pKb=4.74)溶液的pH是()(A)5.13 (B)4.13 (C)3.13 (D)2.13 16.将酚酞指示剂加到无色水溶液中,溶液呈无色,该溶液的酸碱性为()(A)中性(B)碱性(C)酸性(D)不定17.含NaOH和Na2CO3混合碱液,用HCl滴至酚酞变色,消耗V1 mL,继续以甲基橙为指示剂滴定,又消耗V2 mL,其组成为()(A)V1=V2 (B)V1>V2 (C)V1<V2 (D)V1=2V218.用0.1mol/L HCl滴定0.1mol/L NaOH时的pH突跃范围是9.7-4.3,用0.01mol/L HCl滴定0.01mol/L NaOH的突跃范围是()(A)9.7~4.3 (B)8.7~4.3 (C)8.7~5.3 (D)10.7~3.319.在不加样品的情况下,用测定样品同样的方法、步骤,对空白样品进行定量分析,称之为()(A)对照试验(B)空白试验(C)平行试验(D)预试验20、根据有效数字运算法则,(1.276×4.17)+ 1.7×10-4 -(0.0021764×0.012)=()。

南京工业大学化工热力学试题(A )卷资格(闭)2011~2012年度第一学期 使用班级 化学工程与工艺专业09级2011.12班级 学号 姓名 成绩1.单项选择题(每题1分,共40分)本大题解答(用A 或B 或C 或D )请填入下表:1.Pitzer 提出的由偏心因子ω计算第二维里系数的普遍化关系式是( )。
A. 01B B B ω=B. 01B B B ω=+C.01ccBP B B RT ω=+ D. 01B B B ω=+ 2.关于化工热力学研究内容,下列说法中不正确的是( )A.判断新工艺的可行性。
B.化工过程能量分析。
C.反应速率预测。
D.相平衡研究 3.纯物质 PV 图临界等温线在临界点处的斜率和曲率都等于( )。
A. -1 B. 0 C.1 D. 不能确定4、范德华方程与R -K 方程均是常见的立方型方程,对于摩尔体积V 存在三个实根或者一个实根,当存在三个实根时,处于中间的实根是 。
A .饱和液体体积 B .饱和蒸汽体积C .无物理意义D .饱和液体与饱和蒸汽的混合体积5.某真实气体符合状态方程()0.5RT aP V b TV V b =--+,a 、b 为常数。
则当该气体进行绝热膨胀时,膨胀后气体的温度 。
A 、升高B 、降低C 、不变D 、不能确定6.流体流过保温良好的换热器、反应器、混合器等设备时稳流体系热力学第一定律的最简数学表达式为A.ΔH=-WsB. ΔH=QC. ΔH=0D. ΔH+1/2Δu 2=Q7.下列论述错误的是 。
A .P-R 方程能同时应用于汽、液两相计算,准确度较高。
B. R-K 方程能同时应用于汽、液两相计算,准确度较高。
C. 活度系数可以大于1也可小于1。
D.压缩因子可以大于1也可小于1。
8.下列偏摩尔自由焓表达式中,错误的为( )。
A. i i G μ=-B. dT S dP V G d i i i ----= C. ()i j n P T i i n nG G ≠⎥⎦⎤⎢⎣⎡∂∂=-,,D. ()ij n nV T i i n nG G ≠⎥⎦⎤⎢⎣⎡∂∂=-,, 9. 对于流体混合物,下面式子错误的是 。

海南师范大学化学与化工学院 09 制药工程 专业《物理化学》(下) 2010 — 2011学年度第二学期期中考试卷注意事项:1. 考前请将密封线内填写清楚2. 所有答案请直接答在试卷上(或答题纸上) 3.考试形式:闭 卷4. 本试卷共 5 大题,满分100分, 考试时间100分钟一、单项选择题(本题共20小题,每小题2分,共40分)在每小题列出的四个选项中只有一个是符合题目要求的,请将其代码填在题后的括号内。
错选或未选均无分。
1. 3610 已知Cu 相对原子量为64,用0.5法拉第电量可从CuSO 4溶液中沉淀出多少Cu ? ( A ) (A) 16g(B) 32g (C) 64g(D) 127g2. 3801 298标K ,当H 2SO 4溶液的浓度从0.01mol·kg -1增加到0.1mol·kg -1时,其电导率k 和摩尔电导率Λm 将: ( D ) (A) k 减小,Λm 增加 (B) k 增加,Λm 增加 (C) k 减小,Λm 减小 (D) k 增加,Λm 减小3. 3806 CaCl 2摩尔电导率与其离子的摩尔电导率的关系是: ( C ) (A)Λ∞(CaCl 2)=λm (Ca 2+)+λm (Cl -) (B)Λ∞(CaCl 2)=½λm (Ca 2+)+λm (Cl -) (C)Λ∞(CaCl 2)=λm (Ca 2+)+2λm (Cl -) (D)Λ∞(CaCl 2)=2[λm (Ca 2+)+λm (Cl -)]4. 4006 浓度为0.1mol·kg -1的MgCl 2水溶液,其离子强度为 ( D ) (A)0.1mol·kg -1 (B)0.15mol·kg -1 (C)0.2mol·kg -1 (D)0.3mol·kg -15. 4057科尔劳乌施定律m m (1∞Λ=Λ-适用于 ( D )(A) 弱电解质 (B) 强电解质 (C) 无限稀释溶液 (D) 强电解质的稀溶液6. 4112 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg 2Cl 2(s)|Hg(l)的化学反应是 ( D ) (A) 2Ag(s)+Hg 22+(aq)=2Hg(l)+2Ag + (B) 2Hg+2Ag +=2Ag+Hg 22+ (C) 2AgCl+2Hg=2Ag+Hg 2Cl 2 (D) 2Ag+Hg 2Cl 2=2AgCl+2Hg7. 4169 电极AgNO3(m1)|Ag(s)与ZnCl2(m2)|Zn(s)组成电池时,盐桥为( A )(A) KCl (B) NaNO3 (C) KNO3 (D) NH4Cl8. 4401 已知下列两个电极反应的标准电极电位为:Cu2++2e-→Cu(s),φ=0.337V;Cu++e-→Cu(s),φ2= 0.521 V。
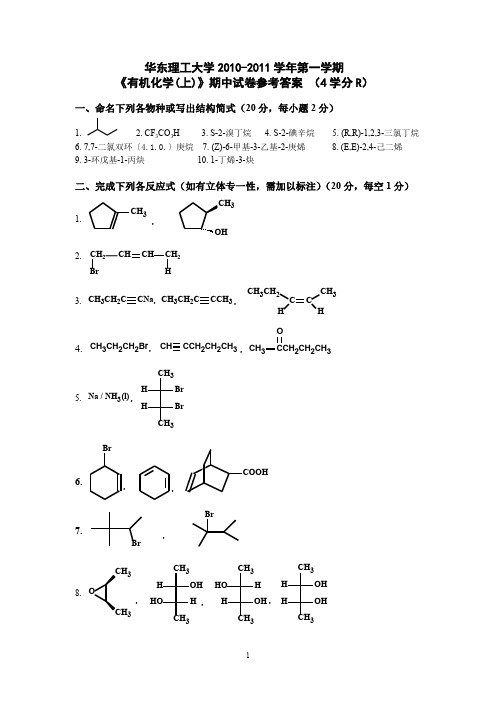
华东理工大学2010-2011学年第一学期《有机化学(上)》期中试卷参考答案 (4学分R )一、命名下列各物种或写出结构简式(20分,每小题2分)1.2. CF 3CO 3H3. S-2-溴丁烷4. S-2-碘辛烷5. (R,R)-1,2,3-三氯丁烷6. 7,7-二氯双环〔4.1.0.〕庚烷7. (Z)-6-甲基-3-乙基-2-庚烯8. (E,E)-2,4-己二烯9. 3-环戊基-1-丙炔 10. 1-丁烯-3-炔 二、完成下列各反应式(如有立体专一性,需加以标注)(20分,每空1分)1. CH 3CH 3,2.CH 2CHCHCH 23. CH 3CH 2C CNa CH 3CH 2CCCH 3CHCH 3CH 3CH 2H ,,4.CH 3CH 2CH 2Br ,CH CCH 2CH 2CH 3CH3CCH 2CH 2CH 3O,5. Na / NH 3CH 3Br Br3H H,(l)6.Br,,7.BrBr,8. 33CH 3OH HH HO3CH 3H HO OH H3CH 3OH H OHHCH 3,,,三、鉴别题(10分)化学方法:分别加入高锰酸钾溶液,使之褪色的是1-丁炔和1-丁烯(3分);于1-丁炔和1-丁烯中分别加入Ag(NH 3)2NO 3,有白色沉淀的为1-丁炔(2分)。
红外光谱法:3340~3300cm -1处有吸收峰的为1-丁炔,3100~3010cm -1处有吸收峰的为1-丁 烯,3340~3300cm -1处或3100~3010cm -1处均无吸收峰的为甲基环丙烷。
或:2250cm -1左右处有吸收峰的为1-丁炔,1680~1600cm -1处有吸收峰的为1-丁烯,2250cm -1 左右处或1680~1600cm -1处均无吸收峰的为甲基环丙烷。
(全对给5分,对2个给3分,对一个给2分)四、 简答题(10分)1. 稳定性:CH 3CCH 3CH 3+CH 3CHCH 3++CH 3CH 2CH 3+>>>(3分)因甲基为供电子基,使正电荷得到分散。

2011年高考化学真题(含答案)第Ⅰ卷(选择题 共120分)本试卷共21小题,每小题6分,共126分。
合题目要求的。
以下数据可供解题时参考: 相对原子质量(原子量):H 1 C 12 B 11 N 14 O 16 Na 23 S 32 Cl 35.5 Ca 40 Cu 647.下列叙述正确的是 A .1.00mol NaCl 中含有6.02×1023个NaCl 分子 B .1.00mol NaCl 中,所有Na +的最外层电子总数为8×6.02×1023 C .欲配置1.00L ,1.00mol .L -1的NaCl 溶液,可将58.5g NaCl 溶于1.00L 水中 D .电解58.5g 熔融的NaCl ,能产生22.4L 氯气(标准状况)、23.0g 金属钠 8.分子式为C 5H 11Cl 的同分异构体共有(不考虑立体异构) A .6种 B .7种 C . 8种 D .9种 9.下列反应中,属于取代反应的是 ①CH 3CH=CH 2+Br 2CH 3CHBrCH 2Br ②CH 3CH 2OHCH 2=CH 2+H 2O③CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O④C 6H 6+HNO 3C 6H 5NO 2+H 2OA . ①②B .③④C .①③D .②④10.将浓度为0.1mol·L -1HF 溶液加水不断稀释,下列各量始终保持增大的是A .c (H +)B .K 2(HF )C .)()(+H c F c - D . )()(HF c H c +11.铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni 2O 3+3H 2O=Fe (OH )2+2Ni (OH )2 下列有关该电池的说法不正确...的是 A .电池的电解液为碱性溶液,正极为Ni 2O 3、负极为Fe B .电池放电时,负极反应为Fe+2OH --2e -=Fe (OH )2 C .电池充电过程中,阴极附近溶液的pH 降低D .电池充电时,阳极反应为2Ni (OH )2+2OH --2e -=Ni 2O 3+3H 2O 12.能正确表示下列反应的离子方程式为A .硫化亚铁溶于稀硝酸中:FeS+2H +=Fe2++H 2S ↑B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2OC.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3-D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2 +H2O13.短周期元素W、X、Y和Z的原子序数依次增大。
2011-2012学年第一学期化工基础A试卷A答案南京师范大学2011-2012学年第一学期化学与材料科学学院化学专业2009年级 《化工基础A 》课程期末试卷(A)答案班 级: 任课教师: 李明海学 号: 姓 名: 题 号 一 二 三 四 总分 得 分一. 填空题 (本题共38分)1、润滑油流过一内径为8mm ,长度为3m 的铅垂向管段。
已知润滑油的运动粘度为1.5cm 2/s ,密度为850kg/m 3。
油由下向上流动,油的流型为层流流动。
测得上、下游的油的压差值为5X104Pa ,则油的流速为( 1 )m/s 。
2、流体在圆形直管内流动时,当Re>4000时,流体的流型为( 2 )。
3、在兰州操作的苯乙烯真空蒸馏塔顶的真空表读数为80×103Pa 。
在天津操作时,若要求塔内维持相同的绝对压强,真空表的读数应为( 3 )。
兰州地区的平均大气压强为85.3×103Pa ,天津地区的平均大气压强为101.33×103Pa 。
4、如本题附图所示,某厂为了控制乙炔发生炉a 内的压强不超过10.7X103Pa(表压),需在炉外装有安全封装置,其作用是当炉内压强超过规定值时,气体就从液封管b 中排出。
试求此炉的安全液封管应插入槽内水面下的深度 h=( 4 )m得分专业: 班级: 系主任签字:5、离心泵的工作点是( 5 )与( 6 )两条曲线的交点。
6、离心泵气蚀现象产生的原因为( 7 )。
7、泵起动时应先关闭出口开关,原因是(_____8_______)。
8、离心泵的扬程含义是(____9_______)。
9、试计算直径为95μm,密度为3000kg/m3的固体颗粒在20℃的水中的自由沉降速度( 10 )m/s,已知水的密度为998.2kg/m3,粘度为1.005X10-5Pa·s。
10、当旋转半径R = 0.4m,切向速度u t = 20m/s 时,离心分离因数为( 11 )。
化工原理前四章的习题(概念题部分)答案发给你们,后面二章的题目同前几章一样,先自己做!期中考试总体考得不错,希望拿到这个后,同学们能认真比对,思考;以获得知识的强化,进而提升自己的知识面,及分析问题,解决问题的超强能力!因学校网络断网,又考虑恰逢五一小长假,故4日回校将电脑上存贮的这个文档发给你们研究一下,至上课时有疑问再讨论。
诚祝大家青年节快乐!第一章 流体流动一、选择题1. 连续操作时,物料衡算通式中的过程积累量G A 为( )。
BA.零B.正数C.负数D.任意值2. 热量衡算中,物料的焓为相对值,通常规定( )的焓为零。
A℃液体 ℃气体 ℃液体 ℃气体3. 流体阻力的表现,下列阐述错误的是( )。
DA.阻力越大,静压强下降就越大B.流体的粘度越大,阻力越大流体的流动状况是产生流体阻力的根本原因 D.流体的内摩擦力在流体激烈流动时不存在4. 压强的具有专门名称的国际单位是Pa ,用基本单位表示是( )。
Am25. 水在直管中流动,现保持流量不变,增大管径,则流速( )。
BA.增大B.减小C.不变D.无法判断6. 对可压缩流体,满足( ) 条件时,才能应用柏努力方程求解。
C A.)%(20p p p 121式中压强采用表压表示<- B. )%(01p p p 121式中压强采用表压表示<- C.)%(20p p p 121式中压强采用绝压表示<- D. )%(01p p p 121式中压强采用绝压表示<- 7. 判断流体的流动类型用( )准数。
CA.欧拉B.施伍德C.雷诺D.努塞尔特8. 流体在圆形直管中层流流动时的速度分布曲线为( )。
BA.直线B.抛物线C.双曲线D.椭圆线9. 增大流体的流量,则在孔板流量计的孔板前后形成的压强差( )。
AA.增大B.减小C.不变D.无法判断10. 流体在管内流动时的摩擦系数与( )有关。
BA.雷诺准数和绝对粗糙度B.雷诺准数和相对粗糙度C.欧拉准数和绝对粗糙度 B. 欧拉准数和相对粗糙度11.测速管口置于管道的中心线上,测量得到的流速是流体的()流速。
物 理 化 学 期 中 考 试 卷 姓名 学号 成绩 一、选择题(2×10=20) ( D ) 1. 物质临界点的性质与什么有关? A. 与外界温度有关 B. 与外界压力有关 C. 与外界物质有关 D. 是物质本身的特性 ( A )2.同温、同压下,某实际气体的摩尔体积大于理想气体的摩尔体积,则该气体的压缩因子Z A. >1 B. =1 C. <1 D. =0 ( A )3. 某体系经历一不可逆循环后,下述各答案中,哪些是错误? A. Q=0 B. ≨U=0 C. ≨H=0 D. ≨S=0 ( C )4.某理想气体进行绝热恒外压膨胀,其热力学能变化应为何值? A. ≨U=0 B. ≨U>0 C. ≨U<0 D. 不一定 ( B )5. 公式W膨=CV(T1-T2)适用于什么变化? A. 任何气体的绝热变化 B. 理想气体的任何绝热变化 C. 理想气体的任何变化 D. 理想气体的绝热可逆变化 ( B ) 6. 理想气体进行节流膨胀,下述答案,哪一个正确? A. <0 , ≨S<0 B. =0 , ≨S>0 C. =0 , ≨S=0 D. <0 , ≨S=0 ( D )7.在101kPa下,90℃的液态水汽化为90℃的水蒸气,体系的熵值将如何变化,环境的熵值将如何变化? A. ≨S体<0 ;≨S环<0 B. ≨S体>0 ;≨S环>0 C. ≨S体<0 ;≨S环>0 D. ≨S体>0 ;≨S环<0 ( B)8.理想气体在恒温下向真空膨胀,体积从V1变至V2,吸热为Q,其熵变应如何计算?
A. ≨S=0 B. 12lnVVRS
C. 0TQS D. 12lnppRS ( D)9. 热温熵表达式TQr中的T是什么含义? A. 体系的摄氏温度 B. 环境的摄氏温度 C. 环境的绝对温度 D. 体系的绝对温度 ( A )10.一定量的理想气体从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1,V2,则 (A) V1> V2 (B) V1< V2 (C) V1= V2 (D) 无法确定 二、简答题(4×5=20) 1. 在两个体积相等,密封、绝热的容器中,装有压力相等的某理想气体,试问这两个容器中温度是否相等? 答: 不一定 因为 pV=nRT 所以N1T1=n2T2 因此若装有相同物质的量的该理想气体,则容器中温度相等,否则不等.
2. 指出下列说法中存在的问题: 系统的焓变化等于系统在恒压过程中吸收的热量. 答: 只有在封闭系统恒压下,不存在非体积功的条件下,系统所吸收的热量在数值上等于焓的增加量.
3. 锌与稀硫酸作用, (a)在敞口的容器中进行; (b)在密闭的容器中进行, 哪一种情况放热较多, 为什么? 答: (b)多, 因为有气体产生, Qp=Qv+≨nRT , ≨n>0 因为放热反应, Q<0, 例如:-1000=-1200+200 所以︱Qp︳<︱Qv︳
4. S、G、A作为判据时必须满足的条件 答: 隔离系统或绝热的封闭系统,S≧0 封闭系统恒温恒容非体积功为零 A≦0 封闭系统恒温恒压非体积功为零 G≦0
三、计算题(15×4=60) 1. 有2.0dm3潮湿空气, 压力为101.325kPa, 其中水气的分压为12.33kPa, 设空气中O2(g)和N2(g)的体积分数分别为0.21和0.79,试求 (1)H2O(g), O2(g)和N2(g)的分体积; (2) O2(g), N2(g)在潮湿空气中的分压力。
解: 1217.022总ppxOHOH
6939.079.022总总-pppxOHN
1844.021.022总总-pppxOHO
VH2O=V总×xH2O=0.243dm3 VO2=0.369dm3 VN2=1.388 dm3 pO2=p总×xO2=18.68kPa pN2=70.31kPa 2. 1mol单原子理想气体从始态298K,100kPa,先绝热可逆压缩到200kPa,再恒压冷却使体积缩小至5dm3,求整个过程的Q,W,≨U,≨H,≨S
解: KnRVpT28.120314.815200333 JRTTnCUmV49.221529828.1205.1113,
JRTTnCHmp05.369329828.1205.2113,
113,3159.2429828.120ln314.85.2200100ln314.8lnlnKJTTnCppnRS
mp
KppTT21.3932001002983535112112
JTTnRTTnCWWWmV36.3457)(2312,21
WUQ85.5672 3. 已知苯在101.325kPa下的沸点为353K,在此条件下的摩尔汽化焓为30.75kJ·mol-1,求1mol液态苯在353K,101.325kPa下全部汽化成为苯蒸气时的Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。 解: 相变为可逆相变 ΔG=0 kJ·mol-1 Q=ΔH= 30.75kJ·mol-1 ΔS=ΔH/T= 87.11 J·mol-1·K-1 W=-pV=-nRT=-2.935 kJ·mol-1 ΔU=Q+W=27.815 kJ·mol-1 ΔA=ΔG-pV=-2.935 kJ·mol-1
4. 在一绝热汽缸内装有298K, 2molCO和过量空气,在压力不变的条件下,发生化学反应2CO+O2=2CO2, 假定此反应进行完全, 气体可看作理想气体, 且活塞无重量也无摩擦,nO2:nN2=1:4求此过程的Q,W,≨U,≨H.
125.393)298,(molkJKCOHmf 15.110)298,(molkJKCOH
mf
112,2,57.33)()(KmolJOCNCmpmp 112,0.46)(KmolJCOC
mp 解: ≨H=≨H1+≨H2=0 kJBHHmfBB0.566)(1
≨H2=(2×46.0+4×33.57)×(T2-298) T2=2799K
kJRTnRTnpVHU28.122298314.872799314.861122
W=≨U=-122.28kJ
例1: l mol单原子理想气体由始态(273K,p )经由下列两个途径到达终态( T2,p /2):(l)可逆绝热膨胀;(2)反抗p /2的外压绝热膨胀.试分别求出T2,W,Sm和Gm.并回答能否由Gm来判断过程的方向? 已知S (273K)=100J ·K-1·mol-1。 解:(1)可逆绝热膨胀过程 Qr = Q = 0 J S= 0 J·K-1(可逆过程为恒熵过程) 单原子理想气体的绝热系数 =1.667,利用绝热可逆公式 T= 207K ∴W=U=nCV,m(T2 - T1) =1mol× (1.5×8.3145J·K-1·mol-1)×(207K- 273K)= -823.1 J H=nCP,m(T2 - T1) =1mol× (2.5×8.3145J·K-1·mol-1)×(207K- 273K)= -1371.9 J G= H - (TS) =H - (T2S2 - T1S1)=H - S(T2- T1) = -1371.9 J - 100 J·K-1×(207K-273K) = 5228 J 过程为非恒温过程,不能用G来判断过程的方向。
T1=298K 2mol CO 1mol O2 4mol N2 T2 2mol CO2 4mol N2 T1=298K 2mol CO2 4mol N2 H=0
H1 H2 (2) 恒外压绝热膨胀过程,利用Q=0,U=W建立方程求出T2。 U = n CV,m (T2 - T1) = n(1.5×R)×(T2 - T1) W= - p外(V2 - V1)= - p2(V2 - V1)= - nR[T2 - (T1/ p1) p2] = - nR(T2 - T1/2) ∴ n(1.5×R)×(T2 - T1) = - nR(T2 - T1/2) T2 = 0.8T1 = 0.8×273K = 218.4 K W=U=nCV,m(T2 - T1) =1mol×(1.5×8.3145J·K-1·mol-1)×(218.4K-273K) =-681.0 J 利用公式2112,lnlnppnRTTnCSmp得 S = 1.125 J·K-1
H=nCp,m(T2 - T1) =1mol× (2.5×8.3145J·K-1·mol-1)×(218.4K- 273K)= -1135J G= H - (TS) =H - [T2 S -+ (T2-T1)S1] = -1135 J - [218.4K×1.125J·K-1 +(218.4K - 273K)×100J·K-1] = 4079 J 过程为非恒温过程,不能用G来判断过程的方向。
例2: 苯在正常沸点353K时摩尔汽化焓为30.75kJmol-1,今将353K,101.325kPa下的1mol液态苯向真空定温蒸发变为同温同压的苯蒸气(设为理想气体). (1)求此过程的Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。 (2)应用有关原理,判断此过程是否为不可逆过程.