药物毒理学生物药物安全性评价合集.ppt
- 格式:ppt
- 大小:747.50 KB
- 文档页数:38

动物药学专业的药物毒理学与安全性评价动物药学专业的药物毒理学与安全性评价是该领域中一个重要的研究方向,涵盖了药物对动物体内产生的毒性作用以及评估药物在动物体内的安全性。
通过深入了解药物毒理学和安全性评价,可以为药物研发和临床应用提供重要的依据和指导。
一、药物毒理学药物毒理学是研究药物对生物体产生的毒性作用的学科。
在动物药学专业中,药物毒理学起到了至关重要的作用。
通过研究药物的毒理学特性,可以评估药物的安全性和潜在的副作用。
1.1 急性毒性急性毒性是指药物短期使用下对动物或人体产生的毒性作用。
通过实验观察动物在短时间内接受药物后的生理和行为变化,可以初步评估药物的急性毒性水平。
1.2 慢性毒性慢性毒性是指药物长期使用或连续暴露下对动物或人体产生的毒性作用。
通过长期观察动物在接受药物后的生理和行为变化,可以评估药物的慢性毒性水平,判断药物是否对机体产生积累性毒性作用。
1.3 体外毒理学评价体外毒理学评价是指在体外(如细胞培养、酶活性测定等)进行的对药物毒理学性质的评估。
通过体外实验可以初步了解药物对细胞和分子水平的毒性作用,并为进一步的动物实验提供依据。
二、药物安全性评价药物安全性评价是对药物在动物体内引起安全问题的评估和监测,旨在保证药物的安全使用。
药物安全性评价主要涉及药物的毒性、耐受性、代谢动力学和毒理动力学等方面。
2.1 毒性学评价毒性学评价是对药物毒性作用的定性和定量分析。
通过临床实验和动物实验,可以评估药物对心血管、肝脏、肾脏等重要器官的毒性影响。
2.2 耐受性评价药物耐受性评价是对动物或人体对药物的耐受性进行定性和定量评估。
通过观察动物在长期使用药物后的生理和行为变化,可以评估药物对机体的耐受程度。
2.3 代谢动力学评价药物代谢动力学评价是对药物在体内代谢过程和代谢产物进行研究。
了解药物在动物体内的代谢途径、消除速率和代谢产物有助于判断药物的安全性和潜在毒性。
2.4 毒理动力学评价药物毒理动力学评价是对药物在体内的分布和消除过程进行研究。

药理毒理批
“药理毒理批”是指对新药进行药理毒理学评价的过程中,专家们对新药的药效、安全性、毒性等方面的评价和讨论。
药理毒理学评价是新药研发的重要环节,通过对药物的药理作用、作用机制、安全性、副作用等方面的研究,为药物的上市提供科学依据。
在新药的研发过程中,药理毒理批主要有以下几个方面:
1. 药效学评价:研究药物对生物体的作用及其作用机制,评价药物的疗效和治疗窗口。
2. 药代动力学评价:研究药物在生物体内的吸收、分布、代谢、排泄等过程,为药物的剂量、给药途径和治疗方案提供依据。
3. 安全性评价:通过对药物的急性毒性、亚慢性毒性、慢性毒性、生殖毒性、致癌性等方面的研究,评估药物在临床使用过程中的安全性。
4. 副作用评价:研究药物在治疗剂量下可能产生的不良反应,以便在临床使用时提醒医生和患者注意。
5. 药物相互作用评价:研究药物在体内与其他药物同时使用时可能产生的相互作用,以避免药物组合使用可能导致的不良后果。
药理毒理批的目的是确保新药在上市后能为患者提供
有效、安全、经济的治疗选择。
通过药理毒理学评价,可以发现药物在临床使用过程中可能存在的问题,并为药物的改进提供依据。
同时,药理毒理批也有助于提高药物研发的效率,缩短药物上市时间。


第一章总论1、毒理学:是一门实验性科学,研究毒物对机体有害作用发生发展的特征和机制、最终结果及其危险因素,主要用与外源性物质对机体损伤作用的本质,相关安全性评价和危险性评估。
2、早期毒理学:研究不同毒物的使用、着重毒物对机体的急性危害或致死作用。
3、现代毒理学:是一门研究在特定情况下,机体接触化学、生物或物理物质后呈现有有害作用的科学。
4、药物毒理学:是一门研究药物对机体有害作用及其规律的科学。
5、有毒:指物质具有产生一种未预料或有害于健康作用的特征。
6、毒性:指物质对机体产生的任何有毒作用。
7、只有被药物造成损害的部位,才是药物作用的(靶部位),被损伤的组织器官称为(毒性靶组织),(毒性靶器官)8、直接毒性作用药物必须到达损伤部位简介毒性作用则可能是药物首先改变了机体某些调节功能继而影响其他部位。
9、毒理学研究通常可分为:1、描述毒理学2、机制毒理学3、应用毒理学10、毒理学研究内涵:1)验证梨花或生物因素对机体有害作用的本质2)评价特殊染毒情况下毒性出现的可能性。
11、药物毒理学的基本目的:是认识并掌握某种药物的毒性作用,为临床安全用药提供科学依据,避免或减轻用药过程中的有毒作用的发生。
12、毒物:通常指人工制造的毒性物质。
13、毒素:一般指天然存在的毒性物质。
14、毒物可根据(靶器官)、(用途)、(来源)及(毒性作用)来分类。
15、最小中毒量:在临床常用剂量下,药物不赢出现毒性效应,只有超过了一定的阈值,才会出现的药物毒性作用。
16、从临床应用角度可将药物毒性作用分为哪几种?答:1、变态反应2、毒性反应3、致癌性 4 生殖毒性和发育毒性5、致突变与遗传毒性6、特异质反应17、毒性反应在治疗过程中给药后不久出现的,称为速发型毒性作用。
18、毒性作用在给药后很久才出现,称为迟发型毒性作用。
19、药物的毒性作用在停药或减量后可逐渐减轻或消失,称为可逆性毒性效应。
20、毒性作用一旦出现就不可逆转,成为不可逆毒性效应。


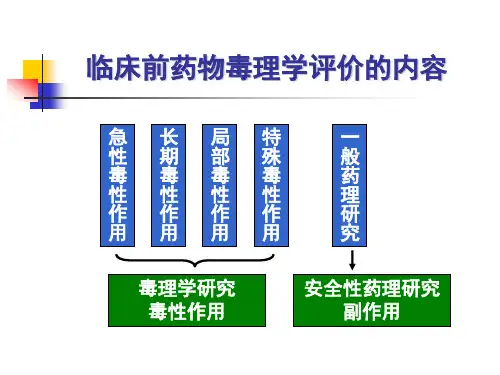


药物毒理学和安全性评价研究药物毒理学是药物安全性评价的重要组成部分。
毒理学研究的目的是确定药物对人体的有害作用,包括毒性反应、副作用、毒性代谢等方面。
随着临床试验、药物研发的不断推进,药物的毒理学安全性评价越来越受到重视。
本文将从药物毒理学和安全性评价的角度出发,探讨相关的研究进展及其意义。
一、药物毒理学研究药物毒理学是一门综合学科,需要多个领域的知识支撑。
药物的毒性反应可能涉及到药物的化学成分、药理学效应、生物代谢、免疫学反应、遗传学和环境因素等多方面的因素。
毒理学研究的主要任务是确定药物毒性发生的机制、药物对组织器官的损伤及其程度以及损伤的可逆性等方面的问题。
现代毒理学研究主要包括预测、识别、监测和评价药物的毒性反应。
预测研究主要是通过计算机模拟、结构分析、基因芯片等技术手段预测药物分子的毒性作用。
识别研究主要是通过体内毒性试验及中毒症状的检测,来识别药物毒性的发生及病理学改变的种类和程度。
监测研究主要是通过分析、评价、监测药物对体内排泄、代谢的影响,发现药物在体内相应的代谢产物的产生与消除的情况。
评价研究主要是对药物毒性及药物毒性机理进行评价。
二、药物安全性评价药物安全性评价是为了保证药物的安全使用,在药物上市后的生命周期内对药物的安全性进行监测、评价和管理。
药物上市后的安全性评价包括不良反应监测、药物风险评估、安全性信号监测等方面的内容。
药物不良反应监测是通过收集、统计、分析药物使用过程中发生的不良反应,评估这些不良反应的严重程度和频率,并提供相关的预防措施和处理措施。
药物风险评估是为了评估药物使用过程中可能产生的风险和危险,包括潜在药物风险的识别、评价、预测其严重程度,以及制定和实施相应的预防和治疗措施。
安全性信号监测是指对药物安全性问题的监控。
药物安全性评价是药物研究中的一个非常重要的环节,可以为药物研发提供重要的参考和指导。
临床试验过程中,药物的毒性作用和安全性评价是决定药物是否能够上市的重要因素之一。


生物药物的质量控制与安全性评价作为一种全新的、高效的治疗手段,生物药物已经被广泛应用于多种疾病的治疗中,包括癌症、风湿病、糖尿病等多种疾病。
随着生物药物的应用越来越广泛,越来越多的人开始关心生物药物的质量控制与安全性评价问题。
生物药物的质量控制生物药物的质量控制是指对生物药物的研制、生产、贮存、运输等全过程进行监管,保证生物药物的安全性、有效性和一致性等方面的质量指标符合国家和国际标准的要求。
生物药物的质量控制有以下几个方面:1. 原材料的选择和采购。
原材料的品质直接影响到生物药物的质量。
生产厂家应该严格选择原材料供应商,确保原材料质量达到标准,选择适于自己产品的原材料。
2. 生产工艺的控制。
生产工艺的控制是生物药物质量控制的核心。
生产过程中需要对每一步操作进行控制,确保生物药物的质量符合标准要求。
3. 产品检验的全面性。
对生物药物进行的检验应该从物理、化学、生物学和毒理学等多个方面进行,确保生物药物的质量符合标准要求,进而保证生物药物的安全性和有效性。
生物药物的安全性评价生物药物的安全性评价是指对生物药物的毒性、免疫原性、致突变性、致癌性等方面进行评价,从而保证生物药物的安全性符合国家和国际标准的要求。
生物药物的安全性评价主要有以下几个方面:1. 严格的安全评价体系。
建立自己的生物药物安全评价体系,确保生物药物安全评价的全面性和有效性。
2. 严格的安全性评价标准。
生产厂家需要对自己的生物药物严格制定安全性评价标准,保证生物药物的安全性符合标准要求。
3. 严格的安全性评价方法和流程。
生产厂家需要结合自身生产和研发情况,选择适合自己产品的安全性评价方法和流程,确保评价结果科学可靠。
结语生物药物的质量控制与安全性评价是生物药物研发、生产和应用过程中不可避免的环节,这一环节的健全与完善关系到生物药物的质量和安全,关系到病患的治疗效果和健康。
只有科学、严格的质量控制和安全性评价,才能保证生物药物的安全有效使用,为人类的健康贡献更大的力量。