滚动小专题(二)溶解度和溶质的质量分数.ppt
- 格式:ppt
- 大小:3.77 MB
- 文档页数:18


溶解度、溶质质量分数知识点复习一、溶液二、1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。
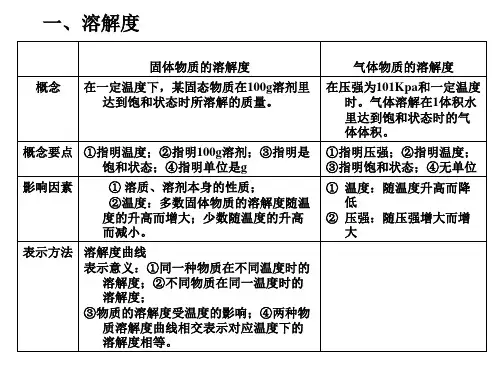
2,溶液的特征(1)均一性(2)稳定性三、二、、饱和溶液与不饱和溶液四、1、概念:五、(1)饱和溶液:六、(2)不饱和溶液:七、2、饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,当温度、溶剂的量发生改变时,两者之间可以相互转化:不饱和溶液饱和溶液三、固体物质的溶解度以及溶解度曲线四、1、概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
2、表达式:溶解度=溶质质量/溶剂质量*1003、3、影响固体溶解度大小的因素(1)溶质、溶剂本身的性质(2)温度4、物质的溶解性跟溶解度的关系溶解度是物质溶解性的量度5、溶解度曲线(1)溶解度曲线的意义:①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时溶液必定是饱和溶液③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。
在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液。
(2)溶解度曲线变化的规律:大多数固体物质的溶解度随温度的升高而增大,如硝酸钾;少数固体物质的溶解度受温度的影响较小,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,如熟石灰。
四、溶质质量分数(1)概念:(2)表示方法:(3)溶解度与溶质质量分数的比较在饱和溶液中:溶质质量分数=溶解度/(100g+溶解度)*100%五、结晶的方法:六、(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
适用范围:溶解度受温度变化影响不大的物质,如氯化钠。