金红石型TiO2光催化性能初步研究
- 格式:doc
- 大小:1.12 MB
- 文档页数:7

TiO2光催化剂的制备及其光催化性能研究梁健;梁耀龙;唐奇;张缇【摘要】以钛酸四丁酯、乙醇为原料,通过溶胶—凝胶法制备了TiO2纳米粉体,并采用XRD、TEM等手段对样品进行结构表征.XRD结果表明,TiO2纳米粉体晶相为锐钛矿型,平均粒径大约为6-12nm.样品对甲基橙溶液进行了降解实验,实验结果显示,TiO2纳米粉体对甲基橙的光催化作用明显.最佳制备工艺条件为:钛酸丁酯与乙醇的体积比为1∶11,在pH值为2-3下,搅拌2小时,在500℃下煅烧.【期刊名称】《中国陶瓷工业》【年(卷),期】2014(021)002【总页数】5页(P1-5)【关键词】TiO2;光催化剂;溶胶-凝胶法;甲基橙溶液【作者】梁健;梁耀龙;唐奇;张缇【作者单位】景德镇陶瓷学院,江西景德镇333001;欧神诺陶瓷有限公司,广东佛山528000;欧神诺陶瓷有限公司,广东佛山528000;欧神诺陶瓷有限公司,广东佛山528000【正文语种】中文【中图分类】TQ175.9自1972年Fujishima和Honda报道了在光电池中光辐射TiO2可持续发生氧化还原反应后,TiO2在研究领域和工业生产上的潜在应用引起了越来越广泛的关注。
1985年日本的Tadashi等首先报道TiO2在紫外灯照射下具有杀菌作用,1998年日本东京大学先进科学技术研究中心Kayano等人发表了二氧化钛薄膜光催化剂抗菌和解毒作用的研究论文。
证实了二氧化钛光催化剂不仅可以杀死细菌,而且可以彻底将细菌的残骸分解,避免了细菌残骸分解出的内毒素对人类的二次毒害。
自此,由于TiO2光催化技术在降解有机物及消毒杀菌方面表现出极大的技术优势近年来引起了人们广泛的兴趣。
光催化氧化技术具有反应条件温和、能耗低、操作简便、可减少二次污染及可用太阳光为反应光源等突出特点,能有效降解几乎所有的有机污染物,并最终生成H2O、CO2等无机小分子,显示出在环保领域广阔的应用前景。
光催化反应指在有光参与的情况下,发生在催化剂及其表面吸附物(如H2O、O2分子和被分解物等)多相之间的光化学反应。

《高效TiO2的制备及其光催化性能的研究》摘要:本文针对TiO2的光催化性能进行深入研究,通过制备高效TiO2材料,探讨其制备工艺、结构特性及光催化性能。
通过实验对比,验证了所制备的TiO2材料在光催化领域的应用潜力。
一、引言TiO2作为一种重要的光催化材料,在环保、能源、医疗等领域具有广泛的应用前景。
然而,传统的TiO2制备方法往往存在效率低下、成本较高、性能不稳定等问题。
因此,探索高效、低成本的TiO2制备方法,并研究其光催化性能,对于推动光催化技术的发展具有重要意义。
二、TiO2的制备方法1. 原料选择与预处理:本实验选用高纯度的钛源(如钛酸四丁酯)作为起始原料,通过溶剂法进行溶解和预处理。
2. 制备工艺:采用溶胶-凝胶法结合热处理工艺,通过控制反应温度、时间及热处理条件,制备出具有不同晶型(如锐钛矿型、金红石型)的TiO2。
三、TiO2的结构特性与表征1. 结构分析:通过X射线衍射(XRD)对所制备的TiO2进行晶型分析,确定其晶体结构。
2. 形貌观察:利用扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察TiO2的形貌和粒径大小。
3. 光吸收性能:通过紫外-可见光谱分析TiO2的光吸收性能,探究其光响应范围。
四、光催化性能研究1. 实验设置:以有机污染物(如染料废水)为研究对象,评估所制备TiO2的光催化降解性能。
2. 性能对比:通过对比实验,探讨所制备TiO2与市售TiO2的光催化性能差异。
3. 反应机理:结合实验数据和文献资料,分析TiO2的光催化反应机理及影响因素。
五、结果与讨论1. 结构特性:所制备的TiO2具有较高的结晶度和良好的形貌。
其中,锐钛矿型TiO2表现出较高的光催化活性。
2. 光催化性能:实验结果显示,所制备的TiO2在可见光照射下对有机污染物具有较高的降解效率。
与市售TiO2相比,所制备的TiO2表现出更高的光催化活性、更快的反应速率和更长的使用寿命。
3. 影响因素:本实验还探讨了反应温度、pH值、催化剂用量等对光催化性能的影响,为进一步优化实验参数提供依据。

纳米TiO2材料的制备及其光催化性能研究随着经济的发展,人们生活水平的提高,人们逐渐意识到可持续发展的重要。
环境问题已严重影响现代文明的发展,有机污染物具有持久性的特点而长期威胁人类健康,开发和设计仅利用太阳能即可完成对有机污染物降解的新材料将会是解决环境问题的有效方法之一。
纳米TiO2作为一种光催化材料,具有优异的物理和化学性质,因而被广泛应用和重点研究。
本文就纳米TiO2材料的制备及其光催化性能展开探讨。
标签:纳米TiO2;光催化;制备方法;光催化效能引言半导体光催化技术是解决环境污染与能源短缺等问题的有效途径之一。
以二氧化钛为代表的光催化剂在染料敏化太阳能电池、锂离子电池、光伏器件以及光催化领域表现出明显的使用优势.但是TiO2本身的弱可见光吸收、低电导率、高载流子复合速率限制了其在工业生产中的进一步使用。
科技工作者一般通过掺杂、半导体复合、燃料敏化、表界面性质改性等方法提高TiO2的光电化学性能,使其能在生产实践中广泛应用。
1、TiO2材料简介TiO2在自然界中的主要存在形态为金红石、锐钛矿和板钛矿三种晶型,其中金红石是TiO2的高温相,锐钛矿和板钛矿两种形态是TiO2的低温相。
在三种晶型中光催化活性最好的为锐钛矿型TiO2。
锐钛矿型TiO2的禁带宽度为3.2eV 与之对应的激发波长为387nm。
所以,TiO2作为光催化剂在紫外光条件下具有催化活性,在可见光下一般没有活性。
只有对它的结构进行改性,使它的禁带宽度得以缩小,才可以实现材料在可见光条件下的催化降解反应。
改性的方式目前主要有以下几种方法:通过改变晶体内部结构来改变催化剂禁带宽度的离子掺杂方法,通过形成异质结改变能带结构的半导体复合法,提高催化剂对光的吸收能力的表面光敏化法,增大催化剂比表面积使晶粒细化的负载载体法等。
光催化材料中电子e一和空穴h十的浓度会影响有机物的降解速度。
粒径的减小能够使表面原子增加,使光催化剂吸收光的效率显著提高,使其表面e一和h十的浓度增大,从而提高光催化剂的催化活性。


不同晶型的纳米TiO2粉体的低温制备及光催化性能纳米TiO2作为一种新型的无机半导体材料, 具有独特的物理和化学特性, 主要用于光催化剂和太阳能转化等领域。
而纳米TiO2粉体以其比表面积大、表面能及表面结合力大, 表面活性中心多的特点, 应用较为广泛。
其粉体的分离和回收较困难, 不利于催化剂的再生和再利用, 可以通过TiO2催化剂的固定化, 寻找合适的载体, 将粉体制成薄膜等方法解决。
一般而言, 在自然界中TiO2主要以锐钛矿型、金红石型和板钛矿型三种形式存在, 前两种晶型可以通过合成的方法制备, 而板钛矿型主要是天然存在的晶型。
在稳定性方面, 锐钛矿和板钛矿型TiO2是亚稳态相, 在一定的条件下可以转变为金红石型, 锐钛矿型TiO2在热处理温度高于550℃时开始向金红石型转变。
由于晶型的不同, 它们表现出的物理、化学性质也不一样, 金红石型TiO2具有很强的散射和吸收紫外线能力, 锐钛矿型TiO2则具有很好的光催化活性。
目前,制备纳米TiO2的方法主要有物理法和化学法, 通过物理方法可以制得分散性好, 粒径符合要求并且纯度较好的纳米TiO2, 但由于该方法要求设备较复杂、成本较高, 很少在实验室中采用。
化学法制备又可以分为气相法和液相法, 较常采用的有沉淀法、水热法、溶胶- 凝胶法和微乳液法。
本试验以廉价的TiCl4为前驱体, 采用反应条件易控制的水解法来制备纳米TiO2, 并通过控制反应条件制备不同晶型的纳米TiO2。
1 试验方法1.1 纳米TiO2粉体的制备本试验采用TiCl4直接水解法制备不同晶型的纳米TiO2。
制备锐钛矿型TiO2时, 以TiCl4为前驱体, 在冰水浴( 本试验采用纯冰块) 的条件下, 将一定量的TiCl4溶液缓慢滴入蒸馏水中, 并不断的搅拌直到冰块完全溶解为止, 之后将浓硫酸滴加到所得的TiCl4水溶液中, 充分搅拌, 整个混合过程中溶液的温度应控制在0 ℃以下, 溶液中TiCl4的浓度为1 mol/L, 浓硫酸与TiCl4的摩尔比为1∶20。

毕业设计(论文)纳米二氧化钛的制备与光催化性能研究1 绪论二氧化钛,化学式为TiO2,俗称钛白粉,多用于光触媒、化妆品,能靠紫外线消毒及杀菌,现正广泛开发,将来有机会成为新工业。
二氧化钛可由金红石用酸分解提取,或由四氯化钛分解得到。
二氧化钛性质稳定,大量用作油漆中的白色颜料,它具有良好的遮盖能力,和铅白相似,但不像铅白会变黑[1];它又具有锌白一样的持久性。
二氧化钛还用作搪瓷的消光剂,可以产生一种很光亮的、硬而耐酸的搪瓷釉罩面。
在过去的研究中,用半导体粉末对水、油和空气中的有毒有机化合物进行光催化降解和完全矿化引起了人们的大量关注。
由于抗光腐蚀性,化学稳定性,成本低,无毒和强氧化性,二氧化钛被作为应用最广泛的光催化剂来光降解水和空气中的有毒化合物。
但是二氧化钛具有较大的带隙(锐钛矿相二氧化钛为3.20ev)因此,只有较小一段太阳光区域,大约为2%~3%紫外光区可被应用[2]。
人们尝试用各种制备方法,如贵金属掺杂、氧化物复合、表面修饰等等方法,防止和减少电子与空穴的复合,提高催化剂的光催化活性。
众所周知,吸附和催化的效率与固体的孔径及表面积有关,因此,对二氧化钛进行修饰、改性及增大比表面积是提高光量子效率和增大反应速率的一个有效的方法与途径。
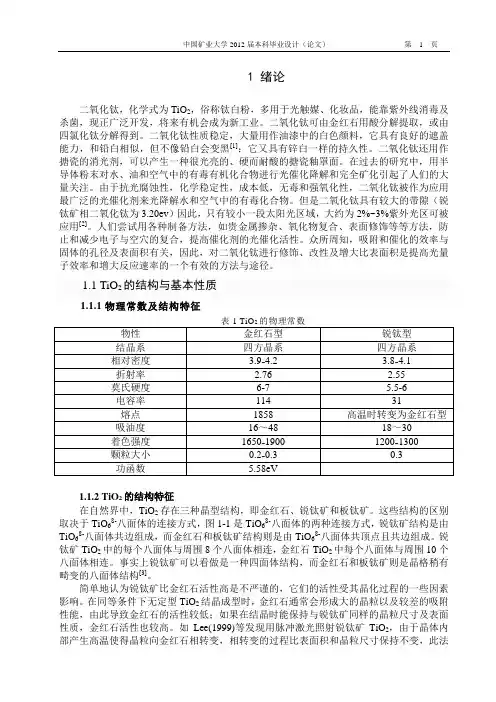
1.1 TiO2的结构与基本性质1.1.1物理常数及结构特征表1 TiO的物理常数1.1.2 TiO2的结构特征在自然界中,TiO2存在三种晶型结构,即金红石、锐钛矿和板钛矿。
这些结构的区别取决于TiO68-八面体的连接方式,图1-1是TiO68-八面体的两种连接方式,锐钛矿结构是由TiO68-八面体共边组成,而金红石和板钛矿结构则是由TiO68-八面体共顶点且共边组成。
锐钛矿TiO2中的每个八面体与周围8个八面体相连,金红石TiO2中每个八面体与周围10个八面体相连。
事实上锐钛矿可以看做是一种四面体结构,而金红石和板钛矿则是晶格稍有畸变的八面体结构[3]。
简单地认为锐钛矿比金红石活性高是不严谨的,它们的活性受其晶化过程的一些因素影响。


金红石型二氧化钛晶体结构引言:金红石型二氧化钛是一种具有重要应用价值的晶体结构,其独特的结构和性质使其在光电子学、能源储存和催化等领域发挥着重要作用。
本文将详细介绍金红石型二氧化钛的晶体结构、性质及其应用。
一、晶体结构金红石型二氧化钛的晶体结构属于立方晶系,空间群为P42/mnm。
其晶胞参数为a=b=4.593 Å,c=2.958 Å。
晶胞中含有8个Ti原子和16个O原子,Ti原子位于晶胞的(1/4,1/4,0)和(3/4,3/4,0)位置,O原子位于晶胞的(1/2,1/2,0)和(0,0,1/2)位置。
二、性质特点金红石型二氧化钛具有许多独特的性质,使其成为研究的热点之一。
1. 光学性质金红石型二氧化钛是一种具有较大能隙的半导体材料,其带隙约为3.0 eV。
它对紫外光的吸收较强,而对可见光和红外光的吸收较弱,因此具有较高的透明度和折射率。
2. 电学性质金红石型二氧化钛具有优异的电学性质,具有较高的电导率和较低的介电常数。
在光电子器件和太阳能电池中广泛应用。
3. 热学性质金红石型二氧化钛的热稳定性较好,具有较高的熔点和热导率。
在高温条件下,仍能保持较好的结构稳定性。
4. 催化性能金红石型二氧化钛具有优异的催化性能,可用于光催化、电催化和热催化等领域。
其特殊的晶体结构和电子结构使其具有较高的催化活性和选择性。
三、应用领域金红石型二氧化钛由于其独特的结构和性质,被广泛应用于各个领域。
1. 光电子学金红石型二氧化钛作为光电子器件的重要材料,可用于制备太阳能电池、光电探测器和光纤通信器件等。
其良好的光学性能和电学性能使其在光电子学领域具有广阔的应用前景。
2. 能源储存金红石型二氧化钛作为电池和超级电容器的电极材料,具有较高的电导率和较低的电极电阻,能够提高能量存储和释放效率。
因此,在能源储存领域具有巨大的应用潜力。
3. 催化剂金红石型二氧化钛作为催化剂,可用于光催化、电催化和热催化等反应中。
1 绪论二氧化钛,化学式为TiO2,俗称钛白粉,多用于光触媒、化妆品,能靠紫外线消毒及杀菌,现正广泛开发,将来有机会成为新工业。
二氧化钛可由金红石用酸分解提取,或由四氯化钛分解得到。
二氧化钛性质稳定,大量用作油漆中的白色颜料,它具有良好的遮盖能力,和铅白相似,但不像铅白会变黑[1];它又具有锌白一样的持久性。
二氧化钛还用作搪瓷的消光剂,可以产生一种很光亮的、硬而耐酸的搪瓷釉罩面。
在过去的研究中,用半导体粉末对水、油和空气中的有毒有机化合物进行光催化降解和完全矿化引起了人们的大量关注。
由于抗光腐蚀性,化学稳定性,成本低,无毒和强氧化性,二氧化钛被作为应用最广泛的光催化剂来光降解水和空气中的有毒化合物。
但是二氧化钛具有较大的带隙(锐钛矿相二氧化钛为3.20ev)因此,只有较小一段太阳光区域,大约为2%~3%紫外光区可被应用[2]。
人们尝试用各种制备方法,如贵金属掺杂、氧化物复合、表面修饰等等方法,防止和减少电子与空穴的复合,提高催化剂的光催化活性。
众所周知,吸附和催化的效率与固体的孔径及表面积有关,因此,对二氧化钛进行修饰、改性及增大比表面积是提高光量子效率和增大反应速率的一个有效的方法与途径。
1.1 TiO2的结构与基本性质1.1.1物理常数及结构特征1.1.2 TiO2的结构特征在自然界中,TiO2存在三种晶型结构,即金红石、锐钛矿和板钛矿。
这些结构的区别取决于TiO68-八面体的连接方式,图1-1是TiO68-八面体的两种连接方式,锐钛矿结构是由TiO68-八面体共边组成,而金红石和板钛矿结构则是由TiO68-八面体共顶点且共边组成。
锐钛矿TiO2中的每个八面体与周围8个八面体相连,金红石TiO2中每个八面体与周围10个八面体相连。
事实上锐钛矿可以看做是一种四面体结构,而金红石和板钛矿则是晶格稍有畸变的八面体结构[3]。
简单地认为锐钛矿比金红石活性高是不严谨的,它们的活性受其晶化过程的一些因素影响。

水解制备金红石型二氧化钛纳米晶及抗紫外的性能一、实验原理:本实验在升温水解时,采用80℃是时加入晶种,在TiCl4水溶液中立即分散形成均匀的纳米分散体——活性晶核。
一纳米活性晶核为引发剂,快速形成更多的活性晶核,在逐渐升温过程中,溶液中[H]+在瞬间中和[Ti n O4n]4n-钛-氧络阴离子,而促成水解初期亚稳态锐钛型微晶体,向稳定的金红石型微晶的转化。
在一定钛浓度条件下,转化过程需要适当时间,才会完成晶型转化过程。
加入预先制备好的纳米晶种,加快了这个转化过程,随着时间的延续,完成了TiCl4水溶液水解的晶种过程,从亚稳定锐钛矿型,锐钛矿型,与金红石混合型,金红石型晶型的转化。
锐钛矿具较好的光催化性,金红石有较好的抗紫外性能。
二、实验仪器及药品:B5-24恒温磁力搅拌器、MYB型可调温电加热套、锥形瓶、三口烧瓶、温度计、DJ1-90 电动搅拌器、冷凝管、烧瓶、量筒、紫外分析仪TiCl4溶液、去离子水、分散剂三、实验步骤:1、晶种制备:取10ml TiCl4溶液加入锥形瓶中;用量筒取40ml去离子水,滴入2-3滴分散剂,摇匀后加入上述锥形瓶中。
磁力搅拌下升温至90℃,停止加热自来水快速冷却。
2、TiCl4水解:在三口烧瓶中加入100mlTiCl4溶液,缓慢加热60min内升至80。
加入25ml晶种继续升温至106℃,加入100ml沸水恒温1.5小时。
3、紫外分析:取1ml反应后混合物稀释至100ml。
加入一滴分散剂,混合均匀后取5ml进行紫外分析。
四、实验记录:晶种制备时,加热10min左右,呈很淡的蓝色,大约80℃,迅速冷却,蓝色加深且在光下呈红色。
五、实验结果:紫外谱图上204nm处有一波峰,338nm处有一波谷,紫外光在400nm以内,说明TiO2具有吸收紫外线的功能,及本实验制备出TiO2。
防晒剂的制备:金红石型制备(外加晶种水解)浆料去母液,得滤饼加水成浆加硅酸纳、Al、Zn 包Si/Al/Zn的纳米金红石型TiO2分散打浆测定钛含量在1升的带回流的玻璃三口烧瓶中加入300ml二氧化钛含量在1.1mol/L试剂TiCl4水溶液,在搅拌下慢慢升温,至80℃时加入金红石型纳米晶种20毫升水解,继续升温至106℃,水解时间大约1.5小时,得到纳米金红石型二氧化钛含酸浆料。

金红石二氧化钛纳米片的性质及其光催化活性赵丹丹;于彦龙;高东子;曹亚安【摘要】采用溶胶-凝胶、质子交换和层状剥离的方法,制备出金红石TiO2纳米片.利用X射线电子衍射谱(XRD)、透射电子显微镜(TEM)、紫外-可见吸收光谱(UV-Vis)、X光电子能谱(xPS)的价带谱和荧光光谱(PL)等对样品进行了表征,研究了光生载流子的转移过程.结果证明:金红石TiO2纳米片具有较大的比表面积(185.7m2/g),厚度约5 nm,与金红石TiO2样品相比,金红石TiO2纳米片的禁带宽度增加,氧化还原能力增强;此外,纳米片结构能够促使光生载流子快速转移到纳米片的表面并产生有效分离,阻止了光生电子和空穴的复合,提高了光催化反应中光生载流子的利用率.金红石纳米片的这些特性导致其具有较高的光催化活性,紫外光催化降解对氯苯酚的实验表明:金红石TiO2纳米片的光催化活性高于金红石TiO2和锐钛矿TiO2样品.【期刊名称】《无机材料学报》【年(卷),期】2016(031)001【总页数】6页(P1-6)【关键词】金红石TiO2纳米片;比表面积;能带结构;光生载流子;光催化活性【作者】赵丹丹;于彦龙;高东子;曹亚安【作者单位】南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457;南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457;南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457;南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457【正文语种】中文【中图分类】O643;O644低维结构TiO2具有维度低、化学稳定性好和氧化还原能力强等特点, 近年来被广泛应用于光催化、太阳能电池和纳米器件等领域[1-13]。
Adachi等[2]合成了锐钛矿纳米管, 并研究了其光催化活性; Quan等[6]报道了改性的锐钛矿纳米管, 具有良好的光电协同催化能力; Zhang等[7]制备了一种高度有序的锐钛矿纳米管阵列电极, 有效地提高了电极光电协同催化活性; Macak等[8]合成了金红石锐钛矿混合的纳米管, 大大提高了TiO2光催化降解有机物的性能。
TiO2光催化剂掺氮TiO2光催化剂的制备、结构表征与光催化性能研究姓名: 罗志勇学号: 20042401143 同组成员:潘曼、徐志锴实验时间:4月18日1、引言由于在太阳能转换和环境净化方面具有巨大的应用价值,光催化反应近年来受到广泛的关注。
TiO2由于具有强氧化能力、化学性能稳定和价格低廉等优点,所以被认为是最具有实用化前景的光催化剂。
但是,作为一种n型半导体,其较大的带隙能(金红石型3.03eV,锐钛矿型3.2eV)使得只有387nm以下的紫外光才能有效激发其价带电子跃迁到导带,所以对太阳能的利用率仅仅为3%-5%,这制约了该项技术在实际工程中的应用。
为了扩展Ti02的响应波长以利用太阳光,早期人们探索了以金属元素、金属氧化物掺杂或复合改性TiO2光催化剂,并取得了有意义的进展;但是金属元素掺杂常常会具有热不稳定性、容易成为载流子复合中心等缺点。
2001年Asahi等首次通过理论计算证明以非金属元素掺杂改性的可行性。
掺杂使得TiO2具有可见光催化活性,需满足下列要求:(1)掺杂应该在Ti02带隙中形成能够吸收可见光的能级;(2)导带最小能级,包括杂质能级,应高于TiO2导带最小能级或高于H2/H2O电位以保证其光还原活性;(3)形成的带隙能级应该与TiO2能级有足够的重叠,以保证光激发载流子在其寿命内传递到达催化剂表面的活性位置。
合成掺氮纳米二氧化钛的方法主要有溅射发、高温焙烧法、钛醇盐水解法、机械化学法、加热含Ti、N的有机前驱体法和溶胶凝胶法等。
溅射法需要在真空下电离惰性气体形成等离子体,离子在靶偏压作用下轰击靶材,利用改变惰性气体成分和靶的材料就可以得到含氮量不同的掺氮二氧化钛薄膜。
而高温焙烧法则是利用二氧化钛或其前驱物在含N气氛中焙烧,通过调节焙烧温度和气相中N的含量来制备不同比例的掺氮二氧化钛。
机械化学法是利用各种强度较大的机械作用力使得物质的物理化学性质发生改变,从而使其与周围物质发生反应,借此得到掺氮二氧化钛。
金红石型TiO2-CNTs复合粉体的制备与光催化性能初步研究 摘要:利用微波等离子体反应装置,以廉价的钛铁矿为原料,制备金红石型TiO2-CNTs复合粉体。并研究在不同反应条件下该产物对甲基橙的光催化降解效率。结果表明了纳米碳管的结构和含量对光催化效率有较强的影响。 关键词:微波等离子体;钛铁矿;碳纳米管;二氧化钛;光催化 0 引言
在水体、土壤和大气环境中存在许多有机污染物,这些只有少量有机污染物能通过水体和大气环境自行降解,其中大多数是有害有毒,一直威胁着人类。工业上处理有机污染物的常见方法有化学法、吸附法和沉淀法。1972年,Akira Fujishima等[1]在N-型半导体电极上发现水在光波辐射下可发生氧化还原反应分解为H2和O2。从此,人们对光催化氧化技术改性技术研究一直没有停止,特别是光催化氧化,操作方便,反应条件温和,光催化活性好,耐光腐蚀能力强等突出特点,因而在水处理技术中具有广阔的应用前景。 关于光催化氧化机理也有深入研究。在污染水中加入一定量的光敏半导体材料(本实验为),通过具有一定能量的光照射,光敏半导体材料即被光激发出电子-空穴对,吸附在光敏半导体表面的溶解氧水及污染物分子接受光生电子或空穴,从而发生一系列氧化还原反应,使污染物降解为小分子、CO2、H2O[2],从而达到被分解的目的。反应过程如下: TiO2+hv→h++e- ① h++e-→hv ② e-+O2→O2- ③ h++H2O→H++-OH h++OH-→-OH ④ 具体来说,当为催化剂光催化氧化污染物时,每一颗半导体微粒吸附污染物后,如同一颗短路的微型电池。在紫外光照射下,被激发出e-和空穴h+,形成电子空穴对(①),而过氧离子O2-(③)由吸附在TiO2颗粒表面的O2俘获电子形成,并阻止电子与空穴的复合(②)。另外,空穴结合H2O和OH-发生氧化反应 生成氢氧自由基-OH(④)。游离的O2-和-OH表现出强烈的化学活性,与化合物相结合,生成CO2和H2O,故而达到降解污染物的目的[3]。 纳米固体中的原子排列是一种介于固体和分子间的亚稳中间态物质。具有小尺寸效应、量子效应、表面效应等一系列纳米特性。从而具有独特的光、电、磁和化学特性。因此,具有更高的量子产率[4-5]和良好的光催化性能。 二氧化钛的三种型态中,锐钛矿光催化效率最高,金红石次之,如何提高金红石相二氧化钛光催化效率已成为近年来科研工作者的研究热点[6-11]。Yawen Wang[6]采用气相法制备出金红石纳米棒,研究发现其优异的光催化性能是由于金红石纳米棒具有窄禁带宽度、大比表面积和较高的结晶度等特性。李璐[7]研究了天然金红石光催化苯酚的性能,发现其在日光条件下光催化性能略低于P25型TiO2,通过X射线发现晶格中的V、Fe等杂质可能是提高其可见光催化活性的主要原因。R. Poblete[7]以钛铁矿为原料,用酸侵蚀的方法制备出铁和TiO2的复合粉体,发现Fe在TiO2晶格中以三价形式形成一些含氧活性基团(FeOOH),该基团可以有效地提高光催化性能。罗永松[9]采用溶胶凝胶法制备了不同型态TiO2/纳米碳管复合粉体,并研究了其光催化性能,发现当制备出金红石-短纳米碳管后,在TiO2外表面及和短纳米碳管接触的内表面形成一层耗尽层,在内外皆产生电子空穴对,其光催化性能优于纯锐钛矿。基于他人的研究,本文以廉价钛铁矿为原料,采用微波等离子体化学气相沉积方法制备出含铁的金红石型TiO2-CNTs复合粉体,讨论了微波处理时间对复合粉体的结构影响,将制得的复合粉体用于光催化降解甲基橙系能的研究。
1 实验部分 1.1 金红石型TiO2粉体的制备 将钛铁矿进行球磨,降低粒径至5-10μm。取适量的钛铁精矿粉末置入微波等离子体化学气相沉积装置中,维持反应气压5.5KPa,加载600W功率,等离子体处理时间为10-70min。采用日本电子株式会社JSM-5510LV型扫描电子显微镜对样品表面形貌进行表征,用XD-5A型X射线衍射仪对样品进行物相分析。 1.2 光催化性能的研究 称取20mg制得的粉体在置入100ml甲基橙溶液(甲基橙浓度为40mg/L)中,在常温常压下静置至吸附平衡,在15W紫外光源和可见光下光照,进行光催化反应。反应一定时间后取样,离心分离,取适量上层澄清液,采用T6型紫外可见分光光度仪测定甲基橙浓度,测定波长为365nm。 2 结果与分析 2.1 金红石型TiO2-CNTs复合粉体的制备 图1为钛铁精矿还原产物的XRD图。由图可见,随着反应时间的增加,大量的碳纳米管生成,反应时间直接影响到金红石-纳米碳管复合粉体的结构及含量。具体反应过程为:钛铁矿在氢气等离子体中裂解形成铁和金红石,甲烷在等离子体中裂解成活性碳粒子,活性碳粒子以铁为催化剂在铁的表面生长出纳米碳管。随着反应的进行,钛铁矿的含量降低,金红石和纳米碳管的含量显著增加,当反应时间达到50min后,钛铁矿相消失。
图1 还原产物的XRD图像(△=FeTiO3,ˇ=Rutile,+=Fe3C,⊙=CNT, R1-R7分别依次对应反应时间从10min-70min) 2.2 金红石型TiO2-CNTs复合粉体的光催化性能 在紫外光下,不同条件下制得的复合粉体在吸附平衡后,甲基橙溶液的降解率如图2所示。从图中可以看出,在600W功率下,反应50min后制得的复合粉 体的降解率最高。这一方面是由于反应50min时,钛铁矿几乎完全被还原成TiO2,大量的TiO2生成增加了光催化的效率。此外,生长出的纳米碳管使甲基橙吸附在颗粒表面,TiO2在光照条件下电离出的电子和空穴能在纳米碳管表面迅速的将甲基橙氧化,优化了光催化的效果。另一方面,当反应超过50min后,大量的纳米碳管形成,由于其团聚相互缠绕,管壁之间接触面积增大,增加电离出的电子和空穴复合的几率,使光催化效率降低[12]。最优催化效率状态下的纳米碳管和金红石型TiO2含量比例约为1:1.。
图2 不同条件下反应产物的光催化活性 2.3 复合粉体形貌观察 图4为600W条件下反应50min和70min的金红石型TiO2-CNTs复合粉体SEM照片。图中白色点状颗粒为铁颗粒,甲烷裂解的活性碳粒子以铁颗粒为催化剂生长出纳米碳管。当反应50min时生长出较蓬松的纳米碳管,管径较均匀。当反应70min后,大量的纳米碳管出现,并且相互缠绕,管壁接触更加紧密,促进了管壁上电子和空穴的复合。 图4 不同条件下制备出复合粉体的SEM照片(a为50min,b为70min) 研究表明,TiO2的结构及负载情况直接影响到其光催化效率,结合本实验结果,复合粉体在紫外光和可见光下都有高的光催化效率的原因可能是[13-15]:(1)纳米碳管具有较高的比表面积,将有机物聚集在纳米碳管的表面,降低的电子、空穴的传输距离和复合率;(2)适量纳米碳管的在粉体中提供了类似空间网络的结构,可以提高电子、空穴的传输效率;(3)复合粉体中还有变价元素铁,铁的掺入可以降低禁带宽度,并抑制电子空穴的复合,使TiO2的光谱响应范围向可见光偏移。 3 结语 采用微波等离子体还原钛铁矿,并制备出具有优异光催化性能的金红石型TiO2-CNTs复合粉体。微波处理钛铁矿时间长短直接影响到TiO2-CNTs复合粉体的结构和性能。在微波处理50min后获得的TiO2-CNTs复合粉体的光降解效率最优,该状态下的金红石和纳米碳管的比例约为1:1。
参考文献 [1]Akira Fujishima,Xintong Zhang,Donald A.Trykc.TiO2 photocatalysis and related surface phenomena.Surface ScienceREport[J],2008,63:515-582 [2]马春蕾.二氧化钛光催化氧化技术的研究进展[J].辽宁化工,2010,39(9):968-971. [3]刘畅,暴宁钟,杨祝红,陆小华.过渡金属离子参杂改性TiO2的光催化性能研 究进展[J]催化学报,2001,(02). [4] 周真一. TiO2光催化剂的研究进展及其应用[J]. 山东陶瓷,2010,33(3):17-19. [5] 郭树梁. 纳米二氧化钛的性能研究及其在环保领域的应用[J]. 广西纺织科技,2010,39(3):31-33. [6] Yawen Wang,Lizhi Zhang,Kejian Deng,et al. Low temperature synthesis and photocatalytic activity of rutile TiO2 Nanorod superstructures[J]. J. Phys. Chem. C,2007,111:2709-2714. [7] 李璐,传秀云,路线春,等. 紫外光及日光下天然金红石光催化降解苯酚的研究[J]. 岩石矿物学杂志,2010,29(5):569-576. [8] R. Poblete,E. Otal,L.F. Vilches,et al. Photocatalytic degradation of humic acids and landfill leachate using a solid industrial by-product containing TiO2 and Fe[J]. Appl Catal B,2011,102:172-179. [9] 罗永松,夏晓红,方涛,等. TiO2/碳纳米短管复合粉体的制备及光催化性能的研究[J] 化工新型材料,2006,34(8):36-39. [10] 张鹏,贾立山,李清彪,等. 金红石相对含量对混晶纳米TiO2光催化分解水制氢的影响[J]. 化工进展,2008,27(9):1473-1482. [11] Naoyuki Mukaihata,Hideo Matsui,Tetsuro Kawahara,et al. SiOx ultrathin layer coverage effect on the (photo)catalytic activites of rutile TiO2 [J]. J. Phys. Chem. C,2008,112:8702-8707. [12] 李维学,吴中立,崔永福,等. SWCNT掺杂改性对纳米TiO2光催化的影响[J]. 应用化工,2008,37(5):478-480. [13] 吴俊明,姚俊杰,杨汉培,等. 纳米二氧化钛/碳纳米管复合催化剂光催化性能及碳纳米管组分的作用[J]. 化学学报,2010,14(68):1349-1356. [14] 贺飞,唐怀军,赵文宽,等. 纳米TiO2光催化剂负载技术研究[J]. 环境污染治理技术与设备,2001,2(2):47-58. [15] 胡晓洪,安太成,张茂林,等. 不同炭材料负载纳米二氧化钛催化降解甲基橙的研究[J]. 中国陶瓷,2006,42(12):21-24. The primary of research on the preparation and