7过渡金属氧化物催化剂及其催化作用
- 格式:ppt
- 大小:1.89 MB
- 文档页数:139

第一章催化简史1、催化剂这一概念历史上最早是由哪个国家的哪位科学家于何年何刊物中正式提出的?答:1836年,瑞典科学家贝采利乌斯(J.J.Berzelius)在《物理学与化学年鉴》中首次提出“催化剂”这一概念。
2、催化剂的本质是什么?它最早由哪个国家的哪位科学家于何年提出?答:催化剂的本质是降低化学反应的活化能,把一个比较难发生的反应变成了两个很容易发生的化学反应。
在这两个反应中,第一个反应中催化剂扮演反应物的角色,第二个反应中催化剂扮演生成物的角色,所以说从总的反应方程式上来看,催化剂在反应前后没有变化。
3、工业合成氨催化剂的主要成分有哪些?历史上由于合成氨催化剂和工业化研究而获得诺贝尔化学奖的科学家是哪个国家的哪两位?答:工业合成氨催化剂为铁触媒,其主要成分为Fe、Al2O3、K2O,由于合成氨催化剂和工业化研究,德国科学家哈伯(F.Haber)获得1919年诺贝尔化学奖,博什(C.Bosch)获得1931年诺贝尔化学工程、高压设备奖。
4、合成高压低密度聚乙烯的催化剂历史上是由谁最早发明的?其主要组成为何?答:合成高压低密度聚乙烯的催化剂历史上是由德国科学家齐格勒(K.Ziegler)最早发明的,其主要组成为四氯化钛-三乙基铝[TiCl4-Al(C2H5)3]。
5、历史上最早模仿合成高压低密度聚乙烯的催化剂而发明聚丙烯合成催化剂的是哪个国家的哪位科学家。
他所发明的聚丙烯催化剂的组成为何?答:历史上最早模仿合成高压低密度聚乙烯的催化剂而发明聚丙烯合成催化剂的是意大利科学家纳塔(G.Natta),他所发明的聚丙烯催化剂的组成为三氯化钛-三乙基铝[TiCl3-Al(C2H5)3]。
第二章催化剂与催化作用1、什么是催化剂?什么是催化作用?催化作用的本质是什么?催化作用的特征主要有哪四个方面?答:催化剂是这样一种物质,由于它的存在,使化学反应趋于平衡的速度大大加快了,而它本身的组成、数量在反应前后没有发生变化。

催化原理一、1、催化剂的定义是:一类能够改变化学反应速度而本身不进入最终产物分子组成中的物质2、催化作用的定义是:催化作用是一种化学作用,是靠用量极少而本身不被消耗的一种叫做催化剂的外来物质来加速化学反应的现象。
3、4、溢流现象——指固体催化剂表面的活性中心经吸附产生一种离子的或自由基的活性物种,它们迁移到别的活性中心处的现象。
5、由于物理或化学的作用力,某种物质的分子能附着或结合在两相界面上(固-固相界面除外),从而使这种分子在两相界面上的浓度大于体系的其他部分的现象6、Bronsted酸碱B酸(质子酸):凡能给出质子的物质,如H+B碱:凡能接受质子的物质,如BF37、Lewis酸碱L酸(非质子酸):凡能接受电子对的物质,如OH-L碱:凡能提供电子对的物质,如NH38/ 软亲软,硬亲硬,软硬交界就不分亲近二1、活性组分、助催化剂(促进剂)和载体2、3、分子间扩散努森扩散构型扩散4、5、Mx/n[(AlO2)x •(SiO2)y] • zH2O或aM2/nO • bX2O3 • cYO2 • dH2O6、立方体( )笼、六方柱笼、八面沸石笼7、方钠型沸石(如A型分子筛);八面型沸石(如X-型、Y-型分子筛);丝光型沸石(M-型);高硅型沸石(如ZSH-5)8、反应物的择形催化产物的择形催化过渡态限制的择形催化分子交通控制的择形催化9 werner配合物原子簇π-配位化合物过渡金属有机化合物1011、过渡金属氧化物、过渡金属复合氧化物三、1、1)催化剂可以影响化学反应的速度。
2)、催化剂只能加速热力学上认为可能发生的反应,对于热力学计算表明不可能发生的反应,使用任何化学催化剂是徒劳的3)催化剂只能加速反应趋向平衡,而不能改变化学平衡位置。
4)、催化剂对化学反应具有选择性。
2、3吸附的微观过程以及吸附过程中的能量关系可以用吸附位能曲线(上图)表示。
图中:P-物理吸附位能曲线: (Lernard - Jones方程)C-化学吸附位能曲线:(Morse公式,D:图中DH2;a:双原子分子简谐振子模型的弹力常数)q-化学吸附热,r0´为H与Ni的核间距= 1.25 + 0.35 = 1.6 ÅqP-物理吸附热,r0,H2与表面的距离= 3.2ÅEd -脱附活化能,由图,Ed = Ea + qEa -吸附活化能,达到过渡态所需的最低能量DH-H -H2的解离能从位能曲线可以得到:(1)物理吸附存在的重要作用:它使Ea «DH-H,通过物理吸附,吸收能量Ea 即形成了过渡态。

污水处理中的催化剂一、引言污水处理是保护环境和人类健康的重要环节之一。
在污水处理过程中,催化剂被广泛应用于催化氧化、还原和降解有机污染物等反应中,以提高处理效率和降低成本。
本文将详细介绍污水处理中常用的催化剂及其应用情况。
二、常见的污水处理催化剂1. 活性炭催化剂活性炭催化剂是一种常见的吸附剂,具有高比表面积和孔隙结构,能够有效吸附有机污染物。
在污水处理中,活性炭催化剂通常用于去除有机物、重金属离子和氯气等。
2. 金属氧化物催化剂金属氧化物催化剂如二氧化锰、二氧化钛等具有良好的催化性能,可用于催化氧化有机污染物。
例如,二氧化锰在污水处理中可以将有机物氧化为无害的二氧化碳和水。
3. 过渡金属催化剂过渡金属催化剂如铜、铁、钴等可用于催化还原反应,将有毒的重金属离子还原为无毒的金属沉淀。
这些催化剂在污水处理中广泛应用于重金属去除和废水处理。
4. 生物催化剂生物催化剂如酶和微生物具有高效、特异性和环境友好的特点,可用于降解有机污染物。
例如,过氧化氢酶可催化过氧化氢分解为氧气和水,降解有机废水中的有害物质。
三、污水处理中催化剂的应用案例1. 活性炭催化剂在污水处理中的应用某废水处理厂使用活性炭催化剂对废水中的有机物进行吸附处理。
经过实验验证,活性炭催化剂能够有效去除废水中的有机物,使废水达到国家排放标准。
2. 金属氧化物催化剂在污水处理中的应用某化工厂使用二氧化锰催化剂对废水中的有机物进行氧化处理。
结果表明,二氧化锰催化剂能够高效氧化有机物,降低废水中的有机污染物浓度。
3. 过渡金属催化剂在污水处理中的应用某矿山废水处理厂使用铁催化剂对废水中的重金属离子进行还原处理。
实验结果显示,铁催化剂能够将废水中的重金属离子还原为无毒的金属沉淀,达到废水排放标准。
4. 生物催化剂在污水处理中的应用某食品工厂使用过氧化氢酶催化剂对废水中的有机废弃物进行降解处理。
研究表明,过氧化氢酶催化剂能够高效降解废水中的有机废弃物,减少环境污染。


一氧化氮的催化氧化摘要:本文介绍了分子筛及其负载型催化剂、活性炭负载型催化剂等催化氧化一氧化氮的方法,着重介绍了过渡金属氧化物负载型催化剂催化一氧化氮的方法。
关键词:一氧化氮、催化氧化引言燃烧过程产生的各种氮氧化物(x NO )是引发酸雨和光化烟雾的有害气体污染物[1]。
尽管人类在空气污染控制上已经进行了大量的科学研究和技术开发工作,但氮氧化物的减排和治理依然是全球日益关注的问题[2]。
氮氧气态化合物包括一氧化二氮(2N O )、一氧化氮(NO)、三氧化二氮(23N O )、二氧化氮(2NO )、四氧化二氮(24N O )、五氧化二氮(25N O )和三氧化氮(3NO )。
其中,NO 和2NO 是烟道气中主要的成分。
2NO 在水中的溶解度高,可选用合适的碱或盐溶液(如24Na SO )加以吸收[3];而NO 在水中的溶解度很小,很难用溶液吸收法去除[4]。
相比于物理或非催化反应的方法,催化反应似乎更适于除去NO 。
一般而言,NO的催化反应可分为催化分解、催化还原和催化氧化。
其中,催化分解将NO 直接分解为2O 和2N ,而无须加入其他化学试剂,因而更具吸引力[5],但至今尚未开发出高效且抗失活的催化剂。
选择性催化还原(SCR)目前已经发展成为烟道气脱硝的商业化技术。
例如,日本发明的SCR 技术,用3NH 作为还原剂和V /2TiO :作为催化剂在20世纪20年代就已占领了该领域的国际市场[6]。
但SCR 技术要求预先除去废气中硫氧化物,且处理温度高,反应器体积大,因而并不适合于流动废气源(如汽车尾气)中x NO 的消除。
所以,从经济实用的角度,催化氧化似乎是一种颇具潜力的消除NO 的替代技术。
它先将NO 催化氧化成2NO ,然后用吸附或溶液吸收方法除去2NO [7]。
目前催化剂研发工作大多围绕活性炭[8]、负载金属[9]而进行,并取得了进展。
分子筛及其负载型催化剂用于处理NO 的分子筛催化剂,大多用于还原法和分解法处理工艺,如Cu-ZSM .5催化剂及Co.ZSM.5催化剂等。

1基本概念金属氧化物催化剂常为复合氧化物(Complex oxides),即多组分氧化物。
如VO5-MoO3,Bi2O3-MoO3,TiO2-V2O5-P2O5,V2O5-MoO3-Al2O3,MoO3-Bi2O3-Fe2O3-CoO-K2O-P2O5-SiO2(即7组分的代号为C14的第三代生产丙烯腈催化剂)。
组分中至少有一种是过渡金属氧化物。
组分与组分之间可能相互作用,作用的情况常因条件而异。
复合氧化物系常是多相共存,如Bi2O3-MoO3,就有α、β和γ相。
有所谓活性相概念。
它们的结构十分复杂,有固溶体,有杂多酸,有混晶等。
就催化剂作用和功能来说,有的组分是主催化剂,有的为助催化剂或者载体。
主催化剂单独存在时就有活性,如MoO3-Bi2O3中的MoO3;助催化剂单独存在时无活性或很少活性,但能使主催化剂活性增强,如Bi2O3就是。
助催化剂可以调变生成新相,或调控电子迁移速率,或促进活性相的形成等。
依其对催化剂性能改善的不同,有结构助剂,抗烧结助剂,有增强机械强度和促进分散等不同的助催功能。
调变的目的总是放在对活性、选择性或稳定性的促进上。
金属氧化物主要催化烃类的选择性氧化。
其特点是:反应系高放热的,有效的传热、传质十分重要,要考虑催化剂的飞温;有反应爆炸区存在,故在条件上有所谓“燃料过剩型”或“空气过剩型”两种;这类反应的产物,相对于原料或中间物要稳定,故有所谓“急冷措施”,以防止进一步反应或分解;为了保持高选择性,常在低转化率下操作,用第二反应器或原料循环等。
这类作为氧化用的氧化物催化剂,可分为三类:①过渡金属氧化物,易从其晶格中传递出氧给反应物分子,组成含2种以上且价态可变的阳离子,属非计量化合物,晶格中阳离子常能交叉互溶,形成相当复杂的结构。
②金属氧化物,用于氧化的活性组分为化学吸附型氧物种,吸附态可以是分子态、原子态乃至间隙氧(Interstitial Oxygen)。
③原态不是氧化物,而是金属,但其表面吸附氧形成氧化层,如Ag对乙烯的氧化,对甲醇的氧化,Pt对氨的氧化等即是。

过渡金属催化反应研究过渡金属催化反应是一种常用的有机合成方法,在有机化学、高分子化学以及材料科学等领域有着广泛的应用。
其作用是通过过渡金属催化剂,将反应物转化成最终产物。
随着催化领域的发展,过渡金属催化反应在工业生产和学术研究中扮演着越来越重要的角色。
过渡金属催化反应的历史可以追溯到19世纪初期,当时研究人员首次观察到了金属对有机反应物的催化作用。
然而,由于当时催化剂的不稳定性、反应条件的不可控性,以及催化剂对环境的影响等问题,此后的几十年中,过渡金属催化反应的研究受到了诸多限制。
随着科技发展,人们对催化剂的性能和催化机理有了更深入的了解,过渡金属催化反应的研究得到了重视。
1990年代以后,许多重大的科学发现和技术进展使得过渡金属催化反应进入了新的发展阶段。
过渡金属催化反应的基本原理是催化剂通过吸附反应物原子或分子并加速反应进程。
过渡金属催化剂可以使反应物之间的结合能降低,可以改变反应物分子之间的离子积分布,甚至可以改变反应物之间的立体位阻及其友好性质。
一方面,过渡金属催化剂还能够吸附并打破C-H键,在反应物分子之间形成C-C、C-N、C-O等键。
通过提高反应物之间的反应自由能,过渡金属催化反应能够加速反应进程,降低反应能量,提高产率。
目前,过渡金属催化反应的研究已经为各种有机合成开辟了一个新的领域。
研究人员利用过渡金属催化反应制备二苯甲肼、季胺盐、芳香酮、卡宾中间体、缩醛、咪唑、三元氮等各种中间体。
这些中间体不仅可以作为有机合成的基础,而且可以应用于医药、精细化学品、高分子材料等领域。
值得注意的是,过渡金属催化反应的研究不仅涉及到化学原理等方面的知识,还涉及到工程技术和环境科学等领域的知识。
例如,如何控制催化反应的物质输送速度以及如何调节反应的温度和压力等条件是催化反应研究的重点之一。
同时,过渡金属催化反应也需要考虑环保问题,研究人员不断开发新的催化剂和优化催化减少污染物的生成。
总的来说,过渡金属催化反应是一种非常重要的化学研究领域。

芬顿催化氧化引言芬顿催化氧化是一种高效的废水处理技术,广泛应用于环境保护领域。
它通过利用过渡金属离子催化产生高活性的氢氧自由基,对废水中的有机物进行氧化分解,从而降解有毒有害物质,达到净化水体的目的。
本文将详细讨论芬顿催化氧化的原理、应用及其优缺点,并探讨其在环境保护中的前景。
芬顿催化氧化原理芬顿催化氧化是通过氢氧自由基对有机物进行氧化分解的过程。
其原理基于芬顿反应,芬顿反应是过渡金属离子与过氧化物结合生成氢氧自由基的反应。
在芬顿催化氧化中,常用的过渡金属离子是二价铁离子(Fe2+),过氧化物则通常采用过氧化氢(H2O2)。
芬顿催化氧化的条件芬顿催化氧化需要一定的条件才能实现高效的有机物降解。
以下是芬顿催化氧化的常见条件:1.酸性环境:芬顿催化氧化反应在酸性环境中进行,通常在pH为2.8-3.5之间,pH参数的控制对催化效果至关重要。
2.过渡金属离子:芬顿催化氧化需要过渡金属离子作为催化剂,常用的是铁离子(Fe2+)。
铁离子在催化氧化反应中起到催化分解过氧化物的作用,并生成高活性的氢氧自由基。
3.过氧化氢:过氧化氢作为氧化剂提供氧原子,与铁离子反应生成氢氧自由基。
过氧化氢的浓度和投加量对催化氧化反应有着重要的影响,过高的浓度可能导致催化剂的失活。
芬顿催化氧化的应用芬顿催化氧化技术在环境保护中有着广泛的应用。
它可以有效降解废水中的有机物,使其得到净化,保护水体环境。
以下是芬顿催化氧化的一些应用领域:1.废水处理:芬顿催化氧化技术可应用于各类工业废水的处理,如电镀废水、印染废水、制药废水等。
通过催化氧化反应,有机物得到有效降解,达到排放标准。
2.土壤修复:芬顿催化氧化技术可以用于土壤中有机物的修复。
土壤污染严重影响了农作物的生长和环境的稳定性,芬顿催化氧化可以有效降解有机物,恢复土壤质量。
3.水体净化:芬顿催化氧化技术可以应用于河流、湖泊等水体的净化。
它能够去除水中的有机物,减少水体富营养化现象,促进水体生态的恢复。

过渡金属催化剂有哪些催化领域是一个广泛而多样的领域,其试图模仿自然界所拥有的催化剂酶的精细功能。
过渡金属催化剂能够很容易借出或吸收其他分子的电子,使其成为一类出色的催化剂。
催化的一个吸引人的特征是在化学转化过程中不会消耗催化物成分。
金属的催化作用可进一步细分为多相金属催化作用或均相金属催化作用。
在过渡金属化学领域内,有几类转化方法已在合成化学以及越来越多的非合成化学中流行起来。
这些方法基于其开发实验室而命名,包括但不限于:Stille、Buchwald–Hartwig、Negishi、Heck、Miyaura–Suzuki、和Sonogashira.默克sigma-aldrich®可为合成有机化学家提供大量重要性日益提升的催化剂和金属。
默克广泛的过渡金属催化剂产品线涵盖了大多数过渡金属嵌段。
其中较突出的金属催化剂说明如下。
钛催化剂默克提供具有多种有机配体的钛配合物,从而形成用于有机合成的有效钛催化剂。
例如,CpTiCl3已被用作室温杂环环化反应的一种有效钛催化剂。
在将电子不足的烯烃转化为非对映体纯的7-羟基降冰片烯,以及将丙烯酸甲酯转化为高度取代的降冰片烯衍生物的过程中,采用了二茂钛二氯化物和双(甲基环戊二烯基)二氯化钛作为钛催化剂。
钒催化剂钒催化是钒的第二大应用,仅次于钢铁产量提升添加剂用途。
钒催化剂可以有效活化过氧化物并选择性氧化各种底物,如溴化物、硫化物和烯烃。
研究表明这些催化剂能够将氧原子有效转移到底物上,非常适合在大规模反应中高选择性获取有价值的氧化分子。
另外,钒催化剂可用作烯烃聚合的有效催化剂。
氧化钒可用于车辆排放标准品和原油脱硫工艺。
此外,可利用生态氧化剂(例如氢和烷基过氧化物)大幅提升钒催化剂的工业潜在应用。
铁催化剂铁和铁化合物在自然界中分布广泛,可用作试剂或催化剂。
例如,在经典的亲电子芳族取代反应中,氯化铁和溴化物一直用作Lewis酸铁催化剂。
含有有机配体的铁络合物目前尤为瞩目,可以用作许多转化的环保型Fe催化剂。

催化原理作业第⼀章催化剂与催化作⽤基本知识1.催化剂的定义及催化剂的催化作⽤包含哪三个⽅⾯?2.催化反应的分类?3.催化剂分类并举例。
4.固体催化剂的组成。
5.载体的作⽤。
6.催化剂的反应性能及表⽰⽅法。
7.催化剂要具备哪些性能才能满⾜⼯业⽣产的要求?8.多相催化反应主要包括哪七步?9.简单阐述外扩散和内扩散的定义。
10. 催化剂的稳定性的定义及包含哪⼏个⽅⾯。
第⼆章催化剂的表⾯吸附与孔扩散1.简述吸附现象;吸附及脱附过程的定义。
2.物理吸附及化学吸附的内涵及它们之间的特性区别。
3.化学吸附的类型。
4.解释缔合吸附并举例说明。
5.催化剂的吸附等温线可分为哪⼏种类型?从曲线的形状可对催化剂的性质获得哪些了解?6.将经过活化的硅胶(粒度为40⽬~120⽬)分别采⽤氦和汞的置换体积来测定真密度和假密度。
实验数据如下:硅胶质量为101.5 g ,氦置换体积为45.1mL,汞置换体积为82.7mL。
已知硅胶⽐表⾯积为400m2·g-1,试计算:(1)硅胶的真密度和假密度;(2)硅胶的⽐孔容;(3)硅胶的孔隙率;(4)硅胶的平均孔径。
第三章酸碱催化剂及其催化作⽤1.试述B酸与L酸的本质区别及SHAB原则。
写出分⼦筛的化学组成式。
分⼦筛作为催化剂,对反应选择性主要与它的什么因素有关?⽽稳定性⼜主要与它的什么因素有关?2.⽤正碳离⼦反应规律说明下述反应机理。
CH3CH2CHCH3Br3.Na型分⼦筛⽤做固体催化剂时,为什么要进⾏离⼦交换?⽤不同价数的阳离⼦交换对催化剂活性有何影响?4.如何调节沸⽯酸中⼼的强度和数量?5.沸⽯分⼦筛择形催化的分类,择形催化作⽤的影响因素及其调变。
沸⽯分⼦筛催化机理是什么?⽤分⼦筛催化机理说明下述反应:第四章⾦属催化剂及其催化作⽤1.为什么⾦属催化剂主要是过渡⾦属元素?过渡⾦属元素作为催化剂有什么特点?2.什么是⾦属催化剂的电⼦逸出功和反应物分⼦的电离势?并说明它们对吸附状态有什么影响?3.晶体结构对催化作⽤有什么影响?4.简述催化重整的反应机理以及催化重整有哪些催化剂。
oer催化剂的材料OER(Oxygen Evolution Reaction)催化剂是一类能够促进氧气发生析出反应的材料,广泛应用于能源转换和储存领域。
本文将介绍几种常见的OER催化剂材料及其特点。
一、金属氧化物催化剂金属氧化物催化剂是OER领域中最常见的一类材料。
其中,铁氧化物(Fe2O3)具有良好的OER催化活性和稳定性。
研究表明,Fe2O3可以通过调控晶体结构、表面氧化态和晶格缺陷等来提高其催化活性。
此外,钴氧化物(Co3O4)和锰氧化物(MnOx)等金属氧化物也被广泛应用于OER催化剂的研究中。
二、过渡金属催化剂过渡金属催化剂具有良好的OER催化活性和电化学稳定性。
其中,钴基催化剂是目前应用最广泛的一类过渡金属催化剂。
钴基催化剂具有较低的催化活化能和较高的电子传导性能,能够有效促进OER 反应的进行。
此外,铁基催化剂、镍基催化剂和锰基催化剂等也具有一定的催化活性,正在得到广泛研究和应用。
三、双金属催化剂双金属催化剂是一种将两种不同金属组合而成的材料。
研究表明,双金属催化剂相比于单金属催化剂具有更高的催化活性和稳定性。
例如,钴铁双金属催化剂能够实现低电位下高效的OER反应,具有重要的应用潜力。
此外,镍铁、镍钴、铁锰等双金属催化剂也被广泛研究和开发。
四、碳基催化剂碳基催化剂是一类以碳材料为基底的催化剂。
研究表明,碳基催化剂具有良好的催化活性和电化学稳定性,并且能够实现可控的催化活化能。
其中,碳纳米管、石墨烯和碳纤维等碳材料被广泛研究和应用于OER催化剂领域。
此外,功能化的碳材料也被设计和合成用于提高催化活性和稳定性。
五、有机物催化剂有机物催化剂是一类以有机物分子为基础的催化剂。
相比于传统的无机催化剂,有机物催化剂具有较高的催化活性和选择性。
研究表明,有机物催化剂能够通过调控分子结构和功能基团等来实现高效的OER催化效果。
例如,有机物催化剂可以通过调整分子结构中的共轭体系和电子云密度等来提高催化活性。
《催化原理》教学大纲二、课程目的和任务催化原理课程是化学工程与工艺专业的必修专业课以及其他相关专业的选修课。
催化剂在现代化学工业中占有重要的地位,了解和掌握催化剂与催化作用的基本原理对于化学工程与工艺专业以及相关专业的学生是具有相当重要的意义。
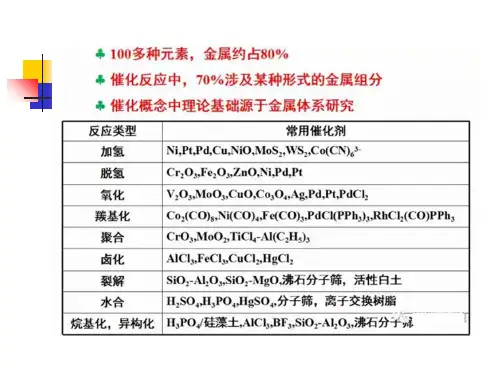
通过对本课程的学习,使学生了解目前工业生产和科学研究中最常用的四大类型催化剂,即酸碱催化剂、金属催化剂、过渡金属氧化物催化剂和络合物催化剂。
掌握催化作用基础,各类催化剂的组成、结构、催化反应、催化作用原理以及催化剂的工业应用和典型实例的剖析。
三、本课程与其它课程的关系本课程是在无机化学、有机化学、物理化学等课程的基础上,综合运用先修课程的基础知识,分析和解决化工生产与科学研究中催化剂与催化作用的问题,同时为今后的工作与进一步学习化工中的其它专业知识提供理论基础。
四、教学内容、重点、教学进度、学时分配(一)绪论(1学时)1、主要内容催化剂与催化作用的重要性;催化科学的发展及特点。
2、重点催化剂、催化作用概念3、教学要求了解本课程的性质、任务和内容,了解催化学科的发展及重要性。
(二)催化剂与催化作用的基础知识(3学时)1、主要内容催化作用的特征;催化作用的分类;固体催化剂的组成和结构层次;催化剂的反应性能及工业对催化剂的要求;多相催化反应系统分析。
2、重点催化作用的基本特征,固体催化剂的组成。
3、教学要求了解催化作用的基础知识,掌握催化作用的基本特征和固体催化剂的组成和结构层次。
利用催化作用的基本特征解决一些实际问题。
(三)催化剂的吸附、表面积、孔结构(2学时)1、主要内容催化剂的物理吸附和化学吸附;化学吸附类型和化学吸附态;吸附平衡与吸附等温方程;催化剂的表面积及孔结构。
2、重点物理吸附和化学吸附鉴别,吸附平衡,化学吸附态。
3、教学要求了解催化剂的物性及主要表征方法,催化剂的吸附。
(四)金属催化剂及其催化作用(8学时)1、主要内容金属催化剂的应用及催化作用;金属催化剂的化学吸附;金属催化剂电子因素与催化作用的关系;金属催化剂晶格结构与催化作用的关系;负载型金属催化剂及其催化作用;合金催化剂及其催化作用;金属催化剂催化作用的典型反应分析。
最新⼯业催化原理—作业汇总(含答案)第⼀章催化剂与催化作⽤基本知识1、简述催化剂的三个基本特征。
答:①催化剂存在与否不影响△Gθ的数值,只能加速⼀个热⼒学上允许的化学反应达到化学平衡状态⽽不能改变化学平衡;②催化剂加速化学反应是通过改变化学反应历程,降低反应活化能得以实现的;③催化剂对加速反应具有选择性。
2、1-丁烯氧化脱氢制丁⼆烯所⽤催化剂为MoO3/BiO3混合氧化物,反应由下列各步组成(1)CH3-CH2-CH=CH2+2Mo6++O2-→CH2=CH-CH=CH2+2Mo5++H20(2)2Bi3++2Mo5+→2Bi2++2Mo6+(3)2Bi2++1/202→2Bi3++02-总反应为CH3-CH2-CH=CH2+1/202→CH2=CH-CH=CH2+H20试画出催化循环图。
CH3-CH22Bi3、合成氨催化剂中含有Fe3O4、Al2O3和K20,解释催化剂各组成部分的作⽤。
答:Fe3O4:主催化剂,催化剂的主要组成,起催化作⽤的根本性物质Al2O3:构型助催化剂,减缓微晶增长速度,使催化剂寿命长达数年K20:调变型助催化剂,使铁催化剂逸出功降低,使其活性提⾼第⼆章催化剂的表⾯吸附和孔内扩散1、若混合⽓体A和B2在表⾯上发⽣竞争吸附,其中A为单活性吸附,B2为解离吸附:A+B2+3*→A*+2B*,A 和B2的⽓相分压分别为p A和p B。
吸附平衡常数为k A和k B。
求吸附达到平衡后A的覆盖率θA和B的覆盖率θB。
解:对于⽓体A:吸附速率v aA=k aA P A(1—θA—θB) ;脱附速率v dA=k dAθA平衡时:v aA=v dA,即θA=(k aA/k dA)P A(1—θA—θB)=k A·k B(1—θA—θB)对于⽓体B:吸附速率v aB=k aB P B(1—θA—θB)2;脱附速率v dB=k dBθB2平衡时:v aB=v dB ,即θB2= k B P B(1—θA—θB)2。