第二轮专题:化学平衡
- 格式:doc
- 大小:97.50 KB
- 文档页数:15

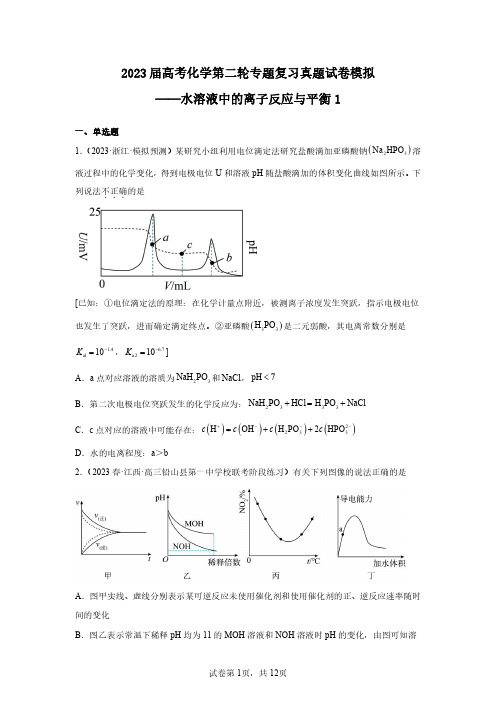
2023届高考化学第二轮专题复习真题试卷模拟——水溶液中的离子反应与平衡1一、单选题[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。
②亚磷酸(H 1.4al 10K -=, 6.7a 210K -=]A .a 点对应溶液的溶质为32NaH PO 和NaCl ,pHB .第二次电极电位突跃发生的化学反应为:NaHC .c 点对应的溶液中可能存在:()()H OH c c +-=D .水的电离程度:a >b2.(2023春·江西·高三铅山县第一中学校联考阶段练习)有关下列图像的说法正确的是A .图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化B .图乙表示常温下稀释pH 均为11的MOH 溶液和NOH 溶液时pH 的变化,由图可知溶A .()-2.3b K ROH =10B .P 、Q 点对应溶液中()()++c R c H 的值:P Q>C .若将溶液无限稀释,溶液中()(+2-4c R 2c SO ≈D .相同条件下,若改为()124c R SO =0.2mol L -⋅4.(2023秋·浙江宁波·高三统考期末)下列溶液因盐的水解而呈酸性的是A .K SO 溶液B .NaHCO 溶液CA .完全沉淀废液中的2Pb +,I -的效果不如B .z 点,()()(2-2+3sp Q=c CO c Pb <K PbCO ⋅C .()sp 2K PbI 的数量级为1410-A .A -是HA 的共轭碱C .增大pH 过程中,()()A HA c c -的值减小()()HA A 1.0δδ-+=9.(2023·辽宁·模拟预测)难溶物2SrF 可溶于盐酸。
常温下,用A .1L 代表()2+-lgc Sr 与()()+c HF lg c H ⎡⎤⎢⎥⎢⎥⎣⎦的变化曲线B .a 、c 两点的溶液中均存在(2c Sr C .()a K HF 的数量级为710-D .c 点的溶液中存在()(2+-c Sr>c Cl 10.(2023·全国·模拟预测)某元素M(OH)3(s)M 3+(aq)+3OH -(aq)、A .曲线①代表lgc(M 3+)与pH 的关系B .M(OH)3的K sp 为1×10-33.5C .4.5≤pH≤9.3时,体系中元素M 主要以D .M(OH)4-与M 3+在溶液中可以大量共存11.(2023·山东·模拟预测)室温下,向柠檬酸A .C 6H 8O 7的K a1为10−3.13B .曲线b 表示δ(677C H O -)随pH 的变化C .在C 6H 6Na 2O 7溶液中,(677C H O -)>(66C H OD .pH 大于6时,发生的反应主要为2667C H O -12.(2023·辽宁·模拟预测)25℃时,用同一NaOH 溶液,pM[p 表示负对数,M 表示()()-c A c HA 、(c CuA .HA 为一元弱酸,25℃时7.4a K =10-B .线①代表滴定4CuSO 溶液时pM 与溶液C .滴定HA 溶液至x 点时,溶液中()()()()()-++-c HA >c A >c Na >c H >c OH D .滴定4CuSO 溶液至x 点时,改为滴加HA 溶液,沉淀逐渐完全溶解二、多选题A .25℃时,BOH 的电离平衡常数的数量级为10-4B .t=0.5,2c(H +)+c(B +)=2c(OH -)+c(BOH)C .P 1所示溶液:c(Cl -)>0.05mol·L -1D .P 2所示溶液:c(B +)>100c(BOH)14.(2023春·山东滨州·高三统考开学考试)25℃时,用HCl 气体调节0.1mol 体系中微粒浓度的对数值(lgc)与pH 的关系如图1所示(a 、b 、c 、d 线分别对应体系中除下列说法错误的是A .4NH Cl 水解平衡常数的数量级为1010-B .3P 对应溶液;()-1c Cl 0.05mol L-<⋅C .水的电离程度:123P P P <<D .4P 对应溶液:()()()-+4323c Cl =2c NH +2c NH H O⋅三、工业流程题常温下,有关金属离子开始沉淀和沉淀完全的pH 见下表:金属离子3Fe +3Al +2Mg +2Ca +(1)萃取塔中经过______(填写操作名称)可将含酚有机层分离出来。

高二年级化学下册第二单元化学平衡知识点世界由物质组成,化学那么是人类用以看法和改造物质世界的主要方法和手腕之一。
以下是查字典化学网为大家整理的高二年级化学下册第二单元化学平衡知识点,希望可以处置您所遇到的相关效果,加油,查字典化学网不时陪伴您。
1、定义:化学平衡形状:一定条件下,当一个可逆反响停止到正逆反响速率相等时,更组成成分浓度不再改动,到达外表上运动的一种平衡,这就是这个反响所能到达的限制即化学平衡形状。
2、化学平衡的特征逆(研讨前提是可逆反响)等(同一物质的正逆反响速率相等)动(静态平衡)定(各物质的浓度与质量分数恒定)变(条件改动,平衡发作变化)3、判别平衡的依据判别可逆反响到达平衡形状的方法和依据例举反响mA(g)+nB(g)C(g)+qD(g)混合物体系中各成分的含量①各物质的物质的量或各物质的物质的量的分数一定平衡②各物质的质量或各物质质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压力、总物质的量一定不一定平衡正、逆反响速率的关系①在单位时间内讧费了mmolA同时生成mmolA,V(正)=V(逆) 平衡②在单位时间内讧费了nmolB同时消耗了pmolC,V(正)=V(逆)平衡③V(A):V(B):V(C):V(D)=m:n:p:q,V(正)不一定等于V(逆) 不一定平衡④在单位时间内生成nmolB,同时消耗了qmolD,因均指V(逆) 不一定平衡压强①m+np+q时,总压力一定〔其他条件一定〕平衡②m+n=p+q时,总压力一定〔其他条件一定〕不一定平衡混合气体平均相对分子质量Mr①Mr一定时,只要当m+np+q时平衡②Mr一定时,但m+n=p+q时不一定平衡温度任何反响都随同着能质变化,当体系温度一定时〔其他不变〕平衡体系的密度密度一定不一定平衡其他如体系颜色不再变化等平衡4、影响化学平衡移动的要素4-1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的状况下,增大反响物的浓度或增加生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反响物的浓度,都可以使平衡向逆方向移动(2)添加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中停止的反响,假设稀释溶液,反响物浓度减小,生成物浓度也减小, V正减小,V逆也减小,但是减小的水平不同,总的结果是化学平衡向反响方程式中化学计量数之和大的方向移动。



高二年级化学下册第二单元化学平衡知识点世界由物质组成,化学则是人类用以认识和改造物质世界的要紧方法和手段之一。
以下是查字典化学网为大伙儿整理的高二年级化学下册第二单元化学平稳知识点,期望能够解决您所遇到的相关问题,加油,查字典化学网一直陪伴您。
1、定义:化学平稳状态:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种平稳,这确实是那个反应所能达到的限度即化学平稳状态。
2、化学平稳的特点逆(研究前提是可逆反应)等(同一物质的正逆反应速率相等)动(动态平稳)定(各物质的浓度与质量分数恒定)变(条件改变,平稳发生变化)3、判定平稳的依据判定可逆反应达到平稳状态的方法和依据例举反应mA(g)+nB(g)C(g)+qD(g)混合物体系中各成分的含量①各物质的物质的量或各物质的物质的量的分数一定平稳②各物质的质量或各物质质量分数一定平稳③各气体的体积或体积分数一定平稳④总体积、总压力、总物质的量一定不一定平稳正、逆反应速率的关系①在单位时刻内消耗了mmolA同时生成mmolA,V(正)=V(逆)平稳②在单位时刻内消耗了nmolB同时消耗了pmolC,V(正)=V(逆)平稳③V(A):V(B):V(C):V(D)=m:n:p:q,V(正)不一定等于V(逆)不一定平稳④在单位时刻内生成nmolB,同时消耗了qmolD,因均指V(逆)不一定平稳压强①m+np+q时,总压力一定(其他条件一定)平稳②m+n=p+q时,总压力一定(其他条件一定)不一定平稳混合气体平均相对分子质量Mr①Mr一定时,只有当m+np+q时平稳②Mr一定时,但m+n=p+q时不一定平稳温度任何反应都相伴着能量变化,当体系温度一定时(其他不变)平稳体系的密度密度一定不一定平稳其他如体系颜色不再变化等平稳4、阻碍化学平稳移动的因素4-1、浓度对化学平稳移动的阻碍(1)阻碍规律:在其他条件不变的情形下,增大反应物的浓度或减少生成物的浓度,都能够使平稳向正方向移动;增大生成物的浓度或减小反应物的浓度,都能够使平稳向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,因此平稳不移动(3)在溶液中进行的反应,假如稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,然而减小的程度不同,总的结果是化学平稳向反应方程式中化学计量数之和大的方向移动。
《高二化学知识点之化学平衡》在高二化学的学习中,化学平衡是一个至关重要的知识点。
它不仅在理论上具有深刻的内涵,而且在实际生产和生活中也有着广泛的应用。
一、化学平衡的概念化学平衡是指在一定条件下,可逆反应中正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态。
这个状态是动态平衡,虽然各物质的浓度不再改变,但反应并没有停止,正反应和逆反应仍在同时进行。
例如,对于可逆反应 N₂ + 3H₂⇌2NH₃,当反应达到平衡时,氮气、氢气和氨气的浓度不再变化,但氮气和氢气仍在不断地转化为氨气,同时氨气也在不断地分解为氮气和氢气。
二、化学平衡的特征1. 逆:化学平衡研究的对象是可逆反应。
只有可逆反应才存在化学平衡状态。
2. 等:正反应速率和逆反应速率相等。
这是化学平衡的本质特征。
当正逆反应速率相等时,单位时间内消耗的反应物和生成的反应物相等,单位时间内消耗的生成物和生成的生成物相等,从而使各物质的浓度保持不变。
3. 动:化学平衡是一种动态平衡。
虽然各物质的浓度不再变化,但反应并没有停止,正反应和逆反应仍在同时进行。
4. 定:在一定条件下,当可逆反应达到平衡时,各物质的浓度保持不变。
这个“定”并不是绝对的不变,而是在一定范围内的相对稳定。
5. 变:化学平衡是在一定条件下建立的。
当条件改变时,化学平衡会被破坏,并在新的条件下建立新的平衡。
三、影响化学平衡的因素1. 浓度- 增加反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增加生成物浓度,平衡向逆反应方向移动。
- 例如,在反应 N₂ + 3H₂⇌2NH₃中,如果增加氮气的浓度,根据勒夏特列原理,平衡会向正反应方向移动,以减弱氮气浓度增加的影响。
2. 压强- 对于有气体参加的可逆反应,增大压强,平衡向气体体积减小的方向移动;减小压强,平衡向气体体积增大的方向移动。
- 例如,对于反应 N₂ + 3H₂⇌2NH₃,正反应是气体体积减小的反应。
化学平衡状态及化学平衡移动1.(2020·北京海淀·101中学高三月考)在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。
下列说法正确的是A.977K,该反应的化学平衡常数值为2B.达到平衡时,向容器I中增加C的量,平衡正向移动C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%【答案】C【解析】A. 977K,根据容器I中的反应数据,该反应的化学平衡常数值为0.20.2= 0.041/ 332 / 331,故A 错误;B. C 是固体,达到平衡时,向容器I 中增加C 的量,平衡不移动,故B 错误;C. 容器Ⅱ与容器Ⅰ相比,相当于加压,达到平衡时,容器Ⅰ中CO 2的转化率比容器Ⅱ中的大,故C 正确;D. 若容器Ⅲ的温度是977K ,则容器Ⅲ与容器I 是等效平衡,平衡时CO 的浓度是0.2mol/L ,CO 的转化率是0.28-0.2100%=28.6%0.28⨯,升高温度,正向移动,CO 浓度增大,容器Ⅲ中的CO 的转化率小于28.6%,故D 错误。
2.(2021·黑龙江大庆中学高三期中)根据下列图示所得出的结论不正确的是( )A .图甲表示()()()2232SO g O g 2SO g 0H +∆<速率与时间关系曲线,说明t 1改变的条件是增大体系的压强 B .图乙表示镁条放入盐酸中生成氢气速率随时间的变化,0~ t 1反应速率加快原因可能是该反应为放热反应C .图丙表示22CO(g)Cl (g)COCl (g)+的反应速率随时间的变化,t 1时改变的条件是加入催化剂D.图丁表示酶催化反应的反应速率随反应温度的变化【答案】A【解析】A.根据图象,t1时刻v逆瞬间不变,v正瞬间增大,则是增大反应物浓度,故A错误;B.随着反应的进行,氢离子浓度减小,速率应该减小,但是实际上速率增大,可能是该反应为放热反应,导致溶液温度升高,而使速率增大,故B正确;C.t1时正、逆反应速率同等程度增大,且反应为体积减小的反应,则t1时改变的条件是加入催化剂,故C正确;D.酶为蛋白质,温度过高,蛋白质发生变性,则酶催化能力降低,甚至失去催化活性,图中能表示酶催化反应的反应速率随反应温度的变化,故D正确;故选A。
化学平衡教学目标知识技能:复习和强化对化学平衡状态标志的认识、对同一平衡状态的判断;勒沙特列原理的广泛应用,以及化学平衡计算知识。
能力培养:培养学生应用化学平衡的概念、平衡移动的原理解决实际问题的能力,以及在化学计算中的另类思维能力。
科学思想:通过对化学平衡概念的深刻讨论,使学生建立平衡思想,并能广泛应用于一定条件下的可逆过程中。
科学品质:通过化学平衡例题的讨论,培养学生认真的审题习惯,多方位的或换位的思维方式,严谨的科学态度。
科学方法:通过对化学平衡理论的复习,培养学生学会讨论问题的科学方法。
重点、难点化学平衡概念的深刻剖析和化学平衡移动原理的应用。
教学过程设计教师活动一、建立化学平衡状态的标志【提问】我们根据什么可以来判断,在一定条件下,一任意可逆反应: mA+nB pC+qD,是否达到了化学平衡状态?学生活动回答:一定条件下。
①正逆反应速率相等;②平衡混合气中各组分的体积分数不变。
【过渡】还有哪些衍生出的因素也可以是建立化学平衡状态的标志?讨论题:例1 在恒温下,密闭容器中的可逆反应:2SO3(气)2SO2(气)+O2(气)可用来确定该反应已经达到平衡状态的是[ ]A.反应容器内,压强不随时间改变B.单位时间消耗1molSO3同时生成1molSO2C.单位时间消耗1molSO3同时消耗1molSO2D.容器内混合气体的总质量不发生变化例2 在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应A(固)+2B(气)C(气)+D(气)+Q已达到平衡状态的是[ ]A.混合气体的压强B.混合气体的密度C.B的物质的量浓度D.反应放出的热量【讨论引导】从化学平衡概念的本质及它的外延去讨论和判断,但需注意题中可逆反应的特征、物质的状态。
讨论:回答例1中可逆反应在反应前后气体的体积不相等,故可以通过容器内压强不再改变来确定反应达到了平衡状态,A正确;B选项只描述了正反应速率,C正确。
回答:例1未指明密闭容器的体积固定,对于体积可变容器,达平衡与否,容器内压强均不会改变,A不正确。
回答:例2中容器的体积虽然固定,但可逆反应在反应前后气体的体积相等,混合气体的总体积不变,达平衡与否,容器内压强均不会改变,A选项不正确。
由质量守恒定律来分析,B选项也不正确。
回答:反应物A为固体,达平衡前后气体质量不相等,B选项正确。
回答:密闭容器的体积固定,虽然混合气体的总物质的量不变,但反应过程中成分气体的物质的量在改变,浓度在改变,所以C选项正确;正反应为放热反应,D选项也正确。
【评价】例1中的A、B、D三个选项均不正确,只有C正确。
例2中只有A选项不能表明可逆反应达到平衡状态。
【小结】化学平衡的判断(标志)1.从反应速率:v正=v逆来判断。
①正逆反应的描述:同一物质消耗和生成反应物和生成物消耗或生成②速率相等:同一物质速率的数值相等不同物质速率的数值与系数成正比即相等2.从混合气体中成分气体的体积分数或物质的量浓度不变来判断。
3.从容器内压强、混合气体平均分子量、混合气体的平均密度、反应的热效应不变等来判断,与可逆反应中m+n和p+q是否相等,容器的体积是否可变,物质的状态、反应过程中有无明显的热效应等因素有关,应具体情况具体分析。
二、同一平衡状态【提问】从化学平衡的概念出发,化学平衡的建立与哪些条件有关?回答:反应温度、压强、物质的量浓度。
【过渡】对于同一可逆反应,如果反应的起始态不同,所达到的平衡状态,是否相同呢?讨论题:例1 可逆反应3H2+N22NH3,在一固定容积的容器内,500℃Fe为催化剂,三种不同的初始态:①3molH2、1molN2,②2mol NH3,③1.5 mol H2、0.5 mol N2、1mol NH3,发生反应达到平衡时,混合气体中NH3的体积分数是否相同?例2 在一个固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(气)+B(气)2C(气)。
已知加入1mol A和2mol B达到平衡后,生成amol C,此时在平衡混合气体中C的摩尔分数为R。
若在相同的条件下,向同一容器中加入2mol A和4mol B,达平衡后的C物质的量为多少?此时C 在平衡混合气体中的摩尔分数与R的关系?【讨论引导】注意例1、例2中相关可逆反应的特征。
在讨论例2时,可将浓度的改变转化为容器体积的改变,从而由平衡移动的角度分析。
讨论:回答:例1,温度相同,容器的体积相同(即压强相同),虽然起始态不同,将②③转换后与①中反应物的初始浓度相同,所以对同一个可逆反应,在相同的条件下,所达到的平衡状态是同一平衡状态。
即三种不同的起始态的平衡混合体系中NH3的体积分数相同。
回答:例2,由于可逆反应的反应前后气体体积不变,在固定体积的容器中充入2molA和4molB,就相当于把第一个起始态容器的体积减小到原来的一半,但由于压强不影响该反应平衡状态,所以,达平衡时C的物质的量为2a mol,C在平衡混合气体中的摩尔分数与R相等。
【评价】例1的答案正确。
对同一可逆反应的三种不同的起始态,在同一温度和压强下达到平衡,平衡混合体系中NH3的体积分数相同。
例2答案正确。
【小结】1.可逆反应的平衡状态只与反应的条件有关,与反应的过程无关。
2.在相同温度和相同体积的容器中,同一可逆反应:mA+nB pC+qD 当m+n≠p+q,由不同的起始态均转换为从正反应开始的起始态,若反应物的浓度完全相同,则达到平衡时,为同一平衡状态;当m+n=p+q,由不同的起始态均转换为从正反应开始的起始态,若反应物的浓度比完全相同,达到平衡时,则为同一平衡状态。
三、勒沙特列原理的应用【讨论引导】什么是勒沙特列原理,在化学平衡中的具体体现有哪些?回答(略)。
【复习讨论】讨论题:在密闭容器中有可逆反应:nA(气)+mB(气)pC(气)—Q处于平衡状态(已知n+ m>p,Q>0),则下列说法正确的是[ ]①升温,[B]/[C]的比值变小②降温时体系内混合气体平均分子量变小③加入B,A的转化率增大④加入催化剂,气体总的物质的量不变⑤加压使容器体积减小,A或B的浓度一定降低⑥若A的反应速率为v A,则B的反应速率为v A n/mA.①②③⑤ B.①②③④ C.①②⑤⑥ D.③④⑤⑥【讨论引导】注意可逆反应的特点,改变条件后的平衡移动方向,以及题中涉及的化学量的概念。
讨论:回答:此可逆反应的正反应是气体体积的缩小反应,是吸热反应。
升高温度,使平衡向正反应方向移动,混合气体的总物质的量减小,平均分子量变大;B的浓度变小,C的浓度增大。
增大压强,使容器的体积变小,各物质的浓度应增大,但由于平衡向正反应方向移动,反应物气体A、B的物质的量变小,生成物气体C的物质的量增大。
正确答案为B。
【评价】讨论的结论正确。
不仅应会判断平衡移动的方向也应会判断平衡移动后的结果。
【过渡】对于其他平衡体系,如:电离平衡、水解平衡、溶解平衡等,勒沙特列原理是否适用呢?例题一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2Ca2++2OH-,当向悬浊夜中加入少量的生石灰时,下列说法正确的是[ ]A.溶液中Ca2+数目减少B.Ca2+浓度增大C.溶液pH保持不变D.溶液pH增大【讲解】难溶物在水中存在着溶解和沉淀的可逆过程,在一定条件下,当溶解的速率等于沉淀的速率,就达到了平衡状态,称为溶解平衡。
同化学平衡一样,改变条件,平衡被破坏而发生移动。
应用勒沙特列原理来分析例题中的问题。
【提问】在一定条件下,石灰乳悬浊液存在着平衡状态,那么对于溶液而言,是否处于饱和状态?加入生石灰会发生什么反应?对溶解平衡有什么影响?倾听。
思考并议论。
回答:是饱和状态。
生石灰与溶剂水反应,虽然由于溶剂的减少,平衡会发生移动,但温度不变,Ca(OH)2的溶解度不变,所以溶液的浓度不变,只是溶质和溶剂的量改变。
A、C正确。
【评价】回答正确。
【结论】凡是存在可逆过程的变化,均会在一定条件下建立平衡状态,均可应用勒沙特列原理来分析解决平衡移动问题,但不能脱离该问题所涉及的概念。
四、化学平衡的有关计算【引入】在复习化学平衡的计算时,除了常规的计算方法,还应具备一些常用的数学思想,以及常用的解题方法。
倾听。
1.极值思想例题:在一定条件下,将物质的量相同的NO和O2混合,发生如下反应:2NO+O22NO2,2NO2N2O4,所得混合气体中NO2的体积分数为40%,则混合气体的平均分子量是 [ ]A.49.6B.41.3C.62D.31【分析】首先确定混合气体的组成,用常规方法解题。
【引导】由于第二个反应是可逆反应,故可以采用化学计算中常用的方法——极端假设法。
【启示】极端假设法常用在混合物的组成的计算中,同样也可以应用在可逆反应的有关计算中。
解题:混合气体是由O2、NO2、N2O4组成的。
(解题过程略)思考:回答:假设混合气体只是由1molO2和2mol NO2组成的,其平均分子量为41.3;假设混合气体只是由1molO2和1 molN2O4组成的,其平均分子量为62。
但实际上混合气体是由O2、NO2、N2O4组成的,所以平均分子量应在二者之间。
A正确。
2.代换思维例题:在一真空的一定体积的密闭容器中盛有1molPCl5,加热到200℃时发生如下反应:PCl5(气)PCl3(气)+Cl2(气),反应达平衡时,PCl5所占体积分数为M%。
若在同一温度和容器中,最初投入的PCl5是2 mol,反应达平衡时,PCl5所占体积分数为N%,则M和N的正确关系是 [ ] A.M>N B.M<N C.M=N D.无法比较【分析】在同一容器中投入不同量的反应物,即反应物的浓度不同,因此,我们可以把两个独立的平衡体系看成是在第一个平衡体系的基础上的平衡移动问题。
所以思考时应注意①浓度的改变对平衡的影响;②平衡混合气体的总体积数也在改变。
思考:提问:平衡移动时PCl5减少的量与投入的PCl5增加的量,哪一个大?思考讨论:</PGN0070.TXT/PGN>回答:在同一容器中投入2molPCl5可相当于容器的体积减小一半,相当于对第一个平衡体系增大压强,使平衡向左移动,PCl5的量增大,B正确。
【引导】为了回避这样的问题,我们可以进行思维代换,把浓度的改变代换为体积的改变,然后再代换为压强的改变。
【启示】当需要比较两个相同的可逆反应的不同平衡状态时,即可采用这样的代换思维方法:①转换为平衡移动问题;3.差量方法例题:在一定条件下,合成氨反应达到平衡,混合气中NH3的体积分数为25%,若反应条件不变,则反应后缩小的气体体积与原反应物体积的比值是[ ]A.1/5 B.1/4C.1/3 D.1/2【分析】根据平衡时混合气中NH3的体积分数为25%,可按常规计算方法列出方程后解题。