胺的制备
- 格式:ppt
- 大小:927.50 KB
- 文档页数:50



制备胺类化合物的方法胺类化合物的制备方法那可真是化学世界里一场奇妙的魔法之旅啊!首先呢,卤代烃的氨解就像是一场热热闹闹的换座游戏。
卤代烃里的卤原子就像个不安分的小调皮,碰到了氨这个热情的小伙伴,然后“噗”的一下,就把自己的位置让给了氨,这样就生成了胺类化合物。
不过这个过程得控制好条件哦,就像控制一场派对的热闹程度,太热烈了可能就会失控,产生一些不想要的副产物呢。
再说说还原硝基化合物制备胺类吧。
硝基化合物就像个被束缚的小怪兽,那些硝基啊就像它身上重重的枷锁。
而还原剂就像是超级英雄,“嗖”的一下就把硝基这个枷锁给打破,把硝基化合物变成了胺类。
比如说用铁和盐酸当这个超级英雄组合的时候,就像两个配合默契的搭档,一个负责出力,一个负责调整环境,完美地把硝基变成胺基。
还有醛和酮的还原胺化,这就像是一场神奇的变身秀。
醛和酮就像舞台上的演员,氨呢就像给演员的魔法药水。
在合适的还原剂这个导演的指挥下,演员喝下魔法药水,然后“哗”的一下就变成了胺类化合物这个全新的角色。
这个过程中,还原剂就像掌控全局的导演,一点差错都不能有,不然舞台上可就要乱套啦。
腈类化合物的还原也能得到胺类呢。
腈类就像个有点高冷的家伙,不过在还原剂这个热情的朋友面前,也不得不放下架子。
还原剂就像一个温暖的小太阳,把腈类的高冷外壳融化,让它变成了胺类这个温柔的存在。
就好像把一个冰山美人变成了邻家小妹一样神奇。
从酰胺制备胺类就像是解开一个精心包装的礼物。
酰胺就像被层层包装起来的宝藏,水解这个动作就像小心翼翼地拆开包装纸。
当包装纸一层一层被剥开,最后就露出了胺类这个珍贵的宝藏。
不过这个拆解过程也得小心哦,太粗暴了可能会把宝藏弄坏呢。
用盖布瑞尔合成法制备胺类,就像是一场神秘的接力赛。
首先是邻苯二甲酰亚胺这个接力棒的第一棒选手,它和卤代烃进行反应,就像把接力棒稳稳地传给了卤代烃。
然后经过一系列神奇的操作,最后就像接力赛的最后一棒冲向终点一样,得到了胺类化合物。


胺的化性及制备胺的化学性质及制备Ⅰ、胺的化学性质C N H(R)N H(R)主要化性:1、胺的N 有孤对电⼦,具有⼀定的碱性;2、胺具碱性,亦具亲核性,可与卤代烃、酰化剂发⽣烃基化、酰基化反应(叔胺不可);3、各级胺可与HNO 2发⽣特殊反应;4、芳胺中存在共轭,N 的给电⼦作⽤使芳胺的碱性↓,⽽苯环上的亲电取代反应活性↑;5、芳胺易氧化。
⼀、碱性NH 3 +HOH[NH 4]+ + OH -..RNH 2 +HCl3]+ Cl -..1、注:(1)胺是弱碱,不能使酚酞显⾊;芳胺由于N 上孤对电⼦参与了共轭,碱性更弱;(2)成盐可改善其⽔溶性,也可⽤于提纯胺。
例如:+NH 2COOCH 2CH 2N(C 2H 5)2HClNH 2COOCH 2CH 2N(C 2H5)2H Cl普鲁卡因盐酸普鲁卡因(局⿇剂)例如:⼄酰苯胺中常混有未反应完的苯胺,如何提纯?解:⼄酰苯胺HCl苯胺不溶溶解分离固体洗涤、⼲燥2、碱性影响因素(1)电⼦效应:N 上ρe ↑,碱性↑;(2)空间效应:N 周围位阻↑,碱性↓;(3)溶剂化效应:N +的溶剂化程度↑,碱性↑。
溶剂化效应:溶剂分⼦与离⼦相互作⽤⽽累积在离⼦周围,提⾼了离⼦的稳定性。
氨的盐通过氢键可与四个⽔分⼦溶剂化,伯胺盐可与三个⽔分⼦溶剂化,仲胺盐可与两个⽔分⼦溶剂化,叔胺盐可与⼀个⽔分⼦溶剂化,因此,在⽔溶液中,溶剂化程度顺序是:NH 3>伯胺>仲胺>叔胺+R 2NH H ............O HHOHH+R 3NH ......OH H(4)综合上述因素,在⽔溶液中,胺的碱性⼤⼩顺序为:季铵碱>脂肪胺>氨>芳胺①脂肪胺碱性与R 数⽬⽆正⽐关系,⼀般的:脂环仲胺>脂肪仲胺>脂肪伯胺、叔胺(掌握:⼆甲胺>甲胺>三甲胺)②芳胺碱性规律:芳伯胺>芳仲胺>芳叔胺;取代芳胺碱性与取代基性质有关。

一、实验目的1. 掌握由苯胺与酰氯反应制备酰胺的方法。
2. 熟悉反应原理及操作步骤。
3. 熟悉重结晶操作方法。
4. 了解实验过程中可能出现的副反应及其预防措施。
二、实验原理苯胺在酰氯的作用下,发生酰化反应生成酰胺。
酰化反应是一种重要的有机合成方法,可用于制备多种有机化合物。
本实验中,苯胺与酰氯反应生成酰胺,反应式如下:C6H5NH2 + RCOCl → C6H5NHCOCl + HCl其中,RCOCl代表酰氯。
三、实验药品与仪器1. 实验药品:- 苯胺:0.1mol- 酰氯:0.15mol- 无水乙醚:适量- 碱性氧化铝:适量- 碳酸钠:适量2. 实验仪器:- 100mL圆底烧瓶- 100mL分液漏斗- 滴液漏斗- 冷却水浴- 抽滤装置- 烘箱- 热水浴四、实验步骤1. 将苯胺和酰氯按一定比例加入100mL圆底烧瓶中,加入适量无水乙醚作为溶剂。
2. 将圆底烧瓶放入冷却水浴中,控制温度在0~5℃。
3. 缓慢滴加碱性的氧化铝,使反应体系呈碱性,加速酰化反应。
4. 反应一段时间后,用滴液漏斗加入适量的碳酸钠溶液,调节pH值至8~9。
5. 将反应液倒入分液漏斗中,静置分层。
有机层用无水乙醚洗涤,水层用碳酸钠溶液洗涤。
6. 将有机层合并,用无水乙醚洗涤,然后加入适量的碱性氧化铝进行干燥。
7. 将干燥后的产物过滤,得到粗酰胺。
8. 将粗酰胺溶解在适量的无水乙醚中,加入适量的碳酸钠溶液,调节pH值至8~9。
9. 将反应液倒入分液漏斗中,静置分层。
有机层用无水乙醚洗涤,水层用碳酸钠溶液洗涤。
10. 将有机层合并,用无水乙醚洗涤,然后加入适量的碱性氧化铝进行干燥。
11. 将干燥后的产物过滤,得到纯净的酰胺。
12. 将纯净的酰胺在烘箱中干燥,得到产物。
五、实验结果与分析1. 反应时间:实验中酰化反应所需时间为30~60min,具体时间取决于反应温度和反应物比例。
2. 产率:实验中酰胺的产率约为60%~70%,具体产率取决于反应物比例和反应条件。

氨的制备与性质氨(化学式:NH3)是一种无色气体,具有强烈的刺激性气味。
它是一种重要的化学物质,广泛应用于农业、医药、化工等领域。
本文将介绍氨的制备方法以及其主要性质。
一、氨的制备方法1. 卡斯特纳方法(Kastner方法)卡斯特纳方法是氨的传统制备方法之一。
该方法利用铜或镍催化剂催化水蒸气和甲烷(CH4)的反应,生成氨。
反应方程式如下:CH4 + H2O → CO + 3H2CO + 2H2 → CH3OHCH3OH → CH2O + H2CH2O + H2 → NH3 + H2O2. 哈伯-博什过程(Haber-Bosch process)哈伯-博什过程是目前主要用于工业制备氨的方法。
该方法以氮气(N2)和氢气(H2)为原料,在高温(400-500°C)和高压(150-200atm)下,经过催化剂(通常是铁或铁锆混合物)的作用生成氨。
反应方程式如下:N2 + 3H2 → 2NH33. 溴胺催化法溴胺催化法是一种非常简便的制备氨的方法。
该方法通过将溴胺反应生成氨气。
溴胺(NH2Br)在高温下分解为氨气和溴化氢(HBr)。
反应方程式如下:2NH2Br → NH3 + HBr + Br2二、氨的性质1. 物理性质氨是一种无色气体,在标准状态下(25°C,1atm),氨的密度为0.73 g/L。
它具有一股刺激性的气味,并且可溶于水,与水形成氨水。
2. 化学性质氨具有一系列重要的化学性质。
(1)碱性氨是一种弱碱性物质,它能和酸反应产生盐和水。
例如,氨与盐酸反应生成氯化铵:NH3 + HCl → NH4Cl(2)与酸性氧化物反应氨能与酸性氧化物反应生成盐和水。
例如,氨与二氧化碳反应生成尿素:2NH3 + CO2 → (NH2)2CO + H2O(3)与过氧化氢反应氨能与过氧化氢发生剧烈反应,产生氮气和水:2NH3 + 2H2O2 → N2 + 3H2O(4)氧化性氨在高温下能够发生自燃反应,生成氮气和水:4NH3 + 3O2 → 2N2 + 6H2O(5)还原性氨是一种良好的还原剂,它能够还原金属离子和氧化物。
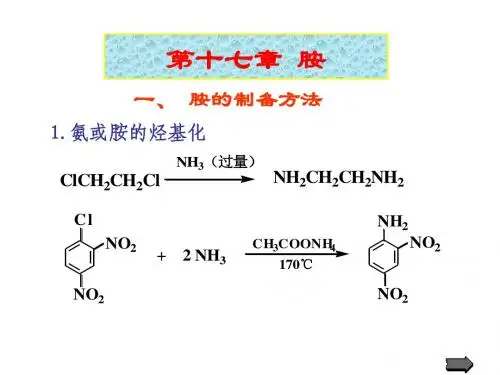

制备芳香胺的方法
芳香胺是一类具有芳香环的有机化合物,通常通过以下方法制备:
1.邻苯二酚胺化法:将邻苯二酚和氨水或者氨水溶液中加入还原剂
(如亚硫酸钠、铁粉等),经过还原和氧化反应,生成邻氨基苯酚,再通过酸碱中和、过滤和结晶等步骤得到芳香胺。
2.硝基还原法:将芳香硝基化合物(如硝基苯)加入还原剂(如亚
铁离子、亚硫酸钠等)中还原,生成相应的芳香胺。
这种方法可以制备单一的芳香胺,而且对于硝基化合物种类不同的情况下也能适用。
3.芳香酰氯胺化法:将芳香酸加入到氯化亚砜等反应物中,生成相
应的芳香酰氯,再将芳香酰氯加入到氨水或胺类反应物中,生成芳香胺。
这种方法的优点在于能够根据不同的芳香酰氯和胺类反应物种类进行反应,从而制备多种不同的芳香胺。
这些方法中,邻苯二酚胺化法和硝基还原法在实验室和工业上广泛应用,而芳香酰氯胺化法则更适用于制备特定的芳香胺。

有机化学中的胺与胺衍生物胺和胺衍生物在有机化学中扮演着重要的角色。
胺是指含有一个或多个氨基(-NH2)官能团的有机物,而胺衍生物则是由胺基官能团和其他官能团组成的化合物。
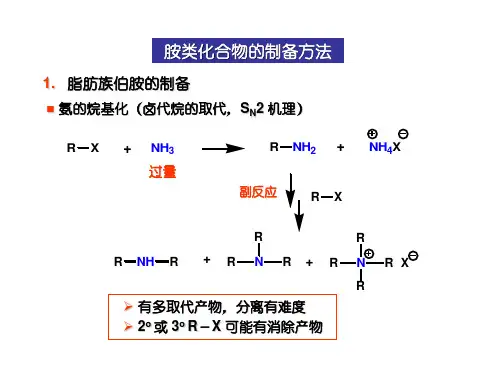
1. 胺的分类胺可以分为三类:一级胺、二级胺和三级胺。
一级胺是指含有一个氨基和两个有机基团的化合物;二级胺含有两个氨基和一个有机基团;三级胺含有三个氨基和没有氢原子的有机基团。
2. 胺的制备胺的制备方法主要有两种:一是通过氨和卤代烷类发生取代反应制备;二是通过亲核取代反应合成。
此外,还可以通过胺的重排反应或通过还原醛、酮和酸的亲核加成来制备胺。
3. 胺的物化性质胺具有氨的性质,可形成氮氢键,以及独特的碱性。
一级胺和二级胺可形成氮氢键,而三级胺则不具有此性质。
胺还可与酸反应生成相应的盐。
4. 胺的化学反应胺在有机化学反应中表现出多种多样的特性。
例如,胺能够与醛、酮等羰基化合物进行亲核加成反应,生成相应的胺衍生物。
此外,胺还可参与亲电取代、烃化等反应。
5. 胺衍生物的应用胺衍生物在药物合成、染料制备、农药研发等领域具有重要的应用价值。
许多药物中都含有胺基结构,例如氨基酸、生物碱等。
胺衍生物还用于合成有机染料,其中许多染料颜料的颜色来源于胺基基团。
农药中也存在许多胺衍生物,用于控制害虫和病虫害。
6. 胺的重要性胺及其衍生物在有机化学中具有重要的地位。
它们不仅可以作为反应底物,还可以作为反应催化剂或配体参与各种重要有机合成反应。
胺也是许多重要化学品和生物分子的构建块,对于我们理解生命的基本单位和化学反应机理至关重要。
综上所述,胺及其衍生物在有机化学中扮演着不可忽视的角色。
它们的分类、制备方法、物化性质、化学反应和应用都具有一定的特点和重要性。
深入了解和研究胺的性质和反应机理对于推动有机化学的发展和应用具有重要意义。
丙胺的工业合成方法丙胺是一种重要的有机化合物,主要应用于制备工业用途的胺类化合物。
它可以通过多种合成方法获得,下面将详细介绍几种常用的工业合成方法。
1.氢氧化氨驱动催化剂法这种合成方法是最常见的工业合成方法之一、其步骤如下:1)首先将丙烯通过氨气和氢氧化钠水溶液反应,生成丙酰胺。
C3H6+NH3+NaOH→CH3CH2CONH2+H2O2)然后将丙酰胺经过氧化反应,在氧气的催化下,生成丙酸。
CH3CH2CONH2+O2→CH3CH2COOH+H2O3)最后,将丙酸与氨气通过提高温度的催化剂反应,生成丙胺。
CH3CH2COOH+NH3→CH3CH2NH2+CO22.亚氨基甲醇氧化法这种方法需要亚氨基甲醇和空气作为原料。
具体步骤如下:1)首先将亚氨基甲醇经过催化剂的反应,在高温下氧化为甲酰胺。
CH3NH2+CH2O→H2C=OCONH2+H2O2)然后甲酰胺和氨气在催化剂的作用下进行合成反应,生成丙胺。
H2C=OCONH2+NH3→CH3CH2NH2+CO2+H2O3.热解丙酮法这种方法是使用丙酮作为起始原料,具体步骤如下:1)首先将丙酮与水合铵反应,生成丙酮氨缩。
CH3COCH3+NH4OH→(CH3)2CHCONH2+H2O2)然后将丙酮氨缩在高温下进行热解,生成丙胺。
(CH3)2CHCONH2→CH3CH2NH2+CO4.乙醇胺气化法这种方法以乙醇胺和过量氨为原料,具体步骤如下:1)首先将乙醇胺和过量氨气反应,生成乙醇胺铵盐。
NH3+(CH3CH2OH)3N→(CH3CH2OH)3NH++NH3-2)然后在高温下将乙醇胺铵盐进行气化,生成甲胺和丙胺。
(CH3CH2OH)3NH++NH3-→CH3NH2+CH3CH2NH2以上是几种常用的工业合成丙胺的方法。
这些方法具有操作简单、反应条件温和、产率高等优点,能够满足工业化生产的需求。
在实际应用中,选择合适方法需要根据具体的工艺要求和原料的供应情况来进行决定。
小分子胺的制备方法有多种,以下是一种常用的制备方法:
1.选择适当的起始原料,通常为醛、酮或羧酸等有机化合物。
2.在碱性条件下,与铵盐发生反应,生成相应的胺。
3.可以采用重氮化、还原、酰胺化等方法进行反应条件的优化和调整,以提高产率和
纯度。
4.通过蒸馏、结晶、萃取等分离手段,提纯得到小分子胺。
需要注意的是,小分子胺的制备涉及到多种化学反应和操作,需要在专业人员的指导下进行。
同时,为了保证安全和效果,建议在制备过程中严格控制反应条件和操作步骤,并遵循相关的安全规范和操作流程。