有机化学绪论——马朝红版
- 格式:ppt
- 大小:8.98 MB
- 文档页数:73

有机化学之绪论知识点1.有机反应类型均裂反应1.均裂反应:共价键断裂时,成键的一对电子平均分给两个成键的原子或基团,这种断裂方式成为均裂。
2.均裂产生的具有未成对电子的原子或基团称为自由基。
3.共价键均裂产生自由基而引发的反应称为自由基反应。
异裂反应1.共价键断裂时,成键一对电子完全由一个原子或基团独得成负离子,另一个原子或基团则缺一个电子而成正离子,这种断裂方式为异裂。
2.由共价键异裂产生离子而进行的反应称为离子型反应。
3.自由基,碳正离子和碳负离子都是反应过程中暂时生成的,瞬间存在的活性中间体。
协同反应在反应中没有明显分布的共价键的均裂和异裂,即没有自由基或带电荷的离子生成,反应是通过一个环状的过渡态,化学键的断裂和形成同时完成而得到产物。
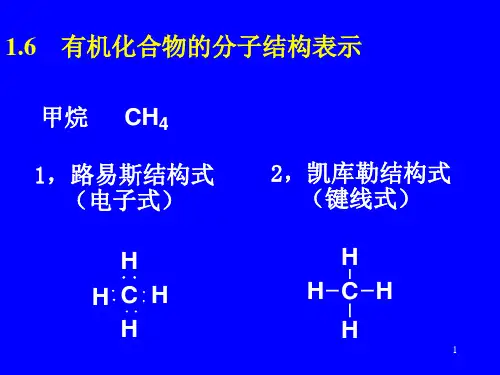
2.有机化合物构造式的表示方法分子式,电子式、结构式、结构简式、键线式3.便于理解有机物分子的结构—分子模型球棍模型、比例模型4.异构现象1.异构体一般分为构造异构体和构型异构体。
2.构造异构体指分子中原子的连接方式和顺序不同。
3.构型异构体指分子的构造相同而原子或基团在空间的排布方式不同。
5.有机化合物的分类1.按碳链分类:开链化合物、碳环化合物、杂环化合物2.按官能团分类:烯、炔、卤代烃、醇或酚、醚等。
6.质子理论1.凡是能给出质子的物质为酸,能接受质子的物质为碱2.一个酸给出质子后生成的物质,即为该酸的共轭碱,一个碱接受质子后形成的物质,即为该碱的共轭酸。
3.酸越强,它的共轭碱的碱性就越弱。
4.优缺点:酸碱的质子理论扩大了酸碱的范围,应用十分方便。
它的缺点是那些不交换H+而具有酸性的物质不能包含在内。
7.电子理论1.由路易斯提出2.能够接受电子对的物质为酸,能够给出电子对的物质为碱。
3.酸碱电子理论中的酸碱反应实际上是形成配位键的过程。
8.分子间力1.即分子间存在的引力,一般称为范德华力2.范德华力包括:取向力、诱导力、色散力。
3.氢键是一种特殊的永久偶极间作用力。


《有机化学》第一章绪论一、教学内容本节课的教学内容来自于《有机化学》第一章绪论。
这部分内容主要包括有机化学的基本概念、有机化合物的分类、有机化学反应类型以及有机化合物的结构和性质。
具体内容包括:1. 有机化合物的定义和特点:介绍有机化合物的概念,解释有机化合物的特点,如碳氢化合物的存在、有机化合物的命名规则等。
2. 有机化合物的分类:介绍烷烃、烯烃、炔烃、芳香烃等有机化合物的分类和特点,解释它们的结构差异和性质特点。
3. 有机化学反应类型:介绍加成反应、消除反应、取代反应等有机化学反应类型,解释反应机理和反应条件。
4. 有机化合物的结构和性质:介绍有机化合物的结构特点,如碳原子的四价键、有机化合物的同分异构现象等,解释有机化合物的物理性质和化学性质。
二、教学目标1. 学生能够理解有机化学的基本概念和特点,掌握有机化合物的分类和命名规则。
2. 学生能够了解有机化学反应的类型和机理,理解反应条件和反应产物的关系。
3. 学生能够分析有机化合物的结构和性质,运用有机化学的基本原理解决实际问题。
三、教学难点与重点重点:有机化合物的分类和特点、有机化学反应类型和机理、有机化合物的结构和性质。
难点:有机化合物的结构和性质的理解和应用、有机化学反应机理的掌握。
四、教具与学具准备教具:黑板、粉笔、多媒体教具、有机化合物的模型或图示。
学具:笔记本、笔、有机化合物的结构模型或图示、有机化学反应机理的图示。
五、教学过程1. 引入:通过展示有机化合物的实际例子,如糖类、脂肪、蛋白质等,引起学生对有机化学的兴趣,引出本节课的主题。
2. 讲解:在黑板上用粉笔写出有机化合物的定义和特点,引导学生理解有机化合物的概念和特点。
然后,通过图示和模型,讲解有机化合物的分类和结构特点,如烷烃、烯烃、炔烃、芳香烃等。
3. 示例:通过具体的有机化学反应实例,讲解加成反应、消除反应、取代反应等有机化学反应类型,解释反应机理和反应条件。
4. 练习:给出一些有机化合物的结构和性质的题目,让学生通过观察和分析,回答题目,巩固对有机化合物的结构和性质的理解。

1第1章 绪 论1.1 基本要求● 掌握有机化合物与有机化学的定义、有机化合物的特点。
● 掌握有机化合物结构特点,熟悉共价键的性质及其意义。
根据有机化合物的价键特征分析分子间作用力,进一步理解有机化合物特点。
● 掌握共价键的断裂方式与有机反应类型、有机反应中间体。
1.2 基本知识点1. 有机化合物及其特点 有机化合物是指含碳的化合物或碳、氢化合物及其衍生物。
组成有机化合物的主要元素包括C ,H ,O ,N ,S ,P ,X (卤素)。
仅由碳、氢两种元素组成的有机物称为烃,若还含有其他官能团,则称为烃的衍生物。
有机化学是研究有机物的组成、结构、性质及其相互转化的一门学科。
与无机物相比,有机物具有以下特点:多数有机物易燃烧;熔点低;化学反应速率慢,副反应多;难溶于水,易溶于有机溶剂。
有机物的以上特点都是由其结构特征所决定的。
2. 经典结构理论 组成分子的若干原子在分子内是按一定的顺序和结合方式连接着的,这种排列和结合方式称为结构。
19世纪中叶,由凯库勒(A.Kekul é)、库柏尔(A.Couper )、布特列洛夫(A.M.Buteleroff )、范特荷夫(J.H.van't Hoff )、勒贝尔(J.A.Le Bel )等提出的经典结构理论要点如下:(1)有机化合物中的碳元素总是四价的,其他元素都有各自的氧化值,如氢一价、氧二价、氮三价、卤素一价;(2)碳原子间可以彼此以单键、双键或叁键结合。
例如: (3)饱和碳原子具有正四面体结构:(4)分子结构决定分子性质,性质反映结构。
根据上述要点,就可以依分子式写出化合物的可能结构。
经典结构理论反映了原子间的结合方式及组成,但无法说明为什么要以一定比例结合。
3. 原子轨道 原子轨道是波函数Ψ的图像。
Ψ是描写原子核外电子运动状态的数学函数式,可以粗略地把Ψ看作是在x,y,z 三维空间里能找到电子的一个区域。
原子轨道有s ,p ,d ,f ,g 等不同类型。




有机化学之绪论知识点1.有机化合物定义:含碳的化合物,或者碳氢化合物及其衍生物。
可含C、H、O、N、P、S等元素。
2.有机化学定义:研究有机化合物的化学,即研究有机化合物的来源、制备、结构、性能、应用以及有关理论和方法的科学。
3.德国化学家伍勒首次用无机物合成了有机物—尿素。
NH4Cl+AgCNO→AgCl+NH4CNONH4CNO△(NH2)2CO4.柯贝尔合成醋酸,柏塞罗合成了油脂。
5.结构特点有机物结构上的特点可以概括为组成简单,数目众多,结构复杂。
有机化合物组成简单,数目众多的主要原因就是它的结构复杂。
6.性质特点(多数有机化合物)1.易燃烧2.熔沸点较低3.易溶于有机溶剂而难溶于水4.反应慢,副反应多5.特例:有机物CCl4不但不能燃烧,而且可用作灭火器。
7.价键理论1.自旋方向相反的未成对电子互相接近时才能形成稳定的共价键。
2.如果一个原子的未成对电子已经配对,就不能在与其它原子的未成对电子配对,这就是共价键的饱和性。
3.形成共价键的本质是电子云重叠。
成键电子云越多,形成的键越强,即共价键的键能与原子轨道重叠程度成正比。
尽可能在电子云密度最大的地方重叠,这就是共价键的饱和性。
4.能量相近的原子轨道可进行杂化,组成能量相等的杂化轨道,使成键能量更强,体系能量更低,成键后达到最稳定的分子状态。
8.σ键和π键1.σ键原子轨道沿着对称轴方向重叠形成的共价键。
2.π键原子轨道侧面重叠而形成的共价键。
9.σ键和π键的比较1.σ键重叠程度比较大,电子的流动性较小,键比较稳定;而π键重叠程度比较小,电子的流动性大,易极化,键比较易断。
2.σ键是轴对称,以σ键相连的两个原子可以绕轴自由旋转;而π键是面对称,以π键相连的两个原子不能自由旋转。
3.σ键可以单独存在,π键不能单独存在。
10.分子轨道理论原子组成分子轨道,必须具备一定的条件1.能量相近2.原子轨道最大重叠3.位相相同(对称性匹配)11.键能1.形成共价键过程中放出的能量或共价键断裂过程中体系吸收的能量,称为键能。