微生物燃料电池资料 共33页
- 格式:ppt
- 大小:697.00 KB
- 文档页数:33



微生物燃料电池1.引言能源紧张和环境污染是可持续发展面临的重大挑战。
经济发展的同时,能源消耗也在急剧增长,而现有的化石能源消耗则带来了环境质量的不断恶化。
寻找新型能源,实现经济、社会和环境的可持续发展是当今社会的主要研究问题。
清洁能源的发展则成为解决问题的关键。
与此同时,不断发展的生物燃料电池成为了人们关注的焦点。
微生物燃料电池的兴起为可再生能源的生产和废弃物的处理开辟了新途径。
首先,微生物电池的燃料来源比较多样化,如多种有机无机材料,甚至能够直接利用废液、废物作为原料产生电能,净化环境。
其次,微生物燃料电池能够实现无污染、零排放、无需能量输入,满足环境友好型电池的需求。
此外,微生物燃料电池的能量转化效率非常高,可以发展成长效、低廉的能量系统;加上其操作条件是在常温常压的温和条件下工作,实现了电池的低维护成本和高安全性[1]。
微生物燃料电池的发展历史中,经历了几次重大进步。
1911年Potter用酵母和大肠杆菌进行实验,首次实现了微生物产电,从此开启了微生物燃料电池发展的道路[2]。
20世纪80年代,细菌发电取得重大进步,随后微生物燃料电池的输出功率也有了较大的提高,其作为小功率电源使用的实际应用也进一步成为可能。
2002年以后,微生物燃料电池的研究更是进入了飞速发展阶段,研究人员不仅发明了无需电子传递中间体的燃料电池,也在降低内阻、功率输出、优化结构和降低成本等方面都取得了重大进步。
近年来,微生物燃料电池的应用领域也更加宽泛。
2.微生物燃料电池的原理微生物燃料电池是一种利用微生物进行能量转换,把呼吸作用产生的电子传递到电极上的装置,能够通过产电菌代谢可生物降解的有机物,并将代谢产生的电子传递到外电路输出电能。
原理如图1所示[3]。
微生物燃料电池中,氧化底物的细菌通常在厌氧条件下将电子通过电子传递中介体或者细菌自身的纳米导线传递给阳极,电子通过连接阴阳两极的导线传递给阴极,而质子通过隔开两极的质子交换膜(Proton exchange membrane, PEM)到达阴极,在含铂的阴极催化下与电路传回的电子和O2反应生成水[4]。

微生物燃料电池原理与应用微生物燃料电池(Microbial Fuel Cell, MFC)是一种利用微生物氧化有机物产生电能的装置。
它基于微生物的电化学反应来产生电力,将化学能直接转化为电能。
微生物燃料电池的原理是通过利用微生物的代谢作用将有机废物(如人类粪便、废水等)中的化学能转化为电能,实现能量回收和减少污染物的排放。
该技术有着巨大的潜力,能够广泛应用于废水处理、能源生产和环境保护等领域。
微生物燃料电池中的关键组成部分是阳极和阴极。
阳极是微生物活动的场所,它提供了一个良好的电子传递通道。
通常情况下,阳极材料是由导电性好的物质构成,如碳纳米管、碳纳米颗粒等。
阴极则是电子和氧气进行还原反应的场所,它常常使用氧化剂(如氧气或氯离子)来参与电子转移反应。
阳极和阴极之间的电子传递通过外部电路完成,从而产生电能。
微生物燃料电池的关键是利用微生物的代谢作用。
在阳极的表面,微生物通过氧化有机物来产生电子和质子。
微生物中的电子经过阳极材料传递到外部电路中去,形成电流。
同时,微生物释放质子到电解质中去。
质子在电解质中通过离子交换膜传递到阴极处与氧气结合,还原发生的氧化反应,并接受电子,形成水。
这个过程实际上是微生物通过氧化有机物来释放能量,将化学能转化为电能。
这个电能可以直接用来驱动负载,如电灯、泵浦等。
微生物燃料电池的应用非常广泛。
一方面,它可以作为一种有效的废水处理技术。
通过将微生物燃料电池应用于废水处理厂,可以不仅处理废水中的有机物,还能够产生电能。
这就在一定程度上实现了能源回收和环境保护的双重效果。
另一方面,微生物燃料电池还可以应用于能源生产。
有机废物广泛存在于农村、城市和工业生产中,通过利用微生物燃料电池来转化这些有机废物为电能,可成为一种可再生能源来源。
此外,微生物燃料电池还可以应用于生物传感器和无源传感器等领域。
尽管微生物燃料电池具有广泛的应用前景,但目前仍然有一些挑战需要克服。
首先,阳极材料的选择和优化对微生物燃料电池的性能至关重要。

微生物燃料电池摘要:微生物燃料电池的研究集中于产电细菌、电极材料和电池反应器构型等方面,同时,微生物燃料电池在废水处理、生物修复等方面具有广阔的应用前景。
本文介绍了微生物燃料电池的原理、影响微生物燃料电池的因素及近几年微生物燃料电池在环境污染治理中的研究进展。
关键词:微生物燃料电池双室质子交换膜微生物燃料电池(Microbial Fuel Cell, MFC)是利用微生物的催化作用将废弃物中碳水化合物的化学能转化为电能的一种装置[1]。
MFC 是一种清洁能源,符合循环经济、清洁生产和可持续发展的要求。
随着微生物、电化学及材料等学科的发展,MFC 的结构和性能不断改善[2],逐步向环境领域扩展。
MFC的构造在双室[3]的基础上出现了单室[4]及升流式MFC[5],底物由单一小分子有机物,如醋酸钠[3]、葡萄糖[4],转向大分子混合有机物,如氯酚废水[6]、秸秆废水[7]、啤酒废水[8]等。
本文对MFC的工作原理、构造态进行了讨论,对提高MFC性能的途径和方法进行了整合。
1MFC工作原理及结构1.1MFC工作原理微生物燃料电池以附着于阳极的微生物作为催化剂,降解有机物(葡萄糖、乳酸盐和醋酸盐等) 产生电子和质子。
产生的电子传递到阳极,经外电路到达阴极,由此产生外电流;产生的质子通过分隔材料(质子交换膜(PEM) 或盐桥) 或直接通过电解液到达阴极,在阴极与电子、氧化物(铁氰化钾、氧气等) 发生还原反应,从而完成电池内部电荷的传递[9]。
而MFC另外一个重要的过程就是电子的转移(图1)[10]。
目前学术界普遍接受的观点有三种:(1)细胞膜:该机理认为,生长在电极表面的细菌只有将细胞膜接触到电极的表面,代谢过程产生的电子才能通过细胞膜中的细胞色素传导到电极上[11]。
有机物在细菌体内代谢,通过同化作用生成细胞体,异化作用生成CO2,释放的电子通过细胞色素传导到电极表面。
直接电子转移需要微生物拥有膜连接电子运输蛋白质中间体,这种中间体能够将电子从细胞内部转移到外部,进而达到固态电子受体表面。

微生物燃料电池简介摘要:微生物燃料电池是一种新型的能源装置,具有污废弃物处理与同步产电的优点,应用范围广,具有巨大的潜在应用价值,本文对其做了一个简要的介绍。
关键词:微生物燃料电池污水处理产电前言:微生物燃料电池(MFC)是一种通过微生物代谢生物质将化学能直接转变为电能的装置,兼具处理废水与产电的功能,从而大大降低污水处理成本。
早在1911年英国植物学家Potte就发现利用酵母菌和大肠杆菌可以产生电流[1];但是一直未受到人们的关注。
直到20世纪80年代美国科学家设计了一种利用宇航员的排泄物和活细菌作为电极活性物质的细菌电池,这种电池可为宇宙飞船提供电能,但其发电效率较低;到2004年,废水首次被用作MFC的燃料来发电,并获得了146±8mW m-2的功率密度。
此后大量研究表明多种类型的废水都可以用于MFC中,MFC在废水处理方面的研究获得了较大进展。
在近20年的研究中,MFC的规模在逐步扩大。
目前,实验室所用MFC的大小从几微升到几升之间。
产电功率得到了明显提升,产电功率已达到2.8kW m-3。
近年来,对MFC 的研究逐渐引起了国内外研究学者的关注。
一、MFC的工作原理一个典型的MFC 共由四部分组成:阳极、阴极、电解池和外电路。
它以阳极室中的微生物作为催化剂,以阳极液中的有机物质作为燃料,利用微生物降解生物质,从而产生电子,产生的电子到达阳极,由阳极转移到外电路,最后通过外电路传递到阴极。
微生物在降解有机物质产生电子的同时还产生质子,产生的质子通过两极室之间的质子交换膜到达阴极。
在阴极催化剂的作用下,质子、电子和氧化剂发生反应生成还原剂。
从而完成电池内的电流传递过程,产生电能。
当外电路接入负载时,MFC 产生的电能足够多时,MFC 便能够支持负载工作。
二、MFC的分类根据分类标准的不同,MFC的分类方法有所不同。
(一)根据不同类型的微生物,MFC可分为沉积物型、异养型和光能异养型三种类型。


Appl Microbiol Biotechnol(2006)71:833–839DOI10.1007/s00253-005-0207-3BIOTECHNOLOGICALLY RELEVANT ENZYMES AND PROTEINSJingxue Wang.Haijin MouXiaolu Jiang.Huashi GuanCharacterization of a novelβ-agarase from marine Alteromonas sp.SY37–12and its degrading productsReceived:22August2005/Revised:25September2005/Accepted:28September2005/Published online:24November2005 #Springer-Verlag2005Abstract The phenotypic and agarolytic features of anunidentified marine bacteria isolated from the southernocean of China was studied.The strain was gram-negative,aerobic,and polarly flagellated.It was identified as thegenus Alteromonas according to its morphological andphysiological characterization.In solid agar,the isolateproduced a diffusible agarase that caused agar softeningaround the colonies.An extracellular agarase was purifiedby the procedure of ammonium sulfate precipitation,gelfiltration on Sephacryl S-100HR,and ion-exchange chro-matography on diethylaminoethyl-Sepharose.The purifiedprotein exhibited a single band on SDS-PAGE with amolecular mass of39.5kDa.The enzyme hydrolyzed the β-1,4-glycosidic linkages of agar,yielding neoagarote-traose and neoagarohexaose as the main products.Theoptimum reaction temperature of the agarase was35°C,with a narrow range from30to45°C.The enzyme activityreached the maximum at pH7.0and in the presence of2%NaCl.Molecular mass and degrading products showed thatthe agarase from Alteromonas sp.SY37-12was muchdifferent from those previously reported.IntroductionAgar,as an important food additive and bacterial culturemedium,is one of the most well-known marine poly-saccharides.Additionally,various potential physiologicalactivities of polysaccharides and oligosaccharides derivedfrom agar have been reported,such as antivirus(Takemoto1966),antitumor(Fernandez et al.1989),immune en-hancement(Yoshizawa et al.1993),antioxidation(Wang et al.2004;Zhang et al.2003),and elicitor activity on plant (Weinberger et al.2001).Agar has been determined to have a linear chain structure composed of alternating residues[O-3,6-α-anhydro-L-galac-topyranosyl(1!3)O-β-D-galactopyranose]combined byβ-1,4bonds(Hamer et al.1977).It is confirmed that agar oligosaccharide can be attained by many methods,including chemical degradation and enzyme hydrolysis.A special enzyme hydrolyzing the agar,agarase(agarose4-glycanohy-drolase,E.C.3.2.1.81),has been found in certain marine mollusks(Usov and Miroshnikova1975).However,the most was reported from several bacterial genera,including Cytophaga (Van der Meulen et al.1974),Vibrio(Aoki et al.1990), Actinomyces(Stanier1942),Alteromonas(Leon et al. 1992),Pseudoalteromonas(Vera et al.1998),and Pseu-domonas(Ha et al.1997),etc.Most of these bacteria were isolated from marine environments,while a few species isolated from rivers(Agbo and Moss1979),hot spring (Shieh and Jean1998),soil(Sampietro and Vattuone de Sampletro1971),and sewage(van Hofsten and Malmqvist 1975)have also been described.Agarase-producing bacteria can be classified into two groups according to the mode of action on agar:α-agarases cleave theα-1,3linkage of agarose(Young et al.1978)and β-agarases cleave theβ-1,4linkage of agarose(Duckworthand Turvey1969).Some of the agarase have been purified and characterized in the past years.In our laboratory,we have isolated a marine bacterium,Alteromonas sp.strain37-12, which has the high ability to decompose the agar from the southern ocean of China.We describe here the identification of this strain,the characterization of its extracellularβ-agarase,and the composition of its degrading products.Materials and methodsIsolation of strains and cell growthThe agarase-producing strain SY37-12was isolated in this laboratory from the surface of rotted red algae in the South China Sea coast in Sanya,Hainan Island.The screeningJ.Wang.H.Mou(*). X.Jiang.H.GuanOcean University of China, Qingdao,266003,PR Chinae-mail:mousun@ Tel.:+86-532-82032290 Fax:+86-532-82894024was carried out on agar plates in a medium containing2.0% NaCl,0.1%K2HPO4,0.1%NH4Cl,0.05%MgSO4,0.01% CaCl2,and1.5%agar.The plates were incubated at33°C for48h.Colonies that formed pits or clearing zones on agar were picked up and purified further by the same plating method.For liquid culture,0.2%agar was added before sterilization.The agar used here was commercial agar powder extracted from Gracilaria verrucosa(Mingfu Sea-weed Industry Co.,Fujian Province,China).Alteromonas sp.strain37-12is stored now in the China Center for Type Culture Collection(CCTCC),with strain number M204009.Evaluation of agarase activityAgarase activity was determined by measuring the increase in the concentration of reducing sugar as described by von Borel et al.(1952).The isolated colonies were inoculated into a medium of the same composition as that of isolation medium,except that the agar concentration was lowered to 0.2%.The cells were incubated in an orbital shaker at 150rpm and33°C for24h.After centrifuging at7,000×g for15min to remove bacterial cells and gel residues,a1-ml culture supernatant was added to20ml pH7.0phosphate buffered saline solution(PBS)with0.5%agar substrate and incubated at33°C for30min.Then the1-ml reaction solution was mixed with1.5ml3,5-dinitrosalicylic acid (DNS)reagent.After being heated at100°C for5min and then cooled,the mixture was diluted to25ml with deionized water.Optical density was read at520nm,and values for reducing sugars were expressed as D-galactose equivalents.One unit of agarase activity was defined as the amount of enzyme that released1μmol reducing sugar (measured as D-galactose)from agar per minute under the above conditions.Purification of agaraseUnless specified otherwise,all operations were done at 4°C.An overnight culture of strain SY37-12was prepared in the medium described above and transferred to250ml of fresh medium containing0.2%agar.Incubation was carried out in an orbital shaker at150rpm and33°C for24h until the stationary phase,followed by centrifugation at7,000×g for15min.The supernatant was brought to80%saturation with solid ammonium sulfate overnight.The collected enzyme protein was resuspended in20ml of50mM Tris–HCl(pH7.5),sealed in dialysis bags(cut-off value, 12,000–14,000MW),and dialyzed three times against the same buffer at4°C for2days.The dialyzate was loaded onto a diethylaminoethyl(DEAE)-Sepharose column (1.5cm×20cm,Pharmacia)equilibrated with50mM Tris–HCl(pH7.5).The flow rate was adjusted to0.5ml/ min.The protein was eluted from the column with the same buffer containing a linear NaCl gradient(0∼1.0M),and the elute fractions were collected.The eluates were monitored continuously at280nm,and fractions were assayed for activity against agar.Fractions containing agarase activity were pooled and concentrated by polyethylene glycol20,000,then applied for gel filtration chromatography on Sephacryl S-100HR (1.2cm×92cm,Pharmacia)equilibrated with50mM Tris–HCl(pH7.8).The flow rate was adjusted to0.7ml/min. Fractions were assayed for protein and agarase activity. The enzyme was lyophilized and stored at−20°C and was stable for more than2months.The purification of the fractions was assessed by sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE).SDS-PAGE was performed in a0.75-mm slab gel consisting of a stacking gel(5%polyacrylamide)and a separating gel(12.5%polyacrylamide)with25mM Tris–HCl buffer,pH7.8.Proteins were stained with Coomassie brilliant blue R-250.Molecular mass standards were phosphorylase (97.4kDa),bovine serum albumin(66.2kDa),ovalbumin (42.7kDa),carbonic anhydrase(31kDa),soybean trypsin inhibitor(21.5kDa),and lysosyme(14.4kDa).Effects of temperature and pH on enzymeactivity and stabilityThe optimum temperature of agarase was determined at different temperatures(from20to50°C).Temperature stability was determined by measuring the residual ac-tivities after incubation at different temperatures.These studies were carried out in sealed Eppendorf tubes that were completely immersed in a water bath at the required temperatures.Samples(1ml)were removed after incuba-tion at each of the indicated time periods,chilled on ice and then assayed for enzyme activity.The optimum pH was determined with agar as substrate dissolved in KH2PO4–NaOH buffer with different pH values(5.0–9.0).The optimum NaCl concentration in the reaction solution was determined in PBS solution(pH7.0) with different NaCl concentration(0–5.0%).Preparation of agar oligosaccharidesTen grams of agar powder was scattered in500ml deionized water.A50-ml agarase solution(total agarase activity was90U)extracted from strain SY37-12was added to the agar solution.The reaction was carried out at 33°C for12h,and then was stopped by heating the solution in boiling water for10min.Twofold ethanol was added to the reaction mixture to remove the high-molecular-mass polysaccharides.After centrifugation and concentration, the depolymerized end-products were produced by re-peated ethanol fractionation.Structural analysis of agar oligosaccharidesThe molecular mass distribution of the agar oligosaccha-rides was determined by matrix-assisted laser desorption834ionization time-of-flight mass spectrometry(MALDI-TOF-MS)using LDI-1700instrument(Linear Scientific, Inc.,USA).The instrument was fitted with a pulsed nitrogen laser at337nm with3ns pulse duration.2,5-Dihydroxybenzoic acid(DHB)was used as the matrix. Infrared spectroscopy was performed using a Nicolet Nexus470spectrophotometer(Thermo Nicolet,Madison, WI,USA).For13C-NMR spectroscopy analysis,the samples were taken up in2H2O and processed at30°C. Spectra were recorded on a JNM-ECP600SCM spec-trometer(JEOL,Tokyo,Japan).ResultsStrain properties and identificationBacteria isolated from different areas of the China Sea were screened for a stable and effective agar-decomposingenzyme.A total of216strains producing agar-decompos-ing enzyme were isolated from the soil or seaweed surface, including Vibrio,Alteromonas,and Cytophaga.Strain SY37–12,isolated from the red alga Gracilaria verrucosa collected on Hainan Island of China,produced a large quantity of extracellular agarase when incubated in basal salt medium.The strain SY37-12produced soft pits on the agar surface with clear haloes around the bacteria colonies, which was regarded as an obvious mark indicating the high ability of degrading agar.Electron micrograph of the strain showed a polarly flagellated and straight-rod-shaped cell, 0.5–0.6μm×1.2–1.5μm.It was gram-negative and oxidase-and catalase-positive.It requires sodium ion for growth,has an oxidative metabolism,and does not ac-cumulate poly-β-hydroxybutyrate(PHB)as an intracellu-lar reserve product.The preliminary identification results showed that the morphologic and physiological character-istics of this strain were in accordance with Alteromonas, according to Bergey’s Manual of Systematic Bacteriology (Holt et al.1994)(Table1).Agarase produced by SY37-12was shown to be an induced enzyme.In the presence of crude agar,the strain produced extracellular agarase.No detectable agarase activity was found in the culture medium without agar. Furthermore,the addition of carrageenan,alginate,starch, galactose,lactose,and glucose in the absence of agar showed no effects on the production of agarase of SY37-12.When the agar was used as the sole carbon source,theTable1Morphologic and physiological characteristics of Altero-monas sp.SY37–12Characteristics tested Results Cell shape Straightrod Microcysts or endospores-Polar flagellum+ Production of pigments-Growth at4°C-Growth at35°C+ Growth at40°C-Anaerobic growth-Organic growth factors required-Oxidase reaction+ Catalase reaction+Argin1ine dihydrolase-Accumulation of PHB-O/F test O Production of H2S-Requirement of sodium for growth+ Hydrolysis of agar,starch,carrageenan,and gelatin+ Hydrolysis of alginate,chitin,and cellulose-Utilization of D-glucose,D-galactose,D-fructose,sucrose, cellobiose,and D-mannose+ Utilization of L-arabinose,dulcitol,raffinose,andD-ribose-Culture time (h)Agaraseactivity(U/ml)Biomass(OD6)Agarase activityFig.1Growth and agarase activity of Alteromonas sp.SY37–12. Fermentation liquids were monitored at600nm for biomass(□)and assayed for agarase activity(◊)by measuring the increase in the concentration of reducingsugar01836547290108Elution time (min)OD28Agaraseactivity(U/ml)Fig.2Ion-exchange chromatography of agarase on DEAE-Sepha-rose.The Tris buffer containing gradient NaCl rising from0to 1.0M at a flow-rate of0.5ml/min was used to wash out the sample. Fractions were monitored continuously at280nm for protein content(♦)and assayed for agarase activity(□)by measuring the increase in the concentration of reducing sugar835agarase activity of fermentation medium of SY37-12reached a maximum of 1.8U/ml after cultivation in conventional batch culture for 20h,whereas the biomass peaked at 24h (Fig.1).Purification of agaraseAccording to the pattern of ion-exchange chromatography on DEAE-Sepharose,several protein peaks were contained in the agarase sample (Fig.2).Additional purification of the fractions with agarase activity was achieved by gel filtration on Sephacryl S-100(Fig.3).Three protein peaks were shown in the chromatography,which was in ac-cordance with the result of SDS-PAGE (Fig.4).Thepurified enzyme had a molecular mass of 39.5kDa,as determined by a comparison with the mobility of protein standards.The purification steps and recovery rate of the agarase is summarized in the Table 2.Enzyme propertiesThe optimum reaction temperature of the agarase was 35°C,with a narrow range from 30to 45°C.At 20°C,the enzyme activity was only 30%in comparison with the maximum.The agarase was heat-labile,with rapid loss of activity when treated at 50°C for 15min or at 70°C for 1min (Fig.5).It even lost above 80%of its original activity after incubation at 90°C for 20s.The effect of pH on the enzyme activity was determined at 33°C in the pH range 5.0–9.0.The agarase exhibited maximum activity at pH 7.0.Since strain Alteromonas sp.SY37-12camefromElution time (min)O D 2800.20.40.60.811.21.4A g a r a s e a c t i v i t y (U /m l )Fig.3Gel filtration chromatography of agarase on Sephacryl S-100.The Tris buffer at a flow-rate of 0.7ml/min was used to wash out the sample.Fractions were monitored continuously at 280nm for protein content (♦)and assayed for agarase activity (□)by measuring the increase in the concentration of reducingsugarFig.4SDS-PAGE of purified ne 1molecular mass standards,lane 2purified agarase by Sephacryl S-100(only one band with a molecular mass of 39.5kDa),lane 3partly purified agarase by DEAE-Sepharose (three bands exist in the sample)Table 2Purification of agarase from Alteromonas sp.SY37-12StepV olume (ml)Agarase (U)Protein (mg)Specific activity (U/mg)Purification (-fold)Yield (%)Cell-free medium 1,0001,818606.2 3.0110080%(NH 4)2SO 4precipitate 45727157.84.61.540.0DEAE-Sepharose 20064217.137.512.535.3Sephacryl S-100HR2002593.183.527.814.2ab510152025Time (min)106050403020Time (s)R e l a t i v e a c t i v i t y (%)R e l a t i v e a c t i v i t y (%)Fig.5Effect of temperature on stability of agarase836the ocean,high NaCl concentration was necessary for its growth and enzyme production.When enzyme activity was measured in the presence of salt,a significant elevation could be observed.The enzyme activity reached the maximum in the presence of 2%NaCl,and then declined when the NaCl concentration continued to increase.MALDI-TOF-MS of the agarooligosaccharidesAfter sufficient hydrolysis and repeated fractionation by ethanol precipitation,the main depolymerized end-prod-ucts were collected.The MALDI-TOF mass spectrum of the sample was shown in Fig.6.According to the mass spectrum,the sample was an oligosaccharide mixture with polymerization degree from 4to 10.No sulfate group was linked in the sugar ring according to the molecular mass assignment.This speculation could be confirmed further by IR spectrum analysis and chemical determination (data not shown).The main composition was tetrasaccharide (MM-630Da)containing two galactopyranose residues (G-units)and two 3,6-anhydrogalaxtopyranose residues (An-units),hexasaccharide (MM-936Da)containing three G-units and three An-units,and octosaccharide (MM-1242Da)con-taining four G-units and four An-units.Furthermore,several minor peaks could be found in the mass spectrum,which were attributed to pentasaccharide (MM-792Da)containing three G-units and two An-units,heptasaccharide (MM-998Da)containing four G-units and three An-units,and decasaccharide (MM-1548Da)containing five G-units and five An-units.13C-NMR of agarooligosaccharidesMALDI-TOF mass analysis of the hydrolysis products of agar generated by agarase from Alteromonas sp.SY 37-12showed the presence of agarotetraose and agarohexaose as the main products.These products were further analyzed by NMR to determine the specificity of the cleavage.Anomeric carbons usually give downfield signals in 13C-NMR spectrum.The configuration of anomeric carbons can be determined according to the downfield shifts.The 13C-NMR spectrum of the oligosaccharide mixture showed a typical pattern for neoagarooligosaccharide (Fig.7).The neoagarooligosaccharide series is typically produced by the cleavage of β-(1,4)linkages by β-agarase.Resonances at about 97and 93ppm are characteristic for the βand αanomeric forms,respectively,of galactose residues at the reducing end of the neoagarooligosaccharides,indicating that the cleavage occurs at the β-(1,4)linkages.No peaks were present at around 90.4ppm corresponding to hydrolyzed α-(1,3)linkages.Thus,the 13C-NMR spectrum confirmed that agarase from strain SY 37-12is a β-agarase,specifically hydrolyzing the β-(1,4)glycosidic linkage between D -galactose and 3,6-anhydro-L-galactose.Fig.713C-NMR spectrum of the hydrolysis products of agar produced by agarase from Alteromonas sp.SY37–12837DiscussionWe describe here the characterization of a new agarolytic bacterium isolated from the southern ocean of China.This strain was identified as Alteromonas sp.according to its morphologic and physiological characteristics.The purified agarase extracted from Alteromonas sp.SY37-12has a molecular mass of39.5kDa,as indicated by SDS-PAGE. This value is close to those reported forβ-agarase from Pseudoalteromonas sp.N-1(33kDa)(Vera et al.1998), Pseudomonasatlantica(32kDa)(Morrice et al.1983),and Vibrio sp.AP-2(34kDa)(Aoki et al.1990).This enzyme acts as an endoenzyme,which decreased rapidly the viscosity of agar substrate at the initial reaction stage. Agarases(E.C.3.2.1.81)are classified into two groups depending upon their specificity of the degradation on the agar:α-agarases cleave theα-1,3linkage of agar,yielding oligosaccharides with3,6-anhydro-L-galactose at the re-ducing end and D-galactose at the nonreducing end,and β-agarase cleave theβ-1,4linkage of agar,yielding oligo-saccharides with D-galactose at the reducing end and3,6-anhydro-L-galactose at the nonreducing end(Vera et al. 1998).From the experiment result on analyzing the oligosaccharides by13C-NMR,it could be deduced that the agarase from the Alteromonas sp.SY37-12wasβ-agarase,which produced the3,6-anhydro-L-galactose as the nonreducing end and D-galactose as the reducing end. According to the assignment of MALDI-TOF-MS,the main composition of hydrolytic products was neotetrasac-charide(An-G-An-G),neohexasaccharide(An-G-An-G-An-G),and neooctosaccharide(An-G-An-G-An-G-An-G). In addition,pentasaccharide(G-An-G-An-G),heptasac-charide(G-An-G-An-G-An-G),and decasaccharide(An-G-An-G-An-G-An-G-An-G)could also be found in the products.It did not release detectable amounts of agaro-biose and agarotriose.With future experiments,the enzyme was confirmed to be not capable of hydrolyzing agarote-trose,agaropentose,agarohexose,and agaroheptose.It could be speculated that the minimal polymer degree of the agar substrate depolymerized by agarase from Alteromonas sp.SY37-12is eight.The agarase produce mainly agarooligosaccharides with even degree of polymerization, with D-galactose as the reducing end.As an endoenzyme,it cleaves theβ-1,4linkage of agar at random and produces a large quantity of low-molecular-mass fragments during the hydrolysis.Therefore,at the end of the hydrolytic reaction, the oligosaccharides with odd degree of polymerization,Table3Molecular mass and depolymerized products of characterized agarasesGroup Strain Molecular mass(kDa)Products Referenceα-Agarase Alteromonas GJIB360(bipolymer)Agarotetraose Potin et al.1993 Vibrio JI010784(bipolymer)Agaropentaose,agarotriose,agarobiose,3,6-anhydro-galactose and D-galactoseSugano et al.1994 Bacillus MK03320(octamer)Agaropentaose,agarotriose,3,6-anhydro-galactose and D-galactoseSuzuki et al.2002β-agarase Cytophaga flevensis26Neoagarotetraose,neoagarobiose Van der Meulen et al.1974 Pseudoalteromonas N-133Neoagarotetraose,neoagarohexaose Vera et al.1998Pseudomonas-like I a:210Neoagarohexaose,neoagarotetraose,neoagarobioseMalmqvist1978II:63NeoagarotetraosePseudomonas atlantica I:32Neoagarotetraose,neoagarobiose Morrice et al.1983II b:N/A NeoagarobioseVibrio AP-2I:34Neoagarotetraose Aoki et al.1990II:20NeoagarobioseIII:18NeoagarotetraoseVibrio JT0107I:107Neoagarotetraose,neoagarobiose Sugano et al.1993,1995II:72Neoagarotetraose,neoagarobioseVibrio PO-303I:87.5Neoagarohexaose,neoagarotetraose Araki et al.1998II:115NeoagarobioseIII:57Neoagarooctaose,neoagarodecaoseBacillus MK0392Neoagarotetraose Suzuki et al.2003Bacillus cereusASK20290Neoagarobiose Kim et al.1999 Alteromonas E-l82Neoagarobiose Kirimura et al.1999Alteromonas C-152Neoagarotetraose Leon et al.1992Alteromonas SY37-1239.5Neoagarotetraose,neoagarohexaose This worka There are several fractions with agarase activity produced by the strainb Data not available838especially pentasaccharide and heptasaccharide,are un-avoidably formed in the products.Molecular mass and depolymerized products of char-acterized agarases were given in Table3,which showed that the molecular mass of agarase from Alteromonas sp. SY37-12is different from the others,especially that from Alteromonas sp.E-1(Kirimura et al.1999)and Alteromo-nas sp.C-1(Leon et al.1992).The main depolymerized products produced by this enzyme are unique in compar-ison with the reports.Therefore,a conclusion was drawn here that the agarase produced by Alteromonas sp.SY37-12might be a novel enzyme.Further characterization of this enzyme will be discussed in the near future. ReferencesAgbo JAC,Moss MO(1979)The isolation and characterization of agarolytic bacteria from a low land river.J Gen Microbiol 113:355–368Aoki T,Araki T,Kitamikado M(1990)Purification and character-ization of a novelβ-agarase from Vibrio sp.AP-2.Eur J Biochem187:461–465Araki T,Hayakawa H,Lu Z,Karita S,Morishita T(1998) Purification and characterization of agarases from a marine bacterium,Vibrio sp.PO-303.J Mar Biotechnol6:260–265 Duckworth M,Turvey JR(1969)The action of a bacterial agarase on agarose,porphyran and alkali treated porphyran.Biochem J 113:687–692Fernandez LE,Valiente OG,Mainardi V,Bello JL,Velez H,Rosado A(1989)Isolation and characterization of an antitumor active agar-type polysaccharide of Gracilaria dominguensis.Carbo-hydr Res190:77–83Ha J,Kim GT,Kim SK,Oh TK,Yu JH,Kong IS(1997)β-Agarase from Pseudomonas sp.W7:purification of the recombinant enzyme from Escherichia coli and the effects of salt in its activity.Biotechnol Appl Biochem26:1–6Hamer GK,Bhattacharjee SS,Yaphe W(1977)Analysis of the enzymic hydrolysis products of agarose by13C-n.m.r.spec-troscopy.Carbohydr Res54:C7-C10Holt JG,Krieg NR,Sneath PHA,Staley JT,Williams ST(1994) Bergey’s manual of determinative microbiology,9th edn.Williams and Wilkins,BaltimoreKim BJ,Kim HJ,Duck Ha S,Hee Hwang S,Seok Byun D,Ho Lee T,Yul Kong J(1999)Purification and characterization ofβ-agarase from marine bacterium Bacillus cereus ASK202.Biotechnol Lett21:1011–1015Kirimura K,Masuda N,Iwasaki Y,Nakagawa H,Kobayashi R, Usami S(1999)Purification and characterization of a novelβ-agarase from an alkalophilic bacterium,Alteromonas sp.E-1.J Biosci Bioeng87:436–441Leon O,Quintana L,Peruzzo G,Slebe JC(1992)Purification and properties of an extracellular agarase from Alteromonas sp.strain C-1.Appl Environ Microbiol58:4060–4063 Malmqvist M(1978)Purification and characterization of two different agarose-degrading enzymes.Biochim Biophys Acta 537:31–43Morrice LM,McLean MW,Williamson FB,Long WF(1983)β-Agarases I and II from Pseudomonas atlantica.Purifications and some properties.Eur J Biochem135:553–558Potin P,Richard C,Rochas C,Kloareg B(1993)Purification and characterization of the alpha-agarase from Alteromonas agar-lyticus(Cataldi)comb.nov.,strain GJ1B.Eur J Biochem 214:599–607Sampietro AR,Vattuone de Sampletro MA(1971)Characterization of the agarolytic system of agarobacterium pastinator.Biochim Biophys Acta244:65–76Shieh WY,Jean WD(1998)Alterococcus agarolyticu s,gen.nov., sp.nov.,a halophilic thermophilic bacterium capable of agar degradation.Can J Microbiol44:637–645Stanier RY(1942)Agar-decomposing strains of the Actinomyces coelicolor species group.J Bacteriol44:555–570Sugano Y,Terada I,Arita M,Noma M,Matsumoto T(1993) Purification and characterization of a new agarase from a marine bacterium,Vibrio sp.strain JT0107.Appl Environ Microbiol59:1549–1554Sugano Y,Kodama H,Terada I,Yamazaki Y,Noma M(1994) Purification and characterization of a novel enzyme,alpha-neoagarooligosaccharide hydrolase,from a marine bacterium, Vibrio sp.strain JT0107.J Bacteriol176(22):6812–6818 Sugano Y,Nagae H,Inagaki K,Yamamoto T,Terada I,Yamazaki Y (1995)Production and characteristics of some newβ-agarases from a marine bacterium,Vibrio sp.strain JT0107.J Ferment Bioeng79:549–554Suzuki H,Sawai Y,Suzuki T,Kawai K(2002)Purification and characterization of an extracellularα-neoagarooligosaccharide hydrolase from Bacillus sp.MK03.J Biosci Bioeng93:456–463Suzuki H,Sawai Y,Suzuki T,Kawai K(2003)Purification and characterization of an extracellularβ-agarase from Bacillus sp.MK03.J Biosci Bioeng95:328–334Takemoto KK(1966)Plaque mutants of animal viruses.Prog Med Virol8:314–348Usov AI,Miroshnikova LI(1975)Isolation of agarase from Littorinamandshurica by affinity chromatography on BiogelA.Carbohydr Res43(1):204–212Van der Meulen HJ,Harder W,Vedkamp H(1974)Isolation and characterization of Cytophaga flevensis sp.nov.,a new agarolytic flexibacterium.Antonie Van Leeuwenhoek40:329–346van Hofsten B,Malmqvist M(1975)Degradation of agar by a Gram-negative bacterium.J Gen Microbiol87:150–158Vera J,Alvarez R,Murano E,Slebe JC,Leon O(1998)Identifi-cation of a marine agarolytic Pseudoalteromonas and char-acterization of its extracellular agarase.Appl Environ Microbiol 64:4378–4383von Borel E,Hostettler F,Deuel H(1952)Fasciculus I-15.Quantitative zuckerbestimmung mit3,5-dinitrosalicylsaure and phenol.Helv Chim Acta35:115–120Wang JX,Jiang XL,Mou HJ,Guan HS(2004)Anti-oxidation of agar oligosaccharides produced by agarase from a marine bacterium.J Appl Phycol16:333–340Weinberger F,Richard C,Kloareg B,Kashman Y,Hoppe H, Friedlander M(2001)Structure-activity relationships of oligoagar elicitors towards Gracilaria conferta.J Phycol 37:418–426Yoshizawa Y,Enomoto A,Todoh H,Ametani A,Kaminogawa S (1993)Activation of murine macrophages by polysaccharide fractions from marine algae(Porphyra yezoensis).Biosci Biotechnol Biochem57:1862–1866Young KS,Bhattacharjee SS,Yaphe W(1978)Enzymic cleavage of theα-linkages in agarose,to yield agaro-oligosaccharides.Carbohydr Res66:207–211Zhang QB,Li N,Zhou GF,Lu XL,Xu ZH,Li Z(2003)In vivo antioxidant activity of polysaccharide fraction from Porphyra haitanesis(Rhodephyta)in aging mice.Pharmacol Res48(2):151–155839。

MFC1. 什么是生物燃料电池(MFC)(07/17/2007)从生物/微生物中提取电能在20世纪初就被发现,直到20世纪70年代陆续有研究文章发表.1980年开始,一些英国的研究者做了不少关于微生物燃料电池(microbial fuel cell---MFC)研究,持续了10年. 到90年代末,美国的一些研究者把这个题目找出来逐步"发扬光大"。
可能因为能源危机的问题,现在MFC的研究表现的越来越热.在这方面做的比较好的是比利时的一个研究组,他们的电池功率目前是最高的.Penn State的Bruce Logan发表的文章最多. 另外Umass的DR Lovley刚拿到一个huge grant $ 23 M, 估计接下来的几年会做出不少的东西.MFC和Fuel cell显著的区别就是anode: MFC在anode里用微生物或者生物酶做催化剂,一般没有Pt.因为生物的存在,anode的温度就不可能很高,一般MFC的运行温度在室温和37C之间.燃料则是"有机物",用于microbe生长. microbes在降解有机物(比如葡萄糖)的时候,产生protons 和electrons,其余的原理就和fuel cell一样了.MFC的cathode也用Pt或者其他化学药品(例如ferricyanide) 来促进反应. MFC产生的功率远小于Fuel cell,最高也就是几W/m2,现在可能提高了一些. 因为MFC和fuel cell应用不同,所以不需要那么高的功率输出. 另外,MFC可能会用于大型反应器,所以anode 的电极不大会用carbon paper,而用一些表面机更大的,象graphite granular;现在计算MFC功率的时候,一般用anode volume (W/m3),而不是电极表面积. MFC 的future application可能是废水处理过程,因为废水可以提供"免费"的有机物让微生物来降解,并且产生电能,一箭双雕. 目前废水处理过程也产生能量,比如甲烷气(methane). 因为methane还需要额外的步骤来发电,而MFC可以一步到位,所以如果MFC可以有high efficiency,比传统的废水处理过程要有不少优势(如果可以达到高效的话).MFC2. 微生物燃料电池中生物阴极的应用(09/04/2007)发展背景微生物燃料电池(microbial fuel cell - MFC)是一种特殊的电化学电池. 它通过微生物在阳极降解有机物产生电子. 而在阴极, 阳极产生的电子和正离子还原氧气,最终产物为水. 电子从阳极到阴极的传输产生电流. 第一个生物电流的实验证明是在十八世纪晚期,Luigi Galvani发现,当用金属导体把青蛙腿连接起来的时候, 有电流反应产生. 为了进一步研究生物电流, Michael C. Potter在1911年建立了第一个微生物燃料电池. 1931年, Barnett Cohen发现在阳极加入铁氰化钾(potassium ferricyanide) 或者苯醌(benzoquinone) 作为电子传输中介物,可以提高电流. 虽然在二十世纪六十年代微生物燃料电池成为一个研究热点, 但是研究人员还无法成功地建造一个可以持续运行的实验装置. 八十年代,英国的研究人员H. Peter Bennetto 成功利用单种细菌和电子传输中介物通过氧化有机物来发电. 同时, 日本的研究人员发现光合自养型的细菌可以把光能转化成电能. 在过去的十年中,因为全球能源危机问题, 微生物燃料电池引起了越来越广泛的关注. 研究的方向包括理解电子传输的机理和建造实用的反应器装置.非生物阴极非生物阴极大多利用氧气为最终电子接收物,也有研究过氧化氢作为阴极氧化物. 因为氧气还原效率在碳/石墨表面很低, 所以通常情况下,阴极反应需要催化剂或者电子传输中介物. 铂是目前使用最广泛的阴极催化剂,但是其材料昂贵, 催化性能容易被一些特殊物质污染.另外, 微生物燃料电池阴极溶液的pH值会随反应而升高, 从而限制铂的催化能力. 电子传输中介物大多是一些含有过渡金属的化合物,比如含铁和钴的物质.生物阴极传统的微生物燃料电池是”半生物性的”,因为只有阳极存在生物反应,而阴极通常采用金属催化剂来完成还原氧气的反应. 但是, 微生物在阴极的生长是不可避免的. 研究人员已经发现了几种在阴极的生物新陈代谢过程,为研究生物阴极开启了大门. 相比于非生物阴极,生物阴极有如下优点: (一) 建造和运行微生物燃料电池的费用可能被降低,因为不再需要贵重金属催化剂, 也不需要添加化合物来作为电子传输中介; (二) 生物阴极可以提高微生物燃料电池的可持续性; (三) 生物阴极里的微生物活动可以被用来产生有用的物质或者去处污染物. 总的说来,生物阴极可以被分为好氧(氧气为最终电子接受物)和厌氧(其他非氧气物质为最终电子接受物)生物阴极.好氧生物阴极氧气是应用最广泛的阴极电子接受物. 氧气有很高的氧化还原电位, 而且大量存在于空气中,降低了使用费用. 好氧生物阴极的一个研究重点是利用过渡金属化合物, 包括锰和铁,协助电子从阴极传输过氧气. 高价位的金属充当临时电子接受物, 从阴极接受电子,通过微生物的”呼吸作用”被还原成低价位金属. 然后低价位的金属被氧气氧化回到高价位, 将电子传输给氧气. 在这个循环过程中,电子从阴极被传送到氧气. 另一种好氧生物阴极则是通过藻类的光合作用为阴极反应提供氧气. 实际应用中, 上述的这些机理可能同时发生. 例如, 研究人员发现海洋生物膜可以提高氧气还原效率. 在这个过程中, 锰化物可能参与电子传输; 另外,藻类的生长也不可避免.厌氧生物阴极在没有氧气的时候,其他物质, 例如硝酸盐,硫酸盐,铁化物和锰化物, 也可以作为最终电子接受物. 其中, 硝酸盐,铁化物和锰化物具有接近氧气的新陈代谢活性,是潜在的替代氧气的阴极电子接受物. 厌氧生物阴极的一个优点就是可以防止氧气通过正离子交换膜渗透到阳极,从而影响到阳极的厌氧微生物生长. 目前为止, 只有硝酸盐和硫酸盐被用于研究. 硝酸盐(+0.74V)的氧化还原电位比硫酸盐(-0.22V)更接近氧气(+0.82V), 所以更适合做为阴极电子接受物. 利用硝酸盐进行阴极反应, 与硝化反应类似,唯一不同的地方是, 硝化反应通过氧化有机物得到电子, 而生物阴极则依靠阴极供给电子. 比利时的研究人员已经成功将硝酸盐用于阴极的还原反应, 为微生物燃料电池应用在污水处理中的可行性提供了进一步的实验证明.小结生物阴极是一项使微生物燃料电池更具优势和可持续性的技术. 在实现这项技术之前, 我们必须理解阴极的生物电子传输机制, 以便于更合理地选择和利用微生物.MFC3. 微生物燃料电池中的共生现象(09/18/2007)共生现象在自然界普遍存在, 比如动物体内的寄生细菌降解一些动物肠胃无法消化的物质,同时也获取用于自身生长的能量. 再比如, 一种小鸟从鳄鱼的嘴中获取食物, 即帮助鳄鱼清洁了牙齿,同时也利用鳄鱼的嘴做为保护自己的场所, 两者和睦相处. 共生现象有几种类别, 有双方彼此都受益的,也有一方受益另一方不受益, 甚至还有一方受益而另一方受害的. 在废水处理中, 也存在共生现象. 一个典型的代表就是厌氧消化过程中,发酵细菌将复杂的碳水化合物分解成相对简单的有机物(酸). 这些发酵产物随后被其他细菌消食, 例如,醋酸化合物可以被甲烷菌(注: 严格意义上, 甲烷菌不是细菌-bacteria, 而是archaea)利用产生甲烷气体. 微生物燃料电池的阳极类似于废水处理中的厌氧消化过程, 因此, 微生物之间的共生现象不可避免. 最近, 宾州州立大学和麻省大学艾莫斯特分校的研究人员先后发表论文, 从不同的角度研究和探讨了阳极的共生现象.宾州州立大学的研究人员利用细菌Clostridium cellulolyticum分解纤维素, 其产物被另一种细菌Geobacter sulfurreducens用于厌氧呼吸(anaerobic respiration), 产生电子和电流. 纤维素是一种富含有机物的生物物质, 也是一种潜在的生物能源(bioenergy)的载体. 但是它很难被直接利用,需要进行预处理和水解成为简单的碳水化合物,比如葡萄糖. 只有很少的一些微生物(bacteria and fungi)或者特殊的生物酶可以水解纤维素, 产物包括氢气, 醋酸物和乙醇. Clostridium是一种专性厌氧细菌, 因其降解纤维素的特殊能力而受到工业届的广泛重视. 在这项研究中, 科研人员设计了对照实验, 证明C. cellulolyticum可以分解纤维素,但无法产生电流; G. sulfurreducen无法利用纤维素生长,因而也没有电流产生. 但是,当把两种细菌混合起来的时候,微生物燃料电池产生出了电流. 而且, 当G. sulfurreducen存在的时候, 纤维素(carboxymethyl cellulose-CMC)的降解效率比C. cellulolyticum单独生长的时候提高了18%. 这项研究的创新之举在于首次利用特殊的细菌在微生物燃料电池降解非水溶性的有机物, 并且用实验展示了两种细菌在发电过程中的共生关系. 此外, 实验结果也进一步论证了发酵过程和厌氧呼吸过程的结合可能比单一菌种的活动更加有利于能量的产生.麻省大学艾莫斯特分校的研究则是关于两种都可以进行厌氧呼吸,利用三价铁做为电子接受物的细菌, Geobacter sulfurreducens和Pelobacter carbinolicus. 前者是已知的可以发电的细菌, 而后者被大量发现于建立在水沉积物中的微生物燃料电池的阳极上. 通常意义上, 可以还原三价铁氧化物的细菌都可以利用阳极作为电子接受物, 但是实验结果表明P. carbinolicus基本不具备这样的能力. 科研人员发现, 当乙醇作为微生物燃料电池的燃料, G. sulfurreducens不能够代谢这种燃料; P. carbinolicus可以将乙醇用于生长,但是不能产生电流. 混合生长的时候, 乙醇被P. carbinolicus转化为氢气和醋酸物, 然后G. sulfurreducens 利用这些产物发电. 共焦显微镜(confocal)和对16S rRNA基因的分析表明, 两种细菌在阳极表面的数量几乎相等, 但是在阳极水溶液中, 绝大多数是P. carbinolicus. P. carbinolicus 是第一种可以还原三价铁氧化物却不能在微生物燃料电池中产生电流的细菌. 与其他可以产生电流的细菌相比, P. carbinolicus缺乏外细胞膜的细胞色素(cytochrome), 一种被认为是连接细胞内部和阳极的可导电的蛋白质.微生物燃料电池研究的一个关键问题就是理解阳极微生物的活动和它们之间的相互作用. 利用单一菌种(pure culture)来研究共生现象将对认识阳极微生物的新陈代谢和电子传输过程有重要的帮助.MFC 4. 沉积物微生物燃料电池工作原理沉积物微生物燃料电池(Sediment Microbial Fuel Cell) 的工作原理与微生物燃料电池(Microbial Fuel Cell) 类似, 但是反应器结构要简单很多. 在沉积物微生物燃料电池中, 作为阳极的电极被埋在水底沉积物的浅层中(1-10厘米深), 而作为阴极的电极则悬于阳极上方的水中. 不同于常规的微生物燃料电池, 沉积物微生物燃料电池不需要使用离子交换膜将阳极和阴极分开, 而是利用水中溶解氧浓度由浅至深逐渐减少自然地把阳极和阴极分成缺氧区和有氧区. 因此, 在沉积物和水体的界面上自然形成了一个氧化还原的梯度, 使阴,阳电极之间可以产生大约0.7 V的开路电压. 水底沉积物含有多种厌氧细菌, 可以将经过多年沉降积累的有机物分解, 并把电子传输给阳极. 而悬在含溶解氧相对高的水中的阴极则接受电子, 完成氧气还原反应. 一些特殊的沉积物微生物燃料电池采用牺牲阳极和生物阴极(参见下文).优缺点沉积物微生物燃料电池的优点就是结构简单, 不需要太多的维护, 建造和运行费用低. 在自然水体中的长期运行会在阴极形成生物膜, 有可能帮助氧气还原反应. 但是,沉积物微生物燃料电池一般都不使用阴极催化剂, 而且沉积物中的有机物含量有限, 所以其功率输出也很有限. 沉积物微生物燃料电池的运行条件不象其他微生物燃料电池那样得到严格的控制, 在自然条件下会产生波动, 也会影响到功率输出. 此外, 因为水中溶解氧浓度随着水深不断降低, 沉积物微生物燃料电池不可能应用于太深的水体中, 也就是说, 不可能应用于离陆地太远的水体中. 华盛顿大学(圣路易斯) 的研究人员设计了一种可旋转的阴电极, 希望利用水流或者海潮来推动阴极旋转, 通过旋转将空气中的氧气带入水中, 提高阴极附近的溶解氧浓度.实际应用因为输出功率低, 沉积物微生物燃料电池的应用大多是为远程监测仪器提供电能. 这类电子设备不需要太高的电能, 也不需要频繁地维护. 尽管如此, 它依然是微生物燃料电池中最有可能在短期内投入到实际应用中的一种. 美国海军研究实验室已经研制开发了一种沉积物微生物燃料电池, 称为Benthic Unattended Generator, 简称BUG. 这种BUG被放置在河水或者海水底部, 为监测空气温度, 气压, 相对湿度和水温的电子仪器提供电能, 数据通过无线发射器(也由BUG 提供电能) 传输到附近的海军研究实验室. 蒙大拿州立大学的研究人员设计了一种由金属镁作为牺牲阳极, 和生物沉积锰化物作为阴极的沉积物微生物燃料电池. 该电池被设置在河底, 为一个无线传感器提供电能. 随着对微生物燃料电池的认识的不断加深和越来越广泛的新材料应用, 沉积物微生物燃料电池还可能被用做生物修复, 或者生态修复的一种手段.MFC5 微生物燃料电池阳极的电子传输机制生物燃料的前景因其潜在的环境影响和原材料来源等问题受到科学届的质疑. 但是, 随着储量有限的fossil fuel不断消耗, 寻求可再生能源成为全球性的紧急问题. 未来可替代性的能源组成应该是多元化的, 能源需求应该被多种形式分担, 既包括某些可提供大规模长期能源的形式, 也包括可提供局部小规模需求的形式.微生物燃料电池(microbial fuel cell – MFC) 是一种新型的”废水–能源” 转化方式. MFC的”原材料”是废水和废物, 不存在与人类争夺粮食(比如,生物乙醇的生产)的问题; 其过程也是清洁环境的过程, 因此它的环境影响是积极的. MFC不可能成为主要的能源提供者, 但是满足局部小规模的能源需求还是可行的. 目前, MFC研究的最主要问题就是理解微生物与电极(阳极; 绝对大部分阴极都是非生物性的)之间的相互作用(电子传输过程), 这是进一步提高MFC功率输出的基础. 虽然具体的电子传输机制还不是十分清楚, 但是在大体上,研究人员总结了两种电子传输机制: 直接电子传输(direct electron transfer – DET) 和间接电子传输(mediated electron transfer – MET). 笔者认为, 电子传输机制还可以按照另一种方式分类: 微生物的新陈代谢过程, 即, 微生物是否通过电子传输获得自身生长的能量. 电子传输实际上就是微生物的呼吸过程(respiration). 就好象人要通过呼吸氧气生存,微生物也需要通过”呼吸过程”获得生长的能量. 在这个过程中, 微生物分解有机和无机物质(electron donor), 产生电子, 并传输到最终电子接受物(terminal electron acceptor). 对于好氧微生物来说, 最终电子接受物为氧气; 而厌氧微生物的最终电子接受物为(亚)硝酸盐,(亚)硫酸盐,金属化合物和二氧化碳等等. 在MFC的阳极,电子接受物则为电极.当微生物可以通过”呼吸”阳极获得生长的能量, 同时产生电流时, 它们可以通过DET或者MET 来传输电子. 在DET过程中, 细菌和电极有直接的接触,并利用细胞外膜的可导电性的蛋白质作为电子中介物,将电子传输到电极上. 研究人员发现, Geobacter的一些菌种在利用电极生长的时候, 某些细胞外膜蛋白(outer membrane protein)有很高的表达, 意味着这些蛋白质可能做为电子传输的中介物. 此外, Geobacter 和Shewanella的某些菌种会产生一种可导电的纳米线(nanowire),既可以连接临近的细菌形成生物膜结构, 还可以传导细菌新陈代谢产生的电子. 通过nanowire, 距离电极一定距离的细菌也有可能参与到MFC的电流产生过程中. MET是另一种主要的电子传输过程, 因为可以利用电子中介物质(electron mediator)传输电子, 细菌不需要和电极有直接的接触. 早期的研究主要通过添加人工合成的化学物质来提高电流输出, 间接证明了电子中介物质的作用. 近年来, 研究人员发现Pseudomonas aeruginosa 可以产生自己的电子中介物- pyocyanin. 当相关的基因被删除后, 电流产量下降很多. 阳极可以诱导pyocyanin的产生. 细菌重复利用这种电子中介物至少11次.在阳极生长的微生物中, 也有很多细菌不能进行”电极呼吸”, 但是它们可以通过新陈代谢的产物间接地参与到电流产生的过程中. 这些产物可以和阳极进行非生物性反应, 从而产生电子以及电流. 在对Bacteroides thetaiotaomicron的研究中, 科研人员发现, 当这种细菌在阳极生长的时候, MFC的电流显著增长, 减缓细菌生长的同时也降低了电流产生. 但是, 基因芯片(DNA Chip)的对比分析显示, 无论细菌是否生长在MFC的阳极上, 其基因表达都没有显著差别, 表明这种细菌不能利用阳极作为电子接受物, 因而也不可以进行”电极呼吸”. 其生长与电流产生之间的关系, 可能是由于新陈代谢产物与电极之间的非生物反应形成的.对于研究电子传输机制, 使用单一菌种有很多优势. 但是, 在一个复杂的阳极环境中(含有多种微生物的菌群), 电子传输的机制不是唯一的, 可能是上述几种过程的混合.前言生物燃料电池是燃料电池中特殊的一类。

微生物燃料电池的工作原理与功率提升微生物燃料电池(Microbial Fuel Cell, MFC)是一种利用微生物代谢产生的电子来实现能量转换的设备。
它是一种环保、可持续的能源技术,具有广泛的应用前景。
本文将介绍微生物燃料电池的工作原理以及如何提升其输出功率。
一、微生物燃料电池的工作原理微生物燃料电池基于微生物的代谢活动,将有机废弃物等可溶性有机物质转化为电能。
其基本工作原理如下:1. 电子转移:当有机废弃物溶解在电解质中时,微生物在阳极表面附着并代谢产生电子。
这些电子通过细胞外电子传递介质(通常为导电聚合物或纳米粒子)传递到阳极。
2. 电化学反应:在阳极和阴极之间,电子通过外部电路流动,从而形成闭合的电路。
在阳极,电子和氧气(或其他氧化剂)发生氧化反应,产生电流。
而在阴极,电子与氢离子(从阴极外界提供)结合,并与氧气发生还原反应。
3. 生成废物:在还原反应中,氢离子和电子结合形成水,这是微生物燃料电池的最终产物。
二、提升微生物燃料电池功率的方法微生物燃料电池的输出功率受到多种因素的影响,包括微生物类型、底物浓度、电解质条件等。
下面将介绍一些常用的方法来提升微生物燃料电池的功率。
1. 微生物选择:不同类型的微生物对底物的利用能力和产电效率不同。
因此,选择适合的微生物菌株是提升燃料电池功率的重要方法。
常用的微生物包括厌氧细菌、厌氧真菌和光合细菌等。
2. 底物浓度优化:提高底物浓度可以增加微生物在阳极附近的生长和代谢活动,从而增强燃料电池的输出功率。
但是,过高的底物浓度可能对微生物产生抑制作用,因此需要进行适当的优化。
3. 电解质条件调控:电解质pH值和温度等条件对微生物的生长和代谢活动具有重要影响。
通过调控电解质条件,可以提高微生物燃料电池的效率和稳定性。
例如,优化电解质pH值可以促进微生物产电酶的活性。
4. 电极材料改进:阳极和阴极的材料选择和结构设计对微生物燃料电池的性能具有重要影响。
优化电极材料可以提高电子传输速率和阻抗降低程度,从而提高微生物燃料电池的输出功率。
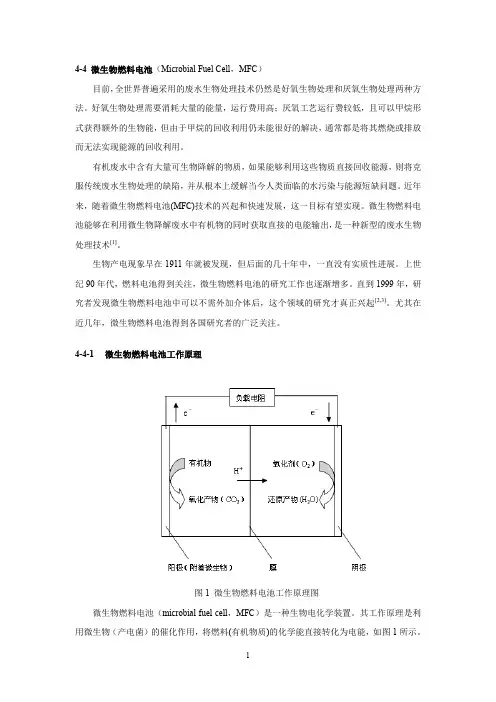
1 4-4 微生物燃料电池(Microbial Fuel Cell,MFC) 目前,全世界普遍采用的废水生物处理技术仍然是好氧生物处理和厌氧生物处理两种方法。好氧生物处理需要消耗大量的能量,运行费用高;厌氧工艺运行费较低,且可以甲烷形式获得额外的生物能,但由于甲烷的回收利用仍未能很好的解决,通常都是将其燃烧或排放而无法实现能源的回收利用。 有机废水中含有大量可生物降解的物质,如果能够利用这些物质直接回收能源,则将克服传统废水生物处理的缺陷,并从根本上缓解当今人类面临的水污染与能源短缺问题。近年来,随着微生物燃料电池(MFC)技术的兴起和快速发展,这一目标有望实现。微生物燃料电池能够在利用微生物降解废水中有机物的同时获取直接的电能输出,是一种新型的废水生物处理技术[1]。 生物产电现象早在1911年就被发现,但后面的几十年中,一直没有实质性进展。上世纪90年代,燃料电池得到关注,微生物燃料电池的研究工作也逐渐增多。直到1999年,研究者发现微生物燃料电池中可以不需外加介体后,这个领域的研究才真正兴起[2,3]。尤其在近几年,微生物燃料电池得到各国研究者的广泛关注。
4-4-1 微生物燃料电池工作原理
图1 微生物燃料电池工作原理图 微生物燃料电池(microbial fuel cell,MFC)是一种生物电化学装置。其工作原理是利用微生物(产电菌)的催化作用,将燃料(有机物质)的化学能直接转化为电能,如图1所示。 2
电池的阳极室处于厌氧环境,阴极室处于好氧环境,两个电极室由质子交换膜分隔。附着在电池阳极的微生物氧化有机物质(电子供体),放出质子和电子;其中,电子通过外电路传递至阴极,质子通过质子交换膜传递至阴极;电池阴极的电子受体(如O2)接受电子发生还原反应,完成整个产电过程。 衡量微生物燃料电池产电性能的主要指标为:电压(mV)、电流密度(mA/m2)、功率密度、库仑效率等。 功率密度分为两种:基于阳极表面积的面积功率密度(mW/m2),以及基于阳极室容积的体积功率密度(mW/m3),前者较为常用。 库仑效率也称为电子回收率,是实际产生的电量与基质(电子供体)能提供的电量之比。库仑效率是反映电池综合产电性能的重要指标。 对于分批模式运行的MFC,其计算公式为[2]:
微生物燃料电池:清洁能源新途径随着全球能源需求的不断增长和环境问题的日益严重,寻找清洁、可再生的能源已成为当今社会的重要任务。
在这个背景下,微生物燃料电池作为一种新型的能源转换技术,引起了广泛的关注。
本文将介绍微生物燃料电池的原理、应用以及未来发展前景。
微生物燃料电池是一种利用微生物代谢产生的电子来产生电能的装置。
其基本原理是通过微生物的代谢活动将有机物质氧化成二氧化碳和水,并在此过程中释放出电子。
这些电子可以通过电极和外部电路传导,从而产生电流。
微生物燃料电池的核心是微生物群落,其中包括阳极上的氧化菌和阴极上的还原菌。
氧化菌通过氧化有机物质释放出电子,而还原菌则在阴极上接受这些电子并与氧气结合形成水。
通过这种方式,微生物燃料电池可以将有机废弃物转化为电能,实现能源的可持续利用。
微生物燃料电池具有许多优点,使其成为一种有潜力的清洁能源技术。
首先,微生物燃料电池可以利用各种有机废弃物作为燃料,如废水、农业废弃物和食品残渣等。
这些废弃物通常会导致环境污染,但通过微生物燃料电池可以将其转化为有用的能源,同时减少了废弃物的处理成本。
其次,微生物燃料电池的运行过程中不产生二氧化碳等温室气体,对环境没有污染。
与传统的化石燃料电池相比,微生物燃料电池是一种低碳、环保的能源转换方式。
此外,微生物燃料电池还具有较高的能量转换效率和较长的使用寿命,可以满足不同场景下的能源需求。
微生物燃料电池的应用领域非常广泛。
在环境领域,微生物燃料电池可以用于废水处理和土壤修复等方面。
通过微生物燃料电池处理废水,不仅可以减少废水的处理成本,还可以产生电能供给其他设备使用。
在农业领域,微生物燃料电池可以用于农业废弃物的处理和农田灌溉等方面。
通过微生物燃料电池将农业废弃物转化为电能,可以为农村地区提供清洁能源,促进农业可持续发展。
此外,微生物燃料电池还可以应用于移动设备、无线传感器网络和生物医学器械等领域,为这些设备提供可靠的电源。
尽管微生物燃料电池在理论上具有很大的潜力,但目前仍面临一些挑战。
微生物燃料电池技术
微生物燃料电池技术是一项新兴的、能源领域中将取代传统能源和可再生能源来满足多样化能源需求的新型技术。
其最大的特点是使用活性微生物来维持电池的反应,为我们提供持续的能源供应。
微生物燃料电池的工作原理是将碳源(如木炭,煤油,糖等)和氧结合在特定条件(如温度,酸碱度和气压)下,利用活性微生物来持续产生电流,从而产生一定电压。
一旦电池连接设备,即可提供可持续的电能。
微生物燃料电池的优势主要体现在实现容量稳定,维护费用低,结构小巧,效率高,使用方便,以及不会造成污染等方面。
首先,微生物燃料电池的实现容量确实可以获得稳定。
由于微生物的生物反应可以持续的提供能量,所以它的行稳定性相对比较好,其可持续性也得以得到保证。
其次,微生物燃料电池的维护费用也是相对较低。
它基本上不需要额外投入,只要每隔一段时间进行清洁和更换,并及时补充新的微生物就能保持良好的性能。
另外,微生物燃料电池的结构小巧,易于携带和使用,可以为我们提供可靠的便携式能源支持能力。
此外,微生物燃料电池还可以提供较高的可再生能源转化效率,使人们能更快更有效地使用可再生能源来满足自身的日常能源需求。
最后,微生物燃料电池还是一种无污染技术,只产生小量的有害废气,因此对环境的损害很小。
综上所述,微生物燃料电池技术具有容量稳定、维护费用低、结构紧凑、效率高、
使用方便和无污染的优点,所以是未来替代传统能源和可再生能源满足多样能源需求的一种潜在技术。
如果能够得到合理的应用,微生物燃料电池必将成为我们新的时代的重要能源来源。
微生物燃料电池的基础研究杨华摘要:随着人类的进步与发展,对能源的需求越加强烈。
为了解决能源问题,人类在积极的寻求新型能源方式。
在能源的寻求过程中,科学家把眼光投向了微生物,利用微生物产生电能,即微生物燃料电池(Microbial Fuel Cell ,MFC )。
本文简要介绍了微生物燃料电池发展历史及其工作原理,归纳了近年来国内外对微生物电池的研究现状,微生物燃料电池的研究进展以及存在的问题和研究的方向。
最后展望了微生物燃料电池的应用前景。
关键词:微生物燃料电池;产电;废水处理;生物修复;反应器构型;1 前言利用微生物的作用进行能量转换(如碳水化合物的代谢或光合作用等),把呼吸作用产生的电子传递到电极上,这样的装置叫微生物燃料电池。
用微生物作生物催化剂,可在常温下进行转[1]。
纵观微生物燃料电池的发展历史,经历了几种形式的变革[2]。
早期的微生物燃料电池是将微生物发酵的产物作为电池的燃料,如从家畜粪便中提取甲烷气体作为燃料发电。
20 世纪60 年代末以来,人们将微生物发酵和制电过程合为一体。
20世纪80年代后,由于电子传递中间体的广泛应用,微生物燃料电池的输出功率有了较大的提高,使其作为小功率电源而使用的可行性增大,并因此推动了它的研究和开发。
但这种装置仍存在诸多缺点,因此也制约了其发展。
2002 年后,随着直接将电子传递给固体电子受体的菌种的发现,人们发明了无需使用电子传递中间体的微生物电池,其中所使用的菌种可以将电子直接传递给电极。
由于微生物燃料电池能够长时间提供稳定电能,所以它在诸如深海底部和敌方境内的军事装备这些“特殊区域”具有潜在用途。
特别是美国科学家Loga n的同时废水处理和微生物发电的研究,给MFC的研究注入了新的活力,引起了世界各国科学家的高度关注[3]。
微生物燃料电池(MFC)是将解决环境污染问题与生产新能源有机结合起来的新技术之一。
具有燃料来源多样化、无污染、能源利用效率高、操作条件温和、生物相容用微生物作催化剂,以污水为原料,将污染环境的有机生物质转化为电能的装置性强、安全、高效和连续等优点。
微生物燃料电池发展历史微生物燃料电池(Microbial Fuel Cell,简称MFC)是一种利用微生物代谢产生的电能的装置。
它能够将有机废弃物转化为电能,具有环保、可持续等优势。
下面将从微生物燃料电池的发展历史角度来介绍它的发展过程。
一、起源与初期研究(20世纪70年代-90年代)微生物燃料电池的起源可以追溯到20世纪70年代,当时研究人员开始尝试利用微生物的代谢活动来产生电能。
最早的微生物燃料电池是基于微生物产生的氢气来产生电能的。
在20世纪80年代,研究人员开始尝试利用微生物产生的电子来产生电能,这是微生物燃料电池发展的重要里程碑。
然而,初期研究受到技术限制和缺乏理论基础的影响,进展缓慢。
二、技术突破与应用拓展(21世纪初)21世纪初,随着生物技术和材料科学的发展,微生物燃料电池得到了重要的突破和应用拓展。
研究人员开始利用新型材料,如碳纳米管和纳米颗粒,改善电子传导和电极表面积,提高微生物燃料电池的性能。
此外,对微生物燃料电池的理论研究也取得了进展,为其应用提供了更多的理论指导。
在应用方面,微生物燃料电池开始被应用于一些特定领域。
例如,在环境领域,微生物燃料电池可以用于处理废水和废气,将有机废弃物转化为电能,并减少环境污染。
在能源领域,微生物燃料电池被用于生物能源的开发,可以利用微生物代谢产生的电能来驱动电力设备。
此外,微生物燃料电池还被应用于传感器和电子装置等领域,为这些设备提供可持续的电源。
三、新型微生物燃料电池的发展(2000年后)近年来,随着对可再生能源的需求增加以及对环境保护的重视,新型微生物燃料电池得到了更多的关注和研究。
其中,光合微生物燃料电池是近年来发展较快的一种新型微生物燃料电池。
它利用光合微生物(如藻类和光合细菌)的光合作用产生的有机物来产生电能。
这种新型微生物燃料电池不仅具有传统微生物燃料电池的优点,还能够利用太阳能来提供能源,具有更高的能源转化效率和更广泛的应用前景。