有机化学 第六章 芳烃
- 格式:ppt
- 大小:3.95 MB
- 文档页数:78

第六章芳香烃
第六章芳香烃一、苯的结构
苯的结构
二、芳香烃的分类与命名
三、芳香烃的物理性质
四、芳香烃的化学性质
五、稠环芳烃
七芳香性和休克尔规则
芳香性条件:1. 环状,封闭的共扼多烯,共平面
2 . π电子数符合4n+2 , n=0,1,2,….正整数芳香性:高度稳定性,发生取代而不发生加成反应
芳香性:高度稳定性发生取代而不发生加成反应
反芳香性极不稳定能量高于开链烯烃
反芳香性:极不稳定。
能量高于开链烯烃。
非芳香性:较稳定。
能量相当于开链烯烃。
具有芳香性化合物的主要性质
()芳香开烯定
(1)芳香性化合物比相应的开链共轭多烯稳定。
(2)芳香性化合物有较强的环电流与抗磁性。
(3)在化学性质上热稳定性增加。
与亲电试剂不发生加成,
而发生取代反应。
对氧化剂稳定性增加。
而发生取代反应对氧化剂稳定性增加
O CH C CH C
O
O O
RCCl O
RC CR
O CCH O
C CCH
O
O
O O
CCH C CCH
CCH O CCH O O CCH CCH O
53%
O
O CCl CCH
O CCl
O
O , -OH, -OR, -NHCR, -OCR
O
-CH
-CR-COR-CNH O O O
O
N
C-R O。



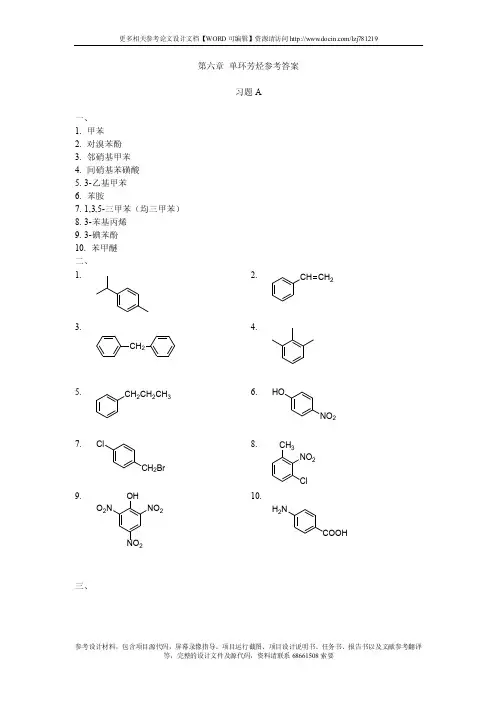
第六章 单环芳烃参考答案习题A一、 1. 甲苯2. 对溴苯酚3. 邻硝基甲苯4. 间硝基苯磺酸5. 3-乙基甲苯6. 苯胺7. 1,3,5-三甲苯(均三甲苯) 8. 3-苯基丙烯 9. 3-碘苯酚 10. 苯甲醚 二、1.2.CH CH 23.CH 24.5.CH 2CH 2CH 36.HONO 27.Cl2Br8.CH 3NO 2Cl9.OHNO 2NO 2O 2N10.H 2N三、1. CH3ClCH3Cl+2. CH2CH33. COOHCOOH 4.O2N NO25. CH3NO2CH3NO2+6.CH2Cl7. CH2CH3SO3H CH2CH3SO3H+8. C2H5CH3H3C9.OC(CH3)3,OC(CH3)3Cl10.,Cl11. CH2CH3,COOH,COOHNO212. ONO2四、1. B2. C3.A4.A5.B五、1.(1)CH 2CH 3CHCH 2CCH_++_(白色沉淀)(2)C 3H7CH CH2_+(褪色)(褪色)_⎽(3)_+(褪色)(褪色)_⎽环己烷环己烯甲苯(4)_+(褪色)(褪色)_+⎽1,3,5-三甲苯叔丁基苯1-苯基丙烯2.在苯和甲苯的混合物中加入浓硫酸,甲苯亲电取代活性比苯强,发生磺化反应生成甲基苯磺酸,溶于浓硫酸中;而苯常温不能用浓硫酸磺化,且与浓硫酸不相容,通过分液将苯分离。
然后再将下层浓硫酸层加水水解,使对应的苯磺酸发生逆磺化反应脱去磺酸基,重新转变成甲苯而分层,最后再分液将甲苯分离。
六、322AlCl3Cl 光Cl2.第一步硝基苯不发生傅克烷基化反应。
NO 2CH 2CH 34NO 2COOH3. 第一步得到硝基苯,第二步不反应。
4.32AlCl 3Cl COCH 3COCH 3CH 2CH 3FeCOCH 3CH 2CH 3Cl COCH 3CH 2CH 3Cl+七、 1. (1)CH 3CH 3(2)BrBrBr2. (1)(2)2(3)(4)3(5)(6)(7)(8)3. (1) A > D > B > C (2) B > C > A4. (1) B > D > E > C > A (2) D > A > B > C1. 甲苯的硝化和硝基苯的硝化都属于苯环上的亲电取代反应,但甲基是供电子基团,使苯环上电子云密度增加有利于亲电取代反应的进行;硝基是强吸电子基团,使苯环上电子云密度下降,不利于反应进行。

第六章 芳香烃● 教学基本要求1、掌握单环芳香烃的同分异构及命名;2、掌握单环芳香烃的化学性质和芳环亲电取代反应历程;3、掌握苯环取代定位规律并能初步应用在合成上;4、了解多环芳烃和Huckel 规则。
● 教学重点单环芳香烃的化学性质和芳环亲电取代反应历程;苯环取代定位规律并能初步在合成上的应用。
● 教学难点单环芳香烃的化学性质和芳环亲电取代反应历程;苯环取代定位规律并能初步在合成上的应用。
● 教学时数: ● 教学方法与手段 1、讲授与练习相结合;2、传统教学方法与与现代教学手段相结合;3、启发式教学。
● 教学内容第一节 单环芳烃在化学反应中不易发生加成、氧化反应,而易进行取代反应的特性,被称之为芳香性。
具有芳香性的烃,统称为芳香烃,简称芳烃。
芳烃有苯系芳烃和非苯系芳烃之分。
1.1苯的结构 1、苯的结构苯的分子式为C 6H 6,碳氢数目比为1:1,应具有高度不饱和性。
事实则不然,在一般条件下,苯不能被高锰酸钾等氧化剂氧化,也不能与卤素、卤化氢等进行加成反应,但它却容易发生取代发应,并且苯环具有较高的热稳定性,加热到900℃也不分解。
苯具有芳香性,必然是由于它存在一个特殊的结构所决定的。
1865年,凯库勒(Kekule’)提出了苯的环状对称结构式: 简写式HCCC CC C H HH此式称为苯的凯库勒式,碳环是由三个C=C 和三个C —C 交替排列而成。
它可以说明苯分子的组成及原子相互连接次序,并表明碳原子是四价的,六个氢原子的位置等同,因而可以解释苯的一元取代产物只有一种的实验事实。
但是凯库勒式不能解释苯环在一般条件下不能发生类似烯烃的加成、氧化反应;也不能解释苯的邻位二元取代产物只有一种的实验事实。
按凯库勒式推测苯的邻位二元取代产物,应有以下两种:显然,凯库勒式不能表明苯的真实结构。
近代物理方法测定证明,苯分子中的六个碳原子和六个氢原子都在同一平面上,碳碳键长均相等(0.1396nm ),六个碳原子组成一个正六边形,所有键角均为120°。