第十一周有机化学教案第六章醇酚醚
- 格式:docx
- 大小:136.58 KB
- 文档页数:13

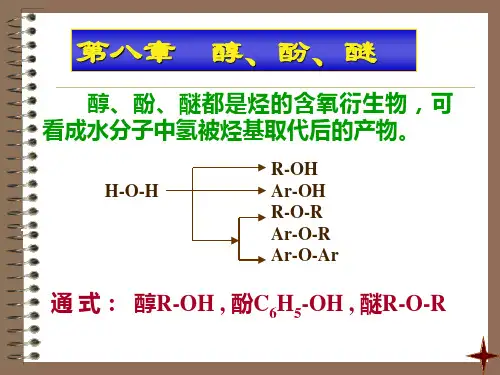








第七章 醇、酚、醚醇、酚和醚都是烃的含氧衍生物,羟基与脂肪烃基直接相连的叫醇,羟基与芳香烃基直接相连的叫酚,两烃基与氧直接相连的叫醚。
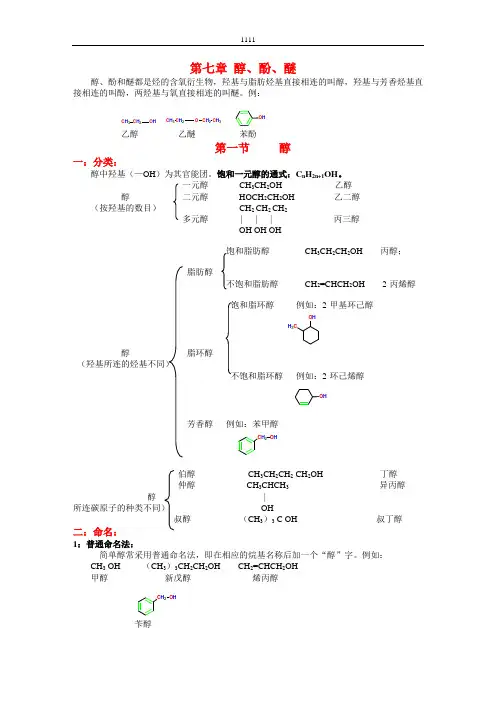
例:乙醇 乙醚 苯酚第一节 醇 一:分类:醇中羟基(—OH )为其官能团。
饱和一元醇的通式:C n H 2n+1OH 。
一元醇 CH 3CH 2OH 乙醇 醇 二元醇 HOCH 2CH 2OH 乙二醇 (按羟基的数目) CH 2 CH 2 CH 2 多元醇 | | | 丙三醇 OH OH OH饱和脂肪醇 CH 3CH 2CH 2OH 丙醇;脂肪醇不饱和脂肪醇 CH 2=CHCH 2OH 2-丙烯醇饱和脂环醇 例如:2-甲基环己醇醇 脂环醇 (羟基所连的烃基不同)不饱和脂环醇 例如:2-环己烯醇芳香醇 例如:苯甲醇伯醇 CH 3CH 2CH 2 CH 2OH 丁醇 仲醇 CH 3CHCH 3 异丙醇 醇 | 所连碳原子的种类不同) OH叔醇 (CH 3)3 C OH 叔丁醇二:命名:1:普通命名法:简单醇常采用普通命名法,即在相应的烷基名称后加一个“醇”字。
例如: CH 3 OH (CH 3)3CH 2CH 2OH CH 2=CHCH 2OH 甲醇 新戊醇 烯丙醇苄醇C H 3C H 2O HC H 3C H 2O C H 2C H 3O HO HCH 3O HC H 2O HC H 2O H2:系统命名法命名原则同前几章,以醇为母体,选取含有羟基的最长链为主链,从离羟基近的一端开始编号。
书写时,末尾加上“醇”字,“醇”字前写上羟基的位号,在位号与“醇”之间加上短横。
如果是不饱和醇,则选含有羟基和不饱和键的最长链为主链,从离羟基近端编号。
书写时,将表示链中碳原子个数的字放在“烯”或“炔”的前面。
分子中含有多个羟基时,则选 含羟基数目尽可能多的最长链为主链,根据羟基的数目称为某元醇。
3-甲基-1-丁醇 E-3-氯-3-戊烯-2-醇 3-环戊烯醇 1,3-环己二醇 2-苯基乙醇芳香醇命名时,常常把芳环作为取代基。
教案(章、节备课)1•俗名:如乙醇俗称酒精,丙三醇称为甘油等。
2•简单的一元醇用习惯命名法命名。
例如:CH 3CH 3CH 3 CH CH 2OH CH 3 C —0HCH 3异丁醇 叔丁醇3. 系统命名法结构比较复杂的醇,采用系统命名法。
选择含有羟基的最长碳链为主链,以羟基 的位置最小编号,称为某醇。
0HCH 3-CH-CH-CH 才CH-CH3CH 3ClCH 3-CH -CH 2-CH =CH 2I OHCH-CH 3OH2-甲基-5-氯-3-己醇4 -戊烯-2-醇1 -苯基乙醇(a 苯乙醇)2 -苯基乙醇(3苯乙醇)多元醇的命名,要选择含 -OH 尽可能多的碳链为主链,羟基的位次要标明。
例如:§ 8.2醇的性质§ 8.2.1醇的物理性质 1 .性状:(略) 2. 沸点: 3. 溶解度:4. 结晶醇的形成低级醇能和一些无机盐(MgCl 2、CaCl 2、CuSO 4等)作用形成结晶醇,亦称醇化MgCb 一 6CH 3OHCaCl 2 ' 4C 2H 5OH CaCl 2 - 4CH 3OHQO 0H环己醇CH 2OH例如:CH I 0H2-CH 2-CH 2 OH1, 3丙二醇不溶于有机溶剂,溶于水。
可用于除去有机物中的少量醇如:苄醇§ 8.1.2醇的化学性质1 •与活泼金属的反应CH 3CH 2OH + Na -------------- CH 3CH 2ONa + 1/2 H 2K K粘稠固体(溶于过量乙醇中)Na 与醇的反应比与水的反应缓慢的多,反应所生成的热量不足以使氢气自燃, 故常利用醇与Na的反应销毁残余的金属钠,而不发生燃烧和爆炸。
CH 3CH 2O -的碱性比-OH 强,所以醇钠极易水解。
CH 3CH 2ONa + H 2O —CH 3CH 2OH + NaOH较强碱较强酸较弱酸 较弱碱醇的反应活性:CH s OH>伯醇(乙醇)> 仲醇 >叔醇pKa 15.09 15.93> 19醇钠(RONa )是有机合成中常用的碱性试剂。
金属镁、铝也可与醇作用生成醇镁、 醇铝。
CH 3CH 3II I6 CH 3—CH — OH + 2AI --------------- 2(CH 3—CH O )3 Al + 3H 2还原剂有机合成中常用的试剂与氢卤酸反应 (制卤代烃的重要方法)反应速度与氢卤酸的活性和醇的结构有关。
卢卡室温^ CH3CH2CH CH3 +⑷10min 钟混浊,放置分层R-OH + HX—R-X + H 2OHX 的反应活性:HI > HBr > HCl醇的活性次序: 烯丙式醇 > 叔醇 > 仲醇 > 伯醇 > CH a OH例如,醇与卢卡斯(Lucas )试剂(浓盐酸和无水氯化锌)的反应:CH 3CH 3 C —OHCH 3(浓 HCl + 无水 ZnCI 2 )室温CH 3CH 3 —C — CI + H 2OCH 3〔min 钟混浊,放置分层CH 3CH 2CHCH 3OH卢卡斯试剂CH3CH2CH2CH2OH CH3CH2CH2CH2CI + H2O室温放置一小时也不反应(混浊)加热才起反应(先混浊,后分层)Lucas试剂可用于区别伯、仲、叔醇,但一般仅适用于3—6个碳原子的醇。
原因:1 —2个碳的产物(卤代烷)的沸点低,易挥发。
大于6个碳的醇(苄醇除外)不溶于卢卡斯试剂,易混淆实验现象。
3 •与酸反应(成酯反应)1)与无机酸反应醇与含氧无机酸硫酸、硝酸、磷酸反应生成无机酸酯。
CH3CH2OH +HOSO2OH——CH3CH2OSO2OH + H2O硫酸氢乙酯(酸性酯)CH3CH2OSO2OH 减压蒸懈”(CH3CH2O)2SO2 + H2SO4硫酸二乙酯(中性酯)CH3OSO2OCH3有机合成中的烷基化剂,有剧毒CH3CH2OSO2OCH2CH3高级醇的硫酸酯是常用的合成洗涤剂之一。
如C i2H25OSO2ONa (十二烷基磺酸钠)。
CH2-OHCH-OH + I 3HNO3 -------------CH2-ONO2CH-ONO 2 + 3H2O三硝酸甘油酯可作炸药CH2-OH CH2-ONO2HO3C4H9OH +\3H2O HO P - O(。
4出0)3卩 -HO磷酸三丁酯(作萃取剂,增塑剂)2)与有机酸反应H IR-OH + CH3COOH CH3COOR + H2O (见第十三章)4. 脱水反应醇与催化剂共热即发生脱水反应,随反应条件而异可发生分子内或分子间的脱水H 2SO 4 170 c CH 2 = CH 2 + H 2O or AI 2O 3, 360 CH 2SO 4, 140 C CH 3CH 2OCH 2CH 3 + H 2O or Al 2O 3, 240〜260CCH 2-CH 2 H OH CH 2-CH 2 H OH醇的脱水反应活性: 3° R-OH > 2° R-OH > 1° R-OH例如:CH3CH2CH2CH2OH 75% H2SO4CH3CH = CHCH 3*-140 °CCH3CH2CHCH3O H(CH3)3C-OH 醇脱水反应的特点:主要生成札依采夫烯,例如:CH3CH2CHCH3OH 60% H2SO4100 C20% H2SO485~90CCH3CH = CHCH 380%CH3CH3-C = CH 2100%HCH3CH = CHCH380%CH=CHCH5.+ CH3CH2CH = CH220%CH2CH=CH 2 3+1)氧化:伯醇、仲醇分子中的a -H原子,由于受羟基的影响易被氧化。
伯醇被氧化为羧酸。
K Q C Y O/ + H 2SO4RCH2OH RCHO CH3CH2OH + Cr2O72-橙红丄RCOOHCH3CHO + Cr3+绿色K2Cr2O7—2 2 7・ CH3COOH 仲醇一般被氧化为酮。
脂环醇可继续氧化为二元酸。
C H 3KMnO4,H CH3-CH-OH ----------------------OCH3-C-CH3丙酮CH 2CH 2COOH ICH 2CH 2COOH 己二酸叔醇一般难氧化,在剧烈条件下氧化则碳链断裂生成小分子氧化物。
2)脱氢:伯、仲醇的蒸气在高温下通过催化活性铜时发生脱氢反应,生成醛和 酮。
§ 8.2酚(1.5学时) § 8.2.1酚的结构及命名1 •结构酚是羟基直接与芳环相连的化合物(羟基与芳环侧链的化合物为芳醇) ,即酚是烃的羟基衍生物。
2•命名酚的命名一般是在酚字的前面加上芳环的名称作为母体,再加上其它取代基的名 称和位次。
特殊情况下也可以按次序规则把羟基看作取代基来命名。
§ 8.2.2酚的化学性质羟基即是醇的官能团也是酚的官能团,因此酚与醇具有共性。
但由于酚羟基连在苯环上,苯环与羟基的互相影响又赋予酚一些特有性质, 所以酚与醇在性质上又存在着较大的差别。
1 •酚羟基的反应 (1)酸性KaP ~10(不能使石蕊试纸变色)酚的酸性比醇强,但比碳酸弱。
OH环己醇I OCu 325 °CRCH 2OHH 2 RCHO + H 2C-CH 3II O故酚可溶于NaOH 但不溶于NaHCO 3,不能与Na 2CO 3、NaHCO a 作用放出CO 2, 反之通入CO 2于酚钠水溶液中,酚即游离出来。
利用酚的这种能溶于碱, 而又可用酸 将它从碱溶液中有离出来的性质,工业上常被用来回收和处理含酚污水。
利用醇、酚与 NaOH 和NaHCO a 反应性的不同,可鉴别和分离酚和醇。
当苯环上连有吸电子基团时, 酚的酸性增强;连有供电子基团时,酚的酸性减弱。
⑵与FeCl a 的显色反应酚能与FeCl a 溶液发生显色反应,大多数酚能起此反应, 故此反应可用来鉴定酚。
6ArOH + FeCl 3 " [ Fe(OAr) 6 ] - + 6H + 3CI蓝紫色 棕红色不同的酚与FeCl a 作用产生的颜色不同。
见 P 292表10-6。
与FeCl a 的显色反应并不限于酚,具有烯醇式结构的脂肪族化合物也有此反应。
(3)酚醚的生成醚不能分子间脱水成醚,一般是由醚在碱性溶液中与烃基化剂作用生成。
苯基烯丙基醚在有机合成上常利用生成酚醚的方法来保护酚羟基。
CH 3CH 2OHP Ka 17Z OH 10H 2CO 3 6.5NaHCO a NaClRCH 2Br(CH02SO 4 -CH 2=CHCH 2Br■+ NaBr+ NaBrONaXOHOHOCH 2R 苯甲醚(茴香醚)OCH 2CH=CH 2HNOXOH邙阿司匹林)水杨酸使苯环上的电子云密度卤代反应苯酚与溴水在常温下可立即反应生成沉淀。
OHBr反应 作苯酚的鉴别和定量测定。
OHOH+BrH+(1) 如需要制取一溴代苯酚,则要在非极性溶剂CS2,CCI4)和低温下进行。
增加,亲电反应容易进行。
2 .芳环上的亲电取代反应2, 4, 6三溴苯酚白色+ 3HBr+ B 「2(H 2。
)OH... Br很灵敏,很稀的苯酚溶液(10ppm )就能与溴水生成沉淀。
故 此反应可用(2)硝化苯酚比苯易硝化,在室温下即可与稀硝酸反应。
+ 3HBrH +羟基是强的邻对位定位基 + CH 3COOHOCOCH 3COOH+ CH 3COOH由于羟基与苯环的 P-n 共轭-:■■ --NO 2OHBr °、Br20 r+ 稀 HNO 3+ B 「20 rH 2SO 4COOH+ (CH 3CO)2O -------------------65-80 r乙酰水杨酸 酚也可被卤素取代,但不象醇那样顺利;酚也可以生成酯,但比醇困难。
OH邻硝基苯酚易形成分子内氢键而成螯环,这样就削弱了分子内的引力;而对硝基苯酚不能形成分子内氢键,但能形成分子间氢键而缔合。
因此邻硝基苯酚的沸点和在水中的溶解度比其异构体低得多,故可随水蒸气蒸馏出来。
3 .氧化反应酚易被氧化为醌等氧化物,氧化物的颜色随着氧化程度的深化而逐渐加深, 色而呈粉红色、红色以致深褐色。
例如:OH OA KMnO4 + H2SO4A丨O|O 对苯醌(棕黄色)多元酚更易被氧化。
OH O2AgBr Al+ 2Ag + HBryOHn O对苯二酚是常用的显影剂。
酚易被氧化的性质常用来作为抗氧剂和除氧剂。
四、重要的酚(自学)§ 8.3 醚(0.5学时)§ 8.3.1醚的结构,分类和命名1 •结构sp3杂化—O、R R'109.5°不饱和醚CH 3OCH 2CH = CH 2 CH 2=CHOCH=CH 2芳香醚I-OCH 3 '[Ji O环醚、o/ 厂b 匚O大环多醚(冠醚)由无饱和醚简单醚CH3CH2OCH2CH3混和醚CH3OCH2CH32 .分类3 •命名1)简单醚在“醚”字前面写出两个烃基的名称。