临床试验安全性评价资料共42页
- 格式:ppt
- 大小:2.65 MB
- 文档页数:42



国家药品监督管理局四、临床评价资料需要进行临床评价的第二类、第三类体外诊断试剂,注册人应根据具体变更情况,基于变化部分对产品安全性、有效性影响的论述,必要时采用适当的方法进行临床评价并按照以下要求提交资料。
(一)章节目录应当包括本章的所有标题和小标题,注明目录中各内容的页码。
(二)临床评价资料要求如适用,应当提交与产品变化部分相关的临床评价资料。
1.综述(1)简要总结支持产品注册申报的临床评价过程和数据,说明临床评价路径和关键内容,包括试验地点(如机构)、试验方法、受试者及样本、评价指标及可接受标准、试验结果、结论、资料位置等。
(2)论证上述临床数据用于支持本次申报的理由及充分性。
2.依据产品变化对产品临床性能的影响及变更后产品的风险分析,变更后产品通过临床前研究不能确认其安全有效的,应提交临床评价资料。
下列变更情况原则上应当提交临床评价资料:(1)适用的样本类型变化。
(2)适用人群变化。
(3)临床适应证变化。
(4)其他显著影响产品临床性能的变化。
3.临床试验资料开展临床试验的,应提交临床试验方案、临床试验机构伦理委员会同意开展临床试验的书面意见、知情同意书样本、临床试验报告(附各机构临床试验小结,包括小结正文及临床试验数据表、临床试验中所采用的其他试验方法或其他体外诊断试剂等产品的基本信息等),并附临床试验数据库,包括原始数据库、分析数据库、说明性文件和程序代码(如有)。
境外临床试验资料应符合要求。
临床试验相关资料签章应符合《医疗器械临床试验质量管理规范》的要求。
4.其他临床评价资料列入免于进行临床试验目录的体外诊断试剂,临床评价资料包括与“目录”对应项目的对比资料、临床评价报告(包括描述性比对分析和比对性能数据)等。
5.其他资料提交使用申报产品在境内、外完成的其他临床评价资料,包括临床评价的摘要、报告、数据和临床文献综述、经验数据等。


药物临床安全性评价报告撰写规范2005年2月 美国FDA发布2009年6月 药审中心组织翻译诺华制药有限公司、赛诺菲安万特制药有限公司翻译药审中心最终核准目录I. 引言 (1)II. 临床安全性审评的一般指南 (2)A. 引言 (2)B. 术语解释 (3)C. 安全性审评概述 (4)D. 安全性和有效性数据评价方法的差异 (5)E. 确定和收集安全性审评中的原始资料 (7)F. 在最开始的时候确定重大关注问题 (8)G. 稽查原始资料 (9)H. 个体病例审评/“药物相关性”的目的 (9)III. 对安全性审评报告内容的特殊指南 (11)7.1 方法与结果 (111)7.1.1 死亡 (13)7.1.2 其它严重不良事件 (17)7.1.3 退出研究和其它显著不良事件 (18)7.1.3.1 退出的总特征 (19)7.1.3.2 与退出有关的不良事件 (180)7.1.3.3 其它显著不良事件 (219)7.1.4 其它研究策略 (220)7.1.5 常见不良事件 (203)7.1.5.1 申请人在开发方案中引出(Eliciting)不良事件的方法 (203)7.1.5.2 确定合适的不良事件分类和优选术语 (213)7.1.5.3 常见不良事件的发生率 – 对不同数据库的评估 (235)7.1.5.4 常见不良事件表 (247)7.1.5.5 鉴定常见和药物有关不良事件 (257)7.1.5.6 补充分析和探索性研究 (258)7.1.6 不常见不良事件 (269)7.1.7 实验室检查结果 (30)7.1.7.1 开发项目中的实验室检查概述 (30)7.1.7.2 选择有关研究/分析法以进行实验室检测值的药物对照比较 (31)7.1.7.3 实验室数据的标准分析和探索性研究 (32)7.1.7.3.1 对集中趋势测量的重点分析 (329)7.1.7.3.2 对异常值或从正常值向异常值变化的数值的重点分析 (329)7.1.7.3.3 显著异常值和因实验室异常而退出 (33)7.1.7.4 补充分析和探索性研究 (34)7.1.7.5 特殊评估项目:肝毒性、QTc、其它 (34)7.1.8 生命体征 (35)7.1.8.1 开发项目中生命体征检查的范围 (35)7.1.8.2 用于整体药物对照比较的研究和分析方法选择 (35)7.1.8.3 生命体征数据的标准分析和探索性研究 (35)7.1.8.3.1 对集中趋势测量的重点分析 (35)7.1.8.3.2 对异常值或从正常值向异常值变化的数值的重点分析 (35)7.1.8.3.3 显著异常值和因生命体征异常而退出 (35)7.1.8.4 补充分析和探索性研究 (35)7.1.9 心电图(ECGs) (35)7.1.9.1 开发项目中ECG检查的范围,包括对临床前结果的简要综述 (36)7.1.9.2 用于整体药物对照比较的研究和分析方法选择 (36)7.1.9.3 ECG数据的标准分析和探索性研究 (36)7.1.9.3.1 对集中趋势测量的重点分析 (36)7.1.9.3.2 对异常值或从正常值向异常值变化的数值的重点分析 (36)7.1.9.3.3 显著异常值和因ECG异常而退出 (36)7.1.9.4 补充分析与探索性研究 (36)7.1.10 免疫原性 (36)7.1.11 人类致癌性 (37)7.1.12 特殊安全性研究 (37)7.1.13 戒断现象/滥用可能性 (38)7.1.14 人类生殖和怀孕数据 (38)7.1.15 对生长发育作用的评估 (38)7.1.16 过量给药经验 (39)7.1.17 上市后经验 (39)7.2 患者暴露量和安全性评估的充分性 (39)7.2.1 用于评价安全性原始临床数据来源介绍(暴露人群和暴露程度) (40)7.2.1.1 研究类型和设计 / 患者计数 (41)7.2.1.2 人口学 (41)7.2.1.3 暴露程度(剂量/周期) (42)7.2.2 用于安全性评价的二级临床数据来源介绍 (439)7.2.2.1 其它研究 (43)7.2.2.2 上市后经验 (43)7.2.2.3 文献 (43)7.2.3 总体临床经验的充分性 (44)7.2.4 特殊动物试验和/或体外试验的充分性 (44)7.2.5 常规临床检测的充分性 (44)7.2.6 代谢、清除率和相互作用检查的充分性 (45)7.2.7 对任何新药(特别是那些能够代表新药类型的药物)潜在不良反应评价的充分性;对进一步研究的建议 (46)7.2.8 数据质量和完整性的评估 (47)7.2.9 补充递交资料,包括安全性更新数据 (49)7.3 选择的不良反应总结、数据重要局限性和结论 (49)7.4 一般方法学 (51)7.4.1 汇总各研究数据以便评估和比较发生率 (51)7.4.1.1 汇总数据与单个研究数据比较 (51)7.4.1.2 结合数据 (549)7.4.2 探索预测性因素 (53)7.4.2.1 对不良事件检查结果剂量依赖性的探索 (53)7.4.2.2 探索不良事件检查结果的时间依赖性 (54)7.4.2.3 探索药物与人口学之间的相互作用 (55)7.4.2.4 探索药物与疾病之间的相互作用 (56)7.4.2.5 探索药物与药物之间的相互作用 (56)7.4.3 确定因果关系 (57)表格目录 (59)药物临床安全性评价报告撰写规范I. 引言本良好审评管理规范(GRP)指导原则拟帮助有关审评员从事临床安全性审评工作(属于NDA和BLA审评程序中的一部分)、为安全性审评报告的格式和内容提供标准统一的要求、同时确保关键内容和分析结果不会因疏忽大意而被遗漏。


附1申报产品与目录中已获准境内注册医疗器械对比表对比项目目录中医疗器械申报产品差异性支持性资料概述基本原理(工作原理/作用机理)结构组成产品制造材料或与人体接触部分得制造材料性能要求灭菌/消毒方式适用范围使用方法……注:对比项目可根据实际情况予以增加。
附2申报产品与同品种医疗器械得对比项目(无源医疗器械)附3申报产品与同品种医疗器械对比表得格式对比项目同品种医疗器械申报产品差异性支持性资料概述基本原理结构组成………………注:对比项目至少应包括附件2所列全部项目。
附4通过同品种医疗器械临床试验或临床使用获得得数据进行分析评价路径附5文献检索与筛选要求一、检索数据库注册申请人需根据申报产品/同品种医疗器械得具体情况(如设计特征、适用范围等)选择检索数据库,并在方案中论述选择得理由。
数据库得选择应具有全面性,可考虑得数据库类型举例如下。
1、科学数据库:如中国期刊全文数据库、美国《医学索引》(Medline)、荷兰《医学文摘》(EM)等。
2、临床试验数据库:如科克伦对照试验注册中心(CENTRAL)、临床试验注册资料库(ClinicalTrials、gov)等。
3、系统评价数据库:如科克伦(Cochrane)图书馆等。
4、专业数据库:如诊断测试索引数据库(MEDION)、骨关节登记数据库等。
二、检索途径、检索词、检索词得逻辑关系为全面、准确地检索出申报产品/同品种医疗器械得临床文献,应综合考虑检索途径得选择、检索词得选择与各检索词间逻辑关系得配置,制定科学得检索策略。
常见得检索途径包括主题词检索、关键词检索、摘要检索、全文检索等。
检索词应与选择得检索途径相适应,考虑因素如产品得通用名称、商品名称、生产企业、基本原理、结构组成、制造材料、设计特征、关键技术、适用范围等。
进行检索词逻辑组配时, 应正确地选用逻辑算符来表达检索词之间得逻辑关系,如逻辑或(OR)扩大检索范围,逻辑与(AND)缩小检索范围。
应在检索方案中论述检索途径、检索词、检索词逻辑关系得确定理由。

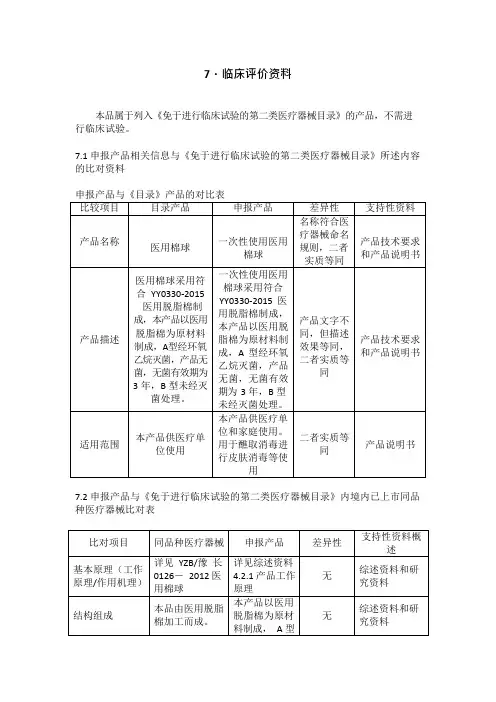
7.临床评价资料
本品属于列入《免于进行临床试验的第二类医疗器械目录》的产品,不需进行临床试验。
7.1申报产品相关信息与《免于进行临床试验的第二类医疗器械目录》所述内容的比对资料
7.2申报产品与《免于进行临床试验的第二类医疗器械目录》内境内已上市同品种医疗器械比对表
【用途】
本产品供医疗单位使用。
【产品结构组成】
医用棉球以医用脱脂棉为原材料制成,A 型经环氧乙烷灭菌,产品无菌,无菌有效期为3 年,B 型未经灭菌处理。
【详细说明】
本产品以医用脱脂棉为原材料制成。
【产品标准】。

临床检验项目安全评估
临床检验项目的安全评估是衡量该检验项目对患者和医务人员的安全风险的评估工作。
主要包括以下几个方面:
1. 检验方法的安全性评估:评估检验方法是否精准、可靠、重复性好,避免误判和漏诊。
评估检验仪器设备是否安全可靠,是否符合医疗设备管理规范。
2. 试剂和标准品的安全评估:评估试剂和标准品的来源和质量,确保不含有有害成分和微生物污染。
评估试剂的保存和使用方法是否安全可靠。
3. 样本采集的安全评估:评估样本采集的方法是否安全无痛、无创伤,并确保采样过程不感染患者和医务人员。
评估样本的质量和保存方式是否符合规范。
4. 结果解读和报告的安全评估:评估结果的解读是否准确可靠,报告信息的准确性和完整性。
5. 检验报告的安全评估:评估检验报告的信息是否准确、完整、易读,并确保报告的保密性。
6. 检验质量控制的安全评估:评估检验质量控制的方法和措施是否可靠,避免误差和风险。
7. 其他安全问题的评估:评估临床检验项目的安全操作规范是否符合规范,评估人员培训是否充分,评估设备维护维修是否
及时。
这些评估工作有助于提高临床检验项目的安全性,减少患者和医务人员的风险,确保检验结果的准确性和可靠性。