二甲醚的生产
- 格式:ppt
- 大小:586.50 KB
- 文档页数:66

二甲醚生产工艺规程及操作目 录第一章 甲醇制二甲醚流程....................................‥1 第一节 流程简述 (1)第二节 控制点表 (1)第二章 合成塔操作 (3)第一节 合成原始开车步骤 (3)第二节 开车 (4)第三节 导热油泵的开车 (5)第四节 合成塔正常工艺条件 (6)第三章 精馏塔操作 (6)第一节 精馏系统的原始开车 (6)第二节 正常操作方法 (8)第三节 正常工艺条件 (10)第四节 异常现象和事故处理 (11)第一章 甲醇制二甲醚流程第一节 流程简述粗甲醇由原料槽经原料泵打入粗甲醇储槽V107,再经甲醇中间泵P106打入甲醇塔C103中部(如原料是精甲醇,则直接进入精甲醇储槽V101)。
在甲醇塔分离出水,>95%的甲醇由塔顶经E106甲醇冷凝器后,进入甲醇回流槽V103,部分甲醇回流入塔C103,部分进入精甲醇储槽V101,甲醇塔尾气排空。
V101槽的甲醇由P101精甲醇泵经E103冷甲醇加热器进入E101甲醇蒸发器,蒸发的甲醇蒸气经E102甲醇气加热器与反应后气体再加热至200℃,进入C101合成塔下部,在经中央管加热至270℃,从合成塔上部进入催化剂床层,合成反应为放热反应,合成塔温度由导热油冷却控制。
开车时由导热油加热至反应温度。
反应后的混合气在E102、E103中与入塔的冷甲醇换热后,进入经合成气冷凝器冷凝后进入C102二甲醚分离塔中部,从塔顶得到99%的二甲醚,它经E105二甲醚冷凝器冷凝后进入二甲醚塔回流槽V102,部分回流入塔,部分进入V106精二甲醚冷凝储槽再进入产口储槽。
在C101及C102塔中,操作压力为0.4~1.0Mpa,C102塔底的甲醇水经减压后进入C103塔中部,塔底水分析合格后排放。
第二节 控制点表序位号用途备注特性参数号一、温度3001 TI101 导热油出口温度 L2 TI102 甲醇蒸发器E101温度 L 1303 TI103 出E101甲醇汽温度 L 1304 TI104,5,6 二甲醚合成塔温度 P ~2805 TI107 入合成塔甲醇汽温度 L 2006 TI108 出合成塔混合气温度 L 2807 TI109 入E101冷甲醇温度 L 258 TI110 混合气冷凝器循环出水温度 L 409 TI111 出混合气冷凝器温度 L 12010 TI112 出二甲醚冷凝器循环出水温度 L 4011 TI113 二甲醚分离塔塔底温度 L 14012 TI114 二甲醚分离塔塔顶温度 L 36~3813 TI115 二甲醚分离塔塔顶温度 P 36~3814 TI116 二甲醚中间槽温度 L 3080 15 TI117 甲醇水温度 L6516 TI118 甲醇塔塔顶温度 L17 TI119 甲醇塔塔顶温度 P6510018 TI120 甲醇塔塔底温度 L3019 TI121 二甲醚储槽温度 L二、压力MPa1 PI101 进加热炉导热油压力 L 0.22 PI102 出加热炉导热油压力 L 0.30.33 PI103 导热油泵后压力 L4 PI104 甲醇蒸发器压力 L0.80.85 PI105 合成塔顶压力 L6 PI106,107 甲醇泵后、前压力 L 0.1,0.80.07 PI108 甲醇中间槽压力 L8 PI109 二甲醚分离塔顶压力 L 0.89 PI110,111 二甲醚回流泵前、后压力 L 0.3,0.810 PI112 二甲醚中间槽压力 L 0.311 PI113,114 二甲醚中间泵前、后压力 L 0.3,0.512 PI115,116 甲醇回流泵前后压力 L 0.0,0.113 PI117,118 甲醇中间泵前后压力 L 0.0,0.10.314 PI119 二甲醚储槽压力 L三、液位M0.1-0.51 LI101 导热油储槽液位 L0.1-0.5 2 LI102 甲醇蒸发器液位 L0.1-1.03 LI103 甲醇中间槽液位 L4 LI104 二甲醚分离塔底液位 L 0.1-0.85 LI105 二甲醚中间槽液位 L 0.1-1.00.1-0.8 6 LI106 甲醇塔底液位 L0.1-1.0 7 LI107 甲醇回流槽液位 L0.1-2.0 8 LI108 二甲醚储槽液位 L0.1-5.09 LI109 甲醇储槽液位 L四、流量L/h1 FI101 进蒸发器甲醇流量 L 340-4502 FI102 混合气冷凝器冷却水流量 L 50002203 FI103 二甲醚回流流量 L1204 FI104 甲醇水流量 L5 FI105 甲醇冷却器冷却水流量 L 80006 FI106 二甲醚冷凝器冷却水流量 L 80001207 FI107 甲醇回流流量 L注:P代表控制室仪表,L表示就地仪表五、取样口1 A101 合成混合气取样2 A102 二甲醚分离塔底取样3 A103 甲醇水取样4 A104 甲醇塔底取样5 A105 精甲醇取样6 A106 来料甲醇取样7 A107 二甲醚储槽二甲醚取样第二章 合成塔操作二甲醚由甲醇在催化剂作用下脱水来合成,反应为放热反应,方程式为:2CH3OH—CH3OCH3+H2O+5.5Kcal为严格控制反应温度应及时移走反应热,二甲醚合成设计为列管式,催化剂装于管内,管外用导热油强制换热。
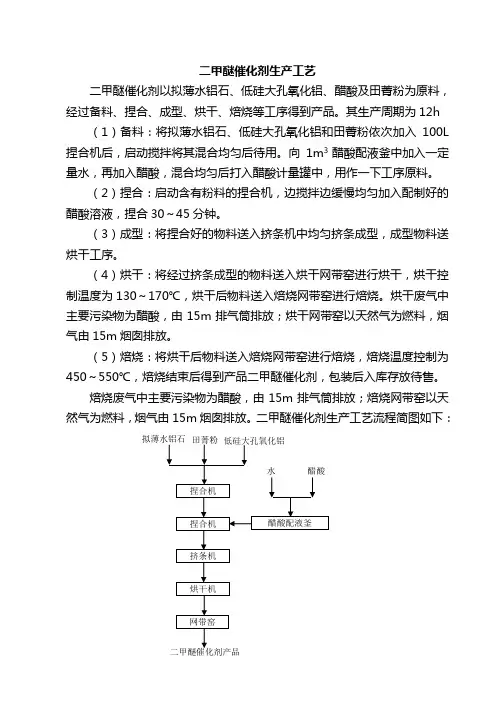
二甲醚催化剂生产工艺
二甲醚催化剂以拟薄水铝石、低硅大孔氧化铝、醋酸及田菁粉为原料,经过备料、捏合、成型、烘干、焙烧等工序得到产品。
其生产周期为12h (1)备料:将拟薄水铝石、低硅大孔氧化铝和田菁粉依次加入100L捏合机后,启动搅拌将其混合均匀后待用。
向1m3醋酸配液釜中加入一定量水,再加入醋酸,混合均匀后打入醋酸计量罐中,用作一下工序原料。
(2)捏合:启动含有粉料的捏合机,边搅拌边缓慢均匀加入配制好的醋酸溶液,捏合30~45分钟。
(3)成型:将捏合好的物料送入挤条机中均匀挤条成型,成型物料送烘干工序。
(4)烘干:将经过挤条成型的物料送入烘干网带窑进行烘干,烘干控制温度为130~170℃,烘干后物料送入焙烧网带窑进行焙烧。
烘干废气中主要污染物为醋酸,由15m排气筒排放;烘干网带窑以天然气为燃料,烟气由15m烟囱排放。
(5)焙烧:将烘干后物料送入焙烧网带窑进行焙烧,焙烧温度控制为450~550℃,焙烧结束后得到产品二甲醚催化剂,包装后入库存放待售。
焙烧废气中主要污染物为醋酸,由15m排气筒排放;焙烧网带窑以天然气为燃料,烟气由15m烟囱排放。
二甲醚催化剂生产工艺流程简图如下:。

二甲醚及生产工艺1、二甲醚的基本概况二甲醚别名:甲醚英文名称:methyl ether;dimethyl ether;DMECAS编号:115-10-6分子式:C2H6O结构式:CH3—O—CH3二甲醚又称甲醚,简称DME。
二甲醚在常压下是一种无色气体或压缩液体,具有轻微醚香味。
相对密度(20℃)0.666,熔点-141.5℃,沸点-24.9℃,室温下蒸气压约为0.5MPa,与石油液化气(LPG)相似。
溶于水及醇、乙醚、丙酮、氯仿等多种有机溶剂。
易燃,在燃烧时火焰略带光亮,燃烧热(气态)为1455kJ/mol。
常温下DME具有惰性,不易自动氧化,无腐蚀、无致癌性,但在辐射或加热条件下可分解成甲烷、乙烷、甲醛等。
二甲醚是醚的同系物,但与用作麻醉剂的乙醚不一样,毒性极低;能溶解各种化学物质;由于其具有易压缩、冷凝、气化及与许多极性或非极性溶剂互溶特性,广泛用于气雾制品喷射剂、氟利昂替代制冷剂、溶剂等,另外也可用于化学品合成,用途比较广泛。
2 生产原理生产方法简介目前国内外二甲醚生产方法主要有合成气一步法和甲醇法。
甲醇法又分为甲醇气相法和甲醇液相法。
合成气一步法的工业化技术尚未成熟,理由是: ①现有的技术未经装置检验; ②即使按现有技术,其生产成本也高于甲醇气相法反应方程式合成气一步法以合成气(CO + H2 )为原料,合成甲醇反应和甲醇脱水反应在一个反应器中完成,同时伴随CO的变换反应。
其反应式如下。
2CO + 4H2 = 2CH3OHCO +H2O =CO2 +H22CH3OH =CH3OCH3 +H2O总反应: 3CO + 3H2 =H3COCH3 +CO2甲醇液相法:甲醇脱水反应在液相、常压或微正压、130 ~130 ℃下进行。
其化学反应式如下:2CH3OH =H3COCH3 +H2O甲醇气相法:催化剂为ZSM分子筛、磷酸铝或γ2Al2O3。
甲醇脱水反应的化学反应式如下。
主反应:2CH3OH =H3COCH3 +H2O主要副反应:CH3OH =CO + 2H2H3 COCH3 =CH4 +H2 +COCO +H2O =CO2 +H23 工艺过程及流程图工艺过程合成气一步法合成气一步法的主要特点在于反应的优势,合成甲醇反应和甲醇脱水反应在一个反应器中完成。


学号:3510020031泰山医学院毕业设计(论文)题目:二甲醚的的合成及其应用前景院(部)系化工系所学专业应用化工技术年级、班级10级1班完成人姓名指导教师姓名专业技术职称年月日论文原创性保证书我保证所提交的论文都是自己独立完成,如有抄袭、剽窃、雷同等现象,愿承担相应后果,接受学校的处理。
专业:班级:签名:年月日摘要二甲醚是一种重要的精细化工产品,因其良好的理化性质在化工和医药行业中一直被广泛用作甲基化剂、气雾剂、致冷剂和各种有机合成原料。
近年来国内外的研究发现它还具有优良的燃烧性能,可直接用作发动机燃料和民用燃料,被誉为“21世纪的清洁燃料”。
本论文将介绍二甲醚的性质,二甲醚的制备方法,二甲醚的应用及市场发展前景,国内二甲醚的生产及研究现状。
关键字:二甲醚;燃料;化工产品;制备方法AbstracTwo ether is an important fine chemical product, because of its physical and chemical properties in the chemical and pharmaceutical industries has been widely used as a methylating agent, aerosol, refrigerant and various organic synthesis of raw materials. In recent years, the domestic and foreign research found that it also has excellent combustion properties, can be directly used as engine fuel and civilian fuel, known as "the twenty-first Century clean fuel". This paper will introduce the properties of two ether, preparation method of two ether, application and market prospect of the two ether, present situation of production and research of the two ether.Keywords: two ether; fuel; chemical products; preparation method目录第一章二甲醚的性质 (1)1.1二甲醚的物理性质 (1)1.2二甲醚的化学性质 (1)第二章二甲醚的制备方法 (3)2.1两步法 (3)2.1.1 甲醇液相脱水法 (3)2.1.2 甲醇气相脱水法 (4)2.2合成气一步法 (5)2.2.1 一氧化碳和氢气合成二甲醚 (5)2.2.2 二氧化碳和氢气合成二甲醚 (6)第三章二甲醚的应用及市场发展前景 (7)3.1化工原料 (7)3.2化工产品 (7)3.3用作燃料 (8)3.3.1 民用燃料 (8)3.3.2 车用燃料 (8)3.4二甲醚的市场发展前景 (9)第四章国内二甲醚生产工艺的发展及研究现状 (10)4.1国内二甲醚的生产工艺的发展 (10)4.2国内二甲醚生产工艺的研究现状 (11)4.3国内二甲醚的主要生产厂家及产能 (11)第五章结论 (13)参考文献 (14)致谢 (15)二甲醚的性质第一章二甲醚的性质1.1 二甲醚的物理性质二甲醚(Dimethyl Ether,缩写为DME),又称甲醚,氧化甲。

原料甲醇的性质:甲醇另名甲基醇、木醇、木精、分子式:CH3OH,分子量32.04,有类似乙醇气味的无色透明、易燃易挥发的液体,比重:0.7915.熔点-97.80℃,沸点:64.7℃,20℃时蒸汽压96.3㎜㎏,表面张力为:0.0226N/m,粘度:0.5945厘斯,闪点(闭点)12.2℃(开口)16℃,自然点385℃,燃烧热:22688J/㎏,在空气中的爆炸极限为6.0-36.5%。
甲醇为有毒化工物品,有显著的麻醉作用,对神经影响很大,严重时可引起失明。
甲醇是最常用的有机溶剂之一,与水互溶且体积较小,能与甲醇、乙酸等多种有机溶剂互溶。
二甲醚性质:二甲醚简称甲醚,分子式:CH3OCH3。
分子量:46.07,常温下无色气体或压缩液体,类似氯仿臭味,密度(20℃)66㎏/m3,凝固点为:-141.5℃,沸点为:-24.9℃,表面张力为(-10℃)16mN/m,0℃时合体粘度为:82.5pa.S,蒸汽压为:(20℃)0.5MPa,闪点为:-41.4℃,着火点为:-27℃,自然点:350℃,燃烧热:31583J/KG,比热:2.24KG/KG.K,在空气中的爆炸极限为:3.45-26.7%(体积)(24℃)20℃时约0.49MPa下,二甲醚在水中的溶解度为:35.3%wt,水在二甲醚中的溶解度为:7%wt能溶于四氯化碳丙酮、氯仿、乙酸甲酯等。
二甲醚为弱麻醉剂,对呼吸道有轻微的刺激作用,长期接触使皮肤发红、水肿。
皮肤接触二甲醚易冻伤。
生产原理甲醇制二甲醚生产工艺过程可分为反应和分馏两大工序。
一、反应工序反应工序包括甲醇气化甲醇脱水反应和粗甲醚收集。
原料甲醇在气化塔内被气化成甲醇蒸汽,甲醇蒸汽浴反应器流出的高温气体进行热交换后升温到240-280℃进入脱水反应器。
甲醇在催化剂和一定温度条件下进行分子间的脱水反应,反应方程式为:主反应:2CH3OH=CH3OCH3+H2O(1)副反应:CH3OCH3=C2H4+H2O(2)CH3OH=CO+2H2(3)CH3OCH3=CH4+H2+CO(4)CO+H2O=CO2+H2(5)甲醇单程转化率大于75%,二甲醚的选择性大于98%。


2023年二甲醚行业市场环境分析二甲醚是一种重要的有机化合物,其具有可溶、易挥发、无色、易燃等特性,被广泛应用于工业生产、医药、化妆品、涂料等领域。
本文将对二甲醚行业市场环境进行分析。
一、行业现状1.产能供需目前,全球二甲醚年产能已超过800万吨,主要集中在中国、美国、日本等地。
其中,中国是全球最大的二甲醚生产国家,占据了全球产能的近一半。
根据中国石化工程建设协会的数据显示,当前国内已有近200家企业参与二甲醚生产,产能已超过400万吨/年。
但是,当前国内二甲醚行业存在着严重的产能过剩问题,导致市场竞争激烈,行业利润普遍不高。
2.市场规模二甲醚作为一种高附加值产品,其全球市场规模前景广阔。
根据市场研究机构的数据显示,2019年全球二甲醚市场规模达到了约1000亿美元,未来几年预计将保持稳定增长。
特别是在中国,由于经济实力的增强,对二甲醚的需求量也在不断增加。
3.技术水平二甲醚行业的技术水平有待进一步提高。
目前,国内二甲醚生产企业大多处于中小型,技术水平整体较低。
部分企业在生产过程中,存在着废水排放量大、废气排放中有害物质含量高等问题,对环境造成了不良影响。
因此,整个行业需要在技术改进、环保水平等方面加大投入。
二、市场竞争分析1.主要厂商国内二甲醚生产企业众多,其中主要厂商包括山东永和化工、上海宝钢化工、浙江富阳化工、江苏恒邦化学物质有限公司等。
这些企业技术实力较强,生产规模较大,产品质量得到市场认可。
2.竞争格局目前,国内二甲醚市场竞争激烈,市场份额集中度较低。
企业之间的竞争主要表现在价格竞争、品质竞争、市场营销能力竞争等方面。
由于市场需求量大、价格波动性较大,因此行业中存在一些小型企业通过低价竞争抢占市场份额的情况。
3.未来发展趋势随着国内环保意识的不断加强,未来二甲醚行业将向高端、环保化发展。
当前,国内企业已加强环保治理措施,但仍需要加强技术更新、资本支持等方面的投入,提高整体产能规模和技术水平,优化竞争格局,保持市场竞争优势。

二甲醚生产工艺操作指南大连化学物理研究所二○○六年九月目录第一章甲醇制二甲醚流程简述第二章合成塔操作第一节合成原始开车步骤第二节开车第三节合成塔正常工艺条件第三章精馏塔操作第一节精馏系统的原始开车第二节正常操作方法第三节正常工艺条件第四节异常现象和事故处理第四章催化剂与装填第五章环境控制第六章二甲醚安全生产安全管理附录第一章甲醇制二甲醚流程简述来自界区外的原料甲醇与本装置回收的未反应甲醇分别被送入甲醇中间罐V-101,其中部分原料甲醇作为吸收液从V-101罐吸收段上部进入塔内回收不凝气中挟带的二甲醚等物料,另一部分从下部直接进入V-101罐内。
甲醇进料泵P-102将V-101罐内甲醇经换热后送入R-01(二甲醚脱水反应器)中进行脱水反应,脱水反应器分为二段催化剂床层,每段床层设四个甲醇冷激盘,以控制催化剂床层的反应温度。
原料甲醇进入R-01(二甲醚脱水反应器)前需与下列设备换热来提升进料甲醇的温度:E-111(C-102塔釜甲醇/废水换热器)、E -114(C-101塔釜甲醇/醇水换热器)、E-101(反应器进出预热器)、E-103(反应器进出换热器);另外在V-102(甲醇闪蒸罐)中E-102(甲醇汽化器)将进料甲醇全部加热变成气相,装置开工防爆加热器(E-104)用于开工阶段氮气或进料甲醇的加热。
预热到预定温度的甲醇蒸汽分段进入R-01(甲醇脱水反应器)内,在反应器中约有70 mol%的甲醇被转化,二甲醚的选择性约为99.5mol%。
反应器出口混合气中含有甲醇、二甲醚及微量的副产不凝气。
反应生成混合物料经E-103(反应器进出换热器)、E-101(反应器进出预热器)、E-109(甲醇回收塔再沸器)、E-113(DME塔进料换热器)换热降温至100℃左右;再经粗DME冷却器E-105A/B冷却至40℃后进入V-103(气液分离罐)进行气液分离。
从V-103(DME分离罐)底部排除的粗DME混合液,经E-113(DME塔进料换热器)与粗DME换热后进入C-101塔(粗DME塔)。

林达气相脱水制二甲醚技术及反应器杭州林达化工技术工程有限公司冯再南周传华钟永芳1、综述二甲醚(DME)作为民用清洁燃料和潜在的车用发动机燃料,市场空间巨大,因此倍受国内外关注。
二甲醚生产方法分为二类:合成气一步法制DME,是近几年世界上竞相开发的工艺路线,它以合成气为原料直接合成DME,具有流程短、成本低、经济效益显著等特点。
美国APC、日本NKK 公司自20世纪90年代初期开始研发,完成了工业试验,取得了长足进展。
国内浙江大学于90年代末在湖北田力公司建成1500t/a工试装置,清华大学等于2003年在重庆3000t/a中试装置,大连物化所、山西煤化所、华东理工大学等也对此有所研究,但真正意义上的工业规模装置尚未见诸报导。
甲醇脱水制DME即二步法,早期采用甲醇与浓硫酸共混加热进行液相脱水的方法制取DME,俗称液相法。
由于此法腐蚀性强、污染较重,不符合国际和国内环保要求,因此该工艺已逐步被淘汰。
1965年美国mobil公司与意大利DSSO公司相继开发了甲醇气相脱水制取DME工艺,经过几十余年的不断改进和优化,该技术已趋于成熟,生产流程简单,如外购原料甲醇生产DME,装置投资省、风险小,因而成为目前国内二甲醚的主要生产方法。
2、国内外甲醇脱水制DME技术现状由于合成气一步法制DME在工程化、特别是大型化装置上应用还存在较多风险,因此当前情况下生产DME技术采用甲醇脱水法技术路线更加合适,国外有日本东洋工程公司(TEC)和美国杜邦等公司,国内经十来年的改进完善,工艺技术也已相当成熟。
如单建DME装置,投资低,建设周期也短。
国内外DME生产技术主要如下:(1) 美国杜邦气相脱水法流程如右所示。
杜邦公司技术采用绝热固定床脱水反应器,合成压力 1.13MPa,进出催化剂床层温度分别为270℃、380℃,甲醇转化率70%。
DME精馏和甲醇回收压力分别为:1 MPa、常压,回收后甲醇送至甲醇贮罐再循环利用。
该技术生产流程较为典型。

二氧化碳制二甲醚化学式《二氧化碳制二甲醚的化学原理与应用》1. 介绍二氧化碳,化学式CO2,是一种常见的无机化合物,广泛存在于自然界中。
二甲醚,化学式CH3OCH3,是一种重要的有机化合物,具有广泛的工业和应用价值。
本文将深入探讨二氧化碳制二甲醚的化学原理以及其在工业生产中的应用。
2. 二氧化碳的来源和性质(1)二氧化碳的来源:二氧化碳主要由生物呼吸、燃烧和化石燃料燃烧等过程释放。
(2)二氧化碳的性质:二氧化碳是一种无色、无味、无毒的气体,在常温下呈现为气态,具有较高的密度。
3. 二甲醚的生产及应用(1)二甲醚的生产工艺:二甲醚通常通过甲醇与碱催化剂反应制备而成。
(2)二甲醚的应用:二甲醚广泛用于工业生产中的溶剂、燃料等领域,具有重要的经济和社会意义。
4. 二氧化碳制二甲醚的化学原理(1)催化剂作用:二氧化碳通常作为反应物与甲醇在催化剂的作用下发生反应。
(2)化学反应方程式:CH3OH + CO2 → CH3OCH3 + H2O (3)反应机理:通过催化剂的作用,甲醇与二氧化碳发生甲醇醚化反应,生成二甲醚和水。
5. 工业中的二氧化碳制二甲醚应用(1)工艺优势:二氧化碳制二甲醚工艺具有原料来源广泛、反应条件温和、产品纯度高等优势。
(2)环保意义:二氧化碳制二甲醚过程中利用了废弃的二氧化碳,有利于减少排放,具有明显的环保意义。
6. 个人观点二氧化碳制二甲醚是一种具有广阔应用前景的新型化工工艺,它充分利用了二氧化碳这一废弃气体资源,对于减少排放、环保和资源循环利用具有重要意义。
在工业化和环保发展的趋势下,该工艺将有望得到更广泛的应用和推广。
7. 总结本文深入探讨了二氧化碳制二甲醚的化学原理和工业应用,并就其技术优势和环保意义进行了阐述。
二氧化碳制二甲醚工艺的进一步推广将为化工行业的可持续发展和环境保护作出重要贡献。
通过以上的构思,我将在撰写文章的过程中充分综合化学反应原理、工业应用和个人观点,以期形成一篇深度和广度兼具的有价值的中文文章。
年产15万吨甲醇合成二甲醚工艺设计The Process Design of 150kt/a Dimethyl Ether Preparedby Methanol目录摘要 (I)Abstract (II)引言 (1)第一章文献综述 (3)1.1 二甲醚概况 (3)1.1.1 二甲醚的发展状况 (3)1.1.2 二甲醚的传统领域的应用及其拓展 (4)1.2 国内二甲醚市场简况 (5)1.2.1 现状 (5)1.2.2 国内市场预测 (7)1.3 国外二甲醚市场简况 (8)1.3.1 现状 (8)1.3.2 国外市场预测 (10)1.4 原料说明 (11)1.4.1 物理性质 (11)1.4.2 化学性质 (11)1.5 二甲醚的性质 (12)1.5.1 化学性质 (12)1.5.2 物理性质 (12)1.5.3 DME的毒性 (13)第二章工艺流程介绍 (14)2.1生产方法简述 (14)2.1.1 甲醇脱水制二甲醚 (14)2.1.2 合成气直接合成二甲醚 (15)2.2 工艺流程说明 (17)2.2.1 原料甲醇 (18)2.2.2 反应 (18)2.2.3 合成气冷却 (18)2.2.4 二甲醚精馏 (18)2.2.5 甲醇塔和二甲醚精馏塔 (18)2.3生产工艺特点 (19)2.4主要工艺指标 (19)2.4.1 二甲醚产品指标 (19)2.4.2 催化剂的使用 (200)第三章塔设备计算及选型 (21)3.1 汽化塔及其附属设备的计算选型 (21)3.1.1 物料衡算 (21)3.1.2 热量衡算 (23)3.1.3 理论板数、塔径、填料选择及填料层高度的计算 (27)3.1.4 汽化塔附属设备的选型计算 (32)3.2 合成塔物料衡算 (32)3.3 精馏塔及其附属设备的计算选型 (33)3.3.1 物料衡算 (33)3.3.2 热量衡算 (34)3.3.3 附属设备的选型计算 (37)3.3.4 理论塔板数的计算 (37)3.3.5 精馏塔主要尺寸的设计计算 (38)3.3.6 塔径设计计算 (40)3.3.7 填料层高度的计算 (42)3.3.8 填料塔液体分布装置 (43)3.3.9填料塔壁厚的计算 (43)结论 (44)致谢 ....................................................................................... 错误!未定义书签。
二氧化碳催化加氢合成二甲醚的研究进展文摘::二甲醚作为有机化工重要的化工厂品,在现代化工生产中应用非常广泛。
本文综述了二氧化碳催化加氢合成二甲醚的研究进展,对反应的机理、动力学及热力学模型、催化剂以及现代工业催化合成二甲醚的重要方法进行了分析和论述。
关键词:二甲醚;催化加氢;催化剂;合成;二氧化碳2CO 是含碳化合物燃烧的最终产物,作为主要的温室气体,对环境影响极大。
因此研究2CO 的有效用显得特别重要]1[。
二甲醚(Dimethyl ether)又称甲醚,简称DME ,是一种基础化工原料,具有易压缩、冷凝、汽化特性,在燃料、农药、制药等化学工业中有许多独特的用途]2[。
可作为制冷剂]3[、气雾剂]4[、清洁燃料]75[-,还可用于燃料电池及制低碳烯烃]7[。
因此以2CO 为原料催化加氢合成二甲醚具有重要的经济意义和环保意义,其化学方程式为:O H OCH CH H CO 23322362+=+。
一、反应机理目前关于二氧化碳催化加氢合成二甲醚有两种观点]8[,分别是一步法和两步法。
早期人们认为CO 是合成甲醇的直接碳源,所以当利用二氧化碳加氢合成二甲醚时应该先将二氧化碳进行转换而得到CO ,再进行甲醇的合成。
Amenomiya ]9[认为2CO 应先加氢合成甲酸的中间产物,甲酸的中间产物再分解生成CO ,再经由CO 加氢生成甲醇,再由甲醇脱水得到二甲醚。
其反应机理为:2CO →甲酸中间产物→CO →2CO →甲醇→二甲醚直到20世纪70年代Kagan ]10[等使用放射性同位素C14来研究甲醇合成过程中的反应机理,并首先提出,甲醇主要来源于2CO ,而并非CO ,CO2首先被氢气还原成CO, 再由CO 加氢生成甲醇, 甲醇脱水得到二甲醚]11[, 目前得到普遍认可的主要是一步法,其技术已经比较成熟,其反应机理可简单表示为2CO →CO →OH CH 4→330CH CH张建祥]12[认为, 一步法的反应机理可以较好地解释催化剂对原料气吸附性能与产物分布之间的关系,即在催化剂上CO2与H2的吸附活化发生在不同的催化位上, CO2 吸附活化后形成的表面中间物直接分解生成CO, 如果在附近有适宜吸附强度的氢存在, 该中间物将进一步加氢得到甲醇, 并在酸中心上甲醇脱水生成二甲醚。