脑缺血再灌注损伤主要发病机制的研究进展
- 格式:doc
- 大小:75.00 KB
- 文档页数:12

·专题·脑缺血再灌注后血脑屏障损伤机制及药物保护作用的研究进展李蕾1,许栋明2,王文1,王培昌1,艾厚喜1,张丽1,李林1[摘要]脑缺血再灌注导致血脑屏障破坏,从而引起脑出血和脑水肿。
与此同时机体内释放大量的细胞和化学因子可以调控血脑屏障的开放。
目前研究表明,脑缺血再灌注后血脑屏障损伤的主要机制为炎症因子的浸润,蛋白酶的水解作用以及水通道蛋白的开放等。
通过对以上机制的深入研究有助于开发新的脑保护药物,并进一步明确各种脑保护药物的治疗靶点和疗效。
[关键词]脑缺血再灌注;血脑屏障;药物;综述Advance in Damage Mechanism on Blood Brain Barrier after C erebral Ischemia-reperfusion and Neuroprotective Drugs(review)L I L ei,XU Dong-ming,WAN G Wen,et al.X uanwu Hospital o f Capital Medica l University;Torch Hi gh Technology Ind ustry Dev elopment Center,T he Ministry o f Science and T echnology o f the P.R.C.,Beij ing100038,ChinaA bstract:Cerebr al ischemia-reperfusio n results in breakdow n on co nst ruction and function o f blood brain bar rie r,leading to hemo rr hag e tra nsfo rmatio n and br ain edema.A t the same time,g ener ous cy tokines and chemokines r eleased after cerebra l ischemia-reperfusion can regula te the o pening o f the blood brain barrier.M any current studie s show ed that the majo r damag e mechanisms on bloo d brain bar rie r a re inflammatory infiltratio n,pr oteolysis,o pening aquapo rin and so o n.T he deep r esear ch on the mechanism con-tributes to explore new neuro pr otective dr ug s,and fur ther identify the targ et and therapeutic effec t o f drug trea tme nt.Key words:cer ebral ischemia-re perfusio n;bloo d brain bar rier;drug;review[中图分类号]R743.3[文献标识码]A[文章编号]1006-9771(2009)10-0901-04[本文著录格式] 李蕾,许栋明,王文,等.脑缺血再灌注后血脑屏障损伤机制及药物保护作用的研究进展[J].中国康复理论与实践,2009,15(10):901—904.缺血性脑血管病是临床常见的危重疾病,占脑卒中总数的75%~85%。
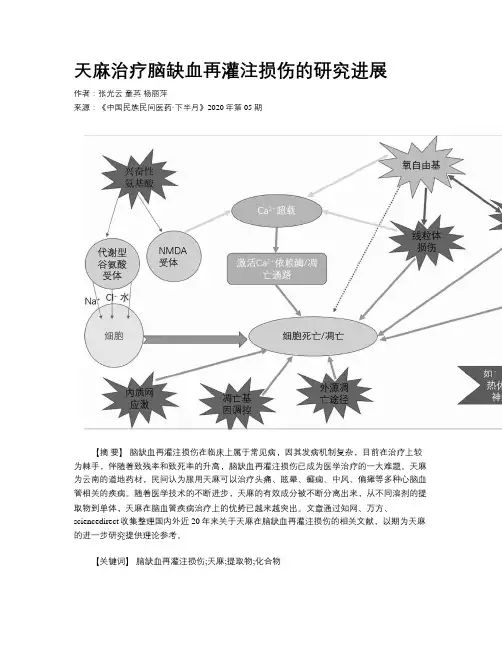
天麻治疗脑缺血再灌注损伤的研究进展作者:张光云童英杨丽萍来源:《中国民族民间医药·下半月》2020年第05期【摘要】脑缺血再灌注损伤在临床上属于常见病,因其发病机制复杂,目前在治疗上较为棘手,伴随着致残率和致死率的升高,脑缺血再灌注损伤已成为医学治疗的一大难题。
天麻为云南的道地药材,民间认为服用天麻可以治疗头痛、眩晕、癫痫、中风、偏瘫等多种心脑血管相关的疾病。
随着医学技术的不断进步,天麻的有效成分被不断分离出来,从不同溶剂的提取物到单体,天麻在脑血管疾病治疗上的优势已越来越突出。
文章通过知网、万方、sciencedirect收集整理国内外近20年来关于天麻在脑缺血再灌注损伤的相关文献,以期为天麻的进一步研究提供理论参考。
【关键词】脑缺血再灌注损伤;天麻;提取物;化合物【中图分类号】R285.6 【文献标志码】 A 【文章编号】1007-8517(2020)10-0069-06Abstract:Cerebral ischemia reperfusion injury is a common disease in clinic, and its pathogenesis is complicated, leading to the treatment is difficult at present. With the increase of disability rate and mortality, cerebral ischemia reperfusion injury has become a difficult problem in medical treatment. Gastrodia elata Blume is a kind of genuine medicinal material in Yunnan. It is believed that Gastrodia elata Blume can be used to treat headache, vertigo, epilepsy, stroke,hemiplegia and other cardiovascular and cerebrovascular diseases. With the continuous progress of medical technology, the effective components of Gastrodia elata Blume have been separated, from the extracts of different solvents to monomers, the advantages of Gastrodia elata Blume in the treatment of cerebrovascular diseases have become more and more prominent. In order to provide a theoretical reference for further study of Gastrodia elata Blume, this paper collected and sorted out the literature about Gastrodia elata Blume in cerebral ischemia reperfusion injury in recent 20 years at home and abroad through HowNet, Wanfang and ScienceDirect.Keywords:Cerebral Ischemia Reperfusion Injury; Gastrodia elata Blume; The Extracts; Monomers脑缺血再灌注损伤(Cerebral Ischemia Reperfusion Injury,CIRI)是指脑组织缺血后一定时间恢复血液供应,出现的更加严重的脑机能障碍现象,是在脑缺血基础上发生的病理过程。



丹参多酚酸盐抗脑缺血再灌注氧化损伤的作用及机
制的开题报告
一、研究背景
脑缺血再灌注(CIR)是脑血管疾病常见的并发症,可导致脑组织氧化损伤、神经细胞死亡等严重后果。
丹参多酚酸盐是一种具有抗氧化、抗炎、促进血液循环等多种生物活性的天然药物成分,常被用于治疗心脑血管疾病。
现有研究表明,丹参多酚酸盐也具有一定的抗脑缺血再灌注氧化损伤作用,但其作用机制尚未明确。
二、研究目的
本研究旨在探究丹参多酚酸盐对脑缺血再灌注氧化损伤的抑制作用及其可能的作用机制,为丹参多酚酸盐在临床治疗脑缺血再灌注等脑血管疾病中的应用提供科学依据。
三、研究内容和方法
1. 建立小鼠脑缺血再灌注模型。
根据文献报道,采用线结扎法建立小鼠脑缺血再灌注模型。
2. 分组处理。
将建立缺血再灌注模型的小鼠随机分为3组(空白对照组、模型组、丹参多酚酸盐处理组),每组10只。
空白对照组接受相同剂量的生理盐水处理,模型组和丹参多酚酸盐处理组接受相同剂量的生理盐水或丹参多酚酸盐治疗,连续治疗7天。
3. 测定指标。
采用行为学测试法、光镜检查法、酶学方法、RT-qPCR以及免疫荧光等方法评价丹参多酚酸盐对脑缺血再灌注氧化损伤的作用,并探究其可能的作用机制。
四、研究意义
本研究的结果可以为丹参多酚酸盐在临床治疗脑缺血再灌注等脑血管疾病提供科学依据,同时为深入理解脑缺血再灌注氧化损伤发生机制和寻找脑缺血再灌注的新治疗策略提供理论基础。

《地黄饮子及其拆方配伍对脑缺血再灌注损伤脑保护作用机理的实验研究》一、引言脑缺血再灌注损伤是临床常见的神经系统疾病,其发病机制复杂,治疗难度大。
近年来,中药复方在脑缺血再灌注损伤的治疗中逐渐受到关注。
地黄饮子作为传统的中药复方,具有滋阴补肾、益气养血的功效,被广泛应用于临床。
本研究旨在探讨地黄饮子及其拆方配伍对脑缺血再灌注损伤的脑保护作用机理,以期为临床治疗提供新的思路和方法。
二、材料与方法1. 材料(1)动物:选用健康成年SD大鼠,体重约250-300g。
(2)药物:地黄饮子及其拆方配伍,均由中药材提取制备而成。
(3)试剂与仪器:实验所需试剂、仪器设备等。
2. 方法(1)动物模型制备:采用大脑中动脉栓塞法(MCAO)制备脑缺血再灌注损伤模型。
(2)实验分组:将大鼠随机分为正常组、模型组、地黄饮子组及拆方配伍组。
(3)药物干预:各组分别进行相应的药物干预。
(4)指标检测:检测各组大鼠的神经功能评分、脑组织病理学变化、氧化应激指标、炎症因子等。
三、实验结果1. 神经功能评分实验结果显示,地黄饮子组及拆方配伍组大鼠的神经功能评分较模型组明显降低,表明地黄饮子及其拆方配伍能够改善脑缺血再灌注损伤大鼠的神经功能。
2. 脑组织病理学变化脑组织病理学检查发现,地黄饮子组及拆方配伍组大鼠的脑组织损伤程度较模型组明显减轻,神经元存活率明显提高。
3. 氧化应激指标及炎症因子检测实验结果显示,地黄饮子组及拆方配伍组大鼠的氧化应激指标及炎症因子水平较模型组明显降低,表明地黄饮子及其拆方配伍具有抗氧化、抗炎作用。
四、讨论本研究结果表明,地黄饮子及其拆方配伍对脑缺血再灌注损伤具有明显的脑保护作用。
其作用机理可能与以下几个方面有关:1. 改善神经功能:地黄饮子及其拆方配伍能够减轻脑缺血再灌注损伤大鼠的神经功能损伤,促进神经功能恢复。
2. 减轻脑组织损伤:地黄饮子能够减轻脑组织损伤,提高神经元存活率,从而保护脑组织。
3. 抗氧化、抗炎作用:地黄饮子及其拆方配伍具有抗氧化、抗炎作用,能够降低氧化应激指标及炎症因子水平,从而减轻脑组织损伤。

《地黄饮子及其拆方配伍对脑缺血再灌注损伤脑保护作用机理的实验研究》摘要:本文通过实验研究地黄饮子及其拆方配伍对脑缺血再灌注损伤的脑保护作用机理。
通过建立脑缺血再灌注损伤模型,观察药物对模型动物神经功能的影响,并探讨其作用机制。
实验结果表明,地黄饮子及其拆方配伍能够显著减轻脑缺血再灌注损伤,并具有一定的脑保护作用。
本文将从实验材料与方法、结果分析、讨论与结论等方面详细阐述研究内容。
一、实验材料与方法1. 材料(1)实验动物:选用成年SD大鼠,体重约250-300g。
(2)药物:地黄饮子及其拆方配伍,均由中药材组成。
(3)模型建立:采用四血管阻断法建立脑缺血再灌注损伤模型。
2. 方法(1)分组与给药:将大鼠随机分为正常对照组、模型组、地黄饮子组及拆方配伍组。
在模型建立后,分别给予相应药物处理。
(2)神经功能评分:采用Longa五级评分法对大鼠神经功能进行评估。
(3)实验指标检测:通过HE染色观察脑组织形态学变化,同时检测相关生化指标。
二、结果分析1. 神经功能评分实验结果显示,模型组大鼠神经功能评分明显高于正常对照组,表明脑缺血再灌注损伤模型建立成功。
与模型组相比,地黄饮子组及拆方配伍组大鼠神经功能评分显著降低,表明两种药物均能改善脑缺血再灌注损伤引起的神经功能障碍。
2. 脑组织形态学观察HE染色结果显示,模型组大鼠脑组织损伤严重,细胞结构紊乱,神经元坏死。
而地黄饮子组及拆方配伍组大鼠脑组织损伤程度较轻,细胞结构相对完整,神经元坏死减少。
3. 生化指标检测实验检测了相关生化指标,如乳酸脱氢酶(LDH)、谷胱甘肽过氧化物酶(GSH-Px)等。
结果显示,地黄饮子组及拆方配伍组大鼠LDH水平降低,GSH-Px水平升高,表明两种药物具有抗氧化、抗炎等作用,有助于减轻脑组织损伤。
三、讨论与结论1. 讨论(1)地黄饮子及其拆方配伍的成分与作用:地黄饮子及其拆方配伍主要由多种中药材组成,具有抗氧化、抗炎、神经保护等作用。




eNOS-NO-cGMP-PKG信号转导通路在心血管系统缺血再灌注损伤中的作用及研究进展发表时间:2014-08-15T16:18:33.263Z 来源:《医药前沿》2014年第16期供稿作者:李洋杨为民 (研究员)(通讯作者)[导读] 本文就eNOS-NO-cGMP-PKG信号转导通路在缺血再灌注损伤过程中的作用及研究进展做一综述。
李洋杨为民 (研究员)(通讯作者)(云南省昆明市呈贡新区雨花街道春融西路1168号昆明医科大学 650500)【摘要】近年来我国心血管疾病(CCVD)位列各种疾病死因的第一位,缺血性心血管疾病(ICCVD)是临床心血管疾病的主要发病类型。
心血管疾病的发病机理较复杂,目前其机制尚未完全阐明,研究表明它的发病与多种因素有关,其中缺血再灌注损伤(ischemia-reperfusion,IR)是缺血性心血管疾病主要的病理过程[1]。
已有研究显示,缺血再灌注过程中,通过激活eNOS-NO系统,从而激活下游的cGMP-PKG信号通路,实现对缺血性组织的保护。
本文就eNOS-NO-cGMP-PKG信号通路在心血管系统缺血再灌注损伤中的作用及研究进展作一综述。
【关键词】缺血再灌注损伤一氧化氮合酶一氧化氮蛋白激酶G 信号通路【中图分类号】R319 【文献标识码】A 【文章编号】2095-1752(2014)16-0353-03前言缺血性心血管疾病具有高发病率、高死亡率、高复发率及高致残率的特点。
早期恢复血液流通是治疗缺血性心血管疾病的关键,而缺血后再灌注(ischemia-reperfusion,IR)则会导致缺血组织损伤程度的进一步加重。
IR包括第一阶段的瞬时性缺血(ischemia)和第二阶段的再灌注(reperfusion)[2-3],其不仅导致缺血性损伤,还导致血管内皮损伤,炎症反应、氧化应激、血栓形成等,短暂缺血也诱导了对IR具有保护作用的缺血预适应反应。
但目前参与缺血再灌注损伤过程的作用机制尚未完全阐明。
《丁苯酞预处理对脑缺血再灌注损伤大鼠的神经保护作用及机制研究》篇一一、引言脑缺血再灌注损伤是临床上常见的神经系统疾病,其发生机制复杂,涉及到多种生物分子和细胞因子的相互作用。
近年来,丁苯酞作为一种具有广泛药理活性的药物,在脑缺血再灌注损伤的治疗中受到了广泛关注。
本文旨在研究丁苯酞预处理对脑缺血再灌注损伤大鼠的神经保护作用及其潜在机制。
二、材料与方法1. 实验动物与分组本实验选用健康成年SD大鼠,随机分为四组:正常对照组、模型组、丁苯酞预处理组和药物对照组。
2. 脑缺血再灌注模型建立采用经典的中动脉闭塞法(MCAO)建立脑缺血再灌注模型。
3. 丁苯酞预处理及给药方法在脑缺血再灌注前,丁苯酞预处理组大鼠接受丁苯酞预处理,药物对照组则给予相应剂量的安慰剂。
4. 指标检测与评估通过神经功能评分、脑组织病理学检查、免疫组化等方法,评估各组大鼠的神经功能恢复情况及脑组织损伤程度。
三、实验结果1. 神经功能评分丁苯酞预处理组大鼠的神经功能评分显著优于模型组,说明丁苯酞预处理能够改善大鼠的神经功能。
2. 脑组织病理学检查脑组织病理学检查显示,丁苯酞预处理组大鼠的脑组织损伤程度较模型组明显减轻,脑水肿、细胞凋亡及炎症反应均得到改善。
3. 免疫组化结果免疫组化结果显示,丁苯酞预处理能够上调神经保护相关蛋白(如BDNF、Nrf2等)的表达,同时抑制细胞凋亡相关蛋白(如Caspase-3)的表达。
这表明丁苯酞预处理可能通过调节相关蛋白的表达发挥神经保护作用。
四、讨论本研究表明,丁苯酞预处理对脑缺血再灌注损伤大鼠具有显著的神经保护作用。
这可能与丁苯酞能够调节神经保护相关蛋白和细胞凋亡相关蛋白的表达有关。
此外,丁苯酞还可能通过抑制炎症反应、减轻脑水肿等途径发挥神经保护作用。
这些机制可能共同作用,使得丁苯酞在脑缺血再灌注损伤的治疗中发挥重要作用。
五、结论本研究通过实验证实了丁苯酞预处理对脑缺血再灌注损伤大鼠具有显著的神经保护作用。
《ANTs和VDAC1蛋白乳酸化修饰参与脑缺血再灌注损伤初探》篇一一、引言脑缺血再灌注损伤是脑卒中治疗过程中的一个重要问题,其机制复杂,涉及多种细胞和分子过程。
近年来,ANTs(腺苷酸转位酶)和VDAC1(线粒体电压依赖性阴离子通道蛋白1)蛋白乳酸化修饰在脑缺血再灌注损伤中的作用逐渐受到关注。
本文旨在初步探讨ANTs和VDAC1蛋白乳酸化修饰在脑缺血再灌注损伤中的可能作用及机制。
二、ANTs和VDAC1蛋白简介1. ANTs:ANTs是一种线粒体内膜上的转运蛋白,参与ATP 合成和ADP分解等过程。
在脑缺血再灌注过程中,ANTs的表达和功能可能发生改变,影响能量代谢和细胞存活。
2. VDAC1:VDAC1是线粒体外膜上的蛋白质,参与物质转运和细胞凋亡等过程。
在脑缺血再灌注过程中,VDAC1的表达和功能也可能发生变化,影响细胞的存活和死亡。
三、ANTs和VDAC1蛋白的乳酸化修饰乳酸化修饰是一种蛋白质翻译后修饰方式,可以影响蛋白质的结构和功能。
近年来研究发现,ANTs和VDAC1蛋白可能发生乳酸化修饰,这种修饰可能影响其在脑缺血再灌注过程中的作用。
关系1. ANTs的乳酸化修饰:在脑缺血再灌注过程中,ANTs的乳酸化修饰可能导致其结构改变,影响其在ATP合成和ADP分解过程中的作用,从而影响细胞的能量代谢。
此外,乳酸化修饰还可能影响ANTs与其他蛋白质的相互作用,进一步影响细胞的功能。
2. VDAC1的乳酸化修饰:VDAC1的乳酸化修饰可能影响其参与的物质转运和细胞凋亡过程。
在脑缺血再灌注过程中,VDAC1的乳酸化修饰可能导致其通道功能改变,影响线粒体与细胞质的物质交换,从而影响细胞的存活和死亡。
五、研究展望目前关于ANTs和VDAC1蛋白乳酸化修饰在脑缺血再灌注损伤中的研究尚处于初步阶段,未来可以通过以下方面进行深入研究:1. 进一步研究ANTs和VDAC1蛋白乳酸化修饰的具体机制,包括乳酸化修饰的过程、影响因素和调控机制等。
《电针调节脑铁代谢减少脑缺血再灌注后氧化损伤的机制研究》一、引言随着生活方式的改变,心脑血管疾病已经成为威胁人类健康的主要问题之一。
脑缺血再灌注损伤是其中常见的病理过程,由于缺血区域在再灌注时发生氧化应激反应,常常会导致严重的神经功能损害。
电针作为一种非药物治疗手段,近年来在神经保护方面显示出良好的应用前景。
本研究旨在探讨电针调节脑铁代谢在减少脑缺血再灌注后氧化损伤中的机制,以期为临床治疗提供新的思路。
二、材料与方法1. 实验动物与分组本实验采用成年SD大鼠,随机分为假手术组、模型组、电针组。
2. 脑缺血再灌注模型建立采用线栓法建立大脑中动脉阻塞(MCAO)模型,模拟脑缺血再灌注过程。
3. 电针干预方法电针组在缺血再灌注后进行电针刺激,参数设定依据前期研究。
4. 指标检测通过免疫组化、Western blot、酶活性检测等方法,检测铁代谢相关指标、氧化应激指标及神经功能相关指标。
三、实验结果1. 电针对脑铁代谢的影响实验结果显示,电针干预后,缺血区铁离子浓度明显降低,铁转运蛋白表达水平也出现显著变化。
这表明电针可以调节脑铁代谢,降低缺血区的铁离子浓度。
2. 氧化损伤及电针的干预效果与模型组相比,电针组在缺血再灌注后的氧化应激反应明显减轻,表现为脂质过氧化物(MDA)含量降低,超氧化物歧化酶(SOD)活性升高。
这表明电针可以减轻氧化损伤。
3. 电针对神经功能的影响电针组大鼠的神经功能恢复情况明显优于模型组,表现为运动能力及感觉功能的改善。
四、讨论本实验结果表明,电针可以调节脑铁代谢,降低缺血区的铁离子浓度,从而减轻氧化应激反应和神经功能损害。
这一结果可能与电针刺激引起的神经保护作用有关。
具体机制可能包括以下几个方面:1. 调节铁转运蛋白表达:电针刺激可能通过影响铁转运蛋白的表达,从而调节脑内铁的分布和代谢。
这有助于降低缺血区的铁离子浓度,减轻氧化应激反应。
2. 抗氧化作用:电针可能通过提高抗氧化酶的活性,降低脂质过氧化物含量,从而减轻氧化损伤。
《地黄饮子及其拆方配伍对脑缺血再灌注损伤脑保护作用机理的实验研究》摘要:本文深入研究了地黄饮子及其拆方配伍在脑缺血再灌注损伤中的应用及对脑保护作用的机理。
实验以中医经典药方为基础,通过动物模型模拟脑缺血再灌注损伤过程,观察并分析地黄饮子及其拆方配伍对脑组织的影响,为临床治疗提供理论依据和新的治疗思路。
一、引言近年来,脑缺血再灌注损伤(CIRI)逐渐成为神经科学研究的热点。
由于该病症对患者的神经功能损害较大,研究有效的治疗药物与机制至关重要。
传统中医药学认为,通过科学合理的药物配伍与调养可以减缓CIRI的发生和程度。
而地黄饮子作为一种经方被广泛应用于此类疾病的辅助治疗中。
因此,本研究以地黄饮子及其拆方配伍为研究对象,探究其脑保护作用机理。
二、材料与方法1. 实验动物及分组:实验选取成年SD大鼠作为实验对象,按实验要求分为对照组、模型组及实验组等。
2. 脑缺血再灌注模型建立:采用线栓法建立大鼠脑缺血再灌注模型。
3. 药物干预:实验组分别给予不同配伍的地黄饮子及拆方药物。
4. 指标检测:通过神经功能评分、脑组织病理学检查、神经递质测定等方法评估药物对CIRI的影响。
三、实验结果1. 神经功能评分:实验组的神经功能评分较模型组显著改善,其中以某配伍地黄饮子效果最为明显。
2. 脑组织病理学检查:与模型组相比,实验组大鼠的脑组织病理学改变明显减轻,表明药物具有明显的脑保护作用。
3. 神经递质测定:实验发现某配伍地黄饮子能显著提高大脑内源性保护物质如神经生长因子等的水平,有效减少细胞凋亡。
四、拆方配伍分析实验还对比了不同拆分药物之间的配伍效应,结果显示合理的配伍能更好地发挥地黄饮子的脑保护作用。
具体到各药物成分的剂量比例和配比关系,仍需进一步深入研究。
五、讨论地黄饮子及其拆方配伍在实验中表现出良好的脑保护作用,这一作用可能是通过多靶点、多机制的共同作用来实现的。
结合中药的属性来看,它能够有效地改善CIRI造成的细胞内外的失衡状态,保护血管壁结构与功能的完整性。
脑缺血再灌注损伤主要发病机制的研究进展脑血管疾病是一种严重危害人类身体健康的疾病,其具有死亡率、致残率高和难以预见的特点,一直受到国内外医学界的广泛关注[1]。
其中,缺血性脑损伤疾病占脑血管疾病的绝大部分,缺血后及时的恢复血流再灌注对于恢复缺血区脑组织血氧供应、维持受损脑组织的正常形态与功能具有重要的意义。
但当脑组织缺血时间较长时,再给予恢复血流再灌注的处理会进一步加重脑组织的损伤程度,此即为脑缺血再灌注损伤。
脑缺血再灌注损伤的发病机制是一个快速的级联反应,这个级联反应包括许多环节[2]。
主要环节有细胞内钙稳态失调、脑组织中氨基酸含量失稳态、自由基生成、炎症反应、凋亡基因激活及能量障碍等。
这些机制彼此重叠,相互联系,形成恶性循环,最终引起细胞凋亡或坏死,导致缺血区脑组织不可逆的损伤[3]。
脑缺血早期,由于阻断血流使相关脑区能量(葡萄糖、O2、ATP等)迅速耗尽而导致能量危机,大脑神经元内钙离子超载,氧自由基增多以及兴奋性氨基酸的过度释放,引发了细胞内的毒性反应,引起神经元的过度凋亡和一系列的炎症反应;长时间的脑缺血恢复再灌注后,存活的脑组织中过氧化物堆积,可加剧脑组织损伤,在缺血区可见坏死、凋亡的细胞并伴随明显的炎症症状,引起脑组织坏死,且坏死区域会随着时间和空间扩大,进一步加重脑损伤程度[4]:1.Ca2+超载与脑缺血再灌注损伤钙离子参与细胞膜电位和细胞内的生化反应过程,对于维持神经细胞的正常功能起到关键性的调节作用[5],钙离子在脑缺血再灌注损伤的作用主要包括:(1)脑缺血再灌注后,细胞内Na+/Ca2+交换蛋白迅速激活,Na+向细胞外转运,同时将大量Ca2+转入细胞内,造成细胞内Ca2+超载,触发线粒体摄取Ca2+,使Ca2+聚集在线粒体内,过量的Ca2+可抑制ATP合成,使能量生成障碍;(2)Ca2+活化能激活线粒体上的磷脂酶, 促进膜磷脂分解产生对细胞有毒害作用的游离脂肪酸、前列腺素、白三烯和溶血磷脂等,改变其通透性,引起线粒体膜损伤。
另外Ca2+还活化钙依赖蛋白酶, 使胞内无害的黄嘌呤脱氢酶转变黄嘌呤氧化酶, 生成大量氧自由基,造成细胞不可逆的损伤[6,7]。
2.氧自由基生成与脑缺血再灌注损伤氧自由基能引起组织脂质过氧化和细胞内钙超负荷导致,主要表现为:急性缺血时脑细胞突然处于低氧、缺氧状态,能量供应不足,导致细胞ATP生成减少,线粒体及内质网质膜上Ca2+-ATP酶活性下降,使细胞内Ca2+平衡紊乱[8];而脑血流再灌注后,原处于低氧缺氧状态的脑细胞的供氧突然增加,刺激细胞产生大量自由基消耗了多种抗氧化酶和抗氧化剂,如超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和维生素E等,使脑组织抗氧化能力明显降低;同时脑组织中又富含易被自由基攻击的脂质,能进一步加重缺血区脑组织的损伤[9,10]。
另外,由于氧自由基的过量释放,使Ca2+的保留、摄取和释放的紊乱程度增加,亦能加速细胞损伤,自由基的这种链锁反应在脑缺血再灌注损伤中起重要作用。
3.兴奋性氨基酸与脑缺血再灌注损伤兴奋性氨基酸(EAA)是中枢神经系统中的兴奋性神经递质,其中谷氨酸(Glu)是兴奋性氨基酸中含量最多、分布最广的氨基酸,其发育早期阶段对组织具有神经营养作用,发育后期则表现为毒性作用[11]。
同时,中枢神经系统中还存在着以γ-氨基丁酸(GABA)为代表的一系列抑制性氨基酸(IAA),它能促进脑的活化性,对抗Glu对脑组织的毒性作用[12]。
生理条件下,高效能的谷氨酸摄取系统的存在使Glu维持在较低的水平,仅有少量作为兴奋性神经递质参与信号传递,使EAA和IAA含量保持在一个正常稳定的状态。
而在脑缺血时,Glu大量释放导致神经元兴奋、溃变和死亡,产生兴奋性毒性[13]。
主要表现在:(1)脑缺血后EAA含量增多,其神经毒性作用通过与N-甲基-D-门冬氨酸(NMDA)受体或非NMDA受体结合,引起Na+和Cl-进入胞内造成神经元损伤以及Ca2+内流使钙超载引起的细胞损伤[14];(2)Glu能抑制细胞膜上的谷氨酸/胱氨酸转运体,胱氨酸在体内能还原成半胱氨酸(cys),cys是合成抗氧化物质谷胱甘肽(GSH)的原料,当胞外Glu过多时可抑制谷氨酸/胱氨酸转运体的功能,导致GSH合成减少,从而使细胞内氧自由基堆积对细胞产生毒性作用[15]。
(3)EAA含量的异常增多会破坏EAA与IAA的动态平衡,引起内环境状态紊乱,使GABA 抗Glu功能降低,加剧细胞毒性。
4.热休克蛋白与脑缺血再灌注损伤热休克蛋白(HSP)在脑缺血再灌注后,能够启动机体内源性保护机制,增强脑缺血耐受、毒耐受及氧化损伤耐受,是一种能提高细胞应激能力的保护性蛋白质。
HSP通过结合相应的蛋白质分子,发挥多种生理功能:HSP能对抗内源性损伤因子引起的毒性作用,保护脑细胞;清除细胞内异常蛋白,加速脑细胞损伤修复;抑制促凋亡蛋白,提高抗凋亡蛋白表达水平[16]。
具体表现为HSP能帮助氨基酸链折叠成正确的三维结构,清除无法正确折叠的变性蛋白及激活某些酶的作用以保护细胞生存和功能,参与细胞的修复。
HSP还能保护线粒体,抑制凋亡促凋亡因子细胞色素C释放,抑制促凋亡基因P53、Bax的表达及诱导抗凋亡基因Bcl-2的表达,阻断细胞凋亡[17]。
近年来对热休克蛋白70(HSP70)的研究越来越受到国内外医学界的重视,生理条件下HSP70的mRNA在脑内表达稳定;应激状态下,其他蛋白合成受到抑制,HSP70的表达在梗死灶周围神经元明显增多,而敲除HSP基因后,HSP表达下降,细胞凋亡增多[18,19],提示HSP70能通过表达的升高来增强机体对抗外界刺激的应激能力。
5.线粒体功能障碍与脑缺血再灌注损伤脑缺血再灌注损伤期间,线粒体通透性转换通道(PTP)会发生明显的异常开放现象。
脑缺血再灌注后,细胞内钙超载、氧自由基和游离脂肪酸的大量生成以及EAA的过度释放均可引起PTP开放,造成线粒体能量合成障碍,继发引起一系列的神经元凋亡及坏死现象。
缺氧缺血情况下,线粒体DNA受损,线粒体正常功能受损,呼吸链复合物活性遭到破坏,使黄素腺嘌呤二核苷酸(FAD)依赖性复合物途径被过度利用,自由基生成增加,超过了细胞本身的清除能力,导致细胞凋亡及坏死[20,21]。
6.炎症反应与脑缺血再灌注损伤脑缺血及再灌注后,脑微血管内白细胞大量聚集引起由相关酶催化的多种炎症反应, 大量的炎性相关因子的释放导致脑微血管功能紊乱及局部脑组织中液体及蛋白质的积聚,造成脑不可逆的损伤,脑组织的这些病理性变化与脑缺血再灌注后继发的脑损害密切相关[22],炎症反应的主要因子包括炎性细胞、炎性介质和炎症反应相关酶。
6.1炎性细胞代表性的炎症细胞主要包括白细胞、小胶质细胞和星形胶质细胞:在脑缺血诱导的炎症反应中, 白细胞尤其是中性粒细胞和单核巨噬细胞的聚集、浸润是炎症反应发生的关键步骤。
白细胞会粘附于内皮细胞,并能穿过血管内皮、浸润到脑组织中,为后续脑内微血管梗阻、脑水肿及脑梗死创造条件[23]。
小胶质细胞是中枢神经系统(CNS)中一种主要的免疫效应细胞,生理状态下,小胶质细胞能清除脑组织损坏的神经元,对脑有重要的保护作用。
但在脑缺血及再灌注后,小胶质细胞被过度激活,能释放大量促炎介质引起神经毒性作用[24]。
星形胶质细胞是中枢神经系统中主要的非神经元细胞,起到在结构和营养上支持神经元的作用。
脑缺血再灌注时,星形胶质细胞会被过度激活而增值肥大,刺激释放Glu 造成兴奋性氨基酸毒性,同时也形成阻碍轴突再生的瘢痕并分泌大量炎性介质,参与脑缺血损伤诱导的炎症反应[25]。
6.2炎症介质6.2.1白细胞介素-1(IL-1):包括IL-1α和IL-1β,IL-1β是血浆和组织液中主要的分泌形式,也是脑组织中的主要形式。
CNS中的内皮细胞、小胶质细胞和星形胶质细胞均可合成IL-1β[26]。
IL-1β可通过刺激内皮细胞表达白细胞黏附分子,使白细胞大量聚集于缺血脑组织,加重脑组织伤害[27]。
6.2.2白细胞介素-6(IL-6):机体内多种细胞经IL-1、肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)的诱导都可合成IL-6。
生理条件下,IL-6可促星形胶质细胞生长,促进神经因子释放,有明显的神经营养作用。
而脑缺血再灌注后高水平表达的IL-6,会对神经元产生明显的毒性作用[26,29]。
6.2.3白细胞介素-8(IL-8):IL-8是中性粒细胞特异性聚集于炎症部位的重要趋化因子[28],会促使中性粒细胞经过着边、捕捉、滚动、活化、黏附和移行等过程从血管到达炎症部位。
因中性粒细胞在炎症部位的聚集和活化是炎症反应的重要环节,故IL-8的大量表达也间接表明了炎症反应的发生和组织损伤程度的加剧[29]。
6.2.4 白细胞介素-10(IL-10):IL-10能抑制巨噬细胞的抗原提呈功能,使其分泌TNF、IL-1和IL-6的能力降低,并能促进B细胞增殖、分化及抗体的产生,从而抑制脑缺血后炎症反应,减少脑缺血后神经元的坏死[30]。
有文献报道,通过中医头针疗法可以在一定范围内促进IL-10的表达,从而减轻急性脑缺血再灌注白细胞的浸润,起到保护神经的作用[31]。
6.2.5细胞黏附分子-1(ICAM-1):ICAM-1介导的黏附过程在白细胞与内皮细胞之间的黏附及白细胞穿出血管壁过程中起重要作用[32]。
在脑缺血及再灌注期间,缺血区脑组织产生的炎性细胞因子诱导脑微血管内皮细胞表达多种黏附分子, 导致白细胞浸润到局部缺血脑组织造成脑损伤。
6.2.6肿瘤坏死因子-α(TNF-α):是由巨噬细胞和单核细胞产生的促炎细胞因子,在病理条件下其表达会明显增多,而TNF-α分泌或合成的增加也脑缺血早期是脑梗塞形成的主要原因[33]。
其作用机制主要包括:(1)调节ICAM-1表达,引起炎症反应。
(2)经内皮细胞激活作用促成凝血状态和血管收缩。
(3)影响血管舒缩活性物质的表达[34]。
6.2.7血小板活化因子(PAF):是迄今为止发现体内最强的血小板聚集剂,能够激活聚集中性粒细胞,增加血管壁通透性,促进TNF-α产生。
实验表明,在沙土鼠短暂性全脑缺血再灌注1h后,皮层、海马和丘脑区能检测到PAF的大量表达[35]。
6.3炎症反应相关酶6.3.1环氧合酶(COX-2):是花生四烯酸代谢的限速酶,正常生理条件下含量低。
机体经脑缺血刺激后能迅速产生大量的COX-2,花生四烯酸活性增强,催化前列腺素合成参与炎症反应,导致血小板和中性粒细胞黏附于内皮细胞,促进血脑屏障开放[36],进一步加重脑损伤。
6.3.2髓过氧化酶(MPO):MPO是一种由中性粒细胞、单核细胞、巨噬细胞分泌的白细胞酶,主要位于中性多形核白细胞颗粒中。
有研究证明,MPO表达与TNF-α表达呈正相关,其活性是评价中性粒细胞在组织中浸润程度的重要指标[37]。