不对称氢化
- 格式:doc
- 大小:30.00 KB
- 文档页数:5

铜催化的不对称反应1. 引言在有机合成领域,不对称合成一直是一个重要的研究方向。
通过不对称合成,可以合成具有特定立体结构的有机化合物,这对于药物研发和生物活性研究具有重要意义。
铜催化的不对称反应是一类重要的不对称合成方法,本文将对铜催化的不对称反应进行全面、详细、完整且深入的探讨。
2. 铜催化的基本原理铜催化的不对称反应是指在铜的催化下,通过控制底物、配体和反应条件等因素,实现对立体结构选择性的控制,从而合成具有高立体选择性的有机化合物。
铜催化的不对称反应通常涉及铜离子的活化和配体的选择。
2.1 铜离子的活化铜离子在催化反应中起到了重要的作用,它可以与底物发生配位,形成活性中间体,进而参与催化反应。
铜离子的活化主要包括氧化还原反应和配体交换反应。
2.2 配体的选择配体的选择对铜催化的不对称反应具有重要影响。
合适的配体能够与铜离子形成稳定的配位化合物,并调控反应的立体选择性。
常用的配体包括手性磷配体、手性氨基醇配体等。
3. 铜催化的应用铜催化的不对称反应在有机合成中具有广泛的应用,本节将介绍几个典型的应用案例。
3.1 不对称氢化反应不对称氢化反应是一类重要的不对称反应,可以将不对称的不饱和化合物转化为具有立体选择性的饱和化合物。
铜催化的不对称氢化反应通常使用手性磷配体,通过控制反应条件和底物结构,可以合成具有高立体选择性的饱和化合物。
3.2 不对称羟酰胺合成反应不对称羟酰胺合成反应是合成手性羟酰胺的重要方法。
铜催化的不对称羟酰胺合成反应可以通过控制底物和配体的结构,实现对手性产物的高立体选择性合成。
3.3 不对称环氧化反应不对称环氧化反应是将不对称的不饱和化合物转化为具有立体选择性的环氧化合物的方法。
铜催化的不对称环氧化反应可以通过选择合适的配体和反应条件,实现对产物的高立体选择性合成。
3.4 不对称醇合成反应不对称醇合成反应是合成手性醇的重要方法。
铜催化的不对称醇合成反应可以通过控制底物和配体的结构,实现对手性醇的高立体选择性合成。

有机合成中的不对称催化不对称催化在有机合成中的应用一、引言不对称催化是一种重要的有机合成方法,它可以有效地提高化学反应的立体选择性。
不对称催化通过使用手性催化剂,实现对底物官能团的选择性转化,从而合成手性有机分子。
本文将详细介绍不对称催化在有机合成中的原理、应用和发展趋势。
二、不对称催化的原理不对称催化的原理基于手性催化剂能够通过与底物特定官能团之间的相互作用,在化学反应中引入立体选择性。
手性催化剂通常分为金属催化剂和有机催化剂两大类。
金属催化剂常见的有金属锌、钯、铑等,而有机催化剂则包括丙酮醛和氨基酸等化合物。
这些催化剂通过与底物形成配位键或氢键等相互作用,使反应路径发生改变,从而实现对底物的选择性转化。
三、不对称催化的应用1. 酮醛不对称催化加成反应不对称催化加成反应是不对称催化中最常见的一种应用。
它通过使用手性催化剂,将有机酮或醛与活性化合物(如烯烃、烯丙酮等)进行加成反应,得到手性醇或手性醛酮。
这种反应具有高立体选择性和高效性,广泛应用于药物合成、天然产物合成等领域。
2. 不对称催化氢化反应不对称催化氢化反应是将不对称手性催化剂应用于化学反应中的另一常见方法。
该反应通常通过催化剂与底物的氢键或配位键相互作用,实现对不对称双键的氢化。
这种反应在合成手性药物和农药的过程中得到广泛应用,为拓宽立体化学空间提供了有效的手段。
3. 不对称催化环化反应不对称催化环化反应是将不对称手性催化剂应用于环化反应的一种方法。
这种反应通过手性催化剂的作用,将开链底物转化为手性环状化合物,并且能够控制环的构型和立体选择性。
这一方法在天然产物合成、医药和农药合成等领域具有重要的应用价值。
四、不对称催化的发展趋势随着有机化学和催化化学的不断发展,不对称催化在有机合成中的应用也在不断扩展和丰富。
未来的发展趋势主要体现在以下几个方面:1. 发展新型手性催化剂。
研究人员将致力于开发新型的手性催化剂,以满足对底物更高立体选择性的需求。


有机化学中的手性催化反应在有机化学领域中,手性催化反应是一种重要的研究领域。
手性催化反应是指通过手性催化剂促使手性底物发生化学反应,产生手性产物的过程。
手性催化反应在药物合成、天然产物合成等领域具有广泛的应用价值。
本文将介绍手性催化反应的基本概念、常用的手性催化剂以及几个典型的手性催化反应。
一、手性催化反应的基本概念手性催化反应中,手性催化剂起到了重要的作用。
手性催化剂是具有手性结构的化合物,通过催化底物的反应,实现手性产物的选择性生成。
手性催化剂的手性结构可以通过对映体的选择性制备来获得。
手性催化反应的基本机理是通过手性催化剂与底物之间的非共价作用实现的。
手性催化剂可以与底物形成手性催化底物复合物,然后通过一系列的反应步骤,实现手性产物的选择性生成。
二、常用的手性催化剂在手性催化反应中,常用的手性催化剂包括金属络合物、有机小分子等。
金属催化剂如钯、铂等常用于氢化反应、不对称氢化反应等。
而有机小分子催化剂如有机胺、有机亚砜等常用于亲电取代反应、不对称亲电取代反应等。
三、手性催化反应的典型实例1. 不对称氢化反应不对称氢化反应是通过手性催化剂实现的一种重要的手性催化反应。
在不对称氢化反应中,手性催化剂和底物之间形成手性催化底物复合物,然后通过加氢反应,实现手性产物的选择性生成。
不对称氢化反应在药物合成中具有广泛的应用。
2. 不对称亲电取代反应不对称亲电取代反应也是一种常见的手性催化反应。
在不对称亲电取代反应中,手性催化剂与底物形成手性催化底物复合物,然后通过亲电取代反应,实现手性产物的选择性生成。
不对称亲电取代反应在天然产物合成中具有重要的应用。
3. 不对称环加成反应不对称环加成反应是一类重要的手性催化反应。
在不对称环加成反应中,手性催化剂与底物形成手性催化底物复合物,然后通过环加成反应,实现手性产物的选择性生成。
不对称环加成反应在有机合成中具有广泛的应用。
四、手性催化反应的应用价值手性催化反应具有广泛的应用价值。

有机合成中的不对称催化方法不对称合成方法是有机合成领域中的重要研究方向之一。
在有机合成过程中,不对称催化方法能够有效地构建手性分子,为合成具有生物活性的化合物提供了重要的途径。
本文将对不对称催化方法在有机合成中的应用进行探讨。
一、不对称催化方法概述不对称合成是指利用手性催化剂,在化学反应中控制手性的生成。
目前,广泛应用的不对称催化方法包括手性配体催化、酶催化和有机小分子催化等。
手性配体催化是最常见的不对称催化方法之一。
手性配体与金属催化剂形成配合物,通过控制手性环境,实现对反应中的手性诱导。
这种方法应用广泛,不仅适用于碳碳键的构建,还适用于不对称氢化、不对称氧化和不对称复分解等反应。
酶催化是生物催化中一种重要的不对称合成方法。
酶具有高催化活性和良好的立体选择性,对于合成手性分子具有独特的优势。
目前,已经发现了许多催化活性高且具有不对称催化作用的酶。
有机小分子催化是近年来崛起的一种不对称催化方法。
有机小分子催化剂通过与底物形成非共价作用,实现对手性分子的合成。
这种方法不依赖于金属催化剂,具有较高的催化活性和立体选择性。
二、不对称催化方法的应用1. 酮的不对称加成反应不对称酮的加成反应是不对称合成中一类重要的反应。
利用手性配体催化剂,可以将有机酮与亲核试剂反应,构建手性α-羟基酮化合物。
这种反应广泛应用于天然产物的合成和药物合成中。
2. 不对称氢化反应不对称氢化反应是一种高效的不对称催化方法。
通过合成具有手性配体的均相催化剂,可以将不对称双键氢化为手性化合物。
此反应广泛应用于制药工业和天然产物的合成中。
3. 不对称烯烃复分解反应不对称烯烃复分解反应是一类重要的不对称合成方法。
通过合成具有手性配体的金属催化剂,可以将烯烃分解成手性化合物。
这种方法可以构建具有多个手性中心的化合物,是不对称合成中的关键方法。
4. 不对称氧化反应不对称氧化反应是一种重要的不对称合成方法。
通过合成具有手性配体的金属催化剂,可以将有机化合物氧化为手性化合物。


有机合成中的不对称催化反应不对称催化反应是有机合成领域中一种重要的方法,能够有效地构建手性化合物。
手性化合物在药物、农药和材料科学等领域有着广泛的应用前景。
本文将介绍不对称催化反应的原理、机制以及在有机合成中的应用。
一、不对称催化反应的原理不对称催化反应是利用手性催化剂促进反应的进行,使得产物中手性部分的生成有选择性。
手性催化剂能够将底物的立体信息转移到产物中,从而实现手性化合物的合成。
二、不对称催化反应的机制不对称催化反应的机制主要分为两类:手性诱导和手性酸碱催化。
手性诱导的反应是通过手性配体与催化剂形成配位键来实现对底物的立体选择性,而手性酸碱催化则是通过手性催化剂与底物形成氢键或离子键来实现选择性。
三、不对称催化反应的应用1. 不对称氢化反应不对称氢化反应是一种常见的不对称催化反应,通过手性催化剂催化底物的不对称氢化,实现手性化合物的合成。
该反应在制药领域中得到广泛应用,能够高效地合成具有药理活性的手性分子。
2. 不对称环加成反应不对称环加成反应是一种重要的不对称催化反应,通过手性催化剂催化底物的环加成反应,实现手性环化合物的合成。
这种反应在天然产物合成和有机小分子合成中具有重要的地位。
3. 不对称亲核取代反应不对称亲核取代反应是一种常见的不对称催化反应,通过手性催化剂催化底物的亲核取代反应,实现手性化合物的合成。
该反应在合成有机分子中起着重要的作用,能够高效地构建手性碳-碳和碳-杂原子键。
四、不对称催化反应的发展趋势随着有机合成领域的不断发展,不对称催化反应也在不断改进和创新。
未来的研究方向主要集中在发展新型高效的手性催化剂、寻找更加环境友好和可持续的反应体系、以及应用机器学习和人工智能等技术加速合成方法的发现和优化。
总结:不对称催化反应作为一种重要的有机合成方法,在合成手性化合物方面发挥着重要的作用。
通过探索不对称催化反应的原理和机制,并结合实际应用,能够推动有机化学领域的发展,为合成更多种类的手性化合物提供新的思路和方法。

不对称合成的四种方法不对称合成是一种有机合成方法,通过控制化学反应的反应条件和催化剂的选择,使得反应中生成的手性分子局限于其中一种手性,从而得到具有想要手性的目标产物。
在有机合成中,不对称合成被广泛应用于药物合成、天然产物合成和材料科学等领域。
下面将介绍四种主要的不对称合成方法。
1.不对称催化反应:不对称催化反应是最常见和最有效的不对称合成方法之一、此类反应中,通过催化剂的存在,控制发生的反应中的手性产生,从而获得目标手性分子。
常见的不对称催化反应包括不对称氢化、不对称羰基化反应和不对称亲核取代反应等。
催化剂常常是手性有机分子配体和过渡金属或有机小分子的复合物,它们能够催化不对称反应的进行,并选择性地产生具有一定手性的产物。
2.不对称诱导反应:不对称诱导反应是通过利用手性分子间的相互作用而实现目标产物手性不对称生成的方法。
在反应中,手性诱导剂通过与底物或中间体的非共价相互作用,使得反应过程中特定手性产物的生成受到手性诱导剂的影响。
常见的手性诱导剂包括手性助剂、手性溶剂和手性催化剂等。
3.不对称模板反应:不对称模板反应是一种依赖于模板分子的手性而实现目标产物手性不对称合成的方法。
在反应中,模板分子能够选择性地与底物或中间体形成手性识别的配合物,从而确定反应过程中产物的手性。
这类反应中,模板分子常常是手性有机分子、金属络合物或有机小分子等,可以被底物或中间体特异地识别并参与反应。
4.不对称自适应反应:不对称自适应反应是一种依据底物分子中的结构特点自发发生的不对称反应方法。
在这些反应中,底物分子本身具有能够选择性地识别和响应手性信息的结构特点,从而引导反应生成特定手性的产物。
这类反应中常用的底物分子包括局部手性的含氧化合物、含氮化合物和酸碱化合物等。
以上介绍的四种不对称合成方法在不同的反应条件和具体反应体系中都具有重要的应用价值。
通过选择合适的反应条件和催化剂,可以实现目标手性的高选择性合成,从而为有机化学合成提供丰富的手性构建工具,对于合成手性药物和天然产物等具有重要的意义。


炔烃不对称氢羧基化炔烃不对称氢羧基化是一种重要的有机化学反应,它可以合成具有药物活性和生物活性的化合物。
本文将对炔烃不对称氢羧基化反应进行探讨,并探索其在有机合成中的应用。
一、炔烃不对称氢羧基化的原理与机制炔烃不对称氢羧基化反应是通过引入手性配体催化剂,将炔烃转化为不对称羧酸酯的化学反应。
其机制主要包括催化剂的活化、炔烃的氢化和羧基化等步骤。
1. 催化剂的活化催化剂通常采用配位型手性催化剂,如金属配合物。
首先,催化剂与配体形成配位键,然后通过与底物分子的相互作用,进一步活化催化剂。
2. 炔烃的氢化活化后的催化剂与炔烃底物发生反应,将其氢化为烯烃。
此步骤通常由催化剂中的金属离子完成,金属离子可作为氢化反应的催化剂。
3. 羧基化反应经过炔烃的氢化后,得到的烯烃与羧酸底物发生反应,形成不对称羧酸酯产物。
这一反应步骤通常由配体控制,通过与底物的选择性作用,实现羧基化反应的不对称性。
二、炔烃不对称氢羧基化的应用炔烃不对称氢羧基化反应在有机合成中具有重要的应用价值,特别是在药物合成和天然产物合成领域。
1. 药物合成炔烃不对称氢羧基化反应可以用于合成药物分子的关键中间体。
例如,通过对具有炔基结构的化合物进行不对称氢羧基化反应,可以有效合成具有药物活性的手性羧酸酯。
这些手性化合物具有较强的选择性和生物活性,对药物研究具有重要意义。
2. 天然产物合成天然产物中常见的一些结构单元可以通过炔烃不对称氢羧基化反应来构建。
通过对天然产物的结构分析,可以利用炔烃不对称氢羧基化反应合成具有天然产物活性的化合物。
这为合成复杂的天然产物提供了新的途径和方法。
三、炔烃不对称氢羧基化反应的发展与展望炔烃不对称氢羧基化反应作为一种重要的有机合成方法,近年来取得了长足的发展。
1. 配体的开发配体是炔烃不对称氢羧基化反应中起关键作用的因素之一。
随着对手性配体研究的深入,新型的手性配体被不断发现和应用于该反应中,提高了对底物的选择性和产物的立体选择性。
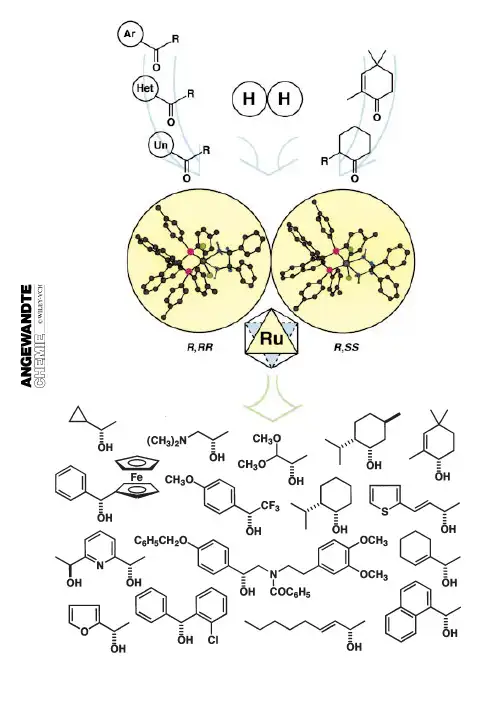
催 化 导 论 -------- 不 对 称 氢 化 1 摘要:不对称催化反应作为一个手性增量过程已成为人工合成旋光性产物最有效的手段之一。其中不对称氢化反应发展较快,是研究得较多的一类反应。不对称催化具有容量大、产率高、反应速度快、产物分离相对容易、催化剂的手性易于通过改变配体来修饰等优点,使该领域成为国际化学家研究的热点。 关键字:不对称氢化、钌、酮、β-酮酸酯。 随着科学技术的发展和人类生活质量的提高, 人类对生命的重视和对药物的要求亦越来越高。近30年来,特别是最近10年来手性药物的合成已经 成为世界各国十分重视的一个领域。20世纪60年代欧洲曾出现过以外消旋体形式出售的药物“反应 停”造成的悲剧,因为其R构型异构体是一种镇静剂,而构型异构体却会导致胎儿的畸型,当外消旋的反应停”作为药物用来治疗妊娠反应时,导致 了数以千计的胎儿畸型。为了不使这类悲剧重演,1992年美国食品和药物管理局(FDA)公布了一系列准则以指导这类药物的开发,规定对外消旋药物, 必须对其进行拆分并证明其无毒副作用。欧共体也有类似的规定。 最新统计结果表明,1999年世界药品销售总额 约3600亿美元,其中手性药物约1177亿美元,占药品总额的32.7%;2000年世界药品销售总额约3900亿美元,其中手性药物约1325亿美元,比1999年约增加13.9%;预计到2005年手性药物的销 售总额将达到约1 718亿美元。北美、日本和欧共体都将在今后几年里上市一大批单一对映体的手性药物。所以,获得光学纯物质,已经成为当代化学家所面临的最具挑战性的任务之一。 长期以来,人们只能从天然产物中提取单一对映体药物,或用生物酶催化方法合成。如用一般的化学方法合成得到的是外消旋体,还需经过繁琐的化学拆分。不对称合成开辟了从非手性物质人工合成手性产物的新途径,而在众多的不对称合成反应中,在手性药物工业制备中最有发展前途的是不对称催化法。它具有手性增殖、高立体选择性和经济性等优点。 不对称催化反应体系包括均相不对称催化和多相不对称催化体系。近年来研究得较多的不对称催化反应包括不对称催化氢化、不对称催化环氧化、不对称催化氢甲酰化等。均相不对称催化体系自从20世纪60年代Knowels发现了手性铑一膦配体的不对称催化氢化反应以来,Noyori又成功地合成了 BINAP等手性配体,并将其用于不对称催化氢化反 应,得到了很好的光学选择催 化 导 论 -------- 不 对 称 氢 化 2 性;20世纪80年代,Sharpless报道了在四异丙氧基钛和酒石酸二乙酯 存在下,用叔丁基过氧化氢对烯丙醇进行环氧化,产物的值大于90,成功地实现了催化的不对称环氧化反应。由于Knowels和Noyori在不对称 氢化方面的杰出贡献以及Sharpless在不对称环氧 化方面的杰出贡献,而获得了2011年诺贝尔化学奖。 多相不对称催化除了具备容易分离、催化剂容易再利用且产物容易纯化等优点之外,还可以利用固体表面的不对称性和纳米孔中的立体选择性来提 高对映体选择性,因此近年来逐渐引起各国科学家的重视;此外,多相不对称催化与均相不对称催化交叉可能在某些体系获得创新性结果,突破目前已有的专利限制。 近年来多相不对称催化领域研究范围较广,本文将主要介绍多相不对称催化氢化领域的一些新进展。 1. 简单酮的不对称氢 对不含官能团的简单芳香酮来说,由于除酮羰基外不具有与催化剂中心金属进行配位的辅助功能基团, 因此导致钌-膦配合物催化剂对这类酮加氢的对映选择性不高。直到1995年才使得简单芳香酮的不对称催化加氢在催化活性和对映选择性上有了突破性的进展。此后,膦配体、钌、手性二胺形成的三元配合物常用作简单酮进行不对称催化氢化反应的催化剂。 机理研究表明,手性双胺双膦钌催化剂之所以获得很高的催化活性和对映选择性. 一个可能的原因是:在反应过程中,上述催化剂可与反应底物酮生成催化活性的六元环过渡态。首先,手性胺膦钌络合物在碱的作用下生成Ru-H 络合物,红外光谱已证实了该结构的存在。此外手性配体中的“NH”官能团,在催化反应过程中,通过形成氢—氧键,可能生成电荷交替的六元环过渡态。 同时,催化剂各配体的存在使底物酮只能沿着特定的反应通道与催化剂络合,从而有利于单一对映体产物的生成。 2. β-酮酸酯的不对称氢化 β-酮酸酯通过加氢得到的光学产物β-羟基酸酯是合成多种物质的手性原料 ,因而具有重要的研究价值。目前常用的方法有多相、两相和均相体系不对称加氢。多相法中兰尼镍(Ni/Ta)是首选的催化剂前体,通过不同的修饰剂改性来提高催化性能;两项和均相法通常用到过度金属配合物催化剂,在此对钌在催 化 导 论 -------- 不 对 称 氢 化 3 该方面的进展简述。 常用的钌配体有BINAP、BIPHEP、P-Phos等。 研究表明,对带有官能团的酮的不对称加氢反应,含有卤素的Ru-BINAP络合物要优 于 含有二羧酸酯的Ru-BINAP。1987年,NOYORI报导了以[RuX2(BINAP)]配合物在温和的条件下催化β-酮酸酯加氢,产物的光学纯度接近100%。这为它的实际应用提供了非常有利的工业化条件。其原因是这些官能团在催化加氢中能起到导向作用,立体识别的关键因素是它们具有辅助基团的杂原子,使得多数功能化的酮都以高对映选择性和可预见构型的方式被加氢。在研究中发现Ru-双膦催化剂用于β-芳基酮酸酯的加氢时,其对映选择性要比用于β烷基酮酸酯的低 。这是因为芳基酮酸酯中的芳基能和BINAP中的一个苯基形成弱的π-π堆叠而形成一个不利的过渡态,这个弱的堆叠对这个不利的过渡态有轻微的稳定作用,导致对映选择性下降。 β-酮酸酯的催化机理为当催化剂与氢气接触时Ru失去一个氯离子形成BINAP 然后它与酮酸酯可逆地形成酮酯络合物B,B再从中心Ru向配位酮的负氢转移形成C,D再与氢气反应 ,完成催化循环,其他配体的钌系催化剂催化机理类是,四川大学彭宗海等通过一系列的对烷氧基取代BIPHEP 型手性双膦钌配合物催化β-酮酸酯不对称加氢反应。发现对位长链烷氧基的引入对反应活性的影响不大,但可显著提高产物的对映选择性。当苯基对位取代基为正丁氧基时, 催化剂对产物的对映选择性最高。当底物羰基上的取代基R为吸电子基或空间位阻较大时, 产物的对映选择性明显下降;但当酯基上的取代基 R′具有较大的空间位阻时, 加氢反应仍能获得较高的活性和对映选择性。当R为芳基或取代芳基时, 反应活性有所降低, 但加氢产物的ee值仍然较高(90.6%以上)。 此外,部分科学家直接将单质钌特殊处理后催化不对称加成也取得了不错的效果。
3. 不对称氢化前景展望 由于在分离、操作等方面的优越性,多相不对称 催化氢化具有广阔的应用背景。随着世界手性药物 市场需求的进一步增加,以及受Sharpless、Noyori 和Knowles等人获2001年诺贝尔化学奖的鼓舞,多相不催 化 导 论 -------- 不 对 称 氢 化 4 对称催化将成为未来有机合成和不对称催化等领域中的热门研究方向之一。但到目前为止,由于 反应底物、手性修饰剂等的特殊性,多相不对称催化氢化研究的体系仅局限于为数不多的几个。对于目前已有的两个典型的多相不对称催化氢化体系还有许多问题亟待进一步解决,且有关多相不对称催化氢化体系工业应用的成功例子还不多。 4. 小结 随着科学技术的发展和人类生活质量的提高,人类对生命的重视和对药物需求的日益高涨,不对称加氢已越来越受到人们的关注。由于酮尤其是β-酮酸酯的不对称加氢产物(β-羟基酸酯)是合成多种物质的手性原料,对它的进一步研究将具有重要的理论意义和实用价值。而钌催化剂对催化酮的不对称加氢反应具有的高活性和高对映选择,使对其理论研究还将不断深入,并逐渐转化为具有实际生产意。 5. 参考文献 [1] 陶明,陈丽,熊伟等。(BISBI)[(R,R)-DPEN]催化苯乙酮不对称加氢反应研究[J]。有机化学,2006,26(4):559-562.2; [2] 陶明,熊伟,陈华等。[P(CH)]-(R,R)-DPEN催化萘乙酮不对称加氢反应[J]。催化学报,2006,27(12); [3]熊伟、汤波、刘德蓉等。( 1S,2S) -DPEN修饰的负载型钌膦配合物催化苯乙酮及其衍生物不对称加氢反应研究[J]。化学研究与应用,2008,8(20); [4]李岩云、董振荣、张娟等。手性胺膦配体在不对称催化中的应用[J]。中国科学:化学,2011,4(41); [5] 蒋召雪,张 宇,杨玉霞。三苯基膦-氯化钌-DPEN催化取代苯乙酮不对称加氢[J]。西昌学院学报·自然科学版,2008,6(22); [6] 吴进。β-酮酸酯的不对称加氢反应研究进展[J]。西昌学院学报·自然科学版 .2005,9(19)3; [7] 汪秋安,廖头根,孙 颢.不对称催化技术在手性药物合成中的应用[J].化工纵横,2003,17(3): 5-9; [8] 章维华,杨春龙,王鸣华等.不对称催化反应在手性农药合成中的一些应用[J].有机化学,2003,23(8): 741-749; 催 化 导 论 -------- 不 对 称 氢 化 5 [9] 郭莉娜,侯仲轲,陈灿,等不对称催化反应合成手性药物的研究进展[J].精细化工中间体,2006,36(2): 1-4,10; [10] 龚大春,曹飞,王雄亮,等.不对称催化加氢技术的研究及其发展趋势[J].化工中间体,2005,(1): 11-14;