氨基酸的理化性质
- 格式:pdf
- 大小:622.44 KB
- 文档页数:14



常见的氨基酸的分类特点及理化性质氨基酸是构成蛋白质的基本单位,是生物体内重要的有机化合物。
它们在生物体内发挥着多种功能,如参与蛋白质合成、信号传递、代谢调节等。
根据氨基酸的结构和性质,可以将它们分为不同的类别,并探讨其理化性质。
一、氨基酸的分类特点1. 根据侧链的结构,氨基酸可以分为非极性氨基酸、极性氨基酸、酸性氨基酸和碱性氨基酸。
(1)非极性氨基酸:侧链不含有极性基团,如甘氨酸、丙氨酸、缬氨酸等。
它们在蛋白质中主要起到结构支撑的作用。
(2)极性氨基酸:侧链含有极性基团,如丝氨酸、苏氨酸、天冬氨酸等。
它们在蛋白质中主要起到与水分子和其他极性分子相互作用的作用。
(3)酸性氨基酸:侧链含有羧基,如天冬氨酸、谷氨酸等。
它们在蛋白质中主要起到调节蛋白质电荷的作用。
(4)碱性氨基酸:侧链含有氨基,如赖氨酸、精氨酸等。
它们在蛋白质中主要起到与酸性氨基酸相互作用,维持蛋白质稳定性的作用。
2. 根据侧链的功能,氨基酸可以分为疏水性氨基酸、亲水性氨基酸、带电氨基酸和带负电氨基酸。
(1)疏水性氨基酸:侧链不含有极性基团,如甘氨酸、丙氨酸、缬氨酸等。
它们在蛋白质中主要起到结构支撑的作用。
(2)亲水性氨基酸:侧链含有极性基团,如丝氨酸、苏氨酸、天冬氨酸等。
它们在蛋白质中主要起到与水分子和其他极性分子相互作用的作用。
(3)带电氨基酸:侧链含有氨基或羧基,如赖氨酸、精氨酸、天冬氨酸等。
它们在蛋白质中主要起到调节蛋白质电荷的作用。
(4)带负电氨基酸:侧链含有羧基,如谷氨酸、天冬氨酸等。
它们在蛋白质中主要起到与带正电氨基酸相互作用,维持蛋白质稳定性的作用。
二、氨基酸的理化性质1. 溶解性:氨基酸的溶解性与其侧链的结构和性质有关。
非极性氨基酸在水中的溶解性较差,而极性氨基酸和带电氨基酸在水中的溶解性较好。
2. 等电点:氨基酸的等电点是指其在溶液中呈电中性的pH值。
不同氨基酸的等电点不同,与其侧链的结构和性质有关。
3. 水解反应:氨基酸在水中可以发生水解反应,相应的羧酸和胺。



氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。

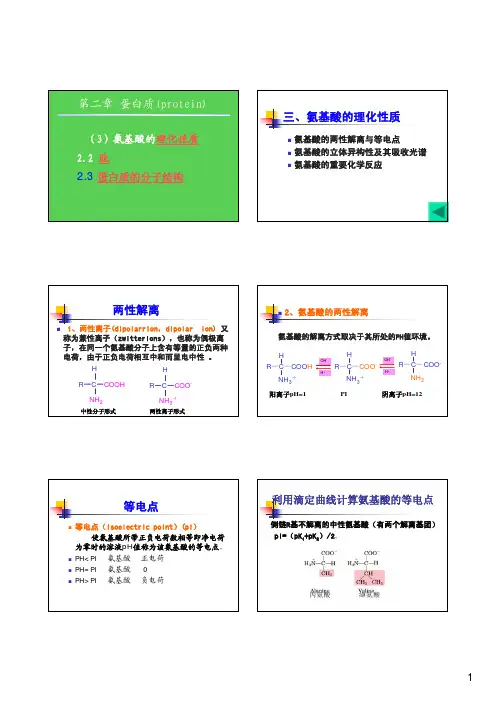
三、氨基酸的理化性质2、氨基酸的两性解离1、两性离子(dipolarrion,dipolar利用滴定曲线计算氨基酸的等电点等电点侧链R基不解离的中性氨基酸(有两个解离基团)丙氨酸缬氨酸1.氨基酸的光学异构体NH2氨基酸的重要化学反应茚三酮反应(ninhydrin reaction):α-H艾德曼反应(Edman 艾德曼反应(Edman肽键(peptide bond)的化合物。
二肽(dipeptide);寡肽丝氨酰甘氨酰酪氨酰丙氨酰亮氨酸H 2NC αHC βH 2C γH 2 -C –NH-CH-CONHCH 2COOHOCH 2SH (谷氨酸)γ(半胱氨酸)(甘氨酸)还原型谷胱甘肽(GSH )γGlu-Cys-GlyS SγGlu-Cys-Gly氧化型谷胱甘肽(GSSG )COOH蛋白质的结构层次蛋白质一级结构Sanger 1955成功地测定了胰岛素二条多肽链上氨一级结构是蛋白质功能多样性的基础蛋白质二级结构1.肽键中C-N 的键长0.132nm,介于C-N(0.147nm)与C=N(0.127nm),具有双键性1α-螺旋分为右手和左手两种螺旋氢键联系。
在α-螺旋体中每隔三个氨基酸残基可形成一个氢键,氢键是每个氨基酸残基上的N-H氢和它前面第四个残C=O氧之间形成的。
2、β-折叠(β-plated sheet)β-折叠结构中两个氨基酸残基之间的轴心距为3、β-转角(β-turn)4、无规则卷曲Ⅱ型β–转角的第三个残基总是Gly超二级结构结构域蛋白质三级结构三级结构蛋白质四级结构维持蛋白质空间结构作用力4、范德华引力:是分子间弱的作用力。
蛋白质结构与功能的关系第六节蛋白质的重要性质1.为什么蛋白质的水溶液是一种比较稳定的亲水胶体?其原因有二: 2.蛋白质沉淀蛋白质盐溶与盐析现象:有机溶剂3. 蛋白质的两性解离和等电点电泳现象 4. 蛋白质变性与复性引起蛋白质变性的因素:5. 蛋白质的呈色反应Folin-酚试剂反应 米伦反应(Millon reaction):蛋白质溶液5. 蛋白质紫外吸收:第七节蛋白质分离提纯的一般原则一般原则:蛋白质在细胞中以复杂的混合物1. 根据分子量大小不同的分离方法2.利用溶解度差别的分离方法3. 根据电荷不同的分离方法电泳法4.根据生物学特异性的分离方法蛋白质分子量的测定分子量(kD)肽链数目残基数目沉降系数(S):物质颗粒在单位离心场中的沉淀速度为恒定值1 S=1×10-13srRNA。


氨基酸的理化性质生化1. 氨基酸的理化性质两性解离等电点紫外吸收核酸的紫外吸收最大值2. 蛋白质的分子结构一级顺序肽键二硫键二级主链氢键三级全部疏水作用离子键氢键范德华力四级亚基氢键离子键3. 蛋白质的变性空间构象破坏理化性质改变生物活性丧失4. DNA双螺旋结构反向平行互补双链==手螺旋横纵5. 转运RNA结构稀有碱基茎环结构二级三级6. DNA变性氢键断裂只改变二级不改变核苷酸排列增色效应解链吸光值增加融解温度Tm紫外吸收值达最大的%时的温度7. 酶结构结合酶酶蛋白辅助因子辅酶辅基必需集团活性中心结合集团催化集团£8. 值等于2005Y25, —个简单的酶促反应,当[S] Km A,反应速度最大B,反应速度太慢难以测出C,反应速度与底物浓度成正比D,增加底物浓度反应速1度不变E,增加底物浓度反应速度降低时9. 可逆性抑制竞争性非竞争性反竞争性Km丙二酸琥珀酸脱氢酶琥珀酸磺胺二氢叶酸合成酶对氨基苯甲酸210. 变构酶速度方程式米氏方程,呈型曲线多为多亚基构成,亚基,亚基:中心,中心: 11. 同工酶催化化学反应,分子结构理化性质免疫学性质乳酸脱氢LDH1 LDH2 LDH3 LDH5#肌酸激酶CK1 CK2 CK312. 糖酵解的调节6-磷酸果糖激酶-1激活AMP ADP 1,6-双磷酸果糖::、2,6-双磷酸果糖:: 抑制ATP、柠檬酸丙酮酸激酶激活1,6-双磷酸果糖抑制ATP、丙氨酸己糖激酶抑制长链脂酰CoA13. 底物水平磷酸化1,3-二磷酸甘油酸3-磷酸甘油酸磷酸甘油酸激酶磷酸烯醇式丙酮酸丙酮酸丙酮酸激酶琥珀酰CoA琥珀酸琥珀酰CoA合成酶脱氢琥珀酸延胡索酸琥珀酸脱氢酶14. 糖异生己糖激酶葡萄糖-6-磷酸酶6-磷酸果糖激酶-1果糖双磷酸酶-1丙酮酸激酶丙酮酸羧化酶磷酸烯醇式丙酮酸羧激酶乙酰CoA丙酮酸羧化酶丙酮酸脱氢酶15. 脂酸氧化限速酶肉碱脂酰转移酶I过程脱氢加水再脱氢硫解、NADH+乙酰CoA16. 能量计算17. 酮体生成关键酶羟甲基戊二酸单酰CoA合成酶肝内生成,肝外利用:肝脏没有318. 脂酸合成原料关键酶乙酰CoA羧化酶激活抑制19. 胆固醇原料分子乙酰CoA、分子ATP及分子NADPH+限速酶HMG CoA还原酶20. 胆固醇的转化Qal胆汁酸::类固醇激素7-脱氢胆固醇:维生素:21. 呼吸链递电子体不递氢递氢体也递电子2.细胞色素223. 抑制剂呼吸链抑制剂鱼藤酮粉蝶霉素A异戊巴比妥Cyt与Cyt抗霉素A二巯基丙醇CO解偶联剂与脱离二硝基苯酚24. 高能化合物磷酸肌酸磷酸烯醇式丙酮酸乙酰磷酸ATP GTP UTP CTP乙酰CoA25. 脱氨基作用转氨酶氧化脱氨基嘌呤核苷酸循环26. 氨的转运丙氨酸- 葡萄糖循环谷氨酰胺27. 鸟氨酸循环限速酶氨基甲酰磷酸合成酶CPS-I 变构激活剂生成一份子尿素需要消耗个高能磷酸键瓜氨酸精氨酸鸟氨酸28. 脱羧基作用氨基酸脱羧酶氨酸- 氨基丁酸氨酸牛磺酸氨酸组胺氨酸5- 羟色胺酸氨酸腐氨精脒精胺429. 一碳单位30. 苯丙氨酸和酪氨酸代谢苯丙氨酸酪氨酸多巴多巴胺去甲肾上腺素肾上腺素黑色素对羟本丙酮酸延胡索酸乙酰乙酸苯丙酮酸31. 核苷酸合成原料和分解产物嘌呤原料天冬氨酸谷氨酰胺C02 —碳单位甘氨酸嘧啶原料天冬氨酸谷氨酰胺C02嘌呤产物尿酸:,,,:嘧啶产物-丙氨酸:,:-氨基异丁酸::32. 脱氧核苷酸的生成在磷酸核苷:N P:上进行:N代表A、G U、C:dTMP由甲基化生成33. 抗代谢物嘌呤类似物6-巯基嘌呤::IMP AMP GMP氨基酸类似物氮杂丝氨酸::UTP CTP叶酸类似物氨碟令氨甲喋呤::dUMP dTMP嘧啶类似物5-氟尿嘧啶::dUMP dTMP次黄嘌呤类似物别嘌呤醇::IMP 尿酸阿糖胞苷CDP dCDP 34. DNA复制的酶学DNA聚合酶解螺旋酶弓I物酶单链DNA结合蛋白DNA拓扑异构酶DNA连接酶DNA聚合酶延长修复原核DNA-pol DNA-pol真核DNA-pol DNA-pol除了DNA-polIII 只有外切酶活性, 其余都有双向外切酶活性I拓扑酶II催化3,5 磷酸二酯键DNA聚合酶RNA聚合酶DNA连接酶DNA拓扑异构酶逆转录酶引物酶535. DNA 生物合成过程起始DnaA 辨别起始点DnaB: : 解螺旋SSB 稳定单链DnaG: : 合成短链RNA 引物:提供末端: 终止后冈崎片段的连接水解引物填补空隙连接缺口36. RNA 聚合酶亚基辨认起始点转录延长仅需要核心酶RNA聚合酶I II IIIS-rRNA S-rRNA,tRNA,snRNA37. 转录后修饰mRNA l子结构聚腺苷酸尾巴mRNA的剪接tRNA 剪切: : 剪接: :添加: : 化学修饰: :外显子内含子38. 遗传密码的特点起始密码终止密码39. 乳糖操纵子三个结构基因一个操纵序列阻遏蛋白一个启动序列RNA 聚合酶一个调节基因阻遏蛋白40. 顺式作用元件启动子启动子是的结合位点至少包括转录起始点和以上的功能组件TATA 盒是的结合位点41. 重组DNA 技术常用工具酶限制性核酸内切酶DNA 连接酶DNA 聚合酶I Klenow 片段反转录酶67。

蛋白质氨基酸共有的理化性质氨基酸是有机化学中的一类结构相对简单的有机化合物,是生物体具有高度组成和功能的重要的组成单位。
氨基酸的分子中包含一个氨基(乙胺基)和一个酸基(羧基),至少包含C、H、O、N 四种化学元素,以脱水缩合方式联接,以-CO-NH-结构连接在一起,因此氨基酸又被称为“二元碱型”。
根据氨基酸的最终加成体,氨基酸可以分为四类:α-酰胺型氨基酸、γ-胺基酸、内酰胺型氨基酸和醛胺型氨基酸。
氨基酸含有一个醇类基团(-HCH2R),是一种典型的碱性氨基,具有较强的核碱反应性质;一个酸类基团(-COOH),具有较强的酸性,可以参与酸基反应;一个酰胺基团(-CO-NH2),可以参与水解、脱水缩合、氨基缩合等反应;一个连接二氧基(-C=O),可形成共价键,是大分子在线缆和蛋白质等生物大分子结构的重要构成部分。
氨基酸的分子结构和分子量,严格来说,其理化性质差别较大:在常温常压下,氨基酸的熔点差异也较大,如γ-氨基丙酸的熔点为172℃,苯丙氨酸的为267℃,而丙二酸的熔点却只有85℃;折射率差异也较大,如右旋糖胺酸的折射率只有1.541,苯兰氨酸的折射率却高达1.641;氨基酸盐的溶解度差别较大,如γ-氨基丙酸钠的溶解度,在0℃下为214g/100ml,而甲基羟基脯氨酸钠在0℃下的溶解度仅为0.15g/100ml;氨基酸的碱度,离子均衡常数和酸度,也有一定差异;氨基酸的质荷比也有较大差异,如精氨酸的质荷比为-0.77,而去氧多巴的质荷比为-1.1等。
通过氨基酸的对比可以发现,同类氨基酸的理化性质具有一定的相似性,它们的分子量和分子式有一定的相似性,比较类似的氨基酸的折射率、熔点等特征也很接近,具有一定的重要性和系统性,可以说是一种有效性的划分。
在生物体中,氨基酸是蛋白质构成的基础,因此不同的氨基酸对它具有重要的作用,通过彼此之间的复合、折叠、加工等,可以组成不同的分子和不同的空间结构,使得蛋白质的形态更加的复杂和丰富,从而发挥出不同的生物学功能,一般来讲,氨基酸的变化越多,蛋白质的功能越丰富、越精确。
氨基酸的理化性质
一、两性解离及等电点
➢定义:氨基酸是两性电解质,其解离程度取决于所处溶液的酸碱度。
➢等电点(pI):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH 值称为该氨基酸的等电点。
➢等电点计算:
➢备注:pI值等于两性离子两边pK值之和的平均值。
➢溶液的pH偏离pI越远,氨基酸带净电荷越多,在电场中越容易分离。
➢pI时氨基酸溶解度最小,容易聚集沉淀。
二、光学性质
1.旋光性:除甘氨酸外,其他氨基酸有不对称C原子,可以用旋光仪测定其旋光性。
➢左旋:Ser、Leu、Pro、Trp、Phe等。
➢右旋:Ala、Ile、Glu、Asp、Val、Lys、Arg等。
2.光吸收:R基团含有芳香环共轭双键系统的色氨酸、酪氨酸、苯丙氨酸,在近紫外区(220—300nm)有光吸收,其最大光吸收(λmax)分别为279nm,278nm和259nm。
蛋白质由于含有这些氨基酸,一般最大光吸收在280nm波长处,因此能利用紫外分光光度法很方便的测定蛋白质含量。
三、重要化学反应
1.茚三酮反应:在ph5-7和80—100°条件下,氨基酸与茚三酮可生成蓝紫色化合物,其最大吸收峰在570nm处。
常作为氨基酸定量分析方法。
脯氨酸或羟脯氨酸与茚三酮生成黄色化合物。
此反应经常用于氨基酸的定性和定量分析。
第一章氨基酸(amino acid)的结构与性质第一节氨基酸的结构与分类一、氨基酸的结构组成蛋白质的基本单位是氨基酸。
如将天然的蛋白质完全水解,最后都可得到约二十种不同的氨基酸。
从氨基酸的结构通式可以看出:构成蛋白质的氨基酸均为L—α—氨基酸。
除R 为H(甘氨酸)外,其余氨基酸均具有旋光性。
*在空间各原子有两种排列方式:L—构型与D—构型,它们的关系就像左右手的关系,互为镜像关系,下图以丙氨酸为例:二、氨基酸的分类:1.按氨基酸分子中羧基与氨基的数目分:酸性氨基酸:一氨基二羧基氨基酸,有天冬氨酸、谷氨酸;碱性氨基酸:二氨基一羧基氨基酸,有赖氨酸、精氨酸、组氨酸;中性氨基酸:一氨基一羧基氨基酸,有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸。
2.按侧基R 基的结构特点分:脂肪族氨基酸芳香族氨基酸:苯丙氨酸、色氨酸、酪氨酸杂环氨基酸:脯氨酸、组氨酸3.按侧基R 基与水的关系分:非极性氨基酸:有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸;极性不带电氨基酸:天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸;极性带电氨基酸:天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸。
4. 按氨基酸是否能在人体内合成分:必需氨基酸:指人体内不能合成的氨基酸,必须从食物中摄取,有八种:赖氨酸、色氨酸、甲硫氨酸、笨丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸。
非必需氨基酸:指人体内可以合成的氨基酸。
有十种。
半必需氨基酸:指人体内可以合成但合成量不能满足人体需要(特别是婴幼儿时期)的氨基酸,有两种:组氨酸、精氨酸。
三、稀有氨基酸:参加天然蛋白质分子组成的氨基酸,除了上述20 种有遗传密码的基本氨基酸之外,在少数蛋白质分子中还有一些不常见的氨基酸,称为稀有氨基酸。
它们都是在蛋白质分子合成之后,由相应的常见氨基酸分子经酶促化学修饰而成的衍生物。
三、氨基酸的理化性质
2、氨基酸的两性解离
1、两性离子(dipolarrion,dipolar
利用滴定曲线计算氨基酸的等电点等电点
侧链R基不解离的中性氨基酸(有两个解离基团)
丙氨酸缬氨酸
1.氨基酸的光学异构体
NH
2
氨基酸的重要化学反应
茚三酮反应(ninhydrin reaction):α-
H
艾德曼反应(Edman 艾德曼反应(Edman
肽键(peptide bond)
的化合物。
二肽(dipeptide);寡肽丝氨酰甘氨酰酪氨酰丙氨酰亮氨酸
H 2NC αHC βH 2C γH 2 -C –NH-CH-CONHCH 2COOH
O
CH 2SH (谷氨酸)γ
(半胱氨酸)
(甘氨酸)
还原型谷胱甘肽(GSH )
γGlu-Cys-Gly
S S
γGlu-Cys-Gly
氧化型谷胱甘肽(GSSG )
COOH
蛋白质的结构层次
蛋白质一级结构
Sanger 1955成功地测定了胰岛素二条多肽链上氨一级结构是蛋白质功能多样性的基础
蛋白质二级结构
1.
肽键中C-N 的键长0.132nm,介于C-N
(0.147nm)与C=N(0.127nm),具有双键性
1
α-螺旋分为右手和左手两种螺旋
氢键联系。
在α-螺旋体中每隔三个氨基酸残基可
形成一个氢键,氢键是每个氨基酸残基上的N-H氢和它前面第四个残
C=O氧之间形成的。
2、β-折叠(β-plated sheet)
β-折叠结构中两个氨基酸残基之间的轴心距为
3、β-转角(β-turn)
4、无规则卷曲Ⅱ型β–转角的第三个残基总是Gly
超二级结构
结构域
蛋白质三级结构
三级结构
蛋白质四级结构
维持蛋白质空间结构作用力
4、范德华引力:是分子间弱的作用力。
蛋白质结构与功能的关系第六节蛋白质的重要性质
1.
为什么蛋白质的水溶液是一种比较稳定的
亲水胶体?其原因有二: 2.蛋白质沉淀
蛋白质盐溶与盐析现象:
有机溶剂
3. 蛋白质的两性解离和等电点
电泳现象 4. 蛋白质变性与复性
引起蛋白质变性的因素:
5. 蛋白质的呈色反应
Folin-酚试剂反应 米伦反应(Millon reaction):蛋白质溶液
5. 蛋白质紫外吸收:第七节蛋白质分离提纯的一般原则
一般原则:蛋白质在细胞中以复杂的混合物
1. 根据分子量大小不同的分离方法
2.利用溶解度差别的分离方法
3. 根据电荷不同的分离方法
电泳法
4.根据生物学特异性的分离方法
蛋白质分子量的测定
分子量(kD)
肽链数目
残基数目
沉降系数(S):物质颗粒在单位离心场中
的沉淀速度为恒定值1 S=1×10-13s
rRNA。