对氨基苯磺酰胺合成实验方案
- 格式:docx
- 大小:58.09 KB
- 文档页数:4

毕业论文实验方案实验原料,中间产物,目标产物的物理化学性质:苯胺:无色油状液体。
熔点-6.3℃,沸点184℃,相对密度1.02 (20/4℃),相对分子量93.128,加热至370℃分解。
稍溶于水,易溶于乙醇、乙醚等有机溶剂。
暴露于空气中或日光下变为棕色。
醋酸酐:无色透明液体。
有强烈的乙酸气味。
味酸。
有吸湿性。
折光率极高。
溶于氯仿和乙醚,缓慢地溶于水形成乙酸。
与乙醇作用形成乙酸乙酯。
相对密度 1.080。
熔点-73℃。
沸点139℃。
折光率1.3904。
闪点54℃。
自燃点400℃。
低毒,半数致死量(大鼠,经口)1780mG/kG。
易燃。
有腐蚀性。
勿接触皮肤或眼睛,以防引起损伤。
有催泪性。
结晶醋酸钠:无色透明结晶或白色颗粒。
在干燥空气中风化,相对密度1.45,熔点58℃。
溶于水,水溶液呈碱性;微溶于乙醇。
浓盐酸:盐酸为无色液体,在空气中冒白雾(由于盐酸有强挥发性,与水蒸气结合形成小液滴),有刺鼻酸味。
粗盐酸或工业盐酸因含杂质氯化铁而带黄色。
乙酰苯胺:乙酰苯胺,学名N-苯(基)乙酰胺,白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
氯磺酸:氯磺酸(化学式:ClSO2OH)是一种无色或淡黄色的液体,具有辛辣气味,在空气中发烟,是硫酸的一个-OH 基团被氯取代后形成的化合物。
分子为四面体构型,取代的基团处于硫酸与硫酰氯之间,有催泪性,主要用于有机化合物的磺化,制取药物、染料、农药、洗涤剂等。
浓氨水:是氨气的水溶液,无色透明且具有刺激性气味。
易挥发,具有部分碱的通性,由氨气通入水中制得,主要用作化肥。
碳酸钠:碳酸钠,俗名苏打、大大苏打、纯碱、洗涤碱,化学式:Na₂CO₃,普通情况下为白色粉末,为强电解质。
密度为2.532g/cm³,熔点为851℃,易溶于水,具有盐的通性。
对乙酰氨基苯磺酰氯:熔点(℃)149,白色至灰色晶体.不溶于水,溶于苯、乙醚、丙酮、氯仿、二氯化乙烯。


对氨基苯磺酸的合成
答案:
对氨基苯磺酸可以通过多种方法合成,主要包括苯胺与浓硫酸反应、溶剂法、微波法以及其他方法。
具体合成步骤
苯胺与浓硫酸反应
在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸。
将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5小时。
将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。
过滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
溶剂法
使用溶剂汽油作为溶剂,加入苯胺和浓硫酸,在搅拌下慢慢滴入溶剂中,加热至170~175℃,保持6小时进行脱水转位反应。
反应期间不断滴入溶剂,同时溶剂又不断被蒸出,保持总溶剂量基本不变。
微波法
在100 mL圆底烧瓶中加入新蒸的苯胺5 mL,用冷水浴冷却,分批加入浓硫酸。
将圆底烧瓶置于微波炉内,以一定功率加热反应。
反应完毕取出圆底烧瓶,待反应物稍冷后倒入冷水中,过滤、重结晶得到对氨基苯磺酸。
其他方法
通过4-氨基苯酚和2-磺酸基甲苯在氯化铝存在下反应,经过滤、洗涤、脱水、烘干得到对氨基苯磺酸。

广州大学化学化工学院本科学生综合性、设计性实验报告实验课程有机化学基础实验实验项目磺胺的合成-多步骤合成对氨基苯磺酰胺专业班级学号姓名指导教师开课学期至学年学期时间年月日磺胺的合成—多步骤合成对氨基苯磺酰胺姓名:摘要:对氨基苯磺酰胺作为一种简单的磺胺药,投入大量生产。
能抑制多种细菌和少数病毒的生长和繁殖,用于防治多种病菌感染。
本实验以苯为原料经过硝化、还原、酰胺化、氯磺化、氨置换、水解及中和等一系列反应,得到磺胺。
最后通过测定熔点和红外光谱图鉴定磺胺的结构。
关键词:对氨基苯磺酰胺、磺胺药物,红外光谱Abstract:As a simple sulfa drugs, Sulfanilamide put into mass production. Sulfa drugs can inhibit the growth and multiplication of certain kinds of bacteria and a few virus for the preventing bacteria infections. In this experiment, benzene was treated by nitration, reduction, acylation, chlorine, ammonia substitution, hydrolysis and a series of reactions to get sulfanilamide. The structure of sulfanilamide was characterized by melt point and IR spectra analysis.Key words: Ammonium p-aminobenzene sulfonic acid, sulfa drugs, IR前言:磺胺药物是含磺胺基团合成抗菌药的总称,能抑制多种细菌和少数病毒的生长和繁殖,用于防治多种病菌感染。

第1篇一、实验目的1. 掌握磺胺类药物的合成原理和实验步骤。
2. 熟悉实验操作技能,包括反应条件控制、产物分离纯化等。
3. 了解磺胺类药物的理化性质和临床应用。
二、实验原理磺胺类药物是一类具有抗菌作用的药物,其化学结构为对氨基苯磺酰胺。
本实验以磺胺为原料,通过乙酰化反应制备磺胺醋酰,再与氢氧化钠反应制备磺胺醋酰钠。
实验原理如下:1. 磺胺与乙酸酐在碱性条件下发生乙酰化反应,生成磺胺醋酰。
2. 磺胺醋酰与氢氧化钠反应,生成磺胺醋酰钠。
三、实验材料与仪器1. 实验材料:- 磺胺(药用)- 乙酸酐(分析纯)- 氢氧化钠(分析纯)- 盐酸(分析纯)- 活性炭(化学纯)- 水(蒸馏水)2. 实验仪器:- 圆底烧瓶(100 mL)- 球形冷凝管- 布氏漏斗- 抽滤瓶- 温度计- 恒温磁力搅拌器- 三颈瓶- 抽滤瓶- 布氏漏斗四、实验步骤1. 磺胺醋酰的制备:- 在装有搅拌、温度计、回流冷凝管的100 mL圆底烧瓶中,加入26 g磺胺(SA)和22.5%的NaOH溶液。
- 将烧瓶置于电热套上,加热至50℃左右,待磺胺溶解后,加入3.6 mL乙酸酐。
- 保持反应温度在50-55℃之间,每隔5分钟分次交替加入乙酸酐和77%的NaOH溶液,每次各2 mL。
- 加毕,继续保温搅拌30分钟。
- 将反应液倒入烧杯中,加入20 mL水,搅拌下用浓盐酸调pH至7-8。
- 冰浴冷却30分钟,析出固体。
- 抽滤,用适量冰水洗涤固体。
- 合并滤液和固体,弃去固体。
2. 磺胺醋酰钠的制备:- 将滤液用浓盐酸调pH至4-5,过滤,弃去滤饼。
- 将滤液压干,得到磺胺醋酰钠粗品。
- 将粗品用三倍量10%盐酸溶解,放置30分钟。
- 抽滤,取滤液。
- 将滤液用20%的NaOH溶液调pH至7-8,抽滤,取固体。
- 将固体干燥,得到磺胺醋酰钠纯品。
五、实验结果与讨论1. 实验结果:- 成功制备了磺胺醋酰钠纯品。
- 纯品熔点为(),与文献值相符。
2. 讨论:- 实验过程中,控制反应温度和pH值对产物的合成和纯度至关重要。

制药工艺学开题报告题目:磺胺的制备及工艺条件考察学生:学号: 25院(系):生命科学与工程学院专业:制药工程指导教师:2011年 3月 12日制药工艺学实验开题报告一·实验题目:磺胺的制备及工艺条件的考察1.1磺胺及磺胺类药物简介1.1.1发展历程:磺胺类药物的发现,开创了化学治疗的新纪元,使死亡率很高的细菌性传染疾病得到了控制。
同时它的作用机制的阐明为药物研究提供了新的思路——代谢拮抗。
早在1908年,磺胺就被合成,但当时仅作为合成偶氮染料的中间体,无人注意到它的医疗价值。
直到1932年Domagk发现了百浪多息,可以使鼠、兔免受链球菌和葡萄球菌的感染,次年报告了用百浪多息治疗由葡萄球菌引起败血症的第一病例,引起了世界范围的极大兴趣。
令人奇怪的是“百浪多息”只有在体内才能杀死链球菌,而在试管内则不能。
而由于乙酰化是体内代谢的常见反应,因此推断百浪多息在体内代谢成磺胺,而产生抗菌作用。
然后证明磺胺在体内外均有抑菌作用。
从此之后,磺胺名字很快在医疗界广泛传播开来;磺胺类药物的研究工作发展极为迅速。
1937年制出“磺胺吡啶”,1939年制出“磺胺噻唑”,1941年制出了“磺胺嘧啶”……至1946年共合成了5500余种磺胺类化合物,并有20余种作为合成抗菌药在临床上使用。
磺胺类药物在细菌性传染的化学治疗上,有卓越的功效。
它的发现以及随之而来的一系列新的磺胺药物合成上的研究成果,是医疗事业上一件有极重要意义的事。
人类依靠了磺胺类药物,在与病菌作战中,取得过空前的胜利。
许多严重的危机人们生命安全的疾病,诸如产褥热、丹毒、猩红热、败血症以及肺炎、骨髓炎、流行性脑膜炎、细菌性痢疾和各种创伤传染及眼耳鼻喉等的化脓性传染等,都纷纷低头;它的治疗功效,在化学治疗学上,写下了光辉的一页。
1.1.2磺胺(对氨基苯磺酰胺)【结构式】:【化学名】对氨基苯磺酰胺【中文通用名称】磺胺【英文通用名称】Sulfanilamide【其他名称】磺酰胺、对苯胺磺酰胺、对磺酰胺苯胺。

对氨基苯磺酰胺【中文名称】磺胺;对氨基苯磺酰胺【英文名称】sulfanilamide;sulfanilic amide【结构或分子式】(C6H8N2O2S)【相对分子量或原子量】172.22【密度】1.08(20℃)【熔点(℃)】164.5~166.5【水溶性】7.5G/L AT 25℃【毒性LD50(mg/kg)】狗经口2000【性状】白色颗粒或粉末状晶体。
无臭,味微苦。
【溶解情况】微溶于冷水、乙醇和丙酮,易溶于沸水、甘油、乙醚和氯仿。
【用途】磺胺类药物中最简单的一种。
用于外敷消炎药和兽药。
【制备或来源】由制造磺胺噻唑的副产物对乙酰磺胺经水解而成。
也可将对乙酰氨基苯磺酰氯与氨水反应,再经水解而得。
危险性概述【健康危害】接触磺胺类的工人,主诉有干咳、食欲不振、口中有恶味、头痛、头晕、易疲乏、精神萎靡、工作后思睡等。
遇热分解放出有毒的氮氧化物和氧化硫。
【环境危害】对环境可能有危害,对水体和土壤可造成污染。
【燃爆危险】可燃。
急救措施【皮肤接触】脱去污染的衣着,用流动清水冲洗。
【眼睛接触】提起眼睑,用流动清水或生理盐水冲洗。
就医。
【吸入】迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
【食入】饮足量温水,催吐。
就医。
消防措施【危险特性】遇明火、高热可燃。
其粉体与空气可形成爆炸性混合物, 当达到一定浓度时, 遇火星会发生爆炸。
受高热分解放出有毒的气体。
【有害燃烧产物】一氧化碳、二氧化碳、氮氧化物、氧化硫。
【灭火方法】消防人员须戴好防毒面具,在安全距离以外,在上风向灭火。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
泄漏应急处理【应急处理】隔离泄漏污染区,限制出入。
切断火源。
建议应急处理人员戴防尘口罩,穿一般作业工作服。
不要直接接触泄漏物。
小量泄漏:避免扬尘,小心扫起,置于袋中转移至安全场所。
大量泄漏:收集回收或运至废物处理场所处置。
操作处置与储存【操作注意事项】密闭操作,提供充分的局部排风。

实验十 对氨基苯磺酰胺(磺胺)的制备一. 实验目的1. 通过对氨基苯磺酰胺的制备,掌握酰氯的氨解和乙酰氨基衍生物的水解;2. 巩固回流、脱色、重结晶等基本操作。
二. 实验原理本实验从对乙酰氨基苯磺酰氯出发经下述三步反应合成对氨基苯磺酰胺(磺胺)。
三. 试剂及实验装置对乙酰氨基苯磺酰氯粗产品(FW 233.5) 自制液氨水(28%) 35mL d 420 0.9g/mL盐酸(10%) 20mL d 420 1.047g/mL 碳酸钠 4g四. 实验步骤1. 对乙酰氨基苯磺酰胺的制备:1. 将自制的对乙酰氨基苯磺酰氯粗品放入一个50mL 的烧杯中。
2. 在通风橱内,搅拌下慢慢加入35mL 浓氨水[1](28%),立即发生放热反应生成糊状物。
3. 加完氨水后,在室温下继续搅拌10min ,使反应完全。
4. 将烧杯置于热水浴中,于70℃反应10min ,并不断搅拌,以除去多余的氨,然后将反应物冷至室温。
5. 振荡下向反应混合液加入10%的盐酸,至反应液使石蕊试纸变红(或对刚果红试纸显 酸性)。
6. 用冰水浴冷却反应混合物至10℃,抽滤,用冷水洗涤。
得到的粗产物可直接用于下步合成[2]。
2. 对氨基苯磺酰胺(磺胺)的制备:1. 将对乙酰氨基苯磺酰胺的粗品放入50mL 的圆底烧瓶中,加入20mL10%的盐酸和一粒 沸石。
2. 装上一回流冷凝管,使混合物回流至固体全部溶解(约需10分钟),然后再回流0.5h [3]。
32NH 32NHCOCH 3SO 2NH 2HCl 22+_2+_2+Na 2CO 3NH 2SO 2NH 22+ 2 NaCl3. 将反应液倒入一个大烧杯中,将其冷却至室温。
4. 在搅拌下小心加入碳酸钠固体[4](约需4g),至反应液对石蕊试纸恰显碱性(Ph=7~8)[5],在中和过程中,磺胺沉淀析出。
5. 在冰水浴中将混合物充分冷却,抽滤,收集产品。
6. 用热水重结晶产品并干燥。
7. 称重,计算产率。

药物化学实验报告实验课程:药物化学实验项目:对氨基苯磺酰胺的制备时间:2010年12月05日对氨基苯磺酰胺的制备一、目的要求:1、通过对氨基苯磺酰胺的制备,掌握酰氯的氨解和乙酰氨基衍生物的水解。
2、进一步熟悉回流重结晶等基本操作。
二、基本原理:对氨基苯磺酰胺可以看作是磺胺类药物的母体三、实验材料:1.器材:电加热搅拌油浴锅、电子天平、铁架台、球形冷凝管、100 mL三口烧瓶、温度计、50 mL烧杯、玻璃棒、100 mL量筒、抽滤瓶(布氏漏斗)、洗瓶、胶头滴管、PH试纸2.试剂:乙酰氨基苯磺酰氯、浓氨水(28%, d=0.9)、稀盐酸(6M)、固体碳酸钠3.主要试剂及产物的性质试剂熔点℃沸点℃水溶性性状化学性质毒性对乙酰氨基苯磺酰氯149 426.8 不溶于水白色至灰色晶体。
易溶于乙醇、乙醚,溶于热苯、热氯仿。
LD50=16500mg/kg(小鼠经口)氨水-77 165 与水以任意比溶无色澄清液体挥发性、腐蚀性、水溶液呈弱碱性、不稳定性、沉淀性、还原性低毒、LD50=350 mg/kg碳酸钠851 ——21g(20℃)白色粉末状,是固体盐的通性无毒稀盐酸-114.8(纯) 108.6(20%)与水以任意比溶无色澄清液体1与酸碱指示反应 2和活泼的金属反应生成盐和氢气3与某些盐反应4与碱反应生成盐和水 5与某些金属氧化物反应生成盐和水低毒对氨基苯磺酰胺164--166 °C7.5 g/Lat 25 ºC白色颗粒或粉末状结晶,无臭。
味微苦。
微溶于冷水、乙醇、甲醇、乙醚和丙酮,易溶于沸水、甘油、盐酸、氢氧化钾及氢氧化钠溶液,不溶于氯仿、乙醚、苯、石油醚。
中毒4.投料比试剂分子量(Mr)质量/体积摩尔数(mol) 摩尔比Ρ(g/ml)对乙酰氨基苯磺酰氯233.5 5g 0.021 1 0.059 浓氨水35.045 35 mL ——0.104稀盐酸36.46 20 mL ———实验步骤 实验内容实验现象第一步 对乙酰氨基苯磺酰胺的制备1.将乙酰氨基苯磺酰氯 5 g 加入50 mL 烧杯中,在搅拌下慢慢加入35mL 浓氨水(28%, d=0.9)立即起放热反应,生产糊状反应物,加完氨水后继续搅拌,以除去多余的氨。

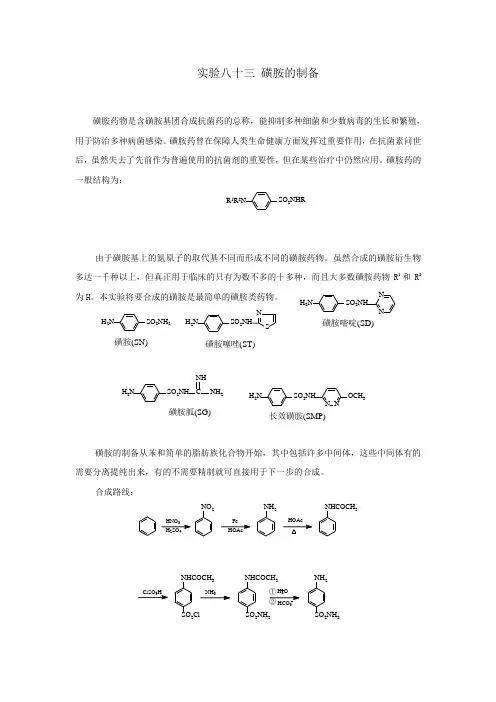
实验八十三 磺胺的制备磺胺药物是含磺胺基团合成抗菌药的总称,能抑制多种细菌和少数病毒的生长和繁殖,用于防治多种病菌感染。
磺胺药曾在保障人类生命健康方面发挥过重要作用,在抗菌素问世后,虽然失去了先前作为普遍使用的抗菌剂的重要性,但在某些治疗中仍然应用。
磺胺药的一般结构为:由于磺胺基上的氮原子的取代基不同而形成不同的磺胺药物。
虽然合成的磺胺衍生物多达一千种以上,但真正用于临床的只有为数不多的十多种,而且大多数磺胺药物R 1和R 2为H 。
本实验将要合成的磺胺是最简单的磺胺类药物。
磺胺的制备从苯和简单的脂肪族化合物开始,其中包括许多中间体,这些中间体有的需要分离提纯出来,有的不需要精制就可直接用于下一步的合成。
合成路线:SO 2N H RR 1R 2N SO 2N H 2H 2N磺胺(SN )3H SO N O 2Fe N H 2N H C OC H 3C lSO 3H N H C O C H 3SO 2Cl N H C O C H 3SO 2N H 2N H 2SO 2N H 2H N H 3②H 2N SO 2N HNS磺胺噻唑(ST )H 2NSO 2N HNN磺胺嘧啶(SD )H 2NSO 2N HCN H 2N H磺胺胍(SG )H 2N SO 2N HN NO CH 3长效磺胺(SM P)一、 乙酰苯胺的制备Preparation of acetanilide【目的与要求】1. 掌握苯胺乙酰化反应的原理和实验操作。
2. 进一步熟悉固体有机物的提纯的方法——重结晶。
【基本原理】芳胺的乙酰化在有机合成中有着重要的作用, 例如保护氨基。
一级和二级芳胺在合成中通常被转化为它们的乙酰化衍生物,以降低芳胺对氧化降价的敏感性或避免与其它功能基或试剂(如RCOCl ,-SO 2Cl ,HNO 2等)之间发生不必要的反应。
同时,氨基经酰化后,降低了氨基在亲电取代(特别是卤化)中的活化能力,使其由很强的第Ⅰ类定位基变为中强度的第Ⅰ类定位基,使反应由多元取代变为有用的一元取代;由于乙酰基的空间效应,对位取代产物的比例提高。
实验一 对氨基苯磺酸的合成一、实验目的:对氨基苯磺酸是一种重要的偶氮染科中间体,用于制造酸性橙Ⅱ、酸性嫩黄2G 、酸性媒介黄棕4G 、酸性媒介深黄GG 、直接黄GR 等。
亦可用于制造某些活性染料以及印染助剂,如助剂B 、增白剂BG 、防染剂H 等。
此外,其钠盐还可用作防治麦锈病的农药。
本实验通过对氨基苯磺酸的制备,使同学们加深对磺化反应、产品分离及氨基化合物重氮化方法的理解。
二、反应原理:芳伯胺用浓硫酸磺化首先生成芳胺硫酸盐,然后在高温下烘培脱水,同时发生分子内重排得到芳胺磺酸:三、药品和仪器:1.实验药品投料量 苯胺15.2ml 浓硫酸27.2ml 活性碳少量 2.仪器名称规格 数量 三口烧瓶250ml 1 烧杯500ml 1 烧杯250ml 1 电热套1 搅拌器1 搅拌器套管1 温度计 250℃ 2NH 2 H 2SO 4 NH 3+.SO 4-180~190℃ -H 2ONHSO 3H SO 3H NH 2温度计套管 1球形冷凝器 1布氏漏斗 1吸滤瓶 1玻璃棒 1表面皿 1量筒10ml 1量筒25ml 1四、实验步骤:在干燥的250ml圆底三口烧瓶中加入27.2ml浓硫酸,搅拌下分次逐渐滴入15.2ml苯胺,升温到180℃,反应3小时,冷却至80℃,然后将反应混合液在搅拌下倾至盛有100ml水的烧杯中,静置后过滤出对氨基苯磺酸白色沉淀。
为提纯产品可进行重结晶操作。
步骤如下:在盛有产品的烧杯中加入100ml 水,加热至沸腾,然后分次加水,加入后再煮沸,直到固体全部溶解为止,将溶液冷却,加入少量活性炭,再煮沸,趁热过滤。
弃掉滤饼,将抽滤瓶中的滤液倒入烧杯中。
是滤液自然冷却到室温,过滤得到无色对氨基苯磺酸晶体,烘干,称重,计算产率。
五、思考题:1.为什么反应终了将反应液倒入水中后产品能析出?若有未反应的苯胺是否也能析出?2.重结晶提纯产品的原理是什么?操作时应注意哪些问题?3.反应终点是怎样确定的?为什么?。
授课题目对氨基苯磺酰胺的制备Preparation of sulfanilamide 授课类型实验课首次授课时间年月日学时8 教学目标1、学习对氨基苯磺酰胺的制备方法。
2、通过对氨基苯磺酰胺的制备掌握酰氯的氨解和乙酰氨基衍生物的水解。
3、熟悉使用有害气体吸收装置和巩固回流、脱色、重结晶与过滤操作。
重点与难点⑴由对乙酰氨基苯磺酰氯氨解、水解制备对氨基苯磺酰胺的原理和方法⑵各步操作要点。
教学手段与方法指导练习法教学过程包括授课思路、过程设计、讲解要点及各部分具体内容、时间分配等本实验的起始原料用上节课制备的乙酰苯胺。
一、实验目的教学目标二、实验原理见乙酰苯胺的制备一节三、试剂及主要试剂的物理常数乙酰苯胺5g 0.037mol 自制氯磺酸22.5g12.5mL0.19mold1.77浓氨水3.5 mL28 d0.9浓盐酸碳酸钠对氨基苯磺酰胺sulfanilamide分子量172.21熔点163-164℃。
白色针状结晶。
易溶于沸水、丙酮及乙醇难溶于乙醚及氯仿。
四、实验步骤 1. 对氨基苯磺酰胺①在100mL干燥的锥形瓶中放置5g干燥的乙酰苯胺先在石棉网上加热熔化然后冷却熔化物使凝结成块。
瓶壁上若有水气凝结应用干净的滤纸吸去。
②将锥形瓶置于冰浴中冷却后迅速倒入12.5mL氯磺酸并迅速吸收氯化氢。
若反应过于剧烈可用冰水浴冷却。
③反应缓和后旋摇锥形瓶使固体全溶温水浴加热10min使反应完全。
④冰浴中充分冷却后把反应混合液慢慢倒入盛有75克碎冰的烧杯中同时在通风橱中用力搅拌。
此时对氨基苯磺酰氯成白色或粉红色块状沉淀析出。
⑤粉碎固体块状物抽滤用少量冷水洗涤、压干立即进行下面反应。
2. 对乙酰氨基苯磺酰胺①在通风橱中将上述产物慢慢加入17.5mL浓氨水并不断搅拌。
放热产生白色糊状物。
加完氨水后继续搅拌10min使反应完全。
②加入10mL水小火加热10min并不断搅拌以除去多余的氨。
得到的混合物直接进行下一步的合成。
对氨基苯磺酸的制备实验报告一、实验目的1、掌握对氨基苯磺酸的制备原理和方法。
2、学习重氮化反应和水解反应的操作。
3、熟练掌握过滤、洗涤等基本实验操作。
二、实验原理对氨基苯磺酸是一种重要的有机化工中间体,通常由苯胺通过重氮化反应和水解反应制备。
苯胺与亚硝酸钠在酸性条件下发生重氮化反应,生成重氮盐:C₆H₅NH₂+ HNO₂+HCl → C₆H₅N₂Cl + 2H₂O重氮盐在酸性条件下水解,生成对氨基苯磺酸:C₆H₅N₂Cl + H₂O → C₆H₇NO₃S + HCl三、实验仪器和试剂1、仪器三口烧瓶(250 mL)温度计(0 100℃)搅拌器布氏漏斗抽滤瓶表面皿玻璃棒2、试剂苯胺(5 mL)浓盐酸(15 mL)亚硝酸钠(4 g)浓硫酸(25 mL)淀粉碘化钾试纸四、实验步骤1、重氮化反应在 250 mL 三口烧瓶中,加入 5 mL 苯胺和 15 mL 浓盐酸,搅拌使其混合均匀。
将烧瓶置于冰水浴中冷却至 0 5℃。
在搅拌下,慢慢加入 4 g 亚硝酸钠溶于 10 mL 水的溶液,控制反应温度不超过 5℃。
用淀粉碘化钾试纸检验反应终点,试纸变蓝表明反应完成。
2、水解反应将反应液小心地倒入盛有 25 mL 浓硫酸的另一三口烧瓶中,搅拌均匀。
将烧瓶置于油浴中,缓慢升温至 180 190℃,保持此温度反应 2 3 小时。
3、分离和提纯反应结束后,将反应液倒入盛有 100 mL 冷水的烧杯中,搅拌,使产物析出。
用布氏漏斗抽滤,收集固体产物。
用少量冷水洗涤产物,直至滤液呈中性。
将产物转移至表面皿上,在空气中晾干,得到粗产品。
4、重结晶将粗产品用适量热水溶解,加入少量活性炭脱色,煮沸 5 分钟。
趁热过滤,将滤液冷却,使对氨基苯磺酸结晶析出。
再次抽滤,收集晶体,干燥,称重,计算产率。
五、实验现象及记录1、重氮化反应过程中,溶液逐渐变为浅黄色,随着反应的进行,颜色逐渐加深。
2、水解反应时,溶液变得浓稠,颜色逐渐变深。
实验 对氨基苯磺酰胺的制备一、实验目的1. 学习对氨基苯磺酰胺的制备方法,掌握苯环上的磺化反应、酰氯的氨解和乙酰氨基衍生物水解反应;2. 巩固回流、脱色、重结晶及抽滤等基本操作。
二、实验原理对氨基苯磺酰胺是一种最简单的磺胺药,俗称SN 。
它是以乙酰苯胺为原料,然后再氯磺化和氨解,最后在酸性介质中水解除去乙酰基而制得。
乙酰苯胺的氯磺化需要用过量的氯磺酸[1],1 mol 的乙酰苯胺至少要用2 mol 的氯磺酸,否则会有磺酸生成。
过量氯磺酸的作用是将磺酸转变为磺酰氯。
反应式: NHCOCH 3+ 2HOSO 2Cl NHCOCH 32Cl+ H 2SO 4 + HCl NHCOCH 32Cl + NH 3NHCOCH 32NH 2+ HCl NH 2SO 2NH 2NHCOCH 32NH 2+ H 2O++ CH 3COOH三、实验步骤1. 对乙酰氨基苯碘酰氯在干燥的100 mL 三口烧瓶中,加入5 g (0.037 mol )干燥的乙酰苯胺,用小火加热熔化[2],瓶壁上若有少量水气凝结,应用干净的滤纸吸去。
边冷却边转动烧瓶使熔化物在瓶壁上凝结成薄层,将烧瓶置于冰水浴中充分冷却后,接上氯化氢吸收装置,迅速加入 13 mL (0.192 mol )氯磺酸。
反应迅速发生,若反应过于激烈,可用冰水浴冷却。
但如果不反应,可将烧瓶温热。
待反应缓和后,轻轻摇动烧瓶使固体全溶,然后再在温水浴中加热10 ~ 15 min 使反应完全,直至无氯化氢气体产生[3]。
将反应瓶在冷水中充分冷却后,于通风橱中在强烈搅拌下,将反应液以细流慢慢倒入盛75 g 碎冰的烧杯中[4],用少量冷水洗涤反应瓶,洗涤液倒入烧杯中。
搅拌数分钟,并尽量将大块固体粉碎[5],使之成为颗粒小而均匀的白色固体。
抽滤收集,用少量冷水洗涤,压干,立即进行下一步反应。
2.对乙酰氨基苯磺酰胺将上述粗产物移入四口圆底烧杯中,装配好吸收装置,在不断搅拌中慢慢加入18mL (0.457mol)浓氨水,立即发生放热反应并产生白色糊状物。
对氨基苯磺酰胺(磺胺)的合成一、实验目的1, 了解氯磺化反应的原理及操作方法。
2, 了解氨基的保护与原理。
二,实验原理磺胺是磺胺药物的最基本结构,也是药性的基本结构。
磺胺类药物是指具有 对氨基苯磺酰胺结构的一类药物的总称,是一类用于预防和治疗细菌感染性疾病 的化学治疗药物。
磺胺药物种类可达数千种,其中应用较广并具有一定疗效的就 有几十种。
磺胺药是现代医学中常用的一类抗菌消炎药,其品种繁多,已成为 一个庞大的家族了。
可是,最早的磺胺却是染料中的一员。
在某次偶然的机会, 人们发现这种红色的染料对细菌具有很强的抑制作用,从而将它应用于药物,并 在二十世纪上特别是一次与二次世界大战期间乃至到现在依然是一种应用非常 广泛的抗菌药物。
磺胺(对氨基苯磺酰胺)的合成步骤有如下:路线一:苯胺法 2)HCO q 3 路线二:氯苯法[1]路线三:二苯脲法⑵NHCOCH 3 NHCOCH 3 NHCOCH 3 N H 2ClSO_H -3 NH3 1)H 3OSO 2Cl SO 2NH 2 SO 2NH 2Cl Cl ClSO 3 HSO 3Cl *SO 3H SO 2ClNH 4OH NH 4OHCu 2ONH 2SO 2NH 2SO 2NH 2本实验将采用路线一。
三、 实验药品与仪器:药品:5g 乙酰苯胺,氯磺酸,浓氨水,浓盐酸,碳酸钠。
仪器:锥形瓶,抽滤瓶,烧瓶,布氏漏斗。
四、 实验步骤:将5克干燥的乙酰苯胺将入到干燥的250ml 锥形瓶中,用温火加热溶解乙酰苯胺,搅拌油状物以让溶解物附在锥形瓶底部。
冰浴冷却锥形瓶使油状物固化, 一次性迅速加入10ml 氯磺酸(密度1.77g/ml )。
然后连接预先配置好的氢氧化 钠溶液收集氯化氢气体。
将锥形瓶从冰浴中取出进行搅拌,氯化氢气体剧烈的释放出来,如果反应太 过剧烈,可放冷水中进行冷却。
当反应变缓后,可轻轻摇晃使固体全部溶解。
待 固体全部溶解后,用蒸气浴加热锥形瓶10min 至不在产生氯化氢气体为止,这过 程中必须进行尾气处理。
毕业论文实验方案
实验原料,中间产物,目标产物的物理化学性质:
苯胺:无色油状液体。
熔点-6.3℃,沸点184℃,相对密度1.02 (20/4℃),相对分子量93.128,加热至370℃分解。
稍溶于水,易溶于乙醇、乙醚等有机溶剂。
暴露于空气中或日光下变为棕色。
醋酸酐:无色透明液体。
有强烈的乙酸气味。
味酸。
有吸湿性。
折光率极高。
溶于氯仿和乙醚,缓慢地溶于水形成乙酸。
与乙醇作用形成乙酸乙酯。
相对密度 1.080。
熔点-73℃。
沸点139℃。
折光率1.3904。
闪点54℃。
自燃点400℃。
低毒,半数致死量(大鼠,经口)1780mG/kG。
易燃。
有腐蚀性。
勿接触皮肤或眼睛,以防引起损伤。
有催泪性。
结晶醋酸钠:无色透明结晶或白色颗粒。
在干燥空气中风化,相对密度1.45,熔点58℃。
溶于水,水溶液呈碱性;微溶于乙醇。
浓盐酸:盐酸为无色液体,在空气中冒白雾(由于盐酸有强挥发性,与水蒸气结合形成小液滴),有刺鼻酸味。
粗盐酸或工业盐酸因含杂质氯化铁而带黄色。
乙酰苯胺:乙酰苯胺,学名N-苯(基)乙酰胺,白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
氯磺酸:氯磺酸(化学式:ClSO2OH)是一种无色或淡黄色的液体,具有辛辣气味,在空气中发烟,是硫酸的一个-OH 基团被氯取代后形成的化合物。
分子为四面体构型,取代的基团处于硫酸与硫酰氯之间,有催泪性,主要用于有机化合物的磺化,制取药物、染料、农药、洗涤剂等。
浓氨水:是氨气的水溶液,无色透明且具有刺激性气味。
易挥发,具有部分碱的通性,由氨气通入水中制得,主要用作化肥。
碳酸钠:碳酸钠,俗名苏打、大大苏打、纯碱、洗涤碱,化学式:Na₂CO₃,普通情况下为白色粉末,为强电解质。
密度为2.532g/cm³,熔点为851℃,易溶于水,具有盐的通性。
对乙酰氨基苯磺酰氯:熔点(℃)149,白色至灰色晶体.不溶于水,溶于苯、乙醚、丙酮、氯仿、二氯化乙烯。
对氨基苯磺酰胺(suifanilamide) 的合成(一)—乙酰苯胺的合成
【反应式】
C6H5NH HCl C
6H5NH3Cl32
CH3CO2Na
C6H5NHCOCH3+CH3CO2H NaCl
+
2
【试剂】苯胺5.5 mL(5.6 g,0.06 mol),醋酸酐7.3 mL(7.5 g,0.073 mol),结晶醋酸钠(CH3CO2Na •3H2O)9 g(0.065 mol),浓盐酸5 mL。
【步骤】在500 mL烧杯中,先加入120 mL水、5 mL浓盐酸,然后在搅拌下加入5.6 g(5.5 mL)苯胺,待苯胺溶解后,再加入少量活性炭(约1 g),把溶液煮沸5 min 左右,停止加热,趁热滤去活性炭及其它不溶性杂质。
将滤液转移到400 mL 烧杯中,冷却至50 ℃,加入7.3 mL 醋酸酐,摇振使其溶解后,立即加入事先配制好的9 g 结晶醋酸钠溶于20 mL 水的溶液,充分摇振混合。
然后将混合物置于冰浴中冷却,使其析出结晶。
抽滤,结晶用少量冷水洗涤,压紧,抽干。
经干燥后称量,产量约5~6 g,熔点113~114 ℃。
用此法制备的乙酰苯胺已
足够纯净,可直接用于下一步合成。
如需进一步提纯,可用水进行重结晶。
对氨基苯磺酰胺(suifanilamide) 的合成(二)
【反应式】
【试剂】乙酰苯胺(自制)5g(0.037mol),氯磺酸22.5g(12.5mL,0.19mol),浓氨水(28%,d=0.9)17.5mL,浓盐酸,碳酸钠或碳酸氢钠。
【步骤】
1. 对乙酰氨基苯磺酰氯的制备
在100mL干燥的锥形瓶中,加入5g干燥的乙酰苯胺,在石棉网上小火加热使之熔化。
瓶壁上若有少量水蒸气凝结,用干净滤纸吸去。
取下锥形瓶放在冰浴中冷却,乙酰苯胺在瓶底上结成一薄层。
迅速倒入12.5mL氯磺酸,立即塞上带有氯化氢导气管的塞子(见图)。
反应很快发生,注意防止倒吸。
若反应过于剧烈,可用水浴冷却。
待反应缓和后,微微摇动锥形瓶以使固体全部反应,然后于温水浴上加热至不再有氯化氢气体产生为止。
冷却后于通风橱中充分搅拌下,将反应液慢慢倒入盛有75mL 冰水的烧杯中,用约10mL 冷水洗涤锥形瓶。
并入烧杯中搅拌数分钟,并尽量使大块固体粉碎形成颗粒小而均匀的白色固体。
抽滤收集固体,用少量冷水洗,压紧抽干。
立即进行下一步反应。
若制备纯品可进行重结晶。
2. 对乙酰氨基苯磺酰胺的制备
将上述粗产物移入烧杯中,在不断搅拌下慢慢加入17.5mL 浓氨水(在通风橱内),此时立即产生白色稠状固体。
加完后继续充分搅拌15min,使反应完全。
然后加入10mL 水,在
石棉网上用小火加热10min,以除去多余的氨。
如不能完全将氨赶净,可加入微量的盐酸中和。
得到的混合物可直接用于下一步合成。
3. 对氨基苯磺酰胺的制备
将上述反应物放入圆底烧瓶中,加入3.5mL 浓盐酸,在石棉网上用小火加热回流0.5h。
冷却后,应得一几乎澄清的溶液。
若溶液呈黄色,可加少量活性炭脱色,煮沸10min 后过滤,在滤液中慢慢加入固体碳酸氢钠,并不断搅拌,在快接近中性(即固体磺胺还未析出前)时(约3.5~4g),慢慢加饱和碳酸氢钠水溶液直至溶液呈中性,此时有固体磺胺析出。
在冰浴中冷却后,抽滤收集固体,用少量冷水洗涤,压干。
粗产物可用水重结晶(每克产物约需12mL 水),产量3~4g,熔点161~162℃。
纯对氨基苯磺酰胺为白色针状结晶,熔点163~164℃。
【注意事项】
[1]氯磺酸对皮肤和衣服有强烈的腐蚀性,曝露在空气中会冒出大量氯化氢气体,遇水会发生猛烈的放热反应,甚至爆炸,故取用时须加小心。
反应中所用仪器及药品皆需十分干燥。
含有氯磺酸的废液不可倒入水槽,而应倒入指定回收缸内。
工业氯磺酸常呈棕黑色,使用前宜用磨口仪器蒸馏纯化,收集148~150℃的馏分。
[2]氯磺化反应常过分猛烈,难以控制,将乙酰苯胺凝结成块状后再反应,可使反应平稳进行。
[3]在氯磺化过程中,将有大量氯化氢气体放出。
为避免污染室内空气,装置应严密,导气管的末端要与接受器内的水面接近,但不能插入水中,否则会造成倒吸。
[4]加入速度必须缓慢,并要充分搅拌,以免局部过热而使对乙酰氨基苯磺酰氯水解。
这是实验成功的关键。
[5]尽量洗去固体所夹杂和吸附的盐酸。
否则产物在酸性介质中放置过久,会很快水解,因此在洗涤后,应尽量压干,且在1~2 h 内将它转变为磺胺类化合物。
[6]粗制的对氨基苯磺酰氯久置容易分解,甚至干燥后也不可避免。
若制备纯品,可将粗品放人250mL圆底烧瓶内,先加入少许氯仿,加热回流,再逐渐加入氯仿直至固体全部溶解。
然后将溶液迅速移入250mL事先温热的分液漏斗中,分出氯仿层,在冰浴中冷却,即有结晶析出,减压过滤,用少量氯仿洗涤结晶,抽干,称量,熔点149℃。
[7]该反应是由一种固体化合物转变成另一种固体化合物,若搅拌不充分,将会有一些未反应物被产物包在里面。
[8]为了节省时间,这一步的粗产物可不必分出。
若要得到纯品,可在冰水浴中冷却,抽滤,用冰水洗涤,干燥,再用水进行重结晶。
熔点为219~220℃。
[9]对乙酰氨基苯磺酰胺在稀酸中水解成磺胺,后者又与过量的盐酸形成水溶性的盐酸盐,所以水解完成后,反应液冷却时应无晶体析出。
由于水解前溶液中氨的含量不同,加3.5mL 浓盐酸有时不够,因此,在回流至固体全部消失前,应测一下溶液的酸碱性,若不呈酸性,应补加盐酸继续回流一段时间。
[10]中和反应中放出大量二氧化碳气体,故应控制加入速度并不断搅拌。
磺胺是一两性化合物,在过量的碱溶液中也易变成盐类而溶解。
故中和时必须仔细控制碳酸氢钠用量。