吡啶的合成方法
- 格式:doc
- 大小:44.50 KB
- 文档页数:2

吡啶的发展历程
吡啶是一种重要的有机化合物,具有广泛的应用。
以下是吡啶的发展历程。
在19世纪初,吡啶并未被人们广泛认识和应用。
直到1876年,德国化学家沃勒合成了吡啶,并首次确定了其化学结构。
这一发现使得人们对吡啶产生了新的兴趣。
20世纪初,吡啶的合成方法得到了进一步的改进。
德国化学
家斯科夫发现了通过脱氧吡啶酸盐与丙酮进行气相反应制得吡啶的方法,这使得吡啶的合成变得更加高效和简便。
随着合成方法的改进,吡啶的研究也进一步深入。
人们发现吡啶具有许多重要的药理活性,例如抗菌、抗病毒、抗癌等。
这些发现极大地推动了吡啶在药物领域的应用,并成为了研究人员们的热点。
到了20世纪中叶,吡啶已经成为了有机合成和药物化学领域
中的重要骨架。
人们进一步研究和改进了吡啶的合成方法,使其合成变得更加多样化和高效。
随着化学技术的不断发展,吡啶的应用领域也在不断扩大。
如今,吡啶已经成为了农药、染料、橡胶添加剂、防腐剂等领域中不可或缺的重要原料。
总的来说,吡啶经历了从未被人们熟知到逐渐被广泛应用的发展历程。
通过不断的研究和改进,吡啶的合成方法得到了改善,
应用领域也得到了拓宽。
吡啶的发展不仅推动了有机合成和药物化学领域的进步,也为其他领域的发展提供了有力的支持。

4-叔丁基吡啶的合成
合成4-叔丁基吡啶,也称为TBP,可以采用多种方法。
一种常用的方法是在室温下将叔丁醇与吡啶反应,形成中间产物4-叔丁基吡啶硼酸盐,然后将其通过碱催化水解反应转化为最终产物4-叔丁基吡啶。
另外,也可以通过先将吡啶与叔丁基溴反应生成叔丁基吡啶溴盐,然后再将其与锌反应得到4-叔丁基吡啶的方法来制备。
或者可以使用氯化氢催化的方法将4-叔丁基呋喃转化为4-叔丁基吡啶。
在第三种方法中,通过使用亚胺生成反应,叔丁基腈可以与吡啶反应生成4-叔丁基吡啶。
另外,通过氯代叔丁烷与叔丁基过氧化氢的反应也可以生成4-叔丁基吡啶。
这些方法的选择取决于对合成条件、副产物、选择性、反应速度和成本等方面的考虑。
具体的合成方法可以通过多种手段来优化,例如反应温度、反应时间、催化剂的选择等。
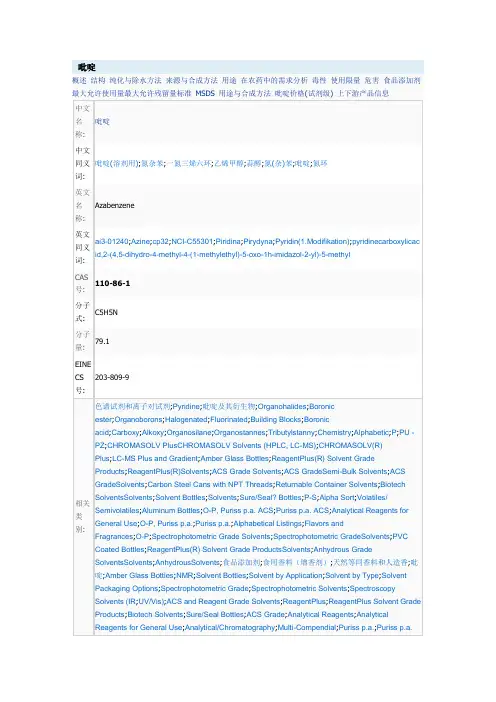
ACS;PVC Coated Bottles;Aluminum Bottles;CHROMASOLV Plus;Chromatography Reagents&;HPLC &;HPLC Plus Grade Solvents (CHROMASOLV);HPLC/UHPLC Solvents(CHROMASOLV);UHPLC Solvents (CHROMASOLV);ACS Grade Solvents;Carbon Steel Cans with NPT Threads;Semi-Bulk Solvents;分析标准品;精细化学品Mol110-86-1.mol文件:吡啶性质熔点-42 °C沸点96-98 °C(lit.)密度0.983 g/mL at 20 °C蒸气密度 2.72 (vs air)蒸气压23.8 mm Hg ( 25 °C)折射率n20/D 1.509(lit.)FEMA 2966闪点68 °F储存条件Store at RT.水溶解性Miscible凝固点-42℃Merck 14,7970BRN 103233稳定性Stable. Flammable. Incompatible with strong oxidizing agents, strong acids.CAS 数据库110-86-1(CAS DataBase Reference)NIST化学物质信息Pyridine(110-86-1)EPA化学物质信息Pyridine(110-86-1)吡啶用途与合成方法概述吡啶(分子式C6H5N)含有一个氮杂原子的六元杂环化合物,即苯分子中的一个-CH=被氮取代而生成的化合物,与苯类似,具有相同的电子结构,仍有芳香性,故又称氮苯和氮杂苯,在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~93℃。

吡啶的化学反应
吡啶(pyridine)是一种含有六个碳原子和一个氮原子的杂环化合物,属于芳香族化合物。
由于其碱性和很好的溶解性,吡啶在有机合成中广泛应用于多种化学反应中。
以下是一些常见的吡啶的化学反应:
1. 氧化反应:
-吡啶可以被常见的氧化剂(如高锰酸钾)氧化为对应的吡啶-N-氧化物。
-艾森鲍姆氧化反应可将吡啶氧化成吡啶-N-氧化物,然后进一步氧化为吡啶-N--二氧化物。
2. 反应中的亲电取代:
-吡啶可以进行酰基化反应,以酰氯或酸酐为亲电试剂,生成吡啶酰化物。
-烷基化反应中,吡啶与烷基卤化物或甲酸酯反应,生成吡啶烷基化物。
3. 反应中的亲核取代:
-脱卤反应:吡啶可以与卤代烷烃反应,生成对应的亲核取代产物。
-羟基化反应:吡啶可以与碱式过氧化氢(如叔丁基过氧化氢)反应,生成相应的吡啶-N-氧化物。
4. 缩合反应:
-吡啶可以与醛、酮等进行亲核加成,发生缩合反应,生成亚胺化合物。
5. 重排反应:
-吡啶可以发生烯丙基重排,生成具有烯丙基结构的产物。
这些只是吡啶的一些常见化学反应,吡啶在有机合成中还有许多其他的应用和反应。
需要根据具体的反应条件和所需目标化合物来选择适当的反应方法。

3-甲基吡啶的合成3-甲基吡啶是一种重要的有机化合物,在医药、农药、染料等领域都有广泛的应用。
下面是3-甲基吡啶的合成方法及反应机理的相关参考内容。
1.氧化碳羰基化合物法合成3-甲基吡啶:这是3-甲基吡啶合成的常用方法之一。
合成步骤如下:1)将肼和醛类或酮类化合物反应,生成肼内酯。
2)将肼内酯与二氧化碳作用,生成以酸性媒介下的吡咯柞酮。
3)用强碱将吡咯柞酮与甲醛反应,生成以酸性脱水媒介下的3-甲基吡啶的中间体。
4)最后,用酸或碱处理,转化中间体为3-甲基吡啶。
2.氨脱羧法合成3-甲基吡啶:这是另一种常用的合成3-甲基吡啶的方法。
合成步骤如下:1)将吡咯柞酮与马来酸酐反应得到马来酰吡咯柞酮。
2)将马来酰吡咯柞酮经氨处理得到3-甲基吡啶。
3.还原胺法合成3-甲基吡啶:这是一种简单高效的3-甲基吡啶合成方法。
合成步骤如下:1)选择合适的醛类和氨基苯甲酸酯,用催化量的铂作为氢化剂,在加热条件下反应得到3-甲基吡啶。
4.氯化亚锡法合成3-甲基吡啶:这是一种通过邻苯二甲酸酯生成3-甲基吡啶的方法。
合成步骤如下:1)将邻苯二甲酸酯与丙烯腈反应,生成丙烯酸邻苯二甲酯。
2)将丙烯酸邻苯二甲酯与氯化亚锡反应得到含有氯化亚锡的3-甲基吡啶环。
3)最后,用盐酸处理得到3-甲基吡啶。
5.合成机理:不同的合成方法涉及的反应机理略有差异。
以氧化碳羰基化合物法为例,其主要反应机理如下:1)肼与醛类或酮类反应生成肼内酯。
2)肼内酯与二氧化碳作用,生成以酸性媒介下的吡咯柞酮。
3)吡咯柞酮与甲醛反应发生加成、缩合和脱水反应,生成3-甲基吡啶的中间体。
4)最后,通过酸或碱处理中间体,将其转化为3-甲基吡啶。
总结:3-甲基吡啶的合成方法主要包括氧化碳羰基化合物法、氨脱羧法、还原胺法和氯化亚锡法等。
不同的合成方法涉及的反应机理各不相同,但都是通过一系列反应步骤将原料转化为3-甲基吡啶。
这些方法为3-甲基吡啶的合成提供了多样化的途径,在不同的应用领域中具有广泛的应用前景。



2-甲基吡啶合成工艺2-甲基吡啶是一种重要的有机合成中间体,在医药、农药、染料等领域有广泛的应用。
本文将介绍2-甲基吡啶的合成工艺,并详细描述其中的步骤和反应条件。
2-甲基吡啶的合成主要分为两步:首先是对乙烯与甲基丙烯酸的缩合反应,得到2-甲基吡啶的前体2-甲基吡啶烯;接着通过催化加氢反应,将2-甲基吡啶烯还原为2-甲基吡啶。
合成步骤如下:1. 2-甲基吡啶烯的制备:将甲基丙烯酸与乙烯按一定摩尔比缩合,反应物经过酸碱催化下的加热反应,首先生成吡啶的衍生物,然后再发生脱水反应生成2-甲基吡啶烯。
反应条件:反应温度:100-130摄氏度反应时间:4-8小时溶剂:甲醇、丁醇等极性溶剂催化剂:过硫酸铵或过硫酸钾pH值: 6-82. 2-甲基吡啶的催化加氢反应:将2-甲基吡啶烯与催化剂和氢气加入催化加氢反应器中,通过加氢反应将2-甲基吡啶烯还原为2-甲基吡啶。
反应条件:反应温度:20-50摄氏度反应时间:8-12小时催化剂:常用的催化剂有铂、钯、镍等金属催化剂氢气气压:1-5MPa在实际合成过程中,需注意以下几点:1. 增加2-甲基吡啶烯的收率:可以通过调节反应温度、催化剂的种类和用量等方法,来提高2-甲基吡啶烯的收率。
2. 催化剂的选择:催化剂的选择对反应的速度和产物的选择性有重要影响。
目前常用的催化剂有贵金属催化剂如铂、钯,它们具有高的活性和选择性。
3. 反应条件的优化:反应温度、反应时间和气压等条件的优化可以显著提高反应效果。
通常情况下,反应温度较低、反应时间较长、氢气气压适中可以得到较高的产率和选择性。
总结起来,2-甲基吡啶的合成工艺包括缩合反应和催化加氢反应两个步骤。
通过调节反应条件、优化催化剂的选择,可以提高产率和选择性,为工业化生产提供了可行的合成路线。
同时,合成工艺的改进和优化也有助于减少废弃物的生成、提高反应的效率,符合可持续发展的要求。
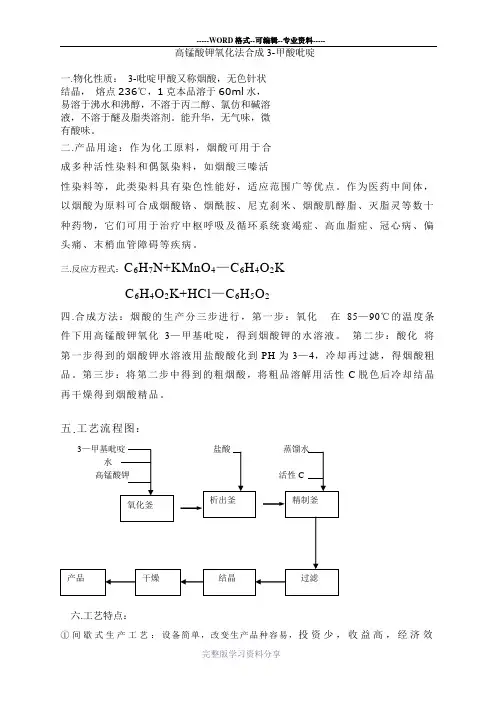
高锰酸钾氧化法合成3-甲酸吡啶一.物化性质:3-吡啶甲酸又称烟酸,无色针状结晶,熔点236℃,1克本品溶于60ml水,易溶于沸水和沸醇,不溶于丙二醇、氯仿和碱溶液,不溶于醚及脂类溶剂。
能升华,无气味,微有酸味。
二.产品用途:作为化工原料,烟酸可用于合成多种活性染料和偶氮染料,如烟酸三嗪活性染料等,此类染料具有染色性能好,适应范围广等优点。
作为医药中间体,以烟酸为原料可合成烟酸铬、烟酰胺、尼克刹米、烟酸肌醇脂、灭脂灵等数十种药物,它们可用于治疗中枢呼吸及循环系统衰竭症、高血脂症、冠心病、偏头痛、末梢血管障碍等疾病。
三.反应方程式:C6H7N+KMnO4—C6H4O2KC6H4O2K+HCl—C6H5O2四.合成方法:烟酸的生产分三步进行,第一步:氧化在85—90℃的温度条件下用高锰酸钾氧化3—甲基吡啶,得到烟酸钾的水溶液。
第二步:酸化将第一步得到的烟酸钾水溶液用盐酸酸化到PH为3—4,冷却再过滤,得烟酸粗品。
第三步:将第二步中得到的粗烟酸,将粗品溶解用活性C脱色后冷却结晶再干燥得到烟酸精品。
五.工艺流程图:六.工艺特点:①间歇式生产工艺:设备简单,改变生产品种容易,投资少,收益高,经济效率好,但原料消耗定额高,能量消耗大,劳动生产率低,产品质量不稳定,适用于品种多,小量生产。
②连续式生产工艺:产生出来的产品质量稳定,原料及能量消耗低,劳动生产率高,因此比较经济,但总投资较大,占地面积较大。
③半连续式生产工艺:与连续操作相比设备费用较少,操作较简单,改变品种较容易,但产品质量不如连续操作稳定;与间歇操作相比,生产规模更大,劳动生产率也更高,用于较大规模的多品种的生产。

3-甲基吡啶的合成
3-甲基吡啶是一种有机化合物,下面是一种合成3-甲基吡啶的常见方法:
合成路线如下:
步骤1: 乙腈与甲醇反应生成甲酸乙酯(甲醇催化)。
步骤2: 甲酸乙酯与甲胺反应生成3-甲基吡啶。
这是一种简化的合成路线,下面是具体的反应方程式:
步骤1:
CH3OH + CH3CN -> CH3COOCH3 + H2O
步骤2:
CH3COOCH3 + CH3NH2 -> CH3C5H4N + CH3OH
请注意,化学合成反应需要在适当的实验条件下进行,并且可能需要特定的试剂和催化剂。
此外,确保在实验室环境下进行实验,并遵循安全操作规程。
如果您打算进行实验,请确保拥有必要的化学知识和实验经验,或在有经验的化学专业人士的指导下进行操作。
1 / 1。

2 -甲基吡啶的制备方法
2-甲基吡啶是一种有机化合物,化学式为C6H7N。
它是一种
常用的有机合成中间体,广泛应用于医药、农药、染料和涂料等领域。
本文将介绍2-甲基吡啶的制备方法。
2-甲基吡啶的制备方法有多种,下面将介绍其中的几种常用方法。
1. 乙酰乙酸甲酯法:
首先,将2-吡啶甲醛与乙酰乙酸甲酯反应,生成2-甲基吡啶
甲醛。
然后,通过还原反应将2-甲基吡啶甲醛转化为2-甲基
吡啶。
2. 乙酸乙酯法:
首先,将2-吡啶甲醛与乙酸乙酯反应,生成2-甲基吡啶甲醇。
然后,通过脱水反应将2-甲基吡啶甲醇转化为2-甲基吡啶。
3. 乙酸法:
首先,将2-吡啶甲醛与乙酸反应,生成2-甲基吡啶甲酸。
然后,通过还原反应将2-甲基吡啶甲酸转化为2-甲基吡啶。
4. 碘化法:
首先,将2-吡啶甲醛与碘反应,生成2-碘代吡啶。
然后,通
过还原反应将2-碘代吡啶转化为2-甲基吡啶。
5. 氨化法:
首先,将2-吡啶甲醛与氨反应,生成2-氨基吡啶。
然后,通
过烷基化反应将2-氨基吡啶转化为2-甲基吡啶。
以上是几种常用的制备方法,不同的方法适用于不同的实际情况。
在实际生产中,可以根据需要选择合适的制备方法。
总结起来,2-甲基吡啶是一种重要的有机合成中间体,在医药、农药、染料和涂料等领域具有广泛的应用。
通过不同的制备方法可以获得2-甲基吡啶,根据实际需要选择合适的制备方法
进行生产。
希望本文对您有所帮助!。
吡啶产品简介一、用途:主要用作医药工业的原料,用作溶剂和酒精变性剂,也用于生产橡胶、油漆、树脂和缓蚀剂等2-氯吡啶2,6-二氯吡啶2-氨基吡啶N,N'-二环己基碳二亚胺吡啶三唑酮硫双灭多威百草枯还原灰M 可溶性还原蓝IBC 盐酸洛美沙星恶丙嗪维生素D2 甲睾酮醋酸氢化可的松氟他胺危险。
二、理化性质中文别称:一氮三烯六环、氮杂苯、氮环、杂氮苯:英文名Pyridine英文别名Pyridine anhydrous; Azabenzene; Pyridin; Pyr分子式C5H5N分子量79.10CAS号110-86-1凝固点:一42℃沸点:115.3℃液体密度(26℃):978kg/m闪点:-20℃自燃点:482.2℃折射率(20℃): 1. 5092爆炸极限:1.8%~12.4%(体积)外观无色微黄色液体,有恶臭含量99.99%熔点115.3℃~116℃在常温常压下吡啶为具有使人恶心的恶臭的无色或微黄色易燃有毒液体。
能溶于水、醇、醚及其它有机溶剂。
其水溶液呈微威性。
遇火种、高温、氧化剂有发生火灾的危险。
与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等反应剧烈,有爆炸的危险。
其蒸气与空气能形成爆炸性混合物。
三、生产方法吡啶可以从炼焦气和焦油内提炼。
汉奇吡啶合成法:这是用两分子的β-羰基化合物,如乙酰乙酸乙酯与一分子乙醛缩合,产物再与一分子的乙酰乙酸乙酯和氨缩合形成二氢吡啶化合物,然后用氧化剂(如亚硝酸)脱氢,再水解失羧即得吡啶衍生物。
主要原料:37%甲醛,乙醛,液氨、丙酮等。
但合成技术上很难突破,被美国等跨国公司垄断全球半个多世纪,我国曾组织专家历经五个五年计划攻关未果。
目前,吡啶国内市场需求很大,目前主要依赖于进口,其吡啶项目生产工艺极其复杂,约有100多道工序。
唐教授:在目前的工业化生产中,催化合成的工艺主要是以甲醛、乙醛和氨气为原料通过缩合反应实现的。
可通过改变原料中醛的种类或反应物的比例来调整产物的种类和产物的量。
史上最全吡啶化学总结以机理学杂环(一)Summarized by CDPYRIDINE吡啶化学:性质、反应与合成参考书目➢Pyridines:from lab to production,ed.Eric F.V.S criven,2013,pp.19-411.➢Modern Heterocyclic Chemistry(4volume set),ed.J ulioAlvarez-Builla,2011,pp.1443-1537.➢Comprehensive Heterocyclic Chemistry,2008,pp.1-306.PYRIDINE2-CDS 1吡啶药物2吡啶的性质3吡啶的反应4吡啶的合成PYRIDINE吡啶药物★1840s Anderson首次发现吡啶;★1877年William Ramsey首次用化学的方法合成了吡啶;★1882年Hantzsch吡啶合成法出现;★1906年Chichibabin吡啶合成法出现;★具独立吡啶结构的天然产物不多见,但吡啶衍生物如喹啉、异喹啉以及氢化吡啶等在天然产物中却大量存在;★具独立吡啶结构的药物广泛存在。
PYRIDINE★2014年全球销售额TOP25的药物中,具吡啶结构的药物有两个,分别为诺华公司的甲磺酸伊马替尼和阿斯利康公司的埃索美拉唑。
PYRIDINEPYRIDINE★10年上市新药PYRIDINEPYRIDINEPYRIDINE9-CDS 吡啶药物★13年上市新药★14年上市新药★15年上市新药(截止到6月份)■吡啶N原子与环上的C原子均以sp2杂化,其轨道相互重叠形成σ键,构成一个平面六元环。
■N原子和C原子均有一个未参与杂化的p轨道,该轨道垂直于环平面,含一个电子,它们侧面重叠形成一个封闭的大π键,π电子数目为6,符合4n+2规则,与苯环类似。
因此,吡啶具有一定的芳香性。
■吡啶N原子sp2杂化轨道上有一对未成键的孤对电子,故具有一定的亲核性和碱性,可与酸、烷化剂、酰化剂以及金属离子等相互作用。
3-氯吡啶的合成
氯吡啶的合成方法有多种,以下是其中一种合成方法:
材料:苯乙醇、吡啶、氯化亚砜、氯化亚锡、三氯化磷、硫酸、水。
步骤:
1. 将苯乙醇(或对应的醛或酮)与吡啶在氯化亚砜的存在下加热反应,生成被保护的胺化合物。
2. 将被保护的胺化合物与氯化亚锡在三氯化磷存在下反应,生成氯代化合物。
3. 将氯代化合物与硫酸反应,生成硫酸盐。
4. 将硫酸盐与水反应,即可生成3-氯吡啶。
需要注意的是,上述合成方法仅为一种示例,实际的合成方法可能会因条件的不同而有所变化。
在进行实验合成时,请按照具体的文献方法进行操作,并注意安全规范。
吡啶氮结构范文吡啶是一种含氮杂环化合物,化学式为C5H5N。
它是一种无色、有特殊气味的液体,在有机合成、药物研究和农业领域具有广泛的应用。
吡啶的结构中有一个六元杂环,杂环上有一个氮原子取代碳原子。
吡啶的杂环中的碳原子与氮原子之间有共轭关系,使得吡啶具有一定的稳定性和活性。
吡啶中的氮原子是一个顺电子供体和π电子受体,使得吡啶具有良好的配体性质。
吡啶还具有一定的碱性,可与酸发生酸碱反应。
这些特性使得吡啶在有机合成和药物研究中得到广泛的应用。
吡啶可以通过多种方法进行合成。
其中最常用的方法是通过氧化剂将饱和脂肪胺氧化为吡啶。
另外,吡啶还可以由乙炔和氨在催化剂的作用下反应生成。
此外,一些光化学和电化学反应也可以用于合成吡啶。
吡啶在有机合成中有多种应用。
首先,吡啶可以作为碱提供氮原子,参与酸碱反应和亲核取代反应。
其次,吡啶具有配位和催化活性,可用于合成金属有机化合物和酸催化反应。
另外,吡啶还可以作为还原剂和氧化剂参与氧化还原反应。
吡啶对碳-碳键的氧化为羧酸提供了一种非常有效的方法。
此外,吡啶也是各种药物中的重要结构基团。
吡啶环具有一定的亲水性和亲脂性,可与靶标蛋白结合,发挥药物效应。
吡啶基团在抗生素、抗癌药物、止痛药物等多种药物中有广泛的应用。
例如,可乐定是一种常用的止痛药物,其分子中含有吡啶环。
另外,一些具有镇痛、镇静和抗抑郁作用的药物中也含有吡啶环。
吡啶还是一种重要的农药中间体。
各种杀虫剂、杀菌剂和除草剂中都含有吡啶结构。
吡啶环具有一定的亲脂性,可以渗透植物表面,进入植物体内,起到保护植物和杀灭害虫的作用。
总之,吡啶是一种重要的含氮杂环化合物,具有广泛的应用。
它在有机合成、药物研究和农业领域发挥着重要的作用。
吡啶的结构特点使其具有较好的化学稳定性和活性,可用于酸碱反应、亲核取代反应、氧化还原反应等。
吡啶还可以作为配体、催化剂和药物等方面的研究对象,为相关研究提供了重要的基础。
吡啶的合成方法
合成
用两分子β-酮酸酯,一分子醛基及氨作原料经多分子环化成吡啶
例如
One-Pot Synthesis of 1,4-Dihydropyridines via a Phenylboronic Acid Catalyzed Hantzsch Three-Component Reaction
Efficient Synthesis of Hantzsch Esters and Polyhydroquinoline Derivatives in Aqueous Micelles
A. Kumar, R. A. Maurya, Synlett, 2008, 883-885.
A. Debache, R. Boulcina, A. Belfaitah, S. Rhouati,
B. Carboni, Synlett, 2008, 509-512.
Yb(OTf)3 catalyzed an efficient, operationally simple and environmentally benign Hantzsch reaction via a four-component coupling reaction of aldehydes, dimedone, ethyl acetoacetate and ammonium acetate at ambient temperature to yield polyhydroquinoline derivatives in excellent yield.
. Wang, J. Sheng, L. Zhang, . Han, . Fan, H. Tian, . Qian, Tetrahedron, 2005, 61, 1539-1543.
2. Krohnke合成法
是利用吡啶叶立德对α,β-不饱和羰基化合物进行共扼加成,先得到1,5—二羰基化合物,然后与氨环合直接得到吡啶衍生物。
这是合成吡啶衍生物的一个好方法,尤其适用于2,4,6—三取代吡啶衍生物的合成。
反应 [4+2]环加成法
该方法实际上是Hetero—Diels—Alder反应。
从理论上讲,可以通过二烯对腈的碳—氯三键进行加成,生成二氢吡啶类化合物,但是,由于腈的活性太弱,所需要的反应条件太苛刻,不易实现。
多数情况下,是采用环状的氮杂二烯体与烯烃或炔烃进行环化加成,再进一步反应,便生成吡啶衍生物。
例如
Catalytic Asymmetric Inverse-Electron-Demand Diels-Alder Reaction of N-Sulfonyl-1-Aza-1,3-Dienes
J. Esquivias, R. G. Arrays, J. C. Carretero, J. Am. Chem. Soc., 2007, 129, 1480-1481.
Imidazolinium salts as catalysts for the aza-Diels-Alder reaction
V. Jurcik, R. Wilhelm, Org. Biomol. Chem., 2005, 3, 239-244
4.吡喃盐的氨解一般能高产率的制得吡啶,但此法的局限性在于能否有合适的吡喃盐。