二氢吡啶合成法
- 格式:docx
- 大小:19.88 KB
- 文档页数:1

一、实验目的1. 熟悉二氢吡啶类化合物的合成方法。
2. 掌握Hantzsch反应在二氢吡啶类心血管药物生产中的应用。
3. 了解合成反应的中间控制方法。
二、实验原理硝苯地平(Nifedipine)是一种钙拮抗剂,具有抗高血压、防治心绞痛等作用。
其化学名称为2,6-二甲基-4-(2-硝基苯基)-1,4-二氢-3,5-吡啶二甲酸二甲酯。
硝苯地平在结构上属于二氢吡啶衍生物,可以通过Hantzsch反应,由2分子酮酸酯和1分子醛、1分子氨缩合成环得到。
三、实验材料与仪器1. 实验材料:- 乙酰乙酸乙酯- 邻硝基苯甲醛- 氨水- 甲醇- 丙酮- 乙酸乙酯- 氯化铵- 氢氧化钠- 铁粉- 碘化钾- 硝酸银- 氯化钠- 氢氧化钠溶液- 碘溶液- 水浴锅- 烧杯- 烧瓶- 蒸发皿- 滴定管- 冷却水- 酸碱滴定液- 显微镜- 紫外可见分光光度计2. 实验仪器:四、实验步骤1. 合成硝苯地平a. 将乙酰乙酸乙酯、邻硝基苯甲醛和氨水按照一定比例混合,置于烧杯中。
b. 将混合液加热至60-70℃,反应2小时。
c. 停止加热,冷却至室温,用饱和食盐水洗涤,去除未反应的原料和副产物。
d. 将洗涤后的混合液转移至蒸发皿中,浓缩至干燥。
e. 将干燥后的固体用甲醇溶解,加入铁粉和碘化钾,搅拌反应2小时。
f. 停止加热,冷却至室温,用饱和食盐水洗涤,去除未反应的原料和副产物。
g. 将洗涤后的混合液转移至烧瓶中,加入硝酸银溶液,反应至沉淀完全。
h. 停止加热,冷却至室温,用饱和食盐水洗涤,去除未反应的原料和副产物。
i. 将洗涤后的混合液转移至蒸发皿中,浓缩至干燥。
j. 将干燥后的固体用甲醇溶解,加入氢氧化钠溶液,搅拌反应2小时。
k. 停止加热,冷却至室温,用饱和食盐水洗涤,去除未反应的原料和副产物。
l. 将洗涤后的混合液转移至烧瓶中,加入乙酸乙酯,搅拌反应2小时。
m. 停止加热,冷却至室温,用饱和食盐水洗涤,去除未反应的原料和副产物。



2-氯吡啶可以通过2-氨基吡啶和氯化亚铜反应来合成。
具体的合成步骤如下:1.准备反应溶剂:在干燥的氮气下,将适量的二甲基亚砜(DMSO)倒入干净的
圆底烧瓶中,然后加入适量的苯和三氯化铜(CuCl3)。
2.合成2-氨基吡啶:将适量的吡啶加入烧瓶中,并加入适量的氨气通过反应溶
液中,保持反应溶液的恒温状态。
3.进行氯化反应:将氯化亚铜加入反应溶液中,进行氯化反应。
4.分离和纯化:通过蒸馏或其他方法将溶剂和未反应的原料从反应液中分离出
来,然后用适当的方法进行纯化,得到2-氯吡啶。

第34卷第2期2021年4月Vol.34No.2Apr.2021投稿网址: 石油化工高等学校学报JOURNAL OF PETROCHEMICAL UNIVERSITIES二氢吡啶酮的不对称催化合成进展贺顺龙1,李飞1,陈运荣2(1.辽宁石油化工大学石油化工学院,辽宁抚顺113001;2.上海科技大学物质科学与技术学院,上海201210)摘要:手性吡啶酮骨架广泛存在于天然产物和具有生理活性的小分子药物中,实现该类手性结构的高效不对称催化合成具有重要的意义。
总结了近年来发展的通过不对称环催化反应合成二氢吡啶酮的研究进展,详细阐述了氮杂⁃D⁃A反应与[3+3]不对称环加成反应的各类催化模式以及它们之间的异同点,分析了各类催化剂的催化原理以及在它们作用下的反应历程,着重介绍了各方法的优势所在,并对该领域的发展进行了展望。
关键词:二氢吡啶酮;不对称催化;氮杂Diels⁃Alder反应;[3+3]环加成中图分类号:O621.25文献标志码:A doi:10.3969/j.issn.1006⁃396X.2021.02.001Progress in Asymmetric Catalytic Synthesis of DihydropyridinonesHe Shunlong1,Li Fei1,Chen Yunrong2(1.School of Petrochemical Engineering,Liaoning Petrochemical University,Fushun Liaoning113001,China;2.School of Physical Science and Technology,Shanghai Tech University,Shanghai201210,China)Abstract:Chiral pyridinone scaffolds widely exist in natural products and biologically active small molecules.Therefore, asymmetric catalytic synthesis with higher efficiency of these chiral compounds is of great importance,which has got significant improvement in this field recently.We reviewed the recent progress of asymmetric synthesis of dihydropyridinones through asymmetric cycloaddition reactions,compared the common points and differences between Aza⁃Diels⁃Alder reactions and[3+3] cycloadditions.The detailed catalytic mechanisms and advantages of these reactions were discussed,and the tendency of future development was also prospected.Keywords:Dihydropyridinones;Asymmetric catalysis;Aza⁃Diels⁃Alder reaction;[3+3]Cycloaddition吡啶酮结构[1]广泛地存在于天然产物分子[2]和具有生理活性的药物分子中[3⁃5]。

二氢吡啶在有机合成中的应用二氢吡啶(pyrrolidine)是一种含有五元杂环的有机化合物,其化学结构中包含一个相对较稳定的四元杂环以及一个氨基。
由于其独特的结构和化学性质,二氢吡啶在有机合成中有着广泛的应用。
首先,二氢吡啶可以作为催化剂参与各种有机反应。
例如,二氢吡啶可以与酸酐反应生成催化剂,用于酯的合成。
其催化作用主要是通过二氢吡啶与酸酐生成酸酐盐的中间体,并与反应底物之间发生缩合反应,促进酯的形成。
这种催化剂具有高效、可重复使用的特点,被广泛应用于药物和有机合成领域。
其次,二氢吡啶还可以作为碱参与有机反应。
由于其氮原子上的孤对电子,二氢吡啶具有碱性。
在一些有机反应中,可以使用二氢吡啶作为中性碱来中和或吸收生成的酸性物质。
例如,当有机合成过程中生成酸性中间体或有酸性条件时,可以加入二氢吡啶来中和酸性物质,以保护反应底物或中间体。
此外,二氢吡啶还可以在氢氧化钠存在的条件下,与醛或酮反应生成一种称为aldol缩合的产物。
这种反应可以提供重要的C-C键连接,是合成复杂有机分子的重要步骤。
另外,二氢吡啶还可以作为溶剂在有机合成中使用。
二氢吡啶在室温下为无色液体,可溶于水和大多数有机溶剂。
由于其较低的极性和较高的沸点,二氢吡啶可以作为非极性溶剂使用,并与一些有机化合物形成溶液。
在一些特定的有机反应中,需要在低温环境下进行反应,此时可以将反应底物溶解于二氢吡啶中,以保持反应底物的溶解度并提供合适的反应环境。
此外,二氢吡啶还可以直接参与有机合成反应,形成新的化学键。
例如,二氢吡啶可以与醛或酮发生缩合反应,生成二氢吡啶衍生物。
这种反应可以通过选择性地加入不同的取代基或通过选择不同的反应条件,实现对目标产物的选择性合成。
总之,二氢吡啶在有机合成中具有广泛的应用。
其作为催化剂、碱、溶剂以及直接参与反应产生新化学键的能力,使其成为有机化学家们广泛使用的化合物。
通过进一步研究二氢吡啶的性质和应用,可以进一步拓展其在有机合成领域的应用,为合成更复杂的有机分子提供有力的工具。

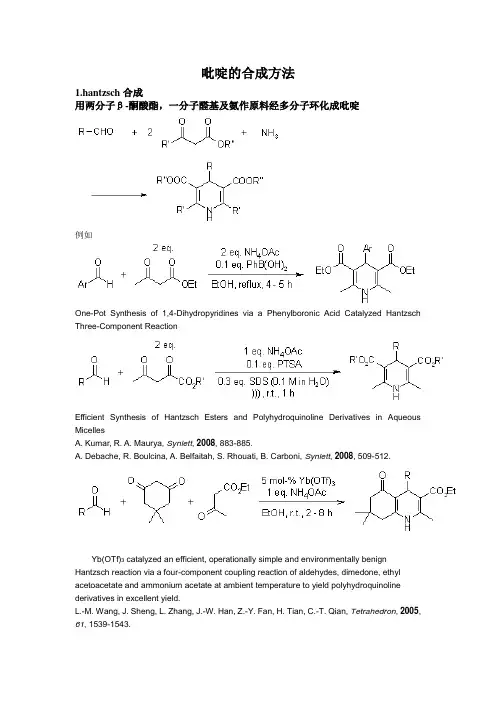
吡啶的合成方法1.hantzsch合成用两分子β-酮酸酯,一分子醛基及氨作原料经多分子环化成吡啶例如One-Pot Synthesis of 1,4-Dihydropyridines via a Phenylboronic Acid Catalyzed Hantzsch Three-Component ReactionEfficient Synthesis of Hantzsch Esters and Polyhydroquinoline Derivatives in Aqueous MicellesA. Kumar, R. A. Maurya, Synlett, 2008, 883-885.A. Debache, R. Boulcina, A. Belfaitah, S. Rhouati,B. Carboni, Synlett, 2008, 509-512.Yb(OTf)3 catalyzed an efficient, operationally simple and environmentally benign Hantzsch reaction via a four-component coupling reaction of aldehydes, dimedone, ethyl acetoacetate and ammonium acetate at ambient temperature to yield polyhydroquinoline derivatives in excellent yield.L.-M. Wang, J. Sheng, L. Zhang, J.-W. Han, Z.-Y. Fan, H. Tian, C.-T. Qian, Tetrahedron, 2005, 61, 1539-1543.2. Krohnke合成法是利用吡啶叶立德对α,β-不饱和羰基化合物进行共扼加成,先得到1,5—二羰基化合物,然后与氨环合直接得到吡啶衍生物。

2羟基吡啶制备
2羟基吡啶,也称为2-羟基吡啶或2-pyridone,是一种重要的有
机化合物,在医药、农药和染料工业等领域有广泛的应用。
下面将介
绍2羟基吡啶的制备方法。
首先,2羟基吡啶可以通过吡啶的催化加氢反应得到。
在反应中,吡啶与氢气在催化剂的存在下发生加氢反应,生成2羟基吡啶。
这种
方法制备高纯度的2羟基吡啶,且反应条件温和,反应物易得,具有
简单、高效的特点。
其次,2羟基吡啶的制备也可以通过吡啶与酮类化合物的缩合反应得到。
在反应中,吡啶与酮类化合物在酸催化剂的作用下发生缩合反应,生成2羟基吡啶。
这种方法对于某些特定结构的2羟基吡啶合成
较为有利,但反应条件较为严苛,需要高温和较长的反应时间。
最后,2羟基吡啶还可以通过吡啶的氧化反应制备而得。
在反应中,吡啶在氧气的氧化下,发生脱氢反应,生成2羟基吡啶。
这种方法具
有简单、环境友好的特点,但需要较高的氧化剂浓度和反应温度较高。
综上所述,2羟基吡啶的制备方法主要有催化加氢反应、酮类缩合反应和吡啶氧化反应。
根据实际需要和具体反应条件的要求,选择合
适的制备方法进行研究和应用。
在制备过程中,应严格控制反应条件,提高反应产率和纯度,同时进行产品的分离和纯化,以保证2羟基吡
啶的质量和应用效果。

2,3-二氯吡啶的合成
2,3-二氯吡啶的合成可以通过以下步骤进行:
1.将吡啶溶解在无水氯化亚铁中,加热至反应温度。
2.将亚硝基氯化钠溶解在氨水中,然后将其加入到上一步骤中
的反应体系中。
3.加热反应混合物,使其保持沸腾状态。
4.通过水洗和中和,将反应混合物中的多余试剂和产生的中间
体去除。
5.用有机溶剂提取,去除产生的杂质。
6.用无水氯化铵处理,然后进行滤液浓缩。
7.将浓缩液进行结晶,得到目标产物2,3-二氯吡啶。
需要注意的是,以上步骤仅为一种常见的合成方法,实际操作中可能会根据实验条件和反应物的特性有所差异。
此外,在操作过程中要注意安全和环保,严格遵守化学实验室的操作规范。