免疫治疗 checkmate 032
- 格式:ppt
- 大小:2.19 MB
- 文档页数:19

EGFR基因突变阳性晚期非小细胞肺癌患者的免疫治疗策略杨路; 王燕【期刊名称】《《癌症进展》》【年(卷),期】2019(017)020【总页数】5页(P2364-2368)【关键词】EGFR突变; 晚期非小细胞肺癌; 免疫治疗【作者】杨路; 王燕【作者单位】国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科北京 1000210【正文语种】中文【中图分类】R734.2近年来,非小细胞肺癌(non-small cell lung cancer,NSCLC)进入了分子靶向精准治疗时代。
据报道,表皮生长因子受体(epidermal grow th factor receptor,EGFR)基因突变在白种人中的发生率约为15%[1],在亚洲人群中的发生率为40.3%~64.5%[2-3]。
EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)可以直接作用于EGFR基因并抑制肿瘤的发展。
多项Ⅲ期临床研究已经证实,与传统的含铂双药联合化疗相比,无论是一代EGFR-TK(I吉非替尼、厄洛替尼、埃克替尼)、二代EGFR-TK(I阿法替尼、达克替尼)还是三代EGFRTK(I奥希替尼),均可以明显提高EGFR突变的晚期NSCLC患者的客观缓解率(objective response rate,ORR),并明显延长患者的无进展生存期(progression-free survival,PFS)[4-9]。
但是接受靶向药物治疗的晚期NSCLC患者会不可避免地出现耐药情况,其中约50%的患者会出现EGFRT790M突变[10]。
对于一代/二代EGFR-TKI治疗后未出现EGFR T790M突变的晚期NSCLC患者以及三代EGFR-TKI治疗耐药后的晚期NSCLC患者而言,治疗方法是有限的,传统的化疗占据主要地位。
因而,EGFR突变的晚期NSCLC患者耐药后的治疗策略已成为目前临床医师面临的重要难题和巨大挑战。


!M"!经肝动脉化疗栓塞术联合靶向/免疫治疗在中晚期肝细胞癌中的应用进展赵晓辉,姚全军,黎海亮,胡鸿涛郑州大学附属肿瘤医院(河南省肿瘤医院)微创介入科,郑州450008摘要:我国肝细胞癌患者发现时多为中晚期,其治疗方法主要包括经肝动脉化疗栓塞术(TACE)和系统治疗。
本文介绍了从索拉非尼、仑伐替尼为代表的靶向药物,再到免疫治疗的异军突起———阿替利珠单抗联合贝伐珠单抗获批一线治疗方案,同时TACE联合靶向和/或免疫治疗的研究也在进行中,取得了较好的疗效,这些都为中晚期肝癌患者带来了更好的生存预后。
但是,想要真正改变中晚期肝癌预后的问题,仍需要在此基础上进行更多的探索与研究。
关键词:癌,肝细胞;靶向治疗;免疫疗法;化学栓塞,治疗性基金项目:河南省自然科学基金面上项目(212300410403);2022年度河南省人力资源和社会保障厅留学人员科研择优资助项目;河南省医学教育研究项目(Wjlx2021334)Advancesinapplicationoftransarterialchemoembolizationcombinedwithtargetedtherapy/immunotherapyinad vancedhepatocellularcarcinomaZHAOXiaohui,YAOQuanjun,LIHailiang,HUHongtao.(DepartmentofMinimallyInvasiveIntervention,TheAffiliatedCancerHospitalofZhengzhouUniversity&CancerHospitalofHenanProvince,Zhengzhou450008,China)Correspondingauthor:HUHongtao,huhongtaogy@163.com(ORCID:0000-0002-5432-4014)Abstract:Mostofthepatientswithhepatocellularcarcinoma(HCC)inChinaareintheadvancedstageatthetimeofdiagnosis,andthetreatmentmethodsforHCCmainlyincludetransarterialchemoembolizationandsystemictherapy.Thisarticleintroducesthetargeteddrugsrepresentedbysorafenibandlenvatinib,andtheemergenceofimmunotherapy.Atezolizumabcombinedwithbevacizumabhasbeenapprovedasthefirst-linetherapyforHCC,andmeanwhile,studiesonTACEcombinedwithtargetedtherapyand/orimmunotherapyhaveachievedasatisfactorytreatmentoutcome,whichbringsbettersurvivalandprognosisforpatientswithadvancedHCC.However,morestudiesareneededtosolvetheissuesrelatedtotheprognosisofadvancedHCC.Keywords:Carcinoma,Hepatocellular;TargetedTherapy;Immunotherapy;Chemoembolization,TherapeuticResearchfunding:HenanProvincialNaturalScienceFoundationGeneralProject(212300410403);2022HenanProvincialDepartmentofHumanResourcesandSocialSecurityResearchScholarshipforOverseasStudents;HenanProvincialMedicalEducationResearchProject(Wjlx2021334)DOI:10.3969/j.issn.1001-5256.2022.12.033收稿日期:2022-04-11;录用日期:2022-06-15通信作者:胡鸿涛,huhongtaogy@163.com 从2007年索拉非尼获批作为肝细胞癌(HCC)一线系统治疗药物[1-2],到2013年FOLFOX4化疗方案取得了较高水平的循证医学证据,肝癌的系统治疗取得了一定的进步,但患者的生存获益仍不理想,总生存期(OS)仅6.47个月[3]。

肺癌免疫治疗进入2.0时代了吗陆舜;晋悦萍【摘要】肺癌作为世界范围病死率最高的恶性肿瘤,除放疗、化疗及靶向治疗外,免疫治疗如今也占一席地位,成为不容忽视的治疗策略.随着更多临床和基础研究发表,新免疫时代的到来势不可挡.文章从免疫检查点抑制剂、精准筛选人群与耐药机制探索等方面进行介绍.%American Society of Clinical Oncology has named immunotherapy 2.0 as the advance of this year recently .This se-lection is based on the recognition of the amazing progress achieved by the immunotherapy agents .Lung cancer is the leading cause of cancer death worldwide .Immunotherapy , along with traditional treatment strategies such as chemotherapy , radiation therapy and targe-ted therapy , provides patients of lung cancer with more possibilities .The new era of immunotherapy seems irresistible .【期刊名称】《医学研究生学报》【年(卷),期】2017(030)011【总页数】4页(P1128-1131)【关键词】肺癌;免疫治疗;精准医学【作者】陆舜;晋悦萍【作者单位】200030 上海,上海交通大学附属胸科医院肿瘤科;200030 上海,上海交通大学附属胸科医院肿瘤科【正文语种】中文【中图分类】R734.2人类对肿瘤免疫系统的研究已逾百年。

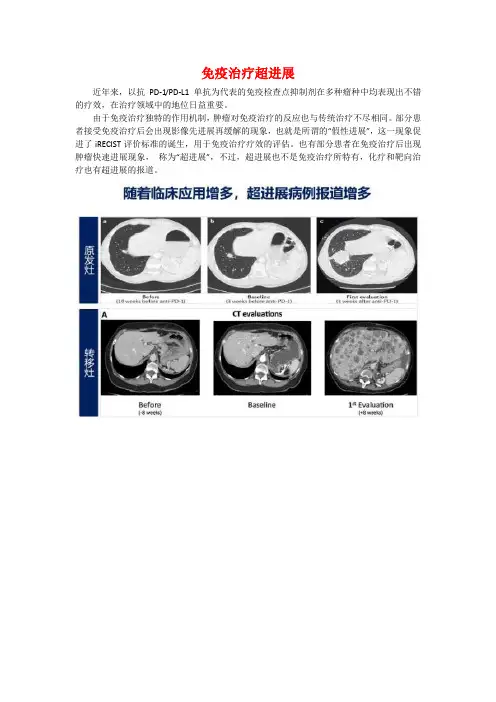
免疫治疗超进展近年来,以抗PD-1/PD-L1单抗为代表的免疫检查点抑制剂在多种瘤种中均表现出不错的疗效,在治疗领域中的地位日益重要。
由于免疫治疗独特的作用机制,肿瘤对免疫治疗的反应也与传统治疗不尽相同。
部分患者接受免疫治疗后会出现影像先进展再缓解的现象,也就是所谓的“假性进展”,这一现象促进了iRECIST评价标准的诞生,用于免疫治疗疗效的评估。
也有部分患者在免疫治疗后出现肿瘤快速进展现象,称为“超进展”,不过,超进展也不是免疫治疗所特有,化疗和靶向治疗也有超进展的报道。
超进展的定义在2016年欧洲肿瘤内科学会年会(ESMO)会议上,免疫超进展的研究首次被报道,当时一份不太显眼的壁报提出“Paradoxical progressive disease”(PPD)这一概念,并使用肿瘤生长速率(TGR)>50%来定义PPD,TGR则主要通过免疫治疗前后CT扫描测量的肿瘤大小改变,以及发生这些变化所用时间来进行计算。
随后古斯塔夫·鲁西研究院的Champiat团队明确提出了超进展(HPD)这一概念,在这之后,很多学者都对超进展现象进行了报道,并将其定义进行补充和完善。
目前,比较全面的超进展定义如下,在免疫治疗后肿瘤进展满足以下三个条件:①在免疫治疗中,肿瘤进展时间小于两个月;②肿瘤负荷相比于基线期增长超过50%;③免疫治疗后肿瘤生长速度超过之前速度2倍以上。
超进展的发生率及预后超进展的发生率在不同的肿瘤类型及不同报道中有较大差异,目前报道在4%~29%之间,该差异除了与瘤种有关,可能还与研究中超进展的定义不同有关。
非小细胞肺癌(NSCLC)免疫治疗超进展发生率最大样本量的研究,来自古斯塔夫·鲁西研究院的Ferrara团队,该团队回顾分析了法国8家中心的406例免疫治疗患者,发现NSCLC患者免疫治疗超进展的发生率为14%(56/406),是化疗组患者超进展发生率的3倍(5%,3/59)。

浅谈肿瘤的免疫治疗肿瘤的免疫治疗目前主要有两大类,主动免疫治疗和被动(或者获得性)免疫治疗。
被动免疫治疗最火的就是当年魏则西事件中的主角免疫细胞治疗,现阶段最火的应该是CAR-T治疗,这方面不是我今天重点要介绍的。
今日我们主要介绍的是主动免疫,目前主要使用的包括三大类,细胞因子类,肿瘤疫苗以及免疫调节制剂,细胞因子类在肾癌等肿瘤中已有广泛应用,比较成熟,但疗效一般;肿瘤疫苗一直是研究的热点,目前无大样本的研究证据,但前景可观;免疫调节剂是我们今天讲解的重点,如PD-1抑制剂、PD-L1抑制剂、CTLA-4抑制剂等。
肿瘤主动免疫治疗的明星药物毫无疑问就是我们俗称的“K”药和“O”药了,2017年被《Science》杂志评选为十大突破性研究进展之一。
2018年6月15日,中国食品药品监督管理总局(CFDA)正式批准PD-1抗体纳武利尤单抗注射液(商品名欧狄沃,英文名Opdivo,俗称O药)上市,标志着我国肿瘤治疗真正进入了“免疫”时代。
2018年10月1日诺贝尔医学奖的揭晓,让免疫治疗进入炙热时代。
那如何预测疗效、选择适宜患者人群是当前的主要问题。
2018年诺贝尔医学奖得主(TasuKu 首先鉴定PD-1为活化T淋巴细胞上的诱导型基因)PD-1抑制剂同既往其他肿瘤治疗措施一样具有局限性,在未经选择的实体瘤患者中有效率只有20%-30%,那如何将这部分幸运儿尽可能地挑选出来,目前主要的办法有以下四种:1.PD-L1表达:通过免疫组化的方法检测肿瘤组织(通常是手术标本或者肿瘤穿刺标本)中PD-L1表达,PD-L1表达越高,有效率越高。
PD-L1表达检测在肺腺癌、恶性黑色素瘤等肿瘤患者中格外有用。
比如在Keynote042 研究中,一项III期多中心临床研究中显示NSCLC一线使用K药对比一线化疗,结果显示:在PD-L1表达>1%时,K药组中位生存16.7个月(对照组12.1个月);PD-L1>20%时,K药组中位生存17.7个月(对照组13个月);当PDL-1>50%时,K药组中位生存20个月(对照组12.2个月)也就是随着PD-L1表达水平的升高,患者获益越多,其生存显著延长。

2024非小细胞肺癌围手术期免疫治疗摘要随着非小细胞肺癌(non-sma11ce111ungcancer,NSC1C)围手术期免疫治疗时代的到来,胸外科的麻醉管理面临新的机会和挑战。
不同麻醉方式和药物的选择会影响免疫功能和肿瘤生长转移,以免疫检查点抑制剂为代表的免疫治疗能够激活抗肿瘤免疫,影响局部和系统性免疫。
麻醉和免疫治疗可能会产生不可预知的交互作用。
本文将对麻醉方式和药物以及免疫治疗对NSC1C免疫状态和预后的影响进行综述,以期为NSC1C围手术期免疫治疗患者的麻醉管理提供新的思路。
近年来,以程序性死亡受体-1(programmedce11death-1,PD-1)/程序性死亡配体-1(programmedce11death-1igand1,PD-11)免疫检查点抑制剂为代表的免疫治疗在早中晚期非小细胞肺癌(non-sma11ce111ungcancer,NSC1C)患者中均取得了成效,开启了NSC1C围手术期免疫治疗的新时代口]。
PD-1/PD-11抑制剂半衰期长且作用持久,不仅对免疫系统有长期作用,甚至对后续药物的安全性和有效性存在影响。
麻醉方式及药物选择也对肿瘤患者的免疫应答以及肿瘤转移有一定作用。
如何优化NSC1C围手术期免疫治疗患者胸外科的麻醉管理,最大地发挥免疫系统的抗肿瘤作用,而不增加药物的毒性,目前尚不完全清楚。
本文将对麻醉方式和药物、免疫检查点抑制剂对NSC1C免疫状态和预后的影响进行综述。
01、NSC1C围手术期免疫治疗的进展CheckMate816是评估可切除NSC1C新辅助免疫联合化疗的In期临床研究,结果证实对比单纯化疗,纳武利尤单抗(PD-1抗体)联合化疗的新辅助治疗模式可显著提升可切除NSC1C患者的病理完全缓解(patho1ogiccomp1eteresponse,pCR)率(24.0%vs.2.2%)和无事件生存期(event-freesurviva1x EFS)(中位EFS:31.6个月vs.20.8个月)[2]oIMpowerOIO是可切除NSC1C经手术切除、化疗之后辅助免疫治疗的HI期临床研究,结果证实对比最佳支持治疗,术后行阿替利珠单抗(PD-11抗体)辅助治疗可显著改善PD-11≥1%的∏~ΠIA期NSC1e患者的无病生存期(disease-freesurviva1z DFS)(中位DFS:未达到vs.35.5个月)和5年总生存(overa11SUrViVa1,0S)率(5年OS率:84.8%vs.67.5%)[3]β纳武利尤单抗联合化疗用于可切除NSC1C患者的新辅助治疗、阿替利珠单抗用于NSc1C 患者的术后辅助治疗已获得国家药品监督管理局批准。

安罗替尼联合替吉奥胶囊治疗复发性或难治性小细胞肺癌的近期疗效及安全性王微; 王建华; 叶军辉; 吕冬青; 吴小脉; 周苏娜; 姚桂飞; 周超; 杨海华【期刊名称】《《浙江医学》》【年(卷),期】2019(041)023【总页数】4页(P2536-2539)【关键词】复发性; 难治性; 小细胞肺癌; 安罗替尼; 联合治疗【作者】王微; 王建华; 叶军辉; 吕冬青; 吴小脉; 周苏娜; 姚桂飞; 周超; 杨海华【作者单位】317000 浙江省台州医院放疗科; 三门县人民医院呼吸科; 317000 浙江省台州医院呼吸科【正文语种】中文小细胞肺癌(small cell lung cancer,SCLC)约占所有肺癌的15%[1-2]。
它是一种高度侵袭、快速倍增、易在早期广泛转移、恶性程度极高的神经内分泌性癌。
尽管SCLC对初始的放化疗具有较高的敏感性,但多数患者仍会在初始治疗后出现复发和转移。
因此,SCLC的二线及以上的后线治疗十分重要。
但近30年来,SCLC的二线治疗进展缓慢,仍以系统性化疗为主。
拓扑替康是唯一获美国和欧盟批准的用于SCLC二线治疗的药物[3-4],其疗效非常有限,铂类敏感患者的应答率约为25%,铂类耐药或难治性患者的客观缓解率(ORR)不到10%,二线化疗后中位生存时间仅为4~5个月。
因此,研发新的后线治疗药物是复发性或难治性SCLC患者的迫切需求。
近年来在SCLC后线治疗中,已开始对纳武单抗和派姆单抗等免疫检查点PD-L1抑制剂[5]、阿帕替尼等小分子血管生成抑制剂、靶向DLL3的抗体耦联药物Rova-T[6]及RNA聚合酶Ⅱ的抑制剂Lurbinectedin等[7]新型药物进行探索性应用,并取得了一定的应答率,但效果仍不是很理想。
盐酸安罗替尼是我国自主研发的一类口服新型小分子多靶点酪氨酸激酶抑制剂(TKI),能够有效抑制血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)及c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的作用[8]。