日本药局方修订品种
- 格式:doc
- 大小:25.50 KB
- 文档页数:4


浅谈2015年版中国药典的变更1.基本情况:1950年1月卫生部成立第一届国家药典委员会,组成8个专家的小组团队,展开中国药典的编制,亦是我国最早的标准化机构。
第一部<中国药典>1953年版由卫生部编印发行。
至今已组建十屇药典委员会,并经已编制共九版中国药典(英文名称为Pharmacopoeia of The People’s Republic of China; 英文简称为Chinese Pharmacopoeia; 英文缩写为Ch.P.)。
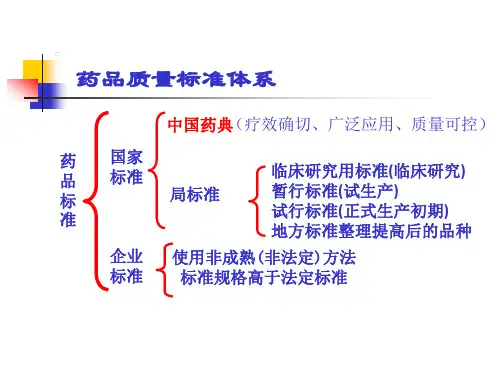
中国药典是为保证药品产量、保障人民群众用药安全、有效、稳定、质量可控的技术法典,亦是药品研究、生产、经营、使用和监管的法定依据。
作为国家药品标准体系的核心及对外的竞争力,药典收载范围遂步扩大,由1953年(第一版)共531品种增加至现有的2010版(第九版)共4567种(包括有中药: 2165种(一部),化学药: 2271种(二部)及生物药制品: 131种(三部)),当中涵盖了中药材、中药饮片、中药饮片、中成药、生物制品、药用辅料、凡例、通则及附录等等。
国家药品标准国家药品标准是由凡例与正文及其引用的附录共同构成。
并且对药典以外的其他国家标准具同等效力。
由此可见,药典是国家对药品监控及为企业建立质量体系的重要手段。
药典的法律地位:依照《药品管理法》规定:药品必须符合国家药品标准。
”“药品必须符合国家药品标准管理部门颁布的药典和药品标准为国家药品标准。
”“国务院药品监国务院药品监督督管理部门颁布的药典和药品标准为国家药品标准2.基本结构:凡例: 为正确使用<中国药典>进行药品质控的基本原则,是对正文、附录及与质量检定有关的共性问题的统一规定。
正文: 各品种项下收载的内容统称正文,是根据药物自身的理化与生物学特性,按照批准的来源、处方、制法、和运输、贮藏等条件所制定的、用以检测药品是否达到用药要求,并衡量其质量是否稳定均一的技术规定。
附录: 主要收载制剂通则、通用检测方法和指引原则。

各国药典更新周期和特点⽐较药典是⼀个国家记载药品标准和规格的法典,⼀般由国家药典委员会编纂、国家药品监督管理机构批准并颁布实施。
⽽国际性药典则由公认的国际组织或者有关国家协商编订。
各个国家或者地区药典更新周期不同,同时也有不同的特点,本⽂对其进⾏⼀个总结和对⽐。
中国药典(CP):⼤家都⽐较熟悉。
/cms/home/发⾏历史和最新版本《中华⼈民共和国药典》(下称《中国药典》) 是中国药典委员会编制完成。
当前更新周期为每五年出版更新⼀次,⽬前最新版本为2015年版中国药典,也是新中国成⽴以来第⼗版药典。
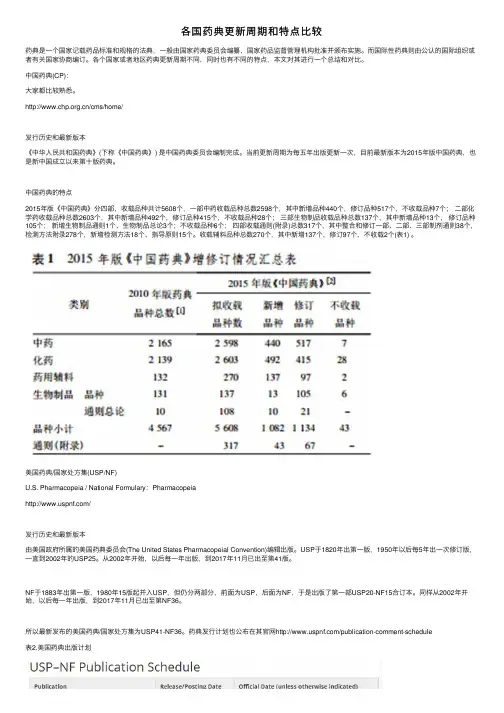
中国药典的特点2015年版《中国药典》分四部,收载品种共计5608个,⼀部中药收载品种总数2598个,其中新增品种440个,修订品种517个,不收载品种7个;⼆部化学药收载品种总数2603个,其中新增品种492个,修订品种415个,不收载品种28个;三部⽣物制品收载品种总数137个,其中新增品种13个,修订品种105个;新增⽣物制品通则1个、⽣物制品总论3个;不收载品种6个;四部收载通则(附录)总数317个,其中整合和修订⼀部、⼆部、三部制剂通则38个,检测⽅法附录278个,新增检测⽅法18个、指导原则15个。
收载辅料品种总数270个,其中新增137个,修订97个,不收载2个(表1) 。
美国药典/国家处⽅集(USP/NF)U.S. Pharmacopeia / National Formulary:Pharmacopeia/发⾏历史和最新版本由美国政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。
USP于1820年出第⼀版,1950年以后每5年出⼀次修订版,⼀直到2002年的USP25。
从2002年开始,以后每⼀年出版,到2017年11⽉已出⾄第41版。
NF于1883年出第⼀版,1980年15版起并⼊USP,但仍分两部分,前⾯为USP,后⾯为NF,于是出版了第⼀部USP20-NF15合订本。


2020年日本《种苗法》部分修正的概述2020年日本政府对1998年版《种苗法》(平成十年法律第83号)进行修正,同年12月9日颁布了新版《种苗法》(令和2年法律第74号,以下简称“修正法”),并于2021年4月1日起施行(其中,自家繁殖等相关规定,延后至2022年4月1日施行)。
一、日本部分修正《种苗法》的原因目前日本有效登记品种已达9000个左右,构成了日本农产品在海外市场的品牌优势和竞争力。
近年来,日本不断有注册品种违规流向海外,在当地繁殖且产地化,并向第三国出口,影响了日本农业发展和农产品海外市场的拓展。
例如,日本国立研究开发法人农业·食品产业技术综合研究机构(以下简称“农研机构”)培育的闪耀玫瑰香葡萄(日文名:シャインマスカットブドウ;英文名:Shine Masscut grape)种苗流失到中国和韩国,然后在东南亚等地以“阳光玫瑰”“阳光パラ”“香印翡翠”等品名销售;草莓、樱桃等也有类似情况发生。
2020年日本农林水产省辅助事业调查中发现,在中国和韩国的网上销售的种苗中,有36个品种与日本在登记的品种名称相同,虽然不确定是否是真货,但可扰乱国际市场对日本品种的评价,造成日本农产品出口企业潜在客户的丧失,损失不可估量[1-4]。
日方据此认为,宽松的品种知识产权管理会挫伤日本农研机构、种苗业界培育新品种的积极性和农民的出口欲望。
农作物由于立地条件和栽培技术等原因,有可能致使品种的特性不能充分表现出来,导致收获物的质量受到很大的影响。
在日本国内,如果主要农作物和果树品种流出到与品种权人意向相左的都道府县地区栽培,一旦产品达不到品种权人要求的品质而上市,不仅会导致注册品种的评价下降,还会妨碍各地战略性的地域品牌化的确立,从而影响农民的积极性。
同时,为了保护日本优良品种持有者的权利,要在海外证明侵权的事实,需要与品种登记时的种苗进行比较栽培试验等,过程复杂,困难不少,往往取证难以成功。


日本药局方(12版)简介奉辐白,鹌药典之页?一f占日本药局方(12版)简介黑龙江省药品检验所(哈尔滨150001)型:三苎靛f.;J3 El本药局方(12版)已于1991年4月1El公布施行;本版对凡例,收载品种,般检查法,生药及生药制剂规格等作了修订现将修订的主要内容介绍如下.1凡例凡例中,增加了第19和2l两项第19项是关于检验数据的处理?第21项是关于检验操作”立即”含义的解释”立即”是指在前一个实验操作完了后,下一个操作应在3Os内进行的意思.在本版中,将原凡例的20项改为22项;37项改为39项.修改了第2,3,j,6,7项.第2项药品名鞯的规定:药品名称应按药品各条所载的El文名或别名.但制剂总则中的散剂项下将散称作细粒.第3项药品合格与否的判定:药品合格与吾应按药品各条及凡例,生药总则,一般检查法的有关规定进行判定.性状项下的晶形,溶液的酸碱性,稳定性,吸收度,凝点,折光率,旋光度,牯度,相对密度,沸点,熔点及生药的含有量等只供参考不作合格与否的判定依据.第5项原子量采用1989年最新原子量表.第6项增加计量单位g,pg, OSYI],r/lOSl~l及内毒素EU;第7项增加表示重量对重量的百万分率ppm删去了原11舨凡例第38项关于药品极量的规定.2收载品种本版共收载1221个品种.其中一部收载750个品种(含新品种170个),二部收载471个品种.继续收载的原l1版品种一部是580个-二部是471个删去的品种一部是3个,二部是9个(附表).新收载的品种中,有机原料药117种.有机制剂26种,抗生紊25种,放射性药2种.2l新收载的有机原料药的品名氮乙酸二羟铝,异山梨醇,雌三醇,利尿酸,酚抻宁,腾喜龙,盐酸金刚烷胺,盐酸精氨酸,心得舒,盐酸异丙肾上腺素,盐酸心得平,盐酸喹诺酮心安,盐酸可乐定,盐酸环戊醇胺酯,盐酸地芬多尼,盐酸地拉齐普克雹革,盐酸羟哌噻唑酮,盐酸多拉普I仑,盐酸抗酞嗪, 盐酸多巴胺,盐酸三甲双酮,盐酸去甲替林,盐酸安太乐,盐酸比哌立登,盐酸布库洛尔,盐酸布非洛尔,盐酸1994年3月第29卷甭3附表收载品种舟类表收载品种类别一部二部无机药品有机药品制剂药品生药植物与动物药抗生素生物制剂放射性药卫生材料总计布拉洛尔,盐酸氟胺安定,盐酸舒心通,盐酸丙卡巴肼, 盐酸甲氯酚酯,肾上腺素色素缩氨脲磺酸钠,氮基甲陵氯甘油醚,坎利酸钾,枸橼酸芬太尼,枸橼酸维静宁,优降糖,氯硝安定,酮布洛芬,醋酸氯地孕酮,酰胺,环扁桃酯,双氯灭酸钠,二氯苯磺胺,安太布星,达舒平,阿糖胞苷,6一去氢逆孕酮,前列腺素Fsj0,潘生丁,溴化异丙阿托品,溴化丁基东莨菪碱,酒石酸烯丙左吗哺,硝酸双氯苯咪唑,肉桂嗪,安妥明,硫糖铝,硫噻嗪, 苯磺唑酮,硝基呋海目钠,磺甲硝咪唑,眭哺氟尿嘧啶, 甲磺氮革脲,乐可安,磷酸二氯乙酯钠,发癣退,达哌啶醇,甲氧萘丙酸,烟酸环己醇酯,淮氯苄烷胺液,18?甲基炔诺酮,氯苯氨丁酸,二苯基醋酸钠,哈洛沙佐姆,吡_苯氧磺钠,双醋苯啶,吡哌酸,安嗽灵,羟甲香豆素,丁苯乙肟,富马酸苄环庚烷,布美他尼,击氧异雄甾酮,丙安定,氟羟甲基睾丸紊,醋酸肤轻松,氟安定,丙酸轻甲雄酮,三羟苯丙酸,丙酸氯地米松,溴吡二氯革,苯蝗香豆酮,己酮可可碱,己烯雌酚,聚维酮碘,聚苯乙烯磺酸钠,亚叶酸钙,甲磺酸二氢麦角胺,甲磺酸去铁胺,甲磺酸溴麦角隐亭,甲磺酸甲胺乙吡啶,炔雌醇甲醚,甲基地高辛,甲氧补固脂紊,甲环硫甾烷,甲呋缩尿,苯阿胺酸氮芥,碘化二乙氧磷酰硫胆碱,硫酸丁酚胺,硫酸异丙喘宁,硫酸长春新碱,硫酸长春碱,硫酸二甲苄哌, 磷酸可的松钠,磷酸哌嗪,磷酸倍他米松钠,氯羟安定.2.2新收载的有机药品制剂雌三醇片,雌三醇混悬注射液,利尿酸片,氰化腾喜龙注射液,盐酸精氨酸注射液,二氯苯磺胺片,6-去氢逆孕酮片,酒石酸烯丙左吗喃片,苯磺唑酮片,磷酸183?舯Ⅲ.,勰,0跎...三氯乙酯钠糖浆,发癣遢溶液,烟酸双己醇醇片,18一甲基炔诺酮,炔雌醇片,氯苯胺丁酸片,双酷苯啶栓,双噻替培吡啶片,丁苯乙肟乳膏,富马酸苄环庚烷片,环苯安定片,氟安定胶囊,丙酸羟甲雄酮注射液,己烯雌酚二磷酸醇片,注射用硫酸长春新碱,硫酸二甲苄哌片, 磷酸哌嚷片.2.3新收载的抗生素更生霉素,盐酸阿柔素比星,盐酸头孢替安,盐酸头孢甲肟,盐酸阿霉素,盐酸巴卡西林,盐酸万古霉素, 克拉维酸钾盐,头孢克罗,头孢羟氮苄,头孢羟唑钠,头孢替坦,头孢哌酮钠,头孢磺啶钠,头孢唑肟钠,头孢抄定,头孢氨呋肟钠,磷霉素钠,拉他头孢钠,硫酸西梭霉素,硫酸博来霉素,硫酸培来霉素,硫酸小诺米星,磷酸氯洁霉素.2.4新收载的放射药氯化铟(“In)注射液,碘化钠(I)胶囊.2.5唰去的品种乳酸心可定,乳酸心可定片,苯氧乙基青霉素,苄青霉素普鲁卡因,胶体金(“Au)注射液,锌,伊克度软膏,水杨酸.酚软膏,缬草酊,远志,桔梗水,麝香,干燥气性坏疽抗毒素.非活性狂犬疫苗,百日咳.白喉混合疫苗,百日咳,白喉,破伤风混合疫苗3关于制剂总则增加两个新剂型.即气雾剂与溶液荆.制剂的外文名,第¨版为拉丁文名,第l2版改用英文名.4一般检童法第12版增加棱磁共振法和铁盐检查法.修订的主要内容:4.1吸收度测定法紫外光区测定的光源,删去了第11版补充本规定的氙灯,改用氚放电管.可见光区测定用光源仍用钨灯及卤钨灯.4.2荧光光度测定法收载了激光和碱卤灯光源.4.3酮,异丙醇,第三丁醇检查法这版规定凡原料药进行此项检查者.用此原料制备制剂时不需再作此项检查.4.4渗透压测定法美国药典xxiI渗透压是用Osmolarity表示,是指wt/vol的意思.如用Osmolarity表示时.则是wt/wt的意思.由于r与1的含义不同.是区别容量与重量浓度的第n版增补本英文版采用了美国药典Osmo—larity用语,操作时应按wt/vol进行但严密的渗透压溶液的浓度与湿度有关.这版排除了温度的影响而采184?用了OsmoIarity这一概念.限于不太浓的溶液,在常温下wt/vo[与wt/wt的差不大,所检验操作按Osmo—larity的概念进行.4.5卡氏水分测定法第11版称水分定量法,本版改为水分测定法”定量法”的概念是测定主要成分的量,测定法”是测定数据.本版对测定法的内窖作了修改,除测定甲醇外也可测定其它低级醇.反应试剂的盐基除用吡啶外也可用咪唑与a一氨基呲啶.4.6粘度测定法本版增加了关于特殊粘度的记述,并考虑与《日本工业标准》的一致性对内窖作了修订.5关于生药的修订内容5.1收载品种删去麝香.5.2基原对黄蓍,甘草,枳实,香附,细辛,山茉萸,地黄,萍蓬草,苍术,桑白皮,泽泻,茯苓,茅根等品种的基原作了修订.5.3对生药含有成分的规格值5.3.1熊果:熊果甙应在7以上,测定方法采用HPLC,对照品:J{Il果甙.5.3.2黄柏:盐酸小檗碱应在1.2以上,测定方法采用HPLC.对照品:盐酸小檗碱5.3.3黄柏粉:同黄柏5.3.4黄连:盐酸小檗碱应在4.2以上:测定方法采用HPLCt对照品:盐酸小檗碱5.3.5黄连粉:同黄连.5.3.6蟾酥:蟾酥甾体(蟾酥灵,华蟾酥毒基,脂蟾毒配基的总量)应在5.8以上.测定方法采用ttPLC,对照品:蟾酥灵,华蟾酥毒基,脂蟾酥毒配基.5.3.7薄荷油:薄荷脑应在30以上.测定方法采用GC法.对照品:L一薄荷脑.5.3.8马钱子:士的宁应在1.07以上.测定方法采用HPLC,对照品:硝酸士的宁5.3.9桉叶油:桉油精应在70以上测定方法采用GC法t对照品:桉油精.5.3.10东莨菪根:总生物碱(莨菪碱,东莨菪碱总量)应在0.29以上.测定方法采用ttPLC,对照品:硫酸阿托品,溴氢酸东莨菪碱.5.4性状5.4.1黄芩粉:将镜检项下的”柔细胞”改为”含少量淀粉粒的柔细胞.5.4.2黄连:册}去性状中通常多为烤焦”.1994年3月第29卷第35.4.3甘草:甘草酸应为2~6,测定方法采用HPLC,对照品:甘草酸5.4.4甘草粉:与甘草同.5.4.5苦参:对横断面的描述作部分修改.5.4.6桂皮粉:将淀粉粒直径6~15Fro改为6~20Fro.5.4.7欧龙胆:对镜检描述作了部分修改5.4.8欧龙胆粉:增加导管径为20~80Fm5.4.9非洲防己:对形状描述作了部分修改5.4.10柴胡:增加淀粉粒直径为2~10m.54.儿栀子:将”果肉中”改为”胎座”.5.4.12栀子粉:将”果皮要素改为”花房与果皮要素”.5.4.13山茱萸:将”果肉去掉种子的裂孔……”.改为“……去掉真正果实的裂孔……”.5.4.14芍药:芍药甙应为2~6测定方法采用HPLC.对照品芍药甙5.4.15芍药粉:与芍药阿.5.4.16生姜:删去”外皮”的描违=5.4.17美远志:对外观和镜检的描述作了调整,部分作r改写5.4.18七节人参:删去对”残茎”和”根”的描述.5.4.19当药粉:将镜捡描述的各要点作了综合. 5.4.20知母:对”中心柱”的描述作了简化.5.4.21当归:对镜检描述的”树脂室”改为”油室”,淀粉糙直径改为i9~20Fm.删去”形成层”的描述. 5.4.22吐根:对性状描述进行了简化.54.23麦冬:增加镜幢描述.5.4.24北抄参:对性状描述作了调整和改写.5.4.25白芷:对性状描述作了部分简化.5.4.26白术:对镜检描述增加了对外皮的描述. 5.4.27白术粉:对味的描述增加了”微苦=5.4.28茯苓;对性状描述作了调整和改写.5.4.29茯苓粉:对菌丝作了详细描述.5.430防己:对外观和镜检的描述作了调整.一部分作了改写5.4.31牡丹皮:对复粒淀粉数2~1o个改为2~10 数个.5.4.32术通:对外观与镜检描述作了调整.一部分进行改写.5.4.33术香:对性状描述进行了部分改写.5.4.34薏苡仁:对性状描述进行了简化.54.35东莨菪:增加镜检的描述.5.5鉴别1994年3月第29嚣第35.5.I梓实,山椒车前草,橙皮,龙胆等品种增加TLC鉴别法.5.5.2紫草:鉴别(2)增加显色反应的描述5.6物理常数5.6.I胡麻油:碘价103~116改为1.3~1185.6.2硬脂醇:对熔点测定法作了改进.5.6.3鲸蜡醇:用硬脂醇的熔点测定法.6中药制剂品种的修订6.I删去的制剂品种缬草酊,递志桔梗水.6.2中药制剂含有成分的规格值62.I熊果流浸膏:熊果甙含量应在3O以上测定方法与熊果叶同.2.2甘草浸膏:甘草酸含量应在5卜.测定方法与甘草同.6.2.3马钱子浸膏:士的宁含量应在6.8i以上.测定方法与马钱子同6.2.4马钱子酊:士的宁音量为0.(9~u.116wv,测定方法与马钱予同6.2.5马钱子浸膏散:士的宁含量应在o.68上测定方法与马钱子同6.2.6东莨菪浸膏:包生物碱(蓖菪碱东莨若碱总量)应为0.90~1.09测定方法与东莨菪碱同6.3鉴别6.3.I苦味酊:增加显色反应和TLC鉴别法6.3.2当药,碳酸氢钠散:增加TLC鉴别洼.6.3.3橙皮糖浆:增加TLC鉴别法.6.3.4橙皮酊:增加TLC鉴别法.6.3.5东莨菪浸膏;修改了鉴别(1)显色反应的操作.6.4纯度检查甘草粗浸膏:删去重金属艟查项目6.5灰分甘草粗浸膏的灰分改为127第12版含量测定采用的分析方法7.I仪器分析方法7.I.I高效液相色谱法测定的品种共101个,其中属二部的品种25个.7.I.2气相色谱法测定的品种33个.其中属二部的品种18个.7.I.3分光光度法测定的品种12个,其中届二部的品种14个.7.I.4吸收度比法测定的品种5个.7.I.5原子吸收法测定的品种9个,其中属二部的品种1个.l857.2化学分析方法7.2.1非水溶媒法测定的品种210个.其中属二部的品种2个.72.2中和法测定的品种117个,其中属二部的品种37十.7.2.3银量法测定的品种34个,其中属二部的品种2十.72.4醇制氢氧化钾法测定的品种l3个,其中属二部的品种1个7.2.s络量法测定品种37个,其中属二部的品种15 ,7.2.6四甲羟胺法测定的品种13个.7.2.7碘量法测定的品种17个.其中属二部的品种5 个.7.2.8溴量法测定的品种1o个,其中属二部的品种5 个:7.2.9四苯硼钠法测定的品种5个.7.210硫代硫酸钠法测定的品种18个.其中属二部的7个7.2.11碘酸钾法测定品种7个.7.2.12三氯化钛法测定的品种3个.7.2.13甲醇钠,二氧六围法测定的品种2个7.2.14硫代硫酸铵法测定的品种4个,其中属二部的品种3个.7.2.15二氯吲哚酚法测定的品种2个.我院药品消耗信息的ABC分析北京军区医院(100700)问善张维旗王建民赵汉臣ABC分析俗称重点分析法,是确定主次关系的可靠方法.它将研究对象分为ABC3类,A类是主要困紊,B类是次主要因索,C类是次要因索.根据该分类找出关键性环节,抓住主要矛盾,采取相应的管理措施,即能提高管理效率.我们在药品采购,供应,管理计算机应用软件的设计中.引入了ABC分析法数学模型, 对我皖近年来的药品消耗数据,进行盒额,数量,价格, 发放频率等多方面分析,收到了较好的效果1应用项目爰数学模型设药品的单价为a(批发价);年消耗量为b;发放频率为P.11消耗数量分析:Ai--b}1.2消耗金额分析:Ai—a×b;1.3价格分析:Ai—a;1.4发放频率分析:Ai竺p}1.5根据上述4个分析目的.分别请取数据,按ABC分析运算步骤求解:(1)以A值大小排序}(2)求各个序号与序号累加值的百分值}(3)求各品种Aj值与_Aj 累加值的百分值(4)求各品种\/A与V Aj累加值的百分值;(j)在At与累加值的百分比值项下的33.3及66.6处划线,分成A,B,C3类,分别得出各类分析结果.2分析目的爰意义l862.1消耗数量的分析可得出消耗量最多及最少的品种,提示台理确定存放货位及库存贮备量A娄药品, 由于用量大.为保证医疗需要,应建立稳定而畅通的供货槊道.适当加大贮备量.在仓库中应提供足够的储藏面积.而c类品种,建立货架就可满足储备要求.2.2通过消耗金额的分析可掌握资金投向.A娄药品占用资金较多,对这部分品种应格控制购买置,避免固定资金占用过多.以有限资金发挥最大的作用,实现最佳经济教益.2.3价格的分析结果可作为药品分级管理的重要依据.由于贵重药品主要根据价格确定,国家无统一标准.不步单位只能凭经验或习晴确定贵重药品品种,随意性大,科学性差,无法反映药品的内在竹值规律.钱院通过逐年价格的ABC分析,确定贵重药品品种,井定期调整,提高了管理的台理性,科学性.2.4发放频率的分析结果可明了药品的发放慨况.提示药库的货位布局在面积大.品种多的仓库内,确定药品货位时,应将发放次数多的A类品种放在易取易运的位置.利于工作.减轻劳动强度.2.5ABC分析可为药品更新换代提供准确信息.肖耗数量,消耗金额及发放次数均为0的药品.如果连续几年无消耗,即应列为淘汰品种对于这些药品采取停止采购.消耗现有库存的方法.减少积压和浪费1994年3月第20卷第3。


Meta-analysis of Kudiezi Injection for Acute Cerebral InfarctionLIU Ying, Wang Fang, Wang Qing, LU Jian-qiu(Beijing University of Chinese Medicine, Beijing 100029, China)【Abstract】Objective: To evaluate the efficacy of Kudiezi injection for acute cerebral infarction we performed a systematic review of clinical trials. Methods: Using Meta-analysis to evaluate the efficacy on the acute cerebral infarction of Kudiezi injection from 20 articles on clinical trials published from 2006 to 2012 in Chinese journals with the software RevMan5.1. It takes sensitivity analysis to analyze the different results of the experiments. Results: 20 studies were included for efficacy analysis, a fixed effects model was chosen and the value of odds ratio (OR)was 3.37 with the 95% confidence interval from 2.54 to 4.47. Conclusions: Based on this review Kudiezi injection may have positive effect on acute cerebral infarction, but its efficacy need to be confirmed with high-quality randomized controlled trials.【Key words】Kudiezi Injection; Acute Cerebral Infarction; Meta-analysis由《日本药局方》第十六改正版中生药标准的规定思考《中华人民共和国药典》2010版一部标准的后续修订工作张丽,丁安伟*[摘要]:介绍了《日本药局方》第十六改正版中生药标准的概况,对相关标准特点与《中国药典》2010版一部的有关规定进行了比较分析,供同道交流并为《中国药典》的后续修订工作提供参考。
世界各国药典大汇总中国药典(CHP):介绍就省了,大家都比较熟悉。
美国药典/国家处方集(简称USP/NF)U.S. Pharmacopeia / National Formulary:由美国政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。
USP于1820年出第一版,1950年以后每5年出一次修订版,到2005年已出至第28版。
NF1883年第一版, 1980年15版起并入USP,但仍分两部分,前面为USP,后面为NF。
美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、使用、管理、检验的法律依据。
NF收载了美国药典(USP)尚未收入的新药和新制剂。
美国药典正文药品名录分别按法定药名字母顺序排列,各药品条目大都列有药名、结构式、分子式、CAS登记号、成分和含量说明、包装和贮藏规格、鉴定方法、干燥失重、炽灼残渣、检测方法等常规项目,正文之后还有对各种药品进行测试的方法和要求的通用章节及对各种药物的一般要求的通则。
可根据书后所附的USP 和NF的联合索引查阅本书。
英国药典(BP):/《英国药典》是英国药品委员会(British Pharmacopoeia Commission)的正式出版物,是英国制药标准的重要来源。
英国药典不仅为读者提供了药用和成药配方标准以及公式配药标准,而且也向读者展示了许多明确分类并可参照的欧洲药典专著。
英国药典出版周期不定。
BP2004该药典由三卷本组成。
其中两卷为英国药典、一卷为英国兽药典(兽医药品部分)。
各条目均以药品名称字母顺序排列,内容包括药品性质、制法、血产品、免疫产品、电磁药品制法及外科材料等部分。
英国药典书后附有全部内容关键词索引。
欧洲药典(EP):/欧洲药典委员会1964年成立。
1977年出版第一版《欧洲药典》。
从1980年到1996年期间,每年将增修订的项目与新增品种出一本活页本,汇集为第二版《欧洲药典》各分册,未经修订的仍按照第一版执行。
甘草Radix Glycyrrhizae 中、日、美三国药典质量标准的比较前言:随着中国加入WTO,我国药品标准工作在促进我国医药事业发展方面、在国际间药品标准协调方面以发挥越来越重要的作用。
参照国际间药品标准协调工作的进展,结合我国实际,调整我国药品标准制订和修订的策略,对促进我国民族医药工业的发展,增进国际间医药贸易往来将会产生深远的影响。
正文:以甘草为例比较重、日、美三国药典质量标准来源:【中国药典】:本品为豆科植物甘草Radix Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza in flataBat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎。
春、秋二季采挖,除去须根,晒干。
【日本药局方】:Glycyrrhiza uralensis Fischer, Glycyrrhiza glabra Linne(Leguminosae)的干燥根。
【美国药典】:Glycyrrhiza glabra L.和G.Uralensis Fischer的根、根茎及匍匐枝。
性状:【中国药典】:根呈圆柱形,长25~100cm,直径0.6~3.5cm。
外皮松紧不一。
表面红棕色或灰棕色,具显著的纵皱纹、沟纹、皮孔及稀疏的细根痕。
质坚实,断面略显纤维性,黄白色,粉性,形成层环明显,射线放射状,有的有裂隙。
根茎呈圆柱形,表面有芽痕,断面中部有髓。
气微,味甜而特殊胀果甘草根及根茎木质粗壮,有的分枝,外皮粗糙,多灰棕色或灰褐色。
质坚硬,木质纤维多,粉性小。
根茎不定芽多而粗大光果甘草根及根茎质地较坚实,有的分枝,外皮不粗糙,多灰棕色,皮孔细而不明显。
【日本药局方】:圆柱形,长1m以上,直径0.5~3.0cm。
表面暗棕色或红棕色,断面略呈纤维性,横切面皮部与木质部界面分明,呈放射状。
气微,味甜。
【美国药典】:呈圆柱形,长约1m,直径0.5~3.0cm,外表深棕色至红棕色,有皮孔。
日本药局方(13版)主要修订内容介绍日本药局方(13版)已于1996年4月1日公布施行。
本版对凡例、收载品种、一般检查等项作了修订。
现将主要修订内容介绍如下。
1凡例日本药局方(13版)英文名为The Japanese Pharmacopeia Thirteenth Edition。
①使用的原子量表为1993年国际原子量表。
分子量至小数点第二位,第三位四舍五入。
②计量单位按国际单位系统进行了调整,但对凡例第7项的“重量对容量百分率”未按国际单位系统进行调整。
另外,对质量对体积百分率未作更改,其相对符号W/V%仍保留,限定用于制剂的处方或表示成分使用。
③测定红外吸收谱所用符号[cm-1]的读法将凯塞改为波数。
④压力改为千帕(kPa)。
⑤浓度的基本单位与摩尔(mol/L)。
⑥粘度。
动力粘度与运动粘度的关系为毫帕秒(mPa*s)与平方毫米每秒(mm2/s)。
⑦凡例31项与药局方(12版)凡例32项的正确度与精密度改为真度与精度。
⑧减压:除另有规定外,应为20kPa以下。
2 新收载的品种2.1 第一部76个品种阿莫沙平、前列地尔、碘托葡胺、氟奋乃静庚酸酯、依诺沙星、盐酸醋丁洛尔、盐酸阿里洛尔、盐酸乙基半胱胺酸、盐酸氯苄帕明、盐酸氯康唑、氯苯达诺、西曲酸酯、盐酸噻氯匹啶、妥布特罗、尼卡地平、盐酸多巴酚丁胺、盐酸匹呋甲亚胺青霉素(pivmecillinam HCl)、盐酸布那唑嗪、盐酸黄酮哌酯、盐酸呋喃硫胺、盐酸苄丝肼、盐酸美心律、盐酸莫西赛利、思氟烷、?丙嗪、卡比多巴、羧甲半胱胺酸、卡莫氟、克利贝特、醋酸胍那苄、醋酸麦地霉素、环孢素A、西咪替丁、噻哌溴胺、溴丁托品、酒石酸苄胍酚醇、磺胺嘧啶银、头孢匹林钠、头孢匹胺钠、头孢布宗钠、葡聚糖硫酸酯钠硫-5、葡聚糖硫酸酯钠硫-18、托菲索泮、托布霉素、曲西泮、烟酸戊四醇酯、泛硫乙胺、联苯苄唑、白内停、法莫替丁、芬布芬、富马酸普鲁卡明(probincamine famarate),富马酸福莫特罗、吡啶布洛芬、腺嘌呤黄素二核苷酸钠、氟甲龙、氟安定、氟硝西泮、氟苯布洛芬、丙谷胺、氟喹胺苯酯、磷霉素钙、麦芽糖、咪康唑、甲磺酸加贝酯、甲磺酸卡莫司他、辅酶Q10、奥沙碘胺、核黄素丁酸酯、乳果糖、硫酸阿司米星、硫酸庆大霉素、硫酸奈替米星、硫酸喷布洛尔、磷酸二甲菲烷,环氧洛芬钠。
2.2 二部收载的新品种野梧桐、茵陈蒿、茴香粉、尿激酶、半乳糖苷酶、山药粉、纤维素粉、猪苓粉、桃仁粉、吐根糖浆、无水乳糖、羟丙甲基纤维素、聚乙烯吡咯酮。
3删去的品种3.1 一部删去的品种2个蛋氨酸硒(75se)注射液、缩酮氨苄西林钾。
3.2 二部删去品种11个有氯醛*水杨酸精;水杨酸*酚软膏;苯海拉明*钙散;盐酸酚水;胃蛋白酶柠檬水;复方氯化苄氧乙胺*滑石粉;复方番本鳖浸膏*胃酶散;复方碘*辣椒精;莨菪浸膏*碳酸氢钠*硅酸铝散;复方莨菪浸膏*碳酸氢钠*氢氧化铝散;复方莨菪浸膏*氢氧化铝散。
4新增一般检查法及修订内容4.1 新收载的检查法①有机物碳素检查法;②制酸力检查法;③消化力检查法;④微生物限度检查法;⑤粉末X线衍射检查法。
4.2 修订的内容①红外吸收谱检查法:由于傅里叶分析仪的普及应用,本法采用了此仪器修订了检查方法。
修订了检样调配;增加了ART测定法及扩散反射法。
根据红外吸收图谱,将鉴别检查法改为样品图谱与对照图谱相一致的方法。
②无菌检查法:修订了以前的直接法,修改为:“除另有规定外,可按直接法或薄膜过滤法进行检验。
”培养基参考美国药典和英国药典进行了修改。
培养基性能及检验用菌株采用美国及英国药典规定的Bacillus Subtilis clostridium sporogenes,candida albicans。
培养时间:直接法与薄膜过滤法都是14日以上。
③吸光度测定法:增加了用光学滤过法校正分光光度计波长及吸光度的刻度。
④砷盐检查法:增加了试液调整配法第4法。
第3法由于加入的硝酸镁量不足,不能定量的回收砷盐,增加硝酸镁的量可获得砷盐较好的回收率。
因此将此法作为第4法。
⑤油脂检查法:将碘价检查法作了修订,将碘价检查法所用溶媒四氯化碳改为环己烷。
⑥高效液相色谱法:删去氨基酸色谱法。
增加了电化检出器、化学发光检出器、电导检出器、质谱分析计及数据处理装置使分析自动化。
省去定量法中“内标法”的规定,内标法与标准曲线法具有相同的分析精度。
对检出灵敏度、试验的再现性、对称因子、相对标准差、峰的完全分离、分离系数、分离度及理论板数等用语的定义作了说明。
⑦气相色谱法:增加了顶空(head space)样品导入装置与药品中的残留溶媒检验相对应,色谱术为填充柱与毛细管柱两种,检测器增加了质谱仪成为气质联用;定量法引入样品添加法与样品基质影响相对应;与液相色谱法不同,本法用内标法。
⑧由于检查中使用了有害硫酸汞试液,因此删去丙酮、异丙醇、第三丁醇检查法,增订了用气相色谱法检查乙醇中挥发性混合物的检查法。
⑨原子吸收分光光度法:伴随引入电加热方式,对记述作了调整,停止无火焰(flame less)方式的叫法,称作冷蒸气方式。
⑩水分测定法(卡氏法):引入电滴定法的同时,对容量滴定法的溶媒,增加水分测定用二甘醇乙醚。
?B11?粘度测定法:采用旋转粘度计的同时,对毛细管粘度计的规格采用了《日本工业标准》的规格。
毛细管粘度计法为第1法,适用于低粘度液体的测定,测定的粘度为运动粘度。
旋转粘度计为第2法,适用于牛顿液体与非牛顿液体的测定,测定的粘度为动力粘度。
?B12?比重测定法:修改为比重及密度测定法。
5对生药、生药制剂及有关油脂检查的修订5.1新收载品种野梧桐、茵陈蒿、茴香粉、山药粉、猪苓粉、桃仁粉、吐根糖浆。
5.2对生药及生药制剂的部分修改对阿仙药粉的性状,删去淀粉粒的部分。
删去延胡索原植物Corydalis ternata Nakai及其同属植物。
黄芪:删去性状中“通常无分枝”部分。
黄芩:黄芩苷含量规定应在10%以上;增加干燥失重及成分含量测定法。
黄芩粉:修改内容与黄芩同。
黄柏:盐酸小檗碱含量规定应在1.2%以上,成分含量测定法采用盐酸小檗碱对照品。
黄柏粉:修改内容与黄柏同。
黄连:盐酸小檗碱含量规定应在4.2%以上,成分含量测定法采用盐酸小檗碱对照品。
性状增加了皮部及髓部的颜色为红褐色;木部为红黄色。
黄连粉:与黄连同。
甘草及甘草粉:甘草酸含量规定应在2.5%以上,含量测定采用甘草酸对照品作对照。
甘草浸膏:甘草酸含量规定应在4.5%以上。
桔梗粉:删去性状中淀粉粒的部分。
厚朴:增加原植物“Mognolia allicinalis Rehder et Wilson及Mognolia officinalis Wilson var.biloba Rehder et Wilson”。
厚朴酚含量规定应在0.8%以上,含量测定法采用高效液相色谱法,鉴别改为薄层色谱法。
牛黄:纯度检查增加“合成色素”、“淀粉”及蔗糖的检查。
吴茱萸:将性状中的大小,由“2.5~5mm”改为“2~5mm”。
五味子:将性状中的“常常”改为“有时”。
细辛:原植物的学名修正为“Asiasarum sieboldii F.Mae Karoa”。
西红花:将性状中的长度由“2~3.5mm”改为“1.5~3.5mm”。
山枳子:将原植物由“同属植物”改为“类缘植物”。
山药:鉴别项下修改为不用有害试剂的鉴别法。
芍药及芍药粉:芍药苷含量规定应在2.0%以上,含量测定法采用高效液相色谱法,鉴别试验之(2)修改了有害试剂的鉴别方法,新增干燥失重检查法。
生姜:增加薄层色谱鉴别法鉴别姜酚。
升麻:性状项下增加外面为“~黑褐色”。
番泻及番泻粉:总番泻苷含量规定应在(含番泻苷A及B)应在1.0%以上,测定方法采用高效液相色谱法,新增干燥失重检查法。
当药粉:对性状项下淀粉粒的记述作了统一。
苍术:删去原植物的别名。
桑白皮:对性状项下淀粉粒的记述作了统一。
大黄及大黄粉:对番泻苷A的含量规定应在0.25%以上,测定方法采用高效液相色谱法。
七节人参:对性状项下淀粉粒的粒径由“10~30μm”改为“3~18μm”。
猪苓:将英文名“Chuling”修改为“Polyporus sclerolium”。
辣椒:将性状中的长度由“约10cm”改为“3~10cm”。
吐根:原植物增加“Cephaelis acuaminata Karster”及应用部位为根茎,总生物碱(吐根碱及吐根酚碱)含量规定应在2.0%以上,测定方法采用高效液相色谱法。
增加干燥失重检查法。
西黄蓍胶:对性状项下淀粉粒的记述作了统一。
白术:将挥发油含量由“0.70ml”以上改为“0.5ml”以上。
白术粉:将挥发油含量“0.5ml”以上修改为“0.4ml”以上。
茯苓:将英文名“Hollen”改为Poria selerotium,将拉丁名“Hoelen”改为“ ponia”。
茯苓粉按茯苓修改。
颠茄根:莨菪碱含量规定应在0.4%以上,测定方法采用高效液相色谱法。
防己:性状中统一了淀粉粒的记述。
牡丹皮:丹皮酚含量规定应在1.0%以上,测定方法采用高效液相色谱法。
牡丹皮粉:丹皮酚含量规定应在0.7%以上,测定方法同上。
麻黄:总生物碱(麻黄碱及伪麻黄碱)含量规定应在0.7%以上,测定方法采用高效液相色谱法。
木通:原植物增加“Akebia trifoliata Koidzumi”,删去其它同属植物。
熊胆:纯度检查项下删去黄柏浸膏的检查。
薏米仁粉:性状项下统一了淀粉粒的记述。
连翘:删去原植物“Forsythia koreana Nakai”。
莨菪根:将鉴别(2)薄层色谱用的硫酸阿托品改为硫酸阿托品对照品,含量测定所用硫酸阿托品改用硫酸阿托品对照品,定量用的氢溴酸莨菪碱改用氢溴酸莨菪碱对照品。
莨菪浸膏及莨菪浸膏散的含量测定法修改同上。
5.3 对油脂检查有关各项的部分修订对性状项下删去使用有害试剂的有:胡麻油、橄榄油、可可豆油、加洛巴蜡、牛脂、大豆油、山茶油、玉米油、花生油、加水羊毛脂。
纯度检查项下删去检查棉油的品种:橄榄油、胡麻油、山茶油、玉米油、豚脂、菜油、花生油、精制羊毛脂。
橄榄油:纯度检查项下删去菜油、芥子油的检查。
可可脂:对融点测定增加测定条件,纯度检查删去对蜡、硬脂、牛脂的检查。
牛脂:增加碘价测定的条件。
椰子油:增加融点测定法(2)法。
加洛巴蜡:删去纯度检查项下四氯化碳不溶物检查。
加水羊毛脂:对鉴别项下删去有害试剂,修改了碘价测定的有害试剂。
精制羊毛脂:删去鉴别项下使用的有害试剂,修改碘价测定使用的有害试剂,对纯度检查(5)检查凡士林作了部分变动。
黄色凡士林:对纯度检查(1)颜色检查作了修改,对纯度检查(2):酸及碱、重金属、砷盐、硫化物、有机酸、油脂及树脂等项检查作了修改。
5.4 对日文别名作了变更对15种原为日文别名的生药现改为汉文名称。