2019最新高考总复习资料金榜学案化学
- 格式:ppt
- 大小:3.75 MB
- 文档页数:44

专题一物质的组成、性质和分类考纲解读考点考纲内容高考示例预测热度物质的组成、性质和分类1.理解混合物和纯净物、单质和化合物的概念2.理解酸、碱、盐、氧化物的概念及其相互联系2015课标Ⅰ,7,6分2014四川理综,2,6分★★★分散系1.了解溶液的含义。
了解溶解度、饱和溶液的概念。
理解溶液中溶质的质量分数的概念,并能进行有关计算2.了解胶体是一种常见的分散系2014福建理综,8,6分★★☆分析解读将物质的组成、性质及分类知识与传统文化、化学史相结合进行考查,是今后高考命题的趋势。
试题侧重基础,但能体现学科素养。
随着考试大纲的变化,对本部分内容的考查有增大的趋势。
命题探究五年高考考点一物质的组成、性质和分类1.(2016北京理综,6,6分)我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法答案 B2.(2015课标Ⅰ,7,6分)我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。
”这里的“强水”是指( )A.氨水B.硝酸C.醋D.卤水答案 B3.(2015北京理综,6,6分)下列我国古代的技术应用中,其工作原理化学反应的是( )A.火药使用B.粮食酿酒C.转轮排字D.铁的冶炼答案 C4.(2015福建理综,6,6分)下列制作铅笔的材料与相应工业的是( )A.橡皮擦——橡胶工业B.铝合金片——冶金工业C.铅笔芯——电镀工业D.铅笔漆——涂料工业答案 C5.(2014四川理综,2,6分)下列关于物质分类的说法正确的是( )A.金刚石、白磷都属于单质B.漂白粉、石英都属于纯净物C.氯化铵、次氯酸都属于强电解质D.葡萄糖、蛋白质都属于高分子化合物答案 A6.(2013课标Ⅰ,7,6分)化学无处不在,下列与化学有关的说法不正确...的是( )A.侯氏制碱法的工艺过程中应用了物质溶解度的差异B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成答案 C教师用书专用(7—9)7.(2015重庆理综,1,6分)中华民族有着光辉灿烂的发明史,下列发明创造化学反应的是( )A.用胆矾炼铜B.用铁矿石炼铁C.烧结粘土制陶瓷D.打磨磁石制指南针答案 D8.(2014北京理综,6,6分)下列试剂中,标签上应标注和的是( )A.C2H5OHB.HNO3C.NaOHD.HCl答案 B9.(2013海南单科,2,2分)下列化合物的俗称与化学式不对应...的是( )A.绿矾——FeSO4·7H2OB.芒硝——Na2SO4·10H2OC.明矾——Al2(SO4)3·12H2OD.胆矾——CuSO4·5H2O答案 C考点二分散系1.(2014重庆理综,3,6分)下列叙述正确的是( )A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度答案 D2.(2014福建理综,8,6分)下列实验能达到目的的是( )A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液B.将NH4Cl溶液蒸干制备NH4Cl固体C.用萃取分液的方法除去酒精中的水D.用可见光束照射以区别溶液和胶体答案 D3.(2013四川理综,2,6分)下列物质分类正确的是( )A.SO2、SiO2、CO均为酸性氧化物B.稀豆浆、硅酸、氯化铁溶液均为胶体C.烧碱、冰醋酸、四氯化碳均为电解质D.福尔马林、水玻璃、氨水均为混合物答案 D三年模拟A组2016—2018年模拟·基础题组考点一物质的组成、性质和分类1.(2018吉林长春普通高中一模,1)化学与社会、技术、环境、生活密切相关。

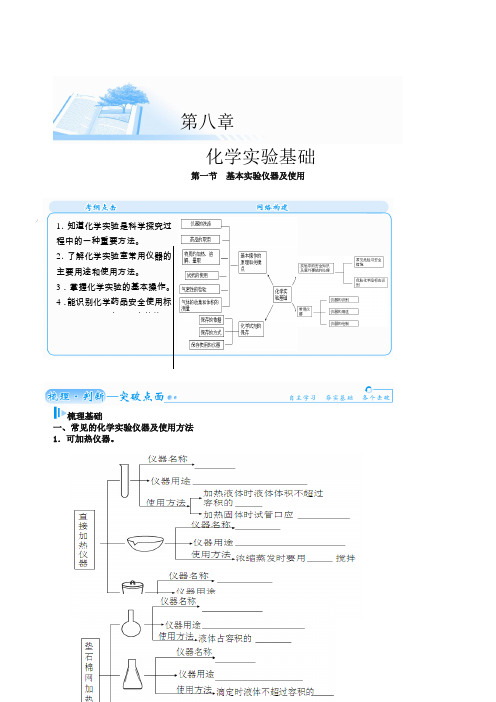
第一节 基本实验仪器及使用梳理基础一、常见的化学实验仪器及使用方法 1.可加热仪器。
第八章化学实验基础1.知道化学实验是科学探究过程中的一种重要方法。
2.了解化学实验室常用仪器的主要用途和使用方法。
3.掌握化学实验的基本操作。
4.能识别化学药品安全使用标识,了解实验室一般事故的预试管少量物质溶解和少量试剂反应的容器13略向下倾斜蒸发皿蒸发浓缩溶液,使固体从溶液中析出玻璃棒坩埚固体物质高温灼烧坩埚钳圆底烧瓶较多固液或液液的反应容器13~23锥形瓶滴定反应容器、不加热时固液反应容器,也可做洗气瓶和接受器12烧杯用于配制、浓缩、稀释溶液,也可作反应器、水浴加热器等判断正误正确的打“√”,错误的打“×”。
1.分别用量筒和酸式滴定管量取10 mL水,读数时仰视,所量液体偏大( )解析:量筒的刻度从下往上增大,量10 mL水仰视体积偏大;滴定管的刻度是从上往下增大,量10 mL水仰视体积偏小。
答案:×2.实验室制氧气时用排水法收集氧气后出现倒吸现象,应立即松开试管上的橡胶塞( )解析:倒吸是因为装置内的气压变小而产生的,出现倒吸现象后立即松开橡胶塞空气进入装置内可终止倒吸。
答案:√3.用广泛pH试纸测得0.10 mol·L-1NH4Cl溶液的pH=5.2( )答案:×4.用下图所示装置分离CCl4萃取碘水后已分层的有机层和水层( )解析:CCl4的密度比水大,位于水的下层,正确。
答案:√5.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌( )解析:液液混合一般是先把密度小的液体倒入容器中,再把密度大的液体倒入密度小的液体中。
答案:√2.计量仪器。
答案:①无 ③0.1⎩⎪⎨⎪⎧名称:注意⎩⎪⎨⎪⎧①不可作反应容器,不可加热②使用前需“ ”③溶液转入时要用玻璃棒 ④不能长时间存放溶液答案:容量瓶 ②查漏 ③引流答案:酸式滴定管 ①查漏 ③酸 强氧化 碱 ④0.01答案:碱式滴定管 ③碱 酸 强氧化 ④0.01(1)(2)(5)⎩⎪⎪⎨⎪⎪⎧名称:托盘天平注意⎩⎪⎨⎪⎧ ①称量前先调零点②腐蚀性药品应放于 内称量③左盘放 ,右盘放 ④精确度为 g答案:②玻璃容器 ③被称物 砝码 ④0.1答案:温度计 ①不 ②支管口3.用于分离除杂的仪器。


金属及其化合物(Fe )【明确考纲】1.常见金属元素(如Na 、Mg 、Al 、Fe 、Cu 等)①了解常见金属的活动顺序。
②了解常见金属及其重要化合物的制备方法,掌握其主要性质及其应用。
③了解合金的概念及其重要应用。
2.以上各部分知识的综合应用。
【知识精讲】一、铁及其化合物1.树立物质转化思想(1)理清知识主线Fe→⎩⎪⎨⎪⎧ FeO Fe 2O 3Fe 3O 4→⎩⎪⎨⎪⎧ Fe (OH )2Fe (OH )3→⎩⎪⎨⎪⎧ FeSO 4·7H 2O FeCl 3(2)形成网络构建2.扫除易忘知识盲点(1)Fe 与O 2、H 2O(g)反应的产物都是Fe 3O 4而不是Fe 2O 3。
Fe 与Cl 2反应时生成FeCl 3,与S 反应时生成FeS ,说明Cl 2的氧化性大于S 的。
常温下,Fe 、Al 在冷的浓硫酸和浓硝酸中发生钝化,但加热后继续反应。
Fe 在Cl 2中燃烧,无论Cl 2过量还是不足均生成FeCl 3。
(2)向含Fe 2+的溶液中加入硝酸、KMnO 4溶液、氯水等具有氧化性的物质时,溶液会出现浅绿色―→棕色的颜色变化,该现象可用于Fe 2+的检验。
(3)Fe 3+的检验方法较多,如观察溶液颜色法(棕黄色)、NaOH 溶液法(生成红褐色沉淀)、KSCN 溶液法(生成红色溶液),前面两种方法需溶液中Fe 3+浓度较大时才适用,最好也最灵敏的方法是KSCN 溶液法。
Fe 2+的检验可采用先加入KSCN 溶液后再加入氧化剂的方法;也可用铁氰化钾检验Fe 2+,现象是生成蓝色沉淀(Fe 3[Fe(CN)6]2)。
(4)生成FeCl 2除了用Fe 和HCl 的置换反应外,还可用化合反应:2FeCl 3+Fe===3FeCl 2;生成Fe(OH)3除了用Fe 3+与碱的复分解反应外,还可用化合反应:4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
(5)配制FeCl 2溶液既要防氧化(加入Fe 粉),又要防水解(加入盐酸);配制FeCl 3溶液要加入浓盐酸防止水解。

知识络构建
解题方法指导——水溶液中的各种平衡
溶液中的平衡包括电离平衡、水解平衡、溶解平衡等内容,在此基础上延伸出强弱电解质、离子共存问题、水的电离、溶液中离子浓度大小的判断、溶液的pH、影响弱电解质电离的外界因素、影响盐类水解的外界因素。
在近年的高考命题中对主要内容的考核:平衡的基本原理;强弱电解质的区别,以及与溶液导电能力的关系;影响水的电离平衡的因素;溶液中离子浓度大小的判断;溶液中的几个守恒(电荷、物料、质子守恒);混合溶液中(不反应的或能反应的)各种量的判断;离子共存问题。
几个值得注意的问题:无论电解质还是非电解质,都是指化合物;有些物质虽然难溶于水,但还属于强电解质,其溶解部分完全电离;有些物质溶于水后能导电,但却是非电解质,因为导电的原因是该物质与水反应生成的电解质能电离出自由移动的离子;强电解质的导电能力不一定比弱电解质强,关键看水中自由移动离子的浓度;电解质溶液浓度越大,导电能力不一定越强;发生水解的盐溶液不一定呈酸性或碱性,可能呈中性;影响水的电离平衡的一般规律是酸、碱抑制水电离,而能水解的盐一般促进水电离;多元弱酸是分步电离的,在发生中和反应或较强酸制较弱酸时也是分步进行的,第一步电离远大于其第二步电离;弱酸不一定不能制强酸;水的离子积常数只与温度有关而与浓度无关,与平衡常数的含义相当;溶液越稀,越有利于电离;比较反应速率时,弱电解质关注已电离的离子,考虑反应的量时,弱电解质关注本身所有的氢离子或氢氧根离子(即已电离的和未电离的)。
电离平衡、水解平衡、难溶电解质的溶解平衡研究对象(主体)不同,但他们都属于动态平衡,是化学平衡理论的延续和应用。
知识络构建
化学实验基本方法常用仪器的使用
用于计量的仪器
用于加热的仪器
用于分离的仪器
化学实验基本操作
仪器的洗涤
药品的保存、装置气
密性的检查
化学实验安全
化学品安全使用标识
事故的预防和处理方法
物质的分离提纯
物理方法:过滤、渗析、分液、蒸发、
结晶、蒸馏、萃取、盐析、升华等
化学方法:遵循不增、不减、易分离、
易复原的原则
化学的实
验基础
物质的检验
鉴别、鉴定、推断:气体,有机物,阴、阳
离子的检验
验证性质
方法:观察、实验、分类、比较
程序:观察外观、预测性质、进行实
验、解释及结论
定量实验
物质的分离、
提纯和检验
常见气体的制备
装置类型:固固加热、固(液)液加热、固(液)液不加热等
净化和干燥:洗气瓶和干燥管
收集:排水法、排空气法
尾气处理
实验设计与评价\
内容:目的、原理、用品、装置、操作、结论、讨论
程序:由内容确定原理、装置等
要求:科学性、安全性、可行性、简约性
续上图
评价:分析、选择、判断、比较优缺点
绘制和识别:典型的实验仪器装置图。