GMP符合性检查及应对培训GMP认证宝典
- 格式:pptx
- 大小:395.60 KB
- 文档页数:54

【培训总结】GMP检查要点及常见问题国际局高级研修学院于17年6月在济南召开了一次培训班,今天分享GMP检查要点及常见问题学习总结和个人感想,具体总结如下:一、如何理解和应用法规“GMP要求你做得,就必须做;GMP没有要求你做的,就不需做(可能);GMP没有阻止你做的,就可以做(可能);GMP阻止你做的,就不能做。
”第二条可以帮助企业节约资源,第三条可以帮助企业开辟新的工作路径。
上述法则,国内国外均适用,管理人员应当掌握其原则。
管理需要创新,创新的前提就是拿去思维障碍,只有创新企业才能够发展,“过去我们一直就是这么做的”就是一种思维障碍,法规没有阻止做的,就可以做。
海正每个月均开简化流程的会议,目的就是要打破旧思维。
用这样4句话来思考并指导我们的工作,很多事情原来是问题的,现在可能就不是问题了。
比如,要求灭菌柜有权限控制、密码管理、数据备份的问题。
其实按照上述4句原则,GMP对数据完整性的要求是要解决人为的操控数据,能从设备的根本上解决问题更好,如果硬件不足,那么可以从软件上补足来解决问题,所以我们应当根据实际情况区别对待,并采取相应的措施。
对于有权限控制、密码管理、数据备份功能的灭菌柜,我们必须设定密码并对数据进行管理。
可是对于没有权限控制的可以采用控制面板上锁等方式。
对于没有数据存储功能的灭菌柜,我们就规定好纸质记录的管理,做好记录的可追溯性即可,硬件本身不足,就不用强求电子数据的管理了。
总之,通过培训能够获得思考问题的思路,是这次培训最大的收获:•思考方式:考虑事情要以达到要求或目标为前提,怎样做并不重要。
这样,复杂的问题就可以简单化,而对于简单问题,我们应该使之流程化。
•根据风险:做事分轻重缓急,就和往水杯里放大石头一样,如果大的石块不先放上,那么大石块就永远失去了放置的机会。
工作中我们也需要根据风险决定先做哪些事,做到什么程度,投入多大的资源。
比如说,国内外检查和飞检最容易出问题的地方还是数据可靠性、工艺一致性、文件管理等问题。







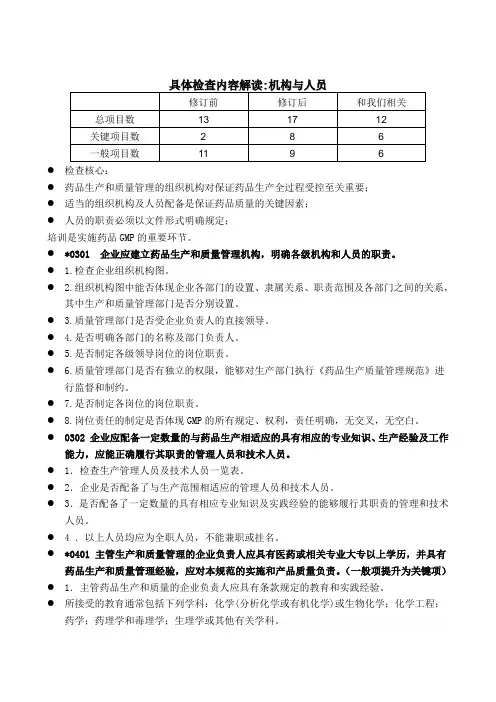
●检查核心:●药品生产和质量管理的组织机构对保证药品生产全过程受控至关重要;●适当的组织机构及人员配备是保证药品质量的关键因素;●人员的职责必须以文件形式明确规定;培训是实施药品GMP的重要环节。
●*0301 企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。
● 1.检查企业组织机构图。
● 2.组织机构图中能否体现企业各部门的设置、隶属关系、职责范围及各部门之间的关系,其中生产和质量管理部门是否分别设置。
● 3.质量管理部门是否受企业负责人的直接领导。
● 4.是否明确各部门的名称及部门负责人。
● 5.是否制定各级领导岗位的岗位职责。
● 6.质量管理部门是否有独立的权限,能够对生产部门执行《药品生产质量管理规范》进行监督和制约。
●7.是否制定各岗位的岗位职责。
●8.岗位责任的制定是否体现GMP的所有规定、权利,责任明确,无交叉,无空白。
●0302 企业应配备一定数量的与药品生产相适应的具有相应的专业知识、生产经验及工作能力,应能正确履行其职责的管理人员和技术人员。
●1.检查生产管理人员及技术人员一览表。
●2.企业是否配备了与生产范围相适应的管理人员和技术人员。
●3.是否配备了一定数量的具有相应专业知识及实践经验的能够履行其职责的管理和技术人员。
● 4 .以上人员均应为全职人员,不能兼职或挂名。
●*0401 主管生产和质量管理的企业负责人应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,应对本规范的实施和产品质量负责。
(一般项提升为关键项)●1.主管药品生产和质量的企业负责人应具有条款规定的教育和实践经验。
●所接受的教育通常包括下列学科:化学(分析化学或有机化学)或生物化学;化学工程;药学;药理学和毒理学;生理学或其他有关学科。
●2.条款中要求的相应资历,从企业人员一览表的相关资料中确认。
●3.主管生产和质量管理的企业负责人,一般应具有三年以上药品生产和质量管理的实践经验。
●*0501 生产管理和质量管理的部门负责人应具有医药或相关专业大专以上学历,并具有药品生产和质量管理的实践经验,有能力对药品生产和质量管理中的实际问题做出正确的判断和处理。
