医疗器械初包装验证方案
- 格式:doc
- 大小:39.00 KB
- 文档页数:5

医疗器械检验规程1. 引言医疗器械检验是保障医疗器械品质和安全性的重要环节。
本文档旨在规范医疗器械检验的流程和标准,确保医疗器械的质量符合相关法规和标准要求。
2. 检验范围本检验规程适用于各类医疗器械的检验工作,包括但不限于手术器械、医用耗材、诊断设备等。
凡是出厂前需要经过检验验证品质的医疗器械,都适用本规程。
3. 检验流程医疗器械的检验流程主要包括以下环节:3.1 接收检验接收检验是指在医疗器械到货后的首次检验。
接收检验应包括检查产品包装完好无损、产品标识和标签是否齐全、附件是否齐备等内容。
3.2 外观检验外观检验是指对医疗器械的外观进行检查。
例如,对器械表面的光滑度、颜色、标示等进行检查,确保外观合格。
3.3 组装检验组装检验是指对需要组装的医疗器械进行检查。
该检验内容包括对各部件的完整性和相互配合的检验,确保组装后的器械可以正常使用。
3.4 功能检验功能检验是指对医疗器械的功能进行测试。
通过操作和测试医疗器械,检查功能是否正常并满足相关要求。
3.5 安全检验安全检验是指对医疗器械的安全性进行评估。
通过对器械的电器安全、辐射安全、材料安全等方面进行检查和测试,确保器械使用过程中的安全性。
3.6 包装检验包装检验是指对医疗器械的包装进行检查。
检查器械包装是否完好、标识是否清晰等,以保障产品在运输和储存过程中的完整性。
4. 检验标准医疗器械的检验标准应遵循国家相关法规和标准要求。
例如,对于医用耗材,检验标准可以参考国家药监局发布的《药品包装材料和验收规范》等。
5. 检验报告每次检验都应生成相应的检验报告。
检验报告内容应包括被检验器械的基本信息、检验结果和评价、检验人员和日期等。
检验报告应详细记录检验过程和结果,以便对器械质量进行溯源和评估。
6. 检验记录与管理所有的检验记录和报告均应妥善保存,并建立相应的检验记录和报告管理系统。
通过建立记录和管理系统,可以追溯医疗器械的检验历史,并及时调整和改进检验工作的流程和标准。

医疗器械包装验证的内容和方法参考目录刖三 (1)1.无菌医疗器械包装材料评估要点解析 (1)2.微生物屏障能力 (2)3.生物相容性和毒理学特性要求 (2)4.物理和化学性能要求 (3)5.成型与密封过程的适应性 (3)6.与预期灭菌过程的适应性 (3)7.灭菌前和灭菌后的贮存寿命限度要求 (4)8.与标签系统的适应性 (4)9.最终灭菌包装无菌有效期的验证 (4)10.毒性物质要求 (4)11.涂料材料要求 (4)12.对医疗器械产生的副作用要求 (5)13.便捷/洁净开启性要求 (5)14.包装材料与标签印刷相适应的要求 (5)15.包装材料对外在条件的敏感度要求 (5)刖百无菌医疗器械包装设计和开发是一项复杂而重要的系统性工作,无菌医疗器械包装材料的选择是重中之重。
无菌医疗器械包装材料的选择应结合预期内包装物实际情况进行全面的评价,一般考虑如下要求。
1.无菌医疗器械包装材料评估要点解析无菌医疗器械包装材料直接关系到产品的质量,所以在开发阶段,研发人员应结合预期包装物实际情况进行如下的全面评估:1、微生物屏障能力;2、生物相容性和毒理学特性要求;3、物理和化学性能要求;4、成型与密封过程的适应性;5、与预期灭菌过程的适应性;6、灭菌前后的贮存寿命限度要求;7、毒性物质要求;8、涂胶材料要求;9、对医疗器械产生的副作用要求;10、便捷、洁净开启性要求;11、包装材料与标签印刷相适应的要求;12、包装材料对外在条件的敏感度要求。
2.微生物屏障能力评价微生物屏障特性的两种方法:不透性材料的方法和多孔透气材料的方法。
其中(透气材料)参考ASTMF1608,不透气材料参考ISO11607:2006。
无菌包装材料应具有屏障微生物的能力,应具有提供、维护产品无菌的基本功能。
对于保障包装的完整性和产品的安全起到十分重要的作用。
对于无菌医疗器械来说,无菌性不能保障被认为是最严重的不合格事件。
评价微生物屏障特性的方法分两类:①适用于不透性材料的方法(如:2.5:636.5:2003中规定的葛尔莱Gurley法、GB/T458:2008肖波尔法)。

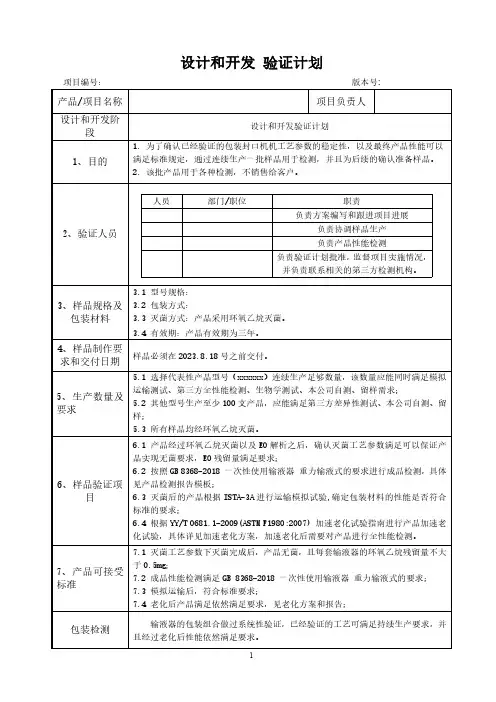
设计和开发验证计划项目编号:版本号:产品/项目名称项目负责人设计和开发阶段设计和开发验证计划1、目的1.为了确认已经验证的包装封口机机工艺参数的稳定性,以及最终产品性能可以满足标准规定,通过连续生产一批样品用于检测,并且为后续的确认准备样品。
2.该批产品用于各种检测,不销售给客户。
2、验证人员人员部门/职位职责负责方案编写和跟进项目进展负责协调样品生产负责产品性能检测负责验证计划批准,监督项目实施情况,并负责联系相关的第三方检测机构。
3、样品规格及包装材料3.1型号规格:3.2包装方式:3.3灭菌方式:产品采用环氧乙烷灭菌。
3.4有效期:产品有效期为三年。
4、样品制作要求和交付日期样品必须在2023.8.18号之前交付。
5、生产数量及要求5.1选择代表性产品型号(xxxxxx)连续生产足够数量,该数量应能同时满足模拟运输测试、第三方全性能检测、生物学测试、本公司自测、留样需求;5.2其他型号生产至少100支产品,应能满足第三方差异性测试、本公司自测、留样;5.3所有样品均经环氧乙烷灭菌。
6、样品验证项目6.1产品经过环氧乙烷灭菌以及EO解析之后,确认灭菌工艺参数满足可以保证产品实现无菌要求,EO残留量满足要求;6.2按照GB8368-2018一次性使用输液器重力输液式的要求进行成品检测,具体见产品检测报告模板;6.3灭菌后的产品根据ISTA-3A进行运输模拟试验,确定包装材料的性能是否符合标准的要求;6.4根据YY/T0681.1-2009(ASTM F1980:2007)加速老化试验指南进行产品加速老化试验,具体详见加速老化方案,加速老化后需要对产品进行全性能检测。
7、产品可接受标准7.1灭菌工艺参数下灭菌完成后,产品无菌,且每套输液器的环氧乙烷残留量不大于0.5mg;7.2成品性能检测满足GB8368-2018一次性使用输液器重力输液式的要求;7.3模拟运输后,符合标准要求;7.4老化后产品满足依然满足要求,见老化方案和报告;包装检测输液器的包装组合做过系统性验证,已经验证的工艺可满足持续生产要求,并且经过老化后性能依然满足要求。


质量管理验证文件产品和原材料初始污染菌计数法验证方案编制:审核:批准:发布日期:年月日2222222222有限公司目录1基本情况2验证目的3验证方案编制依据4验证小组5验证方案6验证记录和报告附件:验证相关表单一览表1 / 171 基本情况初始污染菌数量表示医疗器械产品最终灭菌前的生物负载,用以检验医疗器械产品生产过程初始污染菌控制效果以及最终产品组成部分的相关外购件(如:初包装等)微生物总数,证明灭菌前产品微生物水平是否在确认的保证产品无菌的环氧乙烷灭菌工艺可控制接受范围内,保证医疗器械产品的热原和细菌内毒素生物指标满足产品技术要求,所以确定医疗器械产品初始污染菌洗脱培养计数检验方法的适宜性和准确性尤为重要。
基于YY/T 0287-2017《医疗器械质量管理体系用于法规的要求》“6.4.2污染控制”、“7.5.2产品的清洁”对医疗器械生产、储存、灭菌前过程产品清洁或污染控制要求,以及《医疗器械生产质量管理规范附录无菌医疗器械》第“2.5.3”和“2.7.4”条规定的医疗器械和原材料初始污染菌控制要求,必须对医疗器械产品原材料、待灭菌产品的初始污染菌进行检验和管控,为保证一次性使用输液器(带针)、一次性使用袋式输液器(带针)、一次性使用精密过滤输液器(带针)、一次性使用自动截流输液器(带针)、一次性使用无菌注射器(带针)、一次性使用无菌溶药注射器(带针)、一次性使用静脉输液针、一次性使用无菌注射针、一次性使用静脉采血针、一次性使用无菌阴道扩张器、一次性使用预引式气管导管异型套件、三腔胃管产品及产品原材料(包含产品初包装、橡胶活塞、注射针、输液针、针管、精密药液过滤器、乳胶帽、硅胶垫)的初始污染菌洗脱检验方法的正确适宜性和微生物培养计数准确性,确定用于补偿无法从医疗器械产品和原材料中完全采集培养计数微生物数值的修正系数,现制定产品和原材料初始污染菌计数法验证方案。
2 验证目的将确定数量微生物接种到经灭菌处理的原材料、医疗器械产品外表面和(或)内腔,形成人工生物负载,依据原材料和医疗器械产品的结构特点,在袋蠕动、震摇、冲洗、搅拌、碎裂等微生物采集方法中,选择能充分收集原材料和医疗器械产品外表面和(或)内腔微生物,且对原材料和医疗器械产品不产生降解、溶出等分解化学反应的适宜的采集方法,对接种于原材料、医疗器械产品外表面和(或)内腔的微生物进行采集,通过采集液薄膜过滤,对滤膜进行培养,点计原材料、医疗器械产品外表面和(或)内腔收集的微生物数量,同时分别对原材料、医疗器械产品的微生物采集、微生物培养、微生物计数法完整检验方法的适宜性和准确性进行验证,汇总验证过程记录数据计算并确定原材料、医疗器械产品外表面和(或)内腔初始污染菌回收修正系数,为制定原材料、医疗器械产品初始污染菌采集培养计数方法提供正确依据。

常熟市康宝医疗器械厂FSZ-980多功能薄膜封口机包装验证方案编制:案小日期:日期:2014-09-20审核:」也2猊日期:2014-09-20批准:总“工日期:2014-09-20目录1.概述2.验证目的3.验证小组成员名单4.确认范围5.验证依据及标准6.验证内容7.再验证8.最终评价及验证报告1.概述我公司生产的一次性使用集尿袋、一次性使用喂食袋、带扬克头吸引连接管、不带扬克头吸引连接管、一次性多用途灌肠袋产品,初包装采用纸塑袋包装袋,该包装袋由1059BTyvek 纸和PET/PE复合膜构成。
纸塑袋作为无菌医疗器械的初包装运用有30年的历史,纸塑袋具有高强度,高阻菌,寿命长,优异的抗微生物渗透能力,灭菌后撕口干净不带纸屑。
我公司现有安徽普天塑业有限公司生产的FSZ-980多功能薄膜封口机数台。
该封口机为操作方便,且使用状态良好。
封口机设备参数:封口温度:0〜300℃封口速度:0〜9档(可调,档数越高速度越快)2.目的根据EN ISO 13485:2012/AC:2012, ISO 11607-1:2006的要求,对包装袋封口进行有效性验证,以保证医疗器械的持续安全有效。
3.验证小组成员名单4.确认范围本确认方案仅适用于一次性使用集尿袋、一次性使用喂食袋、带扬克头吸引连接管、不带扬克头吸引连接管、一次性多用途灌肠袋初包装过程的确认,包装材料采用纸塑包装袋,封口设备采用FSZ-980多功能薄膜封口机。
5.验证依据及标准5.1ISO 11607-1:2006 Packaging for terminally sterilized medical devices Part 1: Requirements for materials, sterile barrier systems and packaging systems.5.2ISO 11607-2:2006 Packaging for terminally sterilized medical devices Part 2: Validation requirements for forming, sealing and assembly processes.5.3EN 868-5:2009 Packaging materials and systems for medical devices which are to be sterilizedPart 5: Heat and self-sealable pouches and reels of paper and plastic film construction—Requirement and test methods.5.4GB/T 15171-1994软包装件密封性能试验方法。


医疗器械工艺验证方案1. 引言在医疗器械的生产过程中,工艺验证是确保产品质量和安全性的重要步骤之一。
工艺验证通过验证制造过程中的各项参数,确保产品能够符合设计要求,并且能够稳定可靠地生产出来。
本文将介绍医疗器械工艺验证的目的、步骤和方法。
2. 目的工艺验证旨在确认制造过程的可控性和能力,并验证所采用的工艺是否能够生产符合要求的产品。
通过工艺验证,可以确定设计规格是否符合制造过程的实际情况,并对工艺进行优化和改进。
3. 步骤3.1 制定工艺验证计划在开始工艺验证之前,需要制定详细的验证计划。
验证计划应包括验证的目标、范围、方法和所需资源等信息。
在制定计划时,需考虑以下因素:•验证的目标和需求:明确验证的目标,以及验证需要达到的要求和标准。
•验证的范围:确定验证的范围,包括验证的工艺步骤、参数和所用的设备。
•验证的方法:选择适当的验证方法,如实验验证、统计分析、质量控制图等。
•所需资源:确定所需的人力、设备、时间和预算等资源。
3.2 进行实验验证实验验证是工艺验证的核心步骤之一。
在实验验证中,需要根据验证计划的要求,设计实验方案,并采集和分析实验数据。
实验验证的具体步骤如下:1.设计实验方案:根据验证的要求,确定实验的因素和水平,并设计实验方案,包括样本数量、实验次数、实验顺序等。
2.实施实验:按照实验方案进行实验,并记录实验数据。
3.数据分析:对实验数据进行统计分析,计算验证结果的可靠性和显著性。
4.结果评价:根据数据分析结果,评价工艺的可控性和能力,确定是否符合验证要求。
3.3 优化和改进工艺根据工艺验证的结果,对工艺进行优化和改进是必要的。
根据验证结果,可以确定工艺中存在的问题和不足,并采取相应的措施来改进工艺。
优化和改进工艺的步骤如下:1.问题分析:根据验证结果,分析工艺中存在的问题和不足。
2.制定改进方案:针对存在的问题,制定改进方案,并明确改进的目标和措施。
3.实施改进:按照改进方案,实施相应的改进措施,并记录改进过程和结果。


最终灭菌医疗器械的包装验证方案引言:灭菌是确保医疗器械在使用前不受微生物污染的重要步骤,而包装是保护灭菌器械免受再污染的关键。
为了确保医疗器械在包装过程中的灭菌有效性和包装的完整性,需要进行包装验证。
本文将提出一套适用于最终灭菌医疗器械的包装验证方案。
一、目的和范围本方案的目的是验证最终灭菌医疗器械的包装过程的有效性,并评估包装的完整性。
范围包括包装材料的选择、包装过程的操作验证和包装完整性的评估。
二、方法和流程1.包装材料的选择选择合适的包装材料对保护灭菌医疗器械的完整性至关重要。
因此,需要对包装材料进行验证,确保其符合要求。
2.包装过程的操作验证(1)验证包装操作人员的培训和能力:包装操作人员应接受相应的培训,了解包装操作的要求和操作步骤,熟悉所使用的包装材料和设备。
(2)验证包装过程的有效性:通过验证确保包装过程的有效性,包括使用正确的包装材料,正确的包装方法和适当的封口技术等。
验证方法可以包括监测包装过程中的温度、湿度和压力等参数,确保包装的灭菌效果。
3.包装完整性的评估(1)物理完整性的评估:使用可视化方法检查包装完整性,包括检查是否有撕裂、破损、穿孔或渗漏等现象。
(2)封口完整性的评估:通过使用封口完整性测试设备,检查包装袋的封口是否完好。
如果有任何封口不完整或破损,应立即进行修复或更换。
(3)包装材料的过期日期和批号的确认:确保所使用的包装材料的过期日期和批号是有效的,并与批准的供应商进行确认。
(4)包装的防护性能测试:进行一系列的防护性能测试,包括压力测试、撕裂强度测试、穿刺强度测试和渗漏测试等,以评估包装的性能。
三、记录和报告在包装验证过程中,需要记录和报告验证结果。
记录包括包装操作记录、包装材料验证记录、包装完整性评估记录等。
报告应详细描述验证过程、结果和结论。
四、验证频率和标准包装验证应定期进行,并符合相关标准和法规要求。
验证频率的确定应根据风险评估结果和历史数据进行。
五、验证结果的处理和跟踪如果在包装验证过程中发现任何问题或异常情况,应立即采取纠正和预防措施,并进行记录和跟踪。
医疗器械包装验证程序0、适用范围本文件适用于一次性使用无菌医疗器械的包装过程验证。
本文件不包括包装材料的选择、与之相关的内容参考ISO11607和/或EN 868-1的规定。
对于现行使用满意的包装材料,可用以往的实验数据或资料证明其对于产品的适应性、灭菌的适合性及生物兼容性。
1、程序成形和密封是影响包装的最关键的过程。
本文件针对此过程进行验证,完整的包装验证包括以下内容:——书面的包装验证计划;——设备鉴定; epY中国顾问师网——过程开发(对新开发的产品包装,对于以往使用满意的材料,可用史料证明);——过程验证; epY中国顾问师网——过程性能鉴定;——过程出证和重新验证。
过程开发、过程验证、过程性能鉴定阶段还应建立书面的过程确认计划,所有的试验步骤和用于验证是否符合要求的试验结果都应形成文件,并妥善保存,如无特殊规定,一般保存5年,特殊情况时根据包装材料和/或系统的失效日期和可追溯性等因素另行确定。
2、包装验证计划在进行验证试验之前,验证方案应形成书面文件。
验证计划应包括:——待鉴定的设计构型及产品标准;——预定使用的设备和仪器;——验证所需的资源配备及相关部门、人员的职责;——过程开发过程及验证的方法和具体步骤;——包装性能的试验项目、试验方法(包括试验方法的选择原理);——根据具体的医疗器械要求选择的(基于GB 2828-2003的AQL制订的)抽样方案(包括抽样方案的选择原理);3、设备鉴定在过程开始之前,应验证过程设备和辅助系统是否能始终在规定的设计和操作限度及公差下运行。
应有:a) 检测关键参数的能力;b) 所有相关仪器、传感器、显示器和控制器等的书面校准规程和检定(certified calibration)计划表;c) 成型/密封或其它闭合系统、固定器(工具)的书面检测结果;d) 书面防护计划和清洁程序;e) 软件确认(如适用);f) 书面的操作人员培训。
4、过程开发对于新产品,应该进行过程评价,但产品开发中的过程开发结果可为过程评价提供支持性文件;对于现有产品的包装验证,过程开发可以在OQ确认的基础上简化。
医疗器械产品生产工艺验证方案及报告范例下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!医疗器械产品生产工艺验证方案及报告范例1. 引言在医疗器械行业,产品生产工艺验证是确保产品质量和安全性的重要步骤之一。
WORD文档,可下载修改最终灭菌医疗器械的包装验证报告1.0 包装材料和系统的验证1.1 包装材料的选择评估内容:1.1.1 包装材料的物理化学特性评价目的:可供选择的包装材料基本的物理、化学性能符合产品要求。
评价项目:对包装材料进行物理特性(如外观、克重、厚度、透气性、耐水度、撕裂强度等)、化学特性(如薄膜的溶出物指标、pH值、氯、硫含量等)的评价。
判定方法:通过确认供应商提供的质量保证书验证。
判定结论:验证人:日期:复核人:日期:1.1.2 包装材料的毒理学特征评价项目:确认包装材料不应释放出足以损害健康的毒性物质。
评价项目:对包装材料进行细胞毒性试验、皮内反应试验、皮肤致敏试验、急性全身毒性试验和溶血试验;判定方法:通过供应商提供的生物相容性与毒性测试报告验证。
判定结论:验证人:日期:复核人:日期:1.1.3 包装材料与成型和密封过程的适应性评价目的:确认包装材料与成型和密封过程的适应性。
评价项目:外观、热封强度、包装完整性。
判定方法:通过供应商提供的相关测试报告验证。
判定结论:验证人:日期:复核人:日期:1.1.4 包装材料的微生物屏障特性评价目的:确认包装材料对微生物的屏障特性,以确保维持灭菌后产品的无菌性。
评价项目:对灭菌袋(PET/PE薄膜+医用透析纸包装)进行微生物屏障特性试验。
判定标准:按ISO11607-1:2006附录C测定。
判定方法:通过供应商提供的微生物阻隔测试报告验证。
判定结论:验证人:日期:复核人:日期:1.1.5 包装材料与灭菌过程的相适应性A、灭菌袋的生物负载量验证项目:灭菌袋的生物负载量验证依据:按GB15980-1995、GB 7918.2试验结论验证人:日期:复核人:日期:B、灭菌适应性验证项目:无菌性、灭菌袋的热封强度验证依据:ISO11138-2:1994、EN868-5:1999无菌性检测:验证人:日期:复核人:日期:灭菌袋热封强度检测:验证人:日期:复核人:日期:1.1.6 包装材料与标识系统的相适应性评价目的:包装材料与标签系统在确定的灭菌条件的的适应性。
LOGOXXX 医疗器械有限公司XXX Medical Devices Inc.特卫强(Tyvek)无菌包装3年有效期验证报告目录1 概述 (4)2 目的 (4)3 范围 (4)4 参照文件 (4)5 确认方案及流程 (5)6 验证小组成员及职责 (5)7 验证准备 (6)7.1 检测项目与时间点确认 (6)7.2 验证所需设备清单 (6)7.3 文件确认 (6)8 验证人员确认 (7)8.1 人员确认要求 (7)8.2 方案培训时间 (7)8.3 培训确认报告 (7)9 验证方案 (7)9.1 验证步骤 (7)9.2 环氧乙烷灭菌参数 (8)9.3 加速老化计划 (8)10 检测项目 (8)10.1 包装材料的理化特性评价 (8)10.2 包装材料的生物相容性评价 (9)10.3 包装外观检测 (9)10.4 染色渗透测试 (9)10.5 剥离测试 (10)10.6 封口强度测试 (10)10.7 包装阻菌性测试 (11)11 验证测试结果分析及结论 (11)12 再验证周期 (11)13 附件(验证记录) (112)1概述XXX产品属于二类无菌医疗器械产品,我公司在其包装材质选择方面,采用的是杜邦Tyvek医用纸塑袋。
杜邦Tyvek(特卫强)俗称“撕不烂”,是杜邦公司用高密度聚乙烯纤维材料,它拥有厚度薄、重量轻、柔软平滑、不透明、抗水渍、表面摩擦力小,结合了纸、布及薄膜所具之的特点。
因此被广泛应用在医疗包装上,是目前公认的最好的医疗包装材料。
使用杜邦Tyvek制作的医用纸塑袋,具有透气性高(减少极端温度冷凝水的产生)、灭菌适应性强、良好的生物兼容性等特点,同时使用过程中,具有剥离无粉尘、高撕裂包装强度,高耐破包装,高封力,高阻菌期限(5年以上)等优点,安全防护效果优良。
满足众多II类、III类医疗器械的包装要求。
(目前为透析材料里最好的医疗包装)2目的按照标准中加速老化的方法,对杜邦Tyvek医用纸塑袋进行试验,确认在放置预期时间后,其包装袋的外观、封口剥离强度、渗漏等主要因素仍符合标准。
XXXX医疗器械有限公司
包装验证方案
编号:XX4-JS-024
拟制/日期:
审核/日期:
批准/日期:
目录
一、方案概
述 (3)
二、过程概述 (3)
三、验证步骤 (4)
四、异常状况处理 (4)
五、验证评定及结论 (5)
一、方案概述
1、名称:包装验证方案
2、目的:通过对包装过程和人员资格进行验证和确认,以认定包装是否满足公司规定要求
3、内容:包装设备的安装确认、包装操作过程确认、包装性能的确认
4、类别:确认。
5、依据:XX3-JS-017 《成品包装通用工艺规程》, XX3-JS-026 《初包装封口操作规程》,XX3-JS-028 《清洗,包装检验规程》
6、方案适用产品:所有需要包装的产品
7、参与验证部门:技术部、生产部、采购部、质管部
8、具体实施部门:技术部、生产部、采购部、质管部
9、文件存档部门:技术部。
10、验证小组的构成:
验证小组成员名单
11、验证涉及场所:清洗包装车间。
12、相关文件
1) 图纸及工艺文件
2)本方案涉及到的其他相关文件
二、过程简述
1、设备安装确认(IQ)
确认设备的完整性,安装的正确性;测量装置鉴定;启动设备,验证其运行的可行性;
2) 操作过程确认(OQ)
人员资格确认,确认设备的使用正确,设计工艺参数;
3)产品性能确认(PQ)
检验分析产品的合格性;
三、验证步骤
1 概述
本次确认使用的材料为PE包装袋。
材料的技术参数见供应商提供的资料。
2 验证涉及场所:包装车间。
3 设备安装确认(IQ)
1) 主要设备如下:
SF-900多功能塑料封口机
2)技术资料检查归档
设备供应商提供的图纸、设备清单、各类证书、说明书或手册是否齐全。
3) 操作规程及培训
主要设备供方应制订相应的操作、清洗、日常维修规程。
员工应有培训记录。
4)设备运行和性能确认
查阅供方提供相关设备安装验收记录、设备运行及维护/修记录、有关仪表检定合格证或定期检定记录台帐是否符合要求。
4 操作过程确认(OQ)
4.1根据GMP规定,现重新做包装确认。
4.2确认包装的生产过程及生产的工艺流程
OQ的目的在于确定合适的包装过程以及包装工艺,设定工艺控制的上下限度,确定最佳的包装工艺,寻找影响包装效果的因子,同时挑战工艺的极限,确保工艺的稳定性。
4.3确定包装参数
由于去年已对初包装所需条件进行选取确认,故今年只需对该条件进行验证确认。
初包装封口尺寸为8±0.15mm,封口机温度范围为180-190℃,封口剥离力≥2.5N。
(用SF-900实验时所用包装袋为PE包装袋,大小均为80mmX120mm。
实验所用数量为10个/次)
2) 人员资质
查员工培训记录,确认员工经过培训,有胜任所在岗位的能力,某些特殊岗位应持证上岗。
5 产品性能确认(PQ)
5.1目测要求用肉眼或放大镜观察,以产品包装无明显污染物、脏点、变色和破漏等缺陷为接受标准;纸袋各部分平整,不得有明显的褶皱现象。
5.2热封强度测试使用仪器测量封口剥离力,指定样品的热封强度必须达到依据产品包装方式和采用的包装材料所确定的标准,对于本产品性质,热封强度值取不小于1.5N/15mm。
具体实验测试方法参考YY/T0698-2009,拉伸速度取200mm/min,测试角度为180度;样品宽度为15mm。
5.3 包装材料由于是使用的材料为PE包装袋。
材料的体技术参数见供应商提供的资料。
四、异常状况处理
生产过程中应严格按照标准要求、操作规程、维护保养规程进行操作和判定。
若出现工艺参数、标准要求、设备更换、工作地点变动时则重新进行确认。
若出现个别检验项目不符合标准的规定时,应按下列程序进行处理:
1、重检不合格项目或全部项目。
2、若属设备运行方面的原因,请厂家修理或调整设备运行参数或对设备进
行处理。
3、调整不合格的工艺参数重新进行OQ确认,直至检验结果合格。
五、验证评定及结论
1 验证小组根据验证情况,作出相应的软件验证报告
2 结果评价:
验证结束后,验证小组应将验证结果整理汇总,编写验证报告
3 验证结果
详见:《包装验证报告》
4 验证周期
验证小组负责根据验证情况,拟定软件再验证周期。