(完整版)氧化性和还原性及元素周期律
- 格式:doc
- 大小:30.36 KB
- 文档页数:8

”核外电子(Z 个)1.微粒间数目关系最外层电子数决定元素的化学性质质子数(Z )=核电荷数=原子数序原子序数:按质子数由小大到的顺序给元素排序,所得序号为元素的原子序数。
质量数(A )=质子数(Z )+中子数4.电子总数为最外层电子数 2倍:4Be 。
4.1~20号元素组成的微粒的结构特点元素周期律决定原子种类,中子N (不带电荷), ________________________f 原子核- 质量数(A=N+ZI 质子Z (带正电荷)丿T 核电荷数 ____________豪同位素(核素)—近似相对原子质量事元素 T 元素符号原子结构 : (A x ) 「最外层电子数决定主族元素的■■ f 电子数(Z 个):丿1 ---〔化学性质及最高正价和族序数-■体积小,运动速率高(近光速),无固定轨道核外电子J 运动特征 JL 电子云(比喻)——> 小黑点的意义、小黑点密度的意义。
排布规律 T 电子层数兰J 周期序数及原子半径 ■表示方法 T 原子(离子)的电子式、原子结构示意图决定原子呈电中性原子(AZ X)_______ 2质子(Z 个)]——决定元素种类 原子核卜中子 (A-Z )个决定同位素种类中性原子:质子数=核外电子数 离子:质子数 =核外电子数+ 所带电荷数 离子:质子数=核外电子数一所带电荷数2. 原子表达式及其含义Xd ±表示X 原子的质量数;Z 表示元素X 的质子数;d 表示微粒中X 原子的个数;c ±表示微粒所带的电荷数;±)表示微粒中X 元素的化合价。
3.原子结构的特殊性 (1~18号元素)1. 原子核中没有中子的原子:2 •最外层电子数与次外层电子数的倍数关系。
①最外层电子数与次外层电子数相等:4Be 、i8Ar ;②最外层电子数是次外层电子数 2倍:6C ;③最外层电子数是次外层电子数3倍:80;④最外层电子数是次外层电子数10Ne ;⑤最外层电子数是次外层电子数 1/2倍:3Li 、14Si 。
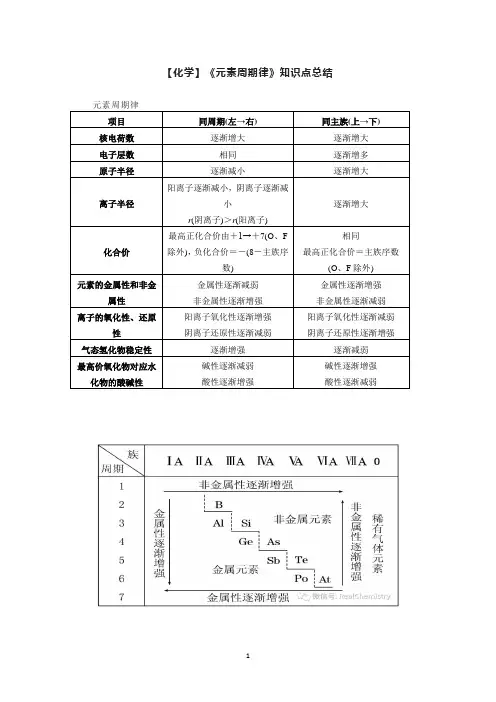
【化学】《元素周期律》知识点总结元素周期律项目同周期(左→右)同主族(上→下)核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小,阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大化合价最高正化合价由+1→+7(O、F除外),负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱重难突破一、元素金属性、非金属性比较1.元素金属性强弱的判断(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
典例2X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是()A.若X、Y均为金属元素,则X的金属性强于YB.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子强C.若X、Y均为非金属元素,则Y的非金属性比X强D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X【答案】B典例1已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是()A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y<X<ZC.原子半径:X>Y>ZD.原子最外层电子数:X<Y<Z【答案】A二、微粒半径大小的比较1. 同周期元素的微粒同周期元素的原子(稀有气体除外),从左到右原子半径或最高价阳离子的半径随核电荷数增大而逐渐减小。
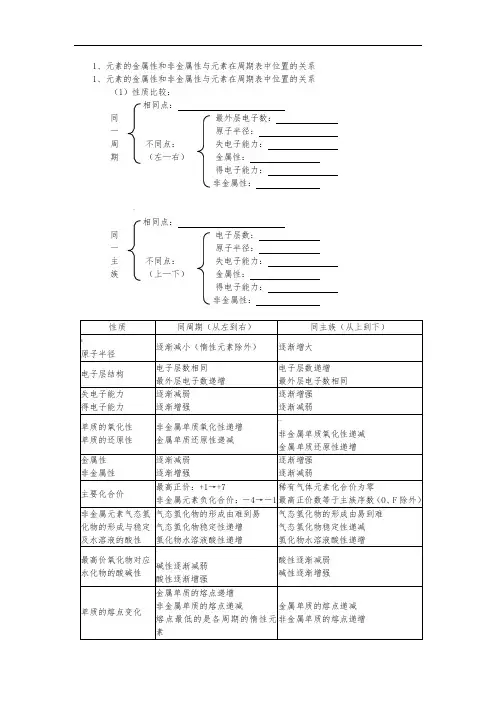
1、元素的金属性和非金属性与元素在周期表中位置的关系 1、元素的金属性和非金属性与元素在周期表中位置的关系 (1)性质比较:相同点:同最外层电子数: 一 原子半径:周 不同点: 失电子能力: 期 (左—右) 金属性: 得电子能力:非金属性:-相同点:同电子层数:一 原子半径: 主 不同点: 失电子能力: 族 (上—下) 金属性:得电子能力:非金属性:元素周期表中主族元素性质的周期性递变规律结论:原子结构与元素在周期表中的位置的关系1、原子核外电子层数== 周期序数2、主族元素的最外层电子数==族序数==主族元素最高正价(O、F 除外)3、原子核外电子数==原子序数==质子数==核电荷数4、主族元素最高正价+ |最低负价|==8、三、核素、同位素1、核素:具有一定数目的质子和一定数目的中子的一种原子叫核素如:11H、21H、31H各为一种核素2、同位素:具有相同质子数和不同中子数的原子互称为同位素如:氧元素有168O、178O、188O三种同位素3、同位素的特性:(1)同一元素的各种同位素虽然质量数不同,但它们的化学性质基本相同(2)在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子百分比一般是不变的。
四、相对质量1、原子的相对原子质量:指一种原子的实际质量与126C的实际质量的1/12的比值,也称同位素的相对原子质量。
@2、元素的相对原子质量:指某元素各同位素的相对原子质量与该同位素原子所占的原子个数百分比的乘积之和。
=M1·a% + M2·b% +……3、元素的近似相对原子质量:是用同位素的质量数及其所占的原子个数比计算出来的平均值。
=A1·a% + A2·b% +……例:已知铜有63Cu 和65Cu 两种同位素,铜元素的原子量是,求63Cu 和65Cu 的原子个数比。
五、元素周期表的应用:1预测元素的性质(由递变规律推测):给出一种不常见的主族元素(如砹、碲、铋、铅、铟、镭、铯等),或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。

物质氧化性、还原性强弱的判断物质氧化性(得电子的能力)、还原性(失电子的能力)的强弱取决于物质得失电子的难易,与得失电子的数目无关,但也与外界因素(如反应条件、反应物浓度、酸碱性等)有关,具体判断方法如下:1.依据氧化还原反应原理判断(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.依据“二表、一律”判断(1)依据元素周期表判断①同主族元素对应单质的氧化性从上到下逐渐减弱,对应阴离子的还原性逐渐增强。
②同周期元素对应单质的还原性从左到右逐渐减弱,氧化性逐渐增强。
Na Mg Al Si P S Cl2还原性减弱,氧化性增强――――――――――――――――――――――――→(2)依据金属活动性顺序表判断(3)依据元素周期律判断①非金属元素的最高价氧化物对应水化物的酸性越强,其对应单质的氧化性越强。
如酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3,则氧化性:Cl2>S>P>C>Si。
②金属元素的最高价氧化物对应水化物的碱性越强,其对应单质的还原性越强。
如碱性:NaOH>Mg(OH)2>Al(OH)3,则还原性:Na>Mg>Al。
3.依据产物中元素价态的高低判断(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
例如:(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
例如:4.依据反应条件判断[细练过关]题点(一)氧化性、还原性强弱判断与应用1.根据下列反应,判断有关物质的氧化性由强到弱的顺序正确的是()①Cl2+2KI===2KCl+I2②2FeCl2+Cl2===2FeCl3③2FeCl3+2HI===2FeCl2+2HCl+I2④H2S+I2===S↓+2HIA.H2S>I2>Fe3+>Cl2B.Cl2>Fe3+>I2>SC.Fe3+>Cl2>H2S>I2D.Cl2>I2>Fe3+>H2解析:选B由反应①可知氧化性:Cl2>I2,由反应②可知氧化性:Cl2>Fe3+,由反应③可知氧化性:Fe3+>I2;由反应④可知氧化性:I2>S,则氧化性:Cl2>Fe3+>I2>S。

氧化还原反应知识点归纳氧化还原一、概念1、氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应氧化还原反应:凡有元素化合价升降的化学反应就是氧化还原反应2、氧化剂和还原剂(反应物)氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力3、氧化产物:氧化后的生成物还原产物:还原后的生成物。
4、被氧化:还原剂在反应时化合价升高的过程被还原:氧化剂在反应时化合价降低的过程5、氧化性:氧化剂具有的得电子的能力还原性:还原剂具有的失电子的能力6、氧化还原反应的实质:电子的转移(电子的得失或共用电子对的偏移 口诀:失.电子,化合价升.高,被氧.化(氧化反应),还原剂; 得.电子,化合价降.低,被还.原(还原反应),氧化剂;7、氧化还原反应中电子转移(或得失)的表示方法(1)双线桥法:表示同种元素在反应前后得失电子的情况。
用带箭头的连线从化合价升高的元素开始,指向化合价降低的元素,再在连线上方标出电子转移的数目.化合价降低 +ne - 被还原氧化剂 + 还原剂 = 还原产物 + 氧化产物化合价升高 -ne -被氧化(2)单线桥法:表示反应物中氧化剂、还原剂间电子转移的方向和数目。
在单线桥法中,箭头的指向已经表明了电子转移的方向,因此不能再在线桥上写“得”、“失”字样.二、物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强还原性→失电子性,失去电子越容易→还原性越强由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1.‘两表’一规律‘(1)根据金属活动性顺序表判断:一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。


专题二氧化还原反应【主干知识整合】一.了解基本概念二.氧化还原反应的一般规律1、表现性质规律同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
2、性质强弱规律氧化剂+ 还原剂= 还原产物+ 氧化产物氧化剂得电子→ 还原产物还原剂失电子→ 氧化产物氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物3、反应先后规律在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。
例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+4、价态归中规律含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
5、电子守恒规律在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
三.氧化性、还原性大小的比较1、由元素的金属性或非金属性比较a、金属阳离子的氧化性随其单质还原性的增强而减弱b、非金属阴离子的还原性随其单质的氧化性增强而减弱2、由反应条件的难易比较不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。
如:2KMnO4+ 16HCl = 2KCl + 2MnCl2+ 5Cl2↑ + 8H2O(常温)MnO2+ 4HCl(浓)= MnCl2+ Cl2↑ +2H2O (加热)前者比后者容易发生反应,可判断氧化性:KMnO4>MnO2。
同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
3、根据被氧化或被还原的程度不同进行比较当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。
如:2Fe + 3Cl 22FeCl3,S + Fe FeS ,根据铁被氧化程度的不同(Fe3+、Fe2+),可判断氧化性:Cl2>S。

化学元素周期表百科名片化学元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
现代化学的元素周期律是1869年的德米特里·伊万诺维奇·门捷列夫首创的。
19 13年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年修订后才成为当代的周期表。
常见的元素周期表为长式元素周期表。
在长式元素周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族,最后有两个系。
除长式元素周期表外,常见的还有短式元素周期表,螺旋元素周期表,三角元素周期表等。
道尔顿提出科学原子论后,随着各种元素的相对原子质量的数据日益完善和原子价(化合价)概念的提出,就使元素相对原子质量与性质(包括化合价)之间的联系显露出来。
德国化学家德贝莱纳就提出了“三元素组”观点。
他把当时已知的54种元素中的15种,分成5组,每组的三种元素性质相似,而且中间元素的相对原子质量等于较轻和较重的两个元素相对原子质量之和的一半。
例如钙、锶、钡,性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
法国矿物学家尚古多提出了一个“螺旋图”的分类方法。
他将已知的62种元素按相对原子质量的大小顺序,标记在绕着圆柱体上升的螺旋线上,这样某些性质相近的元素恰好出现在同一母线上。
这种排列方法很有趣,但要达到井然有序的程度还有困难。
另外尚古多的文字也比较暧昧,不易理解,虽然是煞费苦心的大作,但长期未能让人理解。
英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一一个元素的性质相近。

的1表示最外层电子的数目(是电子自旋态以及pauli原理决定的)。
详情请参考量子力学。
1 H 1s12 He 1s23 Li 2s14 Be 2s25 B 2s2 2p16 C 2s2 2p27 N 2s2 2p38 O2s2 2p49 F 2s2 2p510 Ne 2s2 2p611 Na 3s112 Mg 3s213 Al 3s2 3p114 Si 3s2 3p215 P 3s2 3p316 S 3s2 3p417 Cl 3s2 3p518 Ar 3s2 3p619 K 4s120 Ca 4s221 Sc 3d1 4s222 Ti 3d2 4s223 V 3d3 4s224 Cr 3d5 4s125 Mn 3d5 4s226 Fe 3d6 4s227 Co 3d7 4s228 Ni 3d8 4s229 Cu 3d10 4s130 Zn 3d10 4s231 Ga 4s2 4p132 Ge 4s2 4p233 As 4s2 4p334 Se 4s2 4p435 Br 4s2 4p536 Kr 4s2 4p637 Rb 5s138 Sr 5s239 Y 4d1 5s240 Zr 4d2 5s241 Nb 4d4 5s142 Mo 4d5 5s143 Tc 4d5 5s244 Ru 4d7 5s145 Rh 4d8 5s146 Pd 4d1047 Ag 4d10 5s148 Cd 4d10 5s249 In 5s2 5p150 Sn 5s2 5p251 Sb 5s2 5p352 Te 5s2 5p453 I 5s2 5p554 Xe 5s2 5p655 Cs 6s156 Ba 6s257 La 5d1 6s258 Ce 4f1 5d1 6s259 Pr 4f3 6s260 Nd 4f4 6s261 Pm 4f5 6s262 Sm 4f6 6s263 Eu 4f7 6s264 Gd 4f7 5d1 6s265 Tb 4f9 6s266 Dy 4f10 6s267 Ho 4f11 6s268 Er 4f12 6s269 Tm 4f13 6s270 Yb 4f14 6s271 Lu 4f14 5d1 6s272 Hf 5d2 6s273 Ta 5d3 6s274 W 5d4 6s275 Re 5d5 6s276 Os 5d6 6s277 Ir 5d7 6s278 Pt 5d9 6s179 Au 5d10 6s180 Hg 5d10 6s281 Tl 6s2 6p182 Pb 6s2 6p283 Bi 6s2 6p384 Po 6s2 6p485 At 6s2 6p586 Rn 6s2 6p687 Fr 7s188 Ra 7s289 Ac 6d1 7s290 Th 6d2 7s291 Pa 5f2 6d1 7s292 U 5f3 6d1 7s293 Np 5f4 6d1 7s294 Pu 5f6 7s295 Am 5f7 7s296 Cm 5f7 6d1 7s297 Bk 5f9 7s298 Cf 5f10 7s299 Es 5f11 7s2100 Fm 5f12 7s2101 Md (5f13 7s2) 102 No (5f14 7s2) 103 Lr (5f14 6d17s2) 104 Rf (6d2 7s2)105 Db (6d3 7s2)106 Sg 5f146d47s2 107 Bh 5f146d57s2 108 Hs 5f146d67s2 109 Mt 5f146d77s2 110 Ds 5f146d97s1 111 Rg 5f146d107s1112 Cn 5f146d107s2113 Uut 5f146d107s27p1114 Uuq 5f146d107s27p2115 Uup 5f146d107s27p3116 Uuh 5f146d107s27p4117 Uus 5f146d107s27p5118 Uuo 5f146d107s27p61 原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。

化学元素周期表的规律总结?比如金属性非金属性等元素周期表中元素及其化合物的递变性规律1 原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2 元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3) 所有单质都显零价3 单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增4 元素的金属性与非金属性(1)同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
5 最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
6 非金属气态氢化物元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
7 单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
二、主要化合价(最高正化合价和最低负化合价)同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
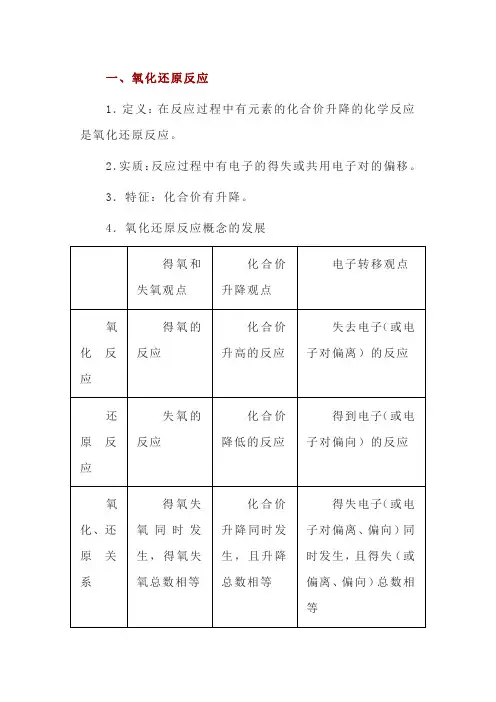
一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展二、氧化还原反应与四种基本反应类型1.四种基本类型的反应2.氧化还原反应与四种基本类型反应的关系①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!解释:四、氧化还原反应电子转移表示方法双线桥法:(1)两条桥线从反应物指向生成物,且对准同种元素;(2)要标明“得”“失”电子,且数目要相等;(3)箭头不代表电子转移的方向。
单线桥法:(1)一条桥线表示不同元素原子得失电子的情况;(2)不需标明“得”“失”电子,只标明电子转移的数目;(3)箭头表示电子转移的方向;(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)(2)元素处于高价时的含氧酸(硝酸、浓硫酸)(3)元素处于高价时的盐:(KClO3、KMnO4、FeCl3)(4)过氧化物(H2O2、Na2O2)(5)其它(HClO)常见的还原剂(处于低价态的元素的单质或化合物):(1)活泼的金属单质:K、Na、Mg等;(2)非金属单质:H2、C、Si等;(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
Al3+/Al,-1.66V)。
②铍和铝经浓硝酸处理都表现钝化,而其它碱土金属均易与硝酸反应。
③铍和铝都是两性金属,既能溶于酸也能溶于碱。
④氢氧化物均为两性,而其它碱土金属氢氧化物均为碱性。
⑤BeO和Al2O3都有高熔点和高硬度。
⑥铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,易升华、易聚合,易溶于有机溶剂。
3、硼和硅的相似性。
B和Si虽是不同族元素,在周期表中处于相邻族的对角位置,由于离子极化作用相近(Si4+电荷高一些,但半径大;B3+电荷低一些,但半径小),性质上有许多相似之处。
①单质晶体都是高熔点原子晶体;与键强度相关。
②在自然界均以含氧化合物存在。
③卤化物都彻底水解,生成含B─O,Si─O键的化合物(硅酸、硼酸)④都有一系列氢化物,氢化物均有挥发性,不稳定。
⑤含氧酸都是弱酸,含氧酸盐都易水解对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律;对此可以用离子极化的观点加以粗略的说明。
同一周期最外层电子构型相同的金属离子,从左至右随离子电荷的增加而引起极化作用的增强;同一族电荷相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱。
因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质比较相似。
由此反映出物质的结构与性质之间的内在联系。
三. 周期表中的变化规律(一) 同一元素:r -离子>r原子>r+离子>r2+离子(二) 同一周期1. 短周期:每一个短周期从左到右,有效核电荷依次增大,所以原子半径依次递减.2. 长周期:过渡元素自左至右,电子逐一填入(n-1)d层,而它对核的屏蔽作用较小,所以自左向右半径减小的幅度不如主族元素那么大.3. 内过渡元素:电子填入再次外层的(n-2)f层,由于f电子对核的屏蔽作用更小,使得原子半径由左至右收缩的平均幅度更小.比较短周期和长周期,相邻元素原子半径减小的平均幅度大致是非过渡元素>过渡元素>内过渡元素(~10pm)(~5pm)(<1pm)(三) 同一族1. 主族:同一主族由上而下,原子半径一般是增大的.因为同族元素原子由上而下电子层数增多,所以半径由上至下依次增大.2. 副族:副族元素由上至下,原子半径增大的幅度较小,特别是五,六周期的同族元素原子半径非常接近,这是由于后面要提到的镧系收缩效应所造成的结果.特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯(Cs)。
定义:元素周期律,指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的递增呈周期性变化的规律。
内容:结合元素周期表,元素周期律可以表述为:元素的性质随着原子序数的递增而呈周期性的递变规律。
原子半径:同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
总体来说:左下方>右上方阴阳离子的半径大小辨别规律:由于阴离子是电子最外层得到了电子而阳离子是失去了电子,所以,总的说来,同种元素的:阳离子半径<原子半径<阴离子半径。
同周期内,阳离子半径逐渐减小,阴离子半径逐渐增加。
同主族内离子半径逐渐增大。
小结:对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
(不适合用于稀有气体)主要化合价:同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F(O无最高正价,F无正价,)元素除外。
最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
元素最高价的绝对值与最低价的绝对值的和为8,代数和为0,2,4,6的偶数之一(仅限除O,F的非金属)。
金属性、非金属性、氧化性、还原性:同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增。
a.单质氧化性越强,还原性越弱,对应简单阴离子的还原性越弱,简单阳离子的氧化性越强。
b.单质与氢气越容易反应,反应越剧烈,其氢化物越稳定。
c.最高价氧化物对应水化物(含氧酸)酸性越强。
同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
a.单质还原性越强,氧化性越弱,对应简单阴离子的还原性越强,简单阳离子的氧化性越弱。
b.单质与水或酸越容易反应,反应越剧烈,单质与氢气越不容易反应;c.最高价氧化物对应水化物(氢氧化物)碱性越强。
为了达到稳定状态,不同的原子选择不同的方式。
表格说明周期表化学元素周期表图集(20张)的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目)递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。
沿着周期表向下,周期的长度逐渐上升,并按元素的电子排布划分出s区元素、p区元素、d区元素和f区元素。
而同一栏中的则称为同一族,同一族的元素有着相似的化学性质。
在印刷的周期表中,会列出元素的符号和原子序数。
而很多亦会附有以下的资料,以元素X为例:A:质量数(Mass number) ,即在数量上等于原子核(质子加中子)的粒子数目。
Z:原子序数,即是质子的数目。
由于它是固定的,一般不会标示出来。
e:净电荷,正负号写在数字后面。
n:原子数目,元素在非单原子状态(分子或化合物)时的数目。
除此之外,部份较高级的周期表更会列出元素的电子排布、电负性和价电子数目。
元素读音第一周期元素:1 氢(qīng) 2 氦(hài) 元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi) 第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà) 第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè) 第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān) 第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng) 第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鈩(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109 䥑(mài) 110 鐽(dá) 111 錀(lún) 112 鎶(gē)[暂定] 注:新元素汉字请使用Win7系统浏览,XP系统下无法显示。
授课教案学员姓名:_____________ 授课教师:__徐莹_____ 所授科目:__化学_______学员年级:__ __ 上课时间:____年__月__日___时___分至___时__分共_ 小时教学标题元素周期表与元素周期律教学目标位构性的统一教学重难点元素周期律上次作业检查授课内容:一、元素周期律:1. 随着原子序数的递增,原子核外电子层排布变化的规律性2. 随着原子序数的递增,元素原子半径变化的规律性【提示】稀有气体元素的原子半径并未列出,这是由于其原子半径的测定与相邻非金属元素的依据不同,数字不具有可比性,故不列出。
【拓展学习】怎样根据粒子结构示意图来判断原子半径和简单离子半径的大小呢?原子半径和离子半径的大小主要是由核电荷数、电子层数和核外电子数决定的..................................。
a.当电子层数及核电荷数均不同时,数越多的,半径越大。
如Na与K。
b.当电子层数相同,核电荷数不同时,数越大的,半径越小。
如Na与Mg。
c.当核电荷数相同,电子层数也相同时,核外数越多的,半径越大。
如Cl与Cl-。
3. 随着原子序数的递增,元素化合价变化的规律性4. 随着原子序数的递增,元素性质(金属性和非金属性)变化的规律性5. 随着原子序数的递增,元素性质(第一电离能、电负性)变化的规律性小结1.元素金属性和非金属性强弱的判断依据:(1)比较元素的金属性强弱,通常从以下四方面考虑:①单质与水或酸反应置换出氢的难易;②最高价氧化物对应水化物的碱性强弱;③单质的还原性(或离子的氧化性)的强弱;④金属单质间的置换反应。
(2)比较元素的非金属性强弱,也可从以下四个方面考虑:①单质与H2反应生成气态氢化物的难易和氢化物的稳定性;②最高价氧化物对应水化物的酸性强弱;③单质的氧化性(或离子的还原性)的强弱;④非金属单质间的置换反应。
2.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
氧化性、还原性强弱的比较1.元素的化合价与物质氧化性、还原性的关系对于可变价态的元素来说,它处于最高价态时,只具有氧化性,处于最低价态时,只具有还原性,处于中间价态时既有氧化性又有还原性。
但特别注意,元素处于最高价态时,不一定具有强氧化性,处于最低价态时,不一定具有强还原性。
2.氧化性、还原性强弱的判断规律(1)按金属活动性顺序金属单质还原性看金属活动顺序表金属阳离子氧化性强弱看金属活动顺序表倒序(2)按非金属活动性顺序非金属单质氧化性顺序表:(氟、氯、氧、溴、碘、硫)非金属元素阴离子还原性强弱看非金属单质氧化性顺序表倒序:(硫、碘、溴、氧、氯、氟)(3)按氧化还原反应的方向同一氧化还原反应,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物(4)按元素周期表在同一周期内,从左到右,随着原子序数的递增,元素单质的氧化性增强,说对应的阴离子的还原性减弱,元素单质的还原性减弱,所对应的金属阳离子的氧化性增强;在同一主族内,从上到下,随着原子序数的递增,单质的还原性增强,氧化性减弱,其所对应的金属阳离子的氧化性减弱,非金属元素的阴离子的还原性增强。
(5)按氧化还原反应的程度在相同条件下,不同氧化剂使同一种还原剂氧化程度大的,其氧化性强。
(6)按原电池和电解池中的放电顺序电极参加反应的电池中,负极物质的还原性强于正极物质,氧化性弱于正极物质。
在电解池中,先放电的阳离子的氧化性强,先放电的阴离子的还原性强。
(7)按反应条件的差异反应对条件的要求越低,物质的氧化性或还原性就越强。
(8)按得电子时放出能量的高低或失电子时吸收能量的高低金属原子失去电子时所需要吸收的能量越少,说明该金属还原性越强;非金属原子得到电子时所放出的能量越多,说明该非金属单质氧化性越强。
元素周期律元素周期律,指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的增加呈周期性变化的规律。
周期律的发现是化学系统化过程中的一个重要里程碑。
2基本概念元素的性质随着元素核电荷数的递增而呈现周期性变化的规律叫做元素周期律。
元素周期律由俄国的门捷列夫首先发现,并根据此规律创制了元素周期表。
3发现19世纪60年代化学家已经发现了60多种元素,并积累了这些元素的原子量数据为寻找元素间的内在联系创造必要的条件。
俄国著名化学家门捷列夫和德国化学家迈锡尼等分别根据原子量的大小,将元素进行分类排队发现元素性质随原子量的递增呈明显的周期变化的规律。
1868年,门捷列夫经过多年的艰苦探索发现了自然界中一个极其重要的规律—元素周期规律。
这个规律的发现是继原子-分子论之后,近代化学史上的又一座光彩夺目的里程碑它所蕴藏的丰富和深刻的内涵,对以后整个化学和自然科学的发展都具有普遍的指导意义。
1869年门捷列夫提出第一张元素周期表,根据周期律修正了铟、铀、钍、铯等9种元素的原子量;他还预言了三种新元素及其特性并暂时取名为类铝、类硼、类硅,这就是1871年发现的镓、1880年发现的钪和1886年发现的锗。
这些新元素的原子量、密度和物理化学性质都与门捷列夫的预言惊人相符,周期律的正确性由此得到了举世公认。
4内涵结合元素周期表,元素周期律可以表述为:元素的性质随着原子序数的递增而呈周期性的递变规律。
随着原子序数的增加,元素的性质呈周期性的递变规律:在同一周期中,元素的金属性从左到右递减,非金属性从左到右递增,在同一族中,元素的金属性从上到下递增,非金属性从上到下递减;同一周期中,元素的最高正价氧化数从左到右递增(没有正价的除外),最低负价氧化数从左到右逐渐增高;同一族的元素性质相近。
主族元素同一周期中,原子半径随着原子序数的增加而减小。
同一族中,原子半径随着原子序数的增加而增大。
如果粒子的电子构型相同,则阴离子的半径比阳离子大,且半径随着电荷数的增加而减小。
(如O2->F->Na+>Mg2+)电子构型是元素性质的决定性因素,而元素周期律是电子构型呈周期性、递变性变化规律的体现。
为了达到稳定状态,不同的原子选择不同的方式。
同一周期元素中,轨道越“空”的元素越容易失去电子,轨道越“满”的越容易得电子。
随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化。
同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性。
具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因。
5内容原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
(注):阴阳离子的半径大小辨别规律由于阴离子是电子最外层得到了电子而阳离子是失去了电子所以, 总的说来(同种元素)(1) 阳离子半径<原子半径(2)阴离子半径>原子半径(3) 阴离子半径>阳离子半径(4)或者一句话总结,对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
(不适合用于稀有气体)主要化合价同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F(O,F无正价,除外)元素除外;最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
元素最高价的绝对值与最低价的绝对值的和为8金属性同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;a.单质氧化性越强,对应阴离子还原性越弱。
b.单质与氢气反应越容易(剧烈)。
c.其氢化物越稳定。
d.最高价氧化物对应水化物(含氧酸)酸性越强。
同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减;a. 单质还原性越强,对应阳离子氧化性越弱。
b.单质与水或酸反应越容易(剧烈)。
c.最高价氧化物对应水化物(氢氧化物)碱性越强。
氧化性同一周期中,从左到右,随着原子序数的递增,元素的非金属性增强,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。
同一族中,从上到下,随着原子序数的递增,元素的金属性增强,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。
酸碱性同一周期中,从左到右,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱);同一族中,从上到下,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。
与氢结合同一周期中,从左到右,随着原子序数的递增,单质与氢气化合逐渐容易;同一族中,从上到下,随着原子序数的递增,单质与氢气化合逐渐困难。
稳定性同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强;同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化。
随同一族元素中,由于周期越高,电子层数越多,原子半径越大,对核外电子的吸引力减弱,越容易失去,因此排在下面的元素一般比上面的元素金属性更强。
第一电离能:6意义元素周期律[1]是自然科学的基本规律,也是无机化学的基础。
各种元素形成有周期性规律的体现,成为元素周期律,元素周期表则是元素周期律的表现形式。
元素周期表是学习和研究化学的一种重要工具.元素周期表是元素周期律的具体表现形式,它反映了元素之间的内在联系,是对元素的一种很好的自然分类.我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导我们对化学的学习研究。
过去,门捷列夫曾用元素周期律来预言未知元素并获得了证实。
此后,人们在元素周期律和周期表的指导下,对元素的性质进行了系统的研究,对物质结构理论的发展起了一定的推动作用。
不仅如此,元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索。
元素周期律和周期表对于工农业生产也有一定的指导作用。
由于在周期表中位置靠近的元素性质相近,这样就启发了人们在周期表中一定的区域内寻找新的物质。
元素周期律的重要意义,还在于它从自然科学方面有力地论证了事物变化中量变引起质变的规律性。
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面,都有重要意义。
(1)在哲学方面,元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,从自然科学上有力地论证了事物变化的量变引起质变的规律性。
元素周期表是周期律的具体表现形式,它把元素纳入一个系统内,反映了元素间的内在联系,打破了曾经认为元素是互相孤立的形而上学观点。
通过元素周期律和周期表的学习,可以加深对物质世界对立统一规律的认识。
(2)在自然科学方面,周期表为发展物质结构理论提供了客观依据。
原子的电子层结构与元素周期表有密切关系,周期表为发展过渡元素结构,镧系和锕系结构理论,甚至为指导新元素的合成,预测新元素的结构和性质都提供了线索。
元素周期律和周期表在自然科学的许多部门,首先是化学、物理学、生物学、地球化学等方面,都是重要的工具。
(3)在生产上的某些应用由于在周期表中位置靠近的元素性质相似,这就启发人们在周期表中一定的区域内寻找新的物质。
①农药多数是含Cl、P、S、N、As等元素的化合物。
②半导体材料都是周期表里金属与非金属交界处的元素,如Ge、Si、Ga、Se等。
③催化剂的选择:人们在长期的生产实践中,已发现过渡元素对许多化学反应有良好的催化性能。
进一步研究发现,这些元素的催化性能跟它们的原子的d轨道没有充满有密切关系。
于是,人们努力在过渡元素(包括稀土元素)中寻找各种优良催化剂。
④耐高温、耐腐蚀的特种合金材料的制取:在周期表里从ⅢB到ⅥB的过渡元素,如钛、钽、钼、钨、铬,具有耐高温、耐腐蚀等特点。
它们是制作特种合金的优良材料,是制造火箭、导弹、宇宙飞船、飞机、坦克等的不可缺少的金属。
⑤矿物的寻找:地球上化学元素的分布跟它们在元素周期表里的位置有密切的联系。
科学实验发现如下规律:原子量较小的元素在地壳中含量较多,原子量较大的元素在地壳中含量较少;原子序数为偶数的元素较多,原子序数为奇数的元素较少。
处于地球表面的元素多数呈现高价,处于岩石深处的元素多数呈现低价;碱金属一般是强烈的亲石元素,主要富集于岩石圈的最上部;熔点、离子半径、电负性大小相近的元素往往共生在一起,同处于一种矿石中。
在岩浆演化过程中,电负性小的、离子半径较的、熔点较高的元素和化合物往往首先析出,进入晶格,分布在地壳的外表面。