电化学腐蚀热力学要点
- 格式:pptx
- 大小:409.93 KB
- 文档页数:97



电化学腐蚀热力学剖析概述电化学腐蚀是金属在与混合电解质接触时产生的一种可逆或不可逆的化学反应,主要是通过产生原子或离子,在这一过程中,通常会产生电子和阳离子或阴离子,这样金属就会被氧化,这种反应有时也叫做“原电池”。
在电化学腐蚀过程中,腐蚀后沉积物是由金属离子和阴、阳离子的复合物组成的,这个复合物的成分、结构、形态和物理化学性质,与电化学反应的热力学特性息息相关。
电位和电动势在电化学腐蚀过程中,金属表面被氧化而形成的离子产生了电动势,可以用电位的概念来描述。
电位是指一个试验电极在电解质中相对于标准电极势的电势差。
标准电极势是未受化学反应影响时所产生的电位,一般为0 V。
根据电位的大小可以判断金属是否会被电化学腐蚀,以及会被腐蚀的程度。
理论上,电动势是由离子在电解质中的迁移产生的。
在系统中,电子和阳、阴离子之间的迁移是通过氧化还原反应活动发生的。
电极间差电势就是金属接触电解液所造成的电荷分布而产生的电势差。
电化学腐蚀的热力学特性电化学腐蚀的热力学特性主要是通过反应自由能来描述的。
反应自由能是所考虑的化学反应的反应热和熵变的差值。
对于一个化学反应来说,自由能越小,其越倾向于发生。
在电化学腐蚀中出现氧化还原反应,如下所示:Fe→Fe2++2e−O2+2H2O+4e−→4OH−通过上述反应可以看出,当发生氧化还原反应的时候,反应物和产物之间的自由能差,将会决定反应是否会发生,也就是反应的方向性。
如果自由能差大于0,反应就会向反方向发生,这就会导致电化学腐蚀。
影响电化学腐蚀的因素电化学腐蚀是由于环境因素和材料特性的相互作用而引起的。
以下是一些影响电化学腐蚀的主要因素:环境因素1.电解质的浓度:电解质浓度越高,电势差越大,腐蚀越严重。
2.离子活性:离子活性越高,电位越负,金属表面的腐蚀程度越大。
3.温度:温度越高,电化学反应速度越快,腐蚀越严重。
材料特性1.金属组成:不同的金属在相同的环境下会产生不同的电位和反应特性。







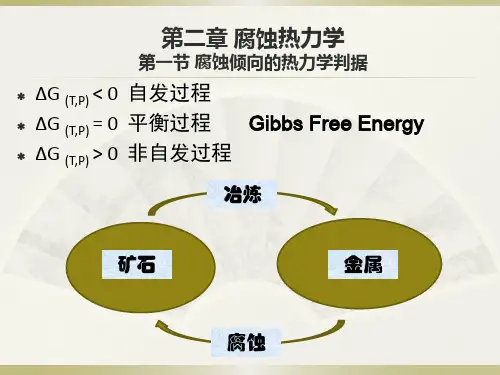
电化学腐蚀热力学电化学腐蚀是金属材料腐蚀破坏的最主要和最普遍的腐蚀形式。
金属材料与电解质溶液相互接触时,在界面上发生电化学腐蚀的倾向有多大,正是腐蚀热力学所要回答的问题。
§1-1 电池过程一、原电池考查锌片放入硫酸溶液中的化学反应:阳极反应:为阳极阴极反应:为阴极反应前后反应物的化合价发生了变化,即在化学反应过程中,反应物和生成物之间有电子的得失,电子由直接转移给溶液中的,且电子的流动是无秩序的,不能形成电子的定向流动。
有电子得失的化学反应称为氧化还原反应。
化合价升高的物质称为还原剂。
化合价降低的物质称为氧化剂。
如果能设计一种装置,使氧化还原反应的电子转移转变为电子的定向移动,即电子有秩序地由一处流向另一处,那么,通过这种装置,就能使氧化还原反应的化学能转变为电能。
借助于氧化还原反应将化学能直接转变为电能的装置叫做原电池。
由阴极和阳极及电解液组成的系统为原电池电流产生的原因:阳极与阴极在电解质溶液中电位不同,而产生的电位差所引起原电池的电位差是电池反应的推动力1、电极系统能够导电的物体称为导体。
根据导体中形成电流的荷电粒子的不同,导体可分为两种类型:由电子形成电流的导体称为电子导体相,简称为电子导体。
由离子形成电流的导体称为离子导体相,简称为离子导体。
由相互接触的电子导体相和离子导体相构成,且不同的荷电粒子能在两个相界面间自由转移电荷的导电系统,称为电极系统。
2、电极反应与电子导体间的导电不同,在电极系统中,电荷通过相界面从电子导体相和离子导体相之间穿越,必然要依靠两种不同的荷电粒子(电子和离子)之间相互转移电荷来实现。
这一过程也就是物质得到或释放外层电子的过程(发生化学变化),而这正是电化学变化的基本特征。
电极反应:电极系统中,伴随着电子导体相和离子导体相之间的电荷转移,在两相界面上所发生的电化学反应。
3、电极反应的类型1)第一类电极反应:由金属与含有该金属离子的溶液或由吸附了某种气体的惰性金属(如)与被吸附元素离子的溶液构成的电极反应。