电化学腐蚀热力学剖析说课讲解
- 格式:doc
- 大小:525.50 KB
- 文档页数:11






电化学腐蚀热力学剖析概述电化学腐蚀是金属在与混合电解质接触时产生的一种可逆或不可逆的化学反应,主要是通过产生原子或离子,在这一过程中,通常会产生电子和阳离子或阴离子,这样金属就会被氧化,这种反应有时也叫做“原电池”。
在电化学腐蚀过程中,腐蚀后沉积物是由金属离子和阴、阳离子的复合物组成的,这个复合物的成分、结构、形态和物理化学性质,与电化学反应的热力学特性息息相关。
电位和电动势在电化学腐蚀过程中,金属表面被氧化而形成的离子产生了电动势,可以用电位的概念来描述。
电位是指一个试验电极在电解质中相对于标准电极势的电势差。
标准电极势是未受化学反应影响时所产生的电位,一般为0 V。
根据电位的大小可以判断金属是否会被电化学腐蚀,以及会被腐蚀的程度。
理论上,电动势是由离子在电解质中的迁移产生的。
在系统中,电子和阳、阴离子之间的迁移是通过氧化还原反应活动发生的。
电极间差电势就是金属接触电解液所造成的电荷分布而产生的电势差。
电化学腐蚀的热力学特性电化学腐蚀的热力学特性主要是通过反应自由能来描述的。
反应自由能是所考虑的化学反应的反应热和熵变的差值。
对于一个化学反应来说,自由能越小,其越倾向于发生。
在电化学腐蚀中出现氧化还原反应,如下所示:Fe→Fe2++2e−O2+2H2O+4e−→4OH−通过上述反应可以看出,当发生氧化还原反应的时候,反应物和产物之间的自由能差,将会决定反应是否会发生,也就是反应的方向性。
如果自由能差大于0,反应就会向反方向发生,这就会导致电化学腐蚀。
影响电化学腐蚀的因素电化学腐蚀是由于环境因素和材料特性的相互作用而引起的。
以下是一些影响电化学腐蚀的主要因素:环境因素1.电解质的浓度:电解质浓度越高,电势差越大,腐蚀越严重。
2.离子活性:离子活性越高,电位越负,金属表面的腐蚀程度越大。
3.温度:温度越高,电化学反应速度越快,腐蚀越严重。
材料特性1.金属组成:不同的金属在相同的环境下会产生不同的电位和反应特性。
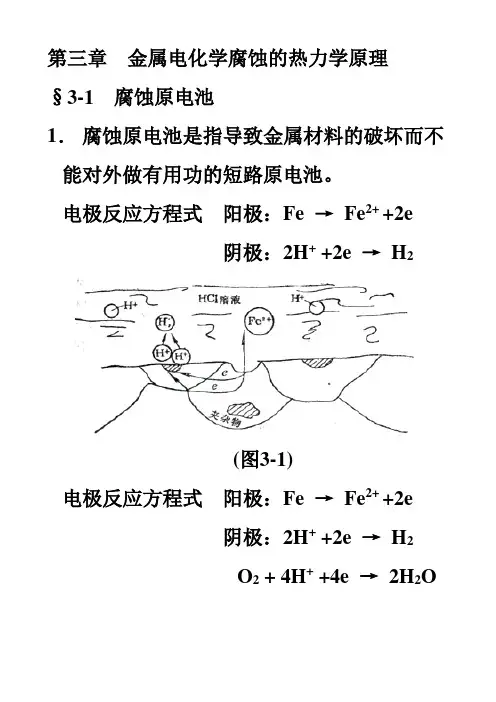
第三章金属电化学腐蚀的热力学原理§3-1 腐蚀原电池1.腐蚀原电池是指导致金属材料的破坏而不能对外做有用功的短路原电池。
电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2(图3-1)电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2O2 + 4H+ +4e →2H2O(图3-2)电化学腐蚀发生的根本原因是由于介质中存在着平衡电极电位高于金属的平衡电极电位的氧化性物质。
2.腐蚀原电池的组成及工作过程1)组成:阳极、阴极、电解质溶液、外电路。
2)工作过程:①金属阳极溶解过程如Fe →Fe2+ +2e②溶液中氧化性物质的阴极还原过程如2H+ +2e →H2③电子和离子的定向流动过程以上三个过程是彼此独立进行的,但又是串联在一起的,因而只要其中的某个过程的进行受到阻滞,则金属的腐蚀速度就会减缓。
3.电化学腐蚀的次生过程腐蚀电池工作过程中,阳极附近金属离子(如Fe2+)浓度增大,阴极附近的pH升高,则随着离子的迁移发生如下反应:Fe2+ + 2OH- →Fe(OH)2 ↓或者进一步被氧化为:4Fe(OH)2+ O2 +2H2O →Fe(OH)3↓即铁在含氧水溶液中腐蚀的次生过程。
如图所示是铁在含氧水溶液中的腐蚀及其次生过程。
(图3-3 P22)4.腐蚀原电池的分类按照电极的大小,被破坏金属的表观形态,腐蚀电池可分为三类:1)超微电池腐蚀:金属表面上存在的超微观的(原子大小的)电化学不均一性引起,可以认为阴阳极是等电位,导致金属材料的均匀腐蚀。
2)微电池腐蚀:金属表面存在许多微小的阴极和阳极区域而形成的腐蚀电池,导致金属腐蚀。
形成原因多种多样。
3)宏电池腐蚀:腐蚀电池的尺寸较大,可用肉眼明显区分出阴阳极区域的腐蚀电池。
5.盐滴实验(例题)腐蚀现象是非常复杂的,形成的腐蚀电池也可能不是一种类型,下面以盐滴实验为例说明:在打磨过的钢片上,滴一滴含有酚酞和铁氰化钾的氯化钠溶液,可观察到液滴覆盖的整个区域上立刻出现粉红色和蓝色的小斑点,原因:发生电池反应,阳极Fe →Fe2+ +2e3Fe2+ + 2Fe(CN)62-→Fe3[Fe(CN)6]2(蓝色)阴极O2 + 2H2O + 4e →4OH-使酚酞显红色。




第二章电化学腐蚀热力学2.1金属腐蚀倾向的热力学判据自然界中绝大多数金属元素(除Au,Pt等贵金属之外)均以化合态存在。
大部分金属单质是通过外界对化合态体系提供能量(热能或者电能)还原而成的,因此,在热力学上金属单质是一个不稳定体系。
在一定的外界环境条件下,金属的单质状态可自发地转变为化合物状态,生成相应的氧化物、硫化物和相应的盐等腐蚀产物,使体系趋于稳定状态,即有自动发生腐蚀的倾向。
金属发生腐蚀的可能性和程度不仅与金属性质有关,还与腐蚀介质的特性和外界条件有关。
研究腐蚀现象需要从两个方面着手,一方面是看腐蚀的自发倾向大小。
另—方面是看腐蚀进程的快慢,前者需要用热力学原理进行分析,后者则要借助动力学理论。
金属腐蚀反应体系是一个开放体系。
在反应过程中,体系与环境既有能量的交换又有物质的交换。
金属腐蚀反应一般都是在恒温和恒压的条件下进行的,用体系的热力学状态函数吉布斯(Gibb)自由能判据来判断反应的方向和限度较为方便。
吉布斯自由能用G表示,对于等温等压并且没有非体积功的过程,腐蚀体系的平衡态或稳定态对应于古布斯自由能G为最低的状态。
设物质系统吉布斯自由能变化为ΔG,则有<0自发过程ΔG=0平衡状态(2-1)>0非自发过程自然环境中的大多数金属的单质态和化合物状态的吉布斯自由能高低表现出如图2.1所示的状况,即腐蚀产物与矿石一样处于低能的稳定状态,金属单质处于高能的状态。
因此金属腐蚀具有自发倾向。
图2.1物质的吉布斯自由能一个腐蚀体系是由金属和外围介质组成的多组分敞开体系。
对于一个腐蚀化学反应,可用下式表示。
0iiAi(2-2)式中νi为反应式中组分i的化学计量数,反应物的计量数取负值,生成物的计量数取正值;Ai为参加腐蚀反应的物质组分。
在任意情况下,腐蚀反应体系吉布斯自由能的改变ΔG服从范特荷甫等温方程。
GGRTlnQ(2-3)式中ΔG为反应的标准吉布斯自由能的改变;R为气体常数;T为热力学温度,Q为活度商(或者逸度商)用下式表示。
电化学腐蚀热力学电化学腐蚀是金属材料腐蚀破坏的最主要和最普遍的腐蚀形式。
金属材料与电解质溶液相互接触时, 在界面上发生电化学腐蚀的倾向有多大, 正是腐蚀热力学所要回答的问题。
§1-1 电池过程一、原电池考查锌片放入硫酸溶液中的化学反应:阳极反应: 为阳极➢阴极反应: 为阴极➢反应前后反应物的化合价发生了变化, 即在化学反应过程中, 反应物和生成物之间有电子的得失, 电子由直接转移给溶液中的, 且电子的流动是无秩序的, 不能形成电子的定向流动。
➢有电子得失的化学反应称为氧化还原反应。
➢化合价升高的物质称为还原剂。
➢化合价降低的物质称为氧化剂。
➢如果能设计一种装置, 使氧化还原反应的电子转移转变为电子的定向移动, 即电子有秩序地由一处流向另一处, 则, 通过这种装置, 就能使氧化还原反应的化学能转变为电能。
➢借助于氧化还原反应将化学能直接转变为电能的装置叫做原电池。
➢由阴极和阳极与电解液组成的系统为原电池➢电流产生的原因: 阳极与阴极在电解质溶液中电位不同, 而产生的电位差所引起➢原电池的电位差是电池反应的推动力1.电极系统能够导电的物体称为导体。
➢根据导体中形成电流的荷电粒子的不同, 导体可分为两种类型:由电子形成电流的导体称为电子导体相, 简称为电子导体。
由离子形成电流的导体称为离子导体相, 简称为离子导体。
由相互接触的电子导体相和离子导体相构成, 且不同的荷电粒子能在两个相界面间自由转移电荷的导电系统, 称为电极系统。
2.电极反应与电子导体间的导电不同, 在电极系统中, 电荷通过相界面从电子导体相和离子导体相之间穿越, 必然要依靠两种不同的荷电粒子(电子和离子)之间相互转移电荷来实现。
这一过程也就是物质得到或释放外层电子的过程(发生化学变化), 而这正是电化学变化的基本特征。
电极反应:电极系统中, 伴随着电子导体相和离子导体相之间的电荷转移, 在两相界面上所发生的电化学反应。
3.电极反应的类型1)第一类电极反应: 由金属与含有该金属离子的溶液或由吸附了某种气体的惰性金属(如)与被吸附元素离子的溶液构成的电极反应。
电化学腐蚀热力学电化学腐蚀是金属材料腐蚀破坏的最主要和最普遍的腐蚀形式。
金属材料与电解质溶液相互接触时,在界面上发生电化学腐蚀的倾向有多大,正是腐蚀热力学所要回答的问题。
§1-1 电池过程一、原电池考查锌片放入硫酸溶液中的化学反应:阳极反应:Zn为阳极阴极反应:Cu为阴极➢反应前后反应物的化合价发生了变化,即在化学反应过程中,反应物和生成物之间有电子的得失,电子由Zn直接转移给溶液中的H+,且电子的流动是无秩序的,不能形成电子的定向流动。
➢有电子得失的化学反应称为氧化还原反应。
➢化合价升高的物质称为还原剂。
➢化合价降低的物质称为氧化剂。
➢如果能设计一种装置,使氧化还原反应的电子转移转变为电子的定向移动,即电子有秩序地由一处流向另一处,那么,通过这种装置,就能使氧化还原反应的化学能转变为电能。
➢借助于氧化还原反应将化学能直接转变为电能的装置叫做原电池。
➢由阴极和阳极及电解液组成的系统为原电池➢电流产生的原因:阳极与阴极在电解质溶液中电位不同,而产生的电位差所引起➢原电池的电位差是电池反应的推动力1、电极系统能够导电的物体称为导体。
根据导体中形成电流的荷电粒子的不同,导体可分为两种类型:➢由电子形成电流的导体称为电子导体相,简称为电子导体。
➢由离子形成电流的导体称为离子导体相,简称为离子导体。
由相互接触的电子导体相和离子导体相构成,且不同的荷电粒子能在两个相界面间自由转移电荷的导电系统,称为电极系统。
2、电极反应与电子导体间的导电不同,在电极系统中,电荷通过相界面从电子导体相和离子导体相之间穿越,必然要依靠两种不同的荷电粒子(电子和离子)之间相互转移电荷来实现。
这一过程也就是物质得到或释放外层电子的过程(发生化学变化),而这正是电化学变化的基本特征。
电极反应:电极系统中,伴随着电子导体相和离子导体相之间的电荷转移,在两相界面上所发生的电化学反应。
3、电极反应的类型1)第一类电极反应:由金属与含有该金属离子的溶液或由吸附了某种气体的惰性金属(如Pt)与被吸附元素离子的溶液构成的电极反应。
如:2)第二类电极反应:由一种金属及该金属的难溶盐(或该金属氧化物)与含有该难溶盐的负离子(或含有氧的负离子,如OH-、SO42-等)溶液构成的电极反应。
如:4、原电池的电化学过程原电池的电化学过程是由阳极的氧化过程、阴极的还原过程以及电子和离子的输运过程组成。
电子和离子的运动就构成了电回路。
二、腐蚀原电池腐蚀原电池实质上是一个只能导致金属材料破坏,而不能对外界作功的短路原电池。
电子通过锌与铜内部直接传递,没有经过外电路,是一个短路的腐蚀原电池化学能→电能→热能三、腐蚀原电池的化学反应及理论不论是何种类型的腐蚀原电池,它都必须包括:阳极、阴极、电解质溶液和电路等四个不可分割的组成部分,缺一不可。
这四个组成部分构成了腐蚀原电池工作的基本过程。
1、阳极和阳极过程阳极:在腐蚀原电池中发生氧化反应的电极。
阳极过程:腐蚀电池工作时,阳极上金属材料溶解,以离子形式进入溶液,并把等量电子留在阳极金属上。
2、电子转移过程电子通过电路从阴极转移到阴极。
3、阴极和阴极过程阴极:在腐蚀原电池中发生还原反应的电极。
阴极过程:溶液中的氧化性物质(氧化剂)接受从阳极转移过来的电子后本身被还原。
腐蚀原电池特征:➢短路的原电池➢材料表面分为阳极和阴极,阴极和阳极具有不同电位,位于不同位置;➢阳极和阴极之间要有两个电性连接:电子导体通道和离子导体通道;➢离子导体为腐蚀环境。
四、宏观电池与微观电池根据构成腐蚀电池的阴极和阳极尺寸大小,可将腐蚀电池分为两大类:1、宏观腐蚀电池(宏电池):阳极和阴极电极尺寸相对较大,宏观上单独的电极肉眼可见,可分辩。
2、微观腐蚀电池(微电池):阳极和阴极尺寸微小,宏观上单独的电极不可见,肉眼不可分辩。
(一)典型的宏观电池1、异金属电池(电偶电池、双金属电池):异种金属在同一腐蚀介质中相接触形成异金属腐蚀电池(电偶腐蚀)的主要原因是异类金属的电位差。
异类金属的电极电位相差愈大,电偶腐蚀愈严重。
2、盐浓差电池:金属材料的电位与介质中该金属离子的浓度有关,浓度高处电位高,浓度低处电位低。
金属构件因与该金属离子含量不同的电解质溶液相接触形成的腐蚀电池称为盐浓差电池。
3、氧浓差电池:金属材料的电位与介质中的氧浓度有关,氧浓度高处电位高,氧浓度低处电位低。
金属构件因与含氧量不同的电解质溶液相接触而形成的腐蚀电池称为氧浓差电池。
4、温差电池:金属的电位与介质温度有关,温度低处电位高,温度高处电位低。
金属构件因与温度不同的电解质溶液相接触形成的腐蚀电池称为温差腐蚀电池。
例如:碳钢制造的热交换器,因高温部位碳钢电位低,从而比低温部位腐蚀更严重。
(二)典型的微观电池金属表面或内部的电化学不均匀性,将使金属材料表面或内部存在电位高低不等的微小区域,从而在金属表面或金属内部形成微观腐蚀电池。
1、成分和组织不均匀引起的微电池:碳钢中的渗碳体、工业纯锌中的铁杂质、铸铁中的石墨等第二相组织与基体组织,以及晶粒与晶界之间、合金成份偏析造成的成份不均等,均会导致金属表面或内部在微观上的电位差异。
当金属与电解质介质接触时,必然会在金属表面或内部形成由微阴极和微阳极组成的众多微观腐蚀电池。
2、金属表面物理状态的不均匀性构成微观电池:金属构件应力分布不均匀或形变不均匀同样会导致电化学不均匀,从而形成微观腐蚀电池。
3、金属表面膜不完整构成微观电池:金属表面钝化膜或镀覆的涂层存在孔隙或发生破损,裸露出金属基体,金属基体电位较负,钝化膜或涂层的电位正,金属基体与钝化膜或阴极性涂层构成微观腐蚀电池,孔隙或破损处作为阳极而受到腐蚀。
腐蚀原电池小结1、金属电化学腐蚀发生的必要条件:金属表面上两个不同的区域存在电位差;两个区域之间存在电子的通路-电子导体,金属或合金;两个区域之间存在离子的通路-离子导体,电解液。
2、金属电化学腐蚀的过程:阳极和阴极同时存在,并形成一个完整的电流回路以维持上述电极反应进行。
阳极多余电子通过电子通道传输到缺电子的阴极,同时阳极发生溶解并以金属离子形式进入溶液本体;溶液本体溶液的氧化剂通过电解质溶液移动到阴极附近,从阴极上得到电子;随着电流流动,阳极反应和阴极反应不断进行,阳极金属不断溶解,造成腐蚀的发生。
3、腐蚀原电池形成的基本原因:金属表面上各部位的物理性质和化学性质,以及与各部位接触的介质的物理性质和化学性质是不均匀的,导致各部位的电位存在差别,即出现了各部位的电化学性能的不均匀性。
4、微观腐蚀电池中阴极和阳极进行的区域:在多数情况下,阳极和阴极过程分别在不同的区域进行的;在某些情况下,阴极和阳极过程在同一部位上随时间交替进行。
§1-2 电化学位一、化学位化学位(化学势)的定义:多组分均相系统中,在等温等压并保持系统中其他物质的量都不变的条件下,系统的吉布斯自由能随某一组分的物质的量的变化率。
物理意义:恒温恒压条件下,在指定组成的无限大体系中,加入一摩尔物质引起体系的吉布斯自由能的改变。
也就是说,在指定条件下一摩尔物质对体系的吉布斯自由能的贡献。
化学势在处理相变或化学变化的问题时才具有重要意义。
物质发生化学反应总是从系统化学位较高的状态转移到化学位较低的状态。
当系统发生化学反应前后生成物和反应物物质总的化学位相等时,则化学反应过程停止,化学反应达到平衡状态,即正反两个方向的化学反应速率相等,系统各物质的总量不再发生变化。
因此,可以通过比较化学反应前后系统物质总的化学位大小来判断化学反应的方向和限度。
二、化学平衡的条件对于化学反应:有:根据吉布斯自由能判据(热力学第二定律),在等温等压条件下:dG:化学反应的推动力三、电化学位(广义化学位)对于电极反应:也是一个化学反应,但与一般化学反应不同。
在电极反应中,除了有物质的变化外,还有电荷在两相之间的转移。
即除了化学能的变化外,还有电能的变化。
系统内带电粒子电能的变化等于该带电粒子对系统所做的电功(热力学第一定律),而一摩尔带电粒子对系统所做的功等于该粒子的电量与系统内电位的乘积,即:因此对上述电极反应有:四、电极反应平衡的条件对于上述电极反应:根据吉布斯自由能判据,反应达到平衡的条件是:可推导出电极反应的平衡条件为:上式中[实际是电极系统中电子导体相与离子导体相间的电位差,亦即是固液两相间的电位差(电极系统的绝对电极电位,记作)。
§1-3 电极电位一、绝对电极电位1、绝对电极电位:电极反应达到平衡时,电极系统中固液两相间所产生的一个稳定不变的电位差称为电极系统的绝对电极电位。
2、绝对电极电位的不可测性仪表测得的数值不是待测电极的绝对电极电位,而是由(M/溶液)和(Cu/溶液)两个电极系统构成的原电池的电动势。
(习惯上被称为待测电极的平衡电极电位)因此,单个电极系统的电极电位是无法测量的,或者说电极电位的绝对值是无法测量的。
3、参比电极与标准氢电极1)参比电极:为满足测量需要,将平衡状态下绝对电极电位人为规定为零的电极系统。
2)标准氢电极:在氢气分压为一个标准大气压的条件下,将镀铂黑的铂片插入氢离子浓度为一摩尔每升的溶液中所构成的电极系统。
国际标准规定标准氢电极的绝对电极电位为零。
以标准氢电极为参比电极所测得的待测电极的电极电位为氢标电位。
二、标准电极电位标准电极电位:在标准状态下,参加电极反应的物质的活度为一个单位量时所测得的电极电位,用表示。
三、能斯特方程1、能斯特方程一般表达式对于电极反应:若以标准氢电极作为参比电极,根据前述讨论,则有:2、能斯特方程的应用范围从前述能斯特方程表达式的推导过程及假设条件,可知能斯特方程成立必须具备以下条件:1)有电子得失的氧化还原反应,即电极反应;2)电极系统处于平衡状态。
四、稳态电位(非平衡电位)1、电极反应达到平衡状态的特征对于单电极反应(即电极界面只发生一个电极反应),处于平衡状态时,阳极反应方向(氧化反应方向)的反应速率与阴极反应方向(还原反应方向)的反应速率必然相等。
此时,电极界面处存在着两个平衡:➢参加电极反应的物质粒子交换处于平衡状态,此时电极界面既无新物质生成,也无旧物质消耗;➢电荷的交换处于平衡状态,此时电极界面的电荷密度分布不变。
即既无新电荷产生,也无旧电荷消失。
2、电极反应处于稳态的特征如铁在盐酸溶液中,会在一个电极界面同时进行着两个不同物质的电极反应,即:阳极过程:阴极过程:阴极过程与阴极过程反应速率相等时(),电极界面处电荷密度分布不变,即电荷交换达到平衡;但此时界面处既不断有新物质生成(和),也不断有旧物质消耗(Fe 和)。
即,此时电极反应只有电荷的平衡,而无物质量的平衡,是一个不可逆的非平衡过程。
稳态电位:在一个电极界面上同时进行着两个或两个以上不同物质的氧化、还原过程,由电荷平衡建立起来的电位。