专题5.3 化学键(练)-2018年高考化学一轮复习讲练测(原卷版)
- 格式:doc
- 大小:776.50 KB
- 文档页数:7

1.(2017江苏)下列有关化学用语表示正确的是 A .质量数为31的磷原子: 3115PB .氟原子的结构示意图:C . CaCl 2的电子式:D .明矾的化学式: Al 2(SO 4)3 【答案】A2.(2017天津)根据元素周期表和元素周期律,判断下列叙述不正确...的是A .气态氢化物的稳定性:H 2O >NH 3>SiH 4B .氢元素与其他元素可形成共价化合物或离子化合物C .图1所示实验可证明元素的非金属性:Cl >C >SiD .用中文“”(ào )命名的第118号元素在周期表中位于第七周期0族【答案】C【解析】A 、气态氢化物稳定性与非金属性一致,非金属性O >N >Si ,所以气态氢化物稳定性H 2O >NH 3>SiH 4,A 正确;B 、氢元素可与非金属元素形成共价化合物如H 2O 等甚至于离子化合物如NH 4H ,也可以与某些金属生成离子化合物如NaH 等,B 正确;C 、不能用氢化物的酸性来验证非金属性强弱,可以采用最高价含氧酸酸性强弱来验证,C 错误;D 、根据元素周期表知识判断,各周期0族元素的原子序数依次为2、10、18、36、54、86、118,所以第118号元素在周期表中位于第七周期0族,D正确。
故选C。
3.(2016课标Ⅲ)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。
下列说法正确的是A.简单离子半径:W< X<ZB.W与X形成的化合物溶于水后溶液呈碱性C.气态氢化物的热稳定性:W<YD.最高价氧化物的水化物的酸性:Y>Z【答案】B化学键是高考点精讲考点一离子键与离子化合物1.氯化钠的形成过程:2.离子键(1)概念:带相反电荷离子之间的相互作用称为离子键。
(2)实质:(3)成键微粒:阴、阳离子。

化学键达标检测一、选择题(每小题5分,共50分)1.现有如下各种说法:①在水中氢、氧原子间均以化学键相结合②金属和非金属化合时一定形成离子键③离子键是阳离子、阴离子的相互吸引力④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程上述各种说法正确的是( )A.①②⑤B.都不正确C.④D.①2.元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。
下列有关推测正确的是( )A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XYB.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZC.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZD.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ23.下列各组中每种物质都既有离子键又有共价键的一组是( )A.NaOH H2SO4(NH4)2SO4B.MgO Na2SO4HNO3C.Na2O2KOH Na3PO4D.HCl Al2O3MgCl24.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )A.将SO2通入水中B.烧碱溶于水C.将HCl通入水中D.硫酸氢钠溶于水5.下列有关表述错误的是( )A.IBr的电子式B.HClO的结构式为H-O-ClC.HIO各原子都满足8电子结构D.MgO的形成过程可以表示为:6.下列分子中各原子都满足8电子稳定结构的化合物是( ) A.CH4B.CH2===CH2C.CO2D.N27.关于离子键、共价键的各种叙述,下列说法中正确的是( ) A.在离子化合物里,只存在离子键,没有共价键B.非极性键只存在于双原子的单质分子 (如Cl2)中C.在共价化合物分子内,一定不存在离子键D.由多种元素组成的多原子分子里,一定只存在极性键8.科学家最近研究出一种环保、完全的储氢方法,其原理可表示为:NaHCO3+H2储氢释氢HCOONa+H2O。
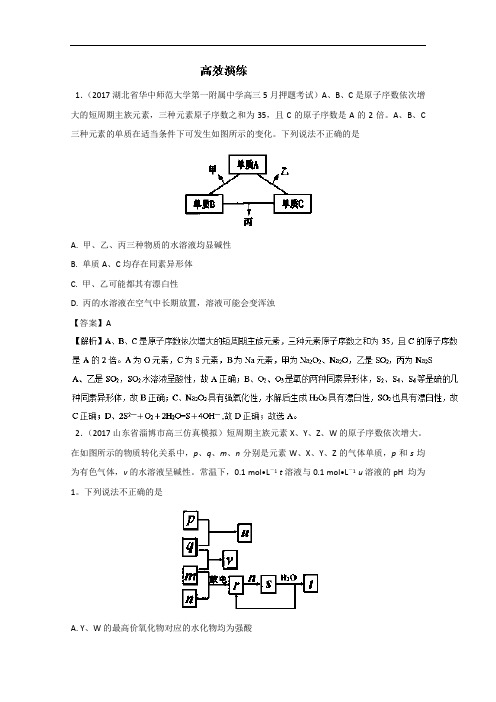
1.(2017湖北省华中师范大学第一附属中学高三5月押题考试)A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。
A、B、C 三种元素的单质在适当条件下可发生如图所示的变化。
下列说法不正确的是A. 甲、乙、丙三种物质的水溶液均显碱性B. 单质A、C均存在同素异形体C. 甲、乙可能都其有漂白性D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊【答案】A2.(2017山东省淄博市高三仿真模拟)短周期主族元素X、Y、Z、W的原子序数依次增大。
在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。
常温下,0.1 mol•L-1t溶液与0.1 mol•L-1u溶液的pH 均为1。
下列说法不正确的是A. Y、W的最高价氧化物对应的水化物均为强酸B. 元素的非金属性:Z>Y>X,原子半径:X<Z<YC. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2D. v的电子式可表示为【答案】D【解析】短周期主族元素X、Y、Z、W的原子序数依次增大。
在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。
常温下,0.1 mol•L-1t溶液与0.1 mol•L-1u溶液的pH 均为1。
根据流程可知m、n放电条件下反应生成r,r与n反应生成有色气体s,则m为氮气,n为氧气,r为一氧化氮,s为二氧化氮,t为硝酸;另一有色气体单质p是氯气,q是氢气,v为氮气,u为氯化氢。
则X、Y、Z、W分别为氢、氮、氧、氯。
故A、Y、W的最高价氧化物对应的水化物HNO3、HClO4均为强酸,选项A正确;B、元素的非金属性:O>N>H,即Z>Y>X,原子半径:H<O<N,即X<Z<Y,选项B正确;C、s溶于水的反应3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的物质的量之比为1:2,选项C正确;D、v为氨气,其电子式可表示为,选项D不正确。

时间:45分钟满分:100分一、选择题(每题6分,共72分)1.[2017·兰州一中高三月考]下列关于化学键的说法正确的是( )A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键B.不同元素的原子构成的分子不一定只含极性共价键C.含极性键的共价化合物一定是电解质D.HF的分子间作用力大于HCl,故HF比HCl更稳定答案 B解析(NH2)2CO(尿素)中只含共价键,A项错误;H2O2中含有O—O非极性键,B项正确;CO中的化学键为极性键,但CO是非电解质,C项错误;分子间作用力与分子稳定性无关,HF 的键能大于HCl,所以HF比HCl更稳定,D项错误。
2.[2016·河南南阳一中月考]下列观点正确的是( )A.反应物的化学键,在化学反应中全部被破坏B.HIO中各原子都满足最外层8电子稳定结构C.某化合物熔融态能导电,该化合物中一定有离子键D.某纯净物在常温常压为气体,则组成该物质的微粒一定含共价键答案 C解析在CH3CH2OH与CH3COOH的酯化反应中,只断裂羟基中的氧氢键和羧基中的碳氧键,A错误;HIO中的氢原子是2电子稳定结构,B错误;Ar在常温常压下为气体,但Ar中无共价键,D错误。
3.[2017·长春高三质检]下列物质的电子式书写正确的是( )答案 A解析B项,NH+4的电子式为,错误;C项,氯化氢为共价化合物,应为,错误;D项,二氧化碳分子中每个O与C之间形成两对共用电子对,应为,错误。
4.[2017·东北师大附中模拟]固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构。
则下列有关说法中错误的是( )A.1 mol NH5中含有5N A个N—H键(N A表示阿伏加德罗常数的值)B.NH5中既有共价键又有离子键C.NH5的电子式为D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑答案 A解析由“NH5”的结构知其为离子化合物(NH4H),既含有共价键,又含有离子键,1 mol NH5中含有4N A个N—H键,A错误,B、C正确;NH4H中-1价的氢离子与H2O中+1价的氢发生归中反应生成H2,D正确。

2018年全国卷高考化学总复习《化学键》专题训练一、选择题:(每题有1~2个选项符合题意)1.下列关于元素的叙述正确的是()A.金属元素与非金属元素能形成共价化合物B.只有在原子中,质子数才与核外电子数相等C.目前使用的元素周期表中,最长的周期含有36种元素D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或82.下列叙述正确的是()A.带相反电荷离子之间的相互吸引称为离子键B.金属元素与非金属元素化合时一定形成离子键C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键D.非金属原子间不可能形成离子键3.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是() A.10与19 B.6与16 C.11与17 D.14与84.下列关于共价键的说法正确的是()A.构成单质分子的粒子之间一定存在共价键B.由非金属元素组成的化合物不一定是共价化合物C.非极性键只存在于双原子单质分子里D.不同种元素组成的多原子分子里的化学键一定是极性键5.下列物质中,既含有离子键又含有非极性共价键的是()A.HClO B.Ba(OH)2C.Na2O2D.Ar6.下列物质中,既含有极性键又含有非极性键的是()A.B.CO2 C.Na2O2D.NH4Cl7.下列各组化合物中,化学键类型都相同的是()A.CaCl2和Na2S B.Na2O和Na2O2C.CO2和CS2D.HCl和NaOH8.下列式子书写正确的是()9.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。
下列叙述错误..的是A.d元素的非金属性最强B.它们均存在两种或两种以上的氧化物C.只有a与其他元素生成的化合物都是离子化合物D.b、c、d与氢形成的化合物中化学键均为极性共价键10.下列电子式正确的是()11.下列各分子中,所有原子都满足最外层电子为8电子结构的是()A.CCl4B.BF3C.HCHO D.NCl5二、填空题1.下表是元素周期表的一部分,请回答下列问题:(1)写出元素⑩的+1⑥与①形成的10电子阴离子的电子式为_________________________。

第三节 化 学 键梳理基础 一、化学键1.概念:____________________,叫做化学键。
答案:相邻原子或离子间强烈的相互作用2.类型。
根据成键原子间的价电子共用或转移可将化学键分为______和______。
答案:共价键 离子键3.化学键与化学反应。
旧化学键的________和新化学键的________是化学反应的本质,是反应中能量变化的根本。
1.认识化学键的定义。
2.了解离子键、共价键的形成。
3.能识别常见的离子化合物和共价化合物答案:断裂形成二、离子键1.定义:_______________________________________________。
答案:带相反电荷的离子间的相互作用2.成键离子:阴阳离子。
3.成键实质:电子转移。
4.形成条件:活泼金属与活泼非金属之间化合时,易形成离子键,如ⅠA族、ⅡA族中的金属与ⅥA族、ⅦA族中的非金属化合时易形成离子键。
5.离子化合物:____________的化合物。
答案:由离子键构成6.离子键的表示方法。
电子式:在________符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子,这种表示的物质的式子叫做电子式。
(1)用电子式表示离子化合物的形成过程,如:①Na2S:;②CaCl2:。
(2)常见物质的电子式。
答案:元素判断正误正确的打“√”,错误的打“×”。
1.N2的电子式为N⋮⋮N()答案:×2.Na2O2为含有非极性键的共价化合物()答案:×3.Na2SO4是离子化合物()答案:√4.不同元素的原子构成的分子只含极性共价键()答案:×5.共价键既可以存在于化合物又可以存在于单质中() 答案:√6.次氯酸的结构式为H—O—Cl,过氧化氢的电子式为( )答案:×7.所有物质中都存在化学键()答案:×8.HClO的电子式为H Cl O )答案:×9.NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物()答案:×10.化学键破坏不一定发生化学变化()答案:√三、共价键1.定义:原子间通过__________所形成的相互作用(或化学键)。
化学键[基础题组]1.(2017·郑州模拟)下列属于共价化合物的是( )A.Cl2B.NaOHC.CH4 D.(NH4)2SO4解析:A项中的Cl2属于单质,不符合题意;B、D两项中的物质属于离子化合物,不符合题意;C项中CH4是由C—H极性共价键构成的共价化合物,符合题意。
答案:C2.(2017·洛阳模拟)下列物质中,从化学键的角度看,有一种与其他三种明显不同,这种物质是( )A.NaOH B.CH4C.SO2 D.H2O解析:B、C、D三项中形成的化学键均为共价键,A项中形成的化学键为离子键和共价键,故A项符合题意。
答案:A3.(2017·北京质检)如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述中不正确的是( )A.A、C两元素形成的化合物都为共价化合物B.AD2的电子式为C.B、C形成的化合物BC中所含化学键为非极性共价键D.B 2的结构式为解析:根据A、B、C、D四种元素在周期表中的位置可知,A、B、C、D分别为C、N、O、S四种元素。
CO、CO2都为共价化合物,A正确;CS2的电子式为,B正确;NO为极性共价键,C错误;N 2的结构式为,D正确。
答案:C4.(2017·沈阳调研)元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。
下列有关推测正确的是( )A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XYB.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZC.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZD.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3解析:由题目可知,XYZ3可能为NaNO3、MgCO3,溶于水不能形成酸,A项错;若XYZ3为MgCO3,微溶于水,则XZ形成离子化合物MgO,B项正确;若XYZ3为NaNO3,易溶于水,YZ(NO)不是离子化合物,C项错;若XYZ3是离子化合物,YZ2为NO2或CO2,均不是离子化合物,D 项错。
2018山东科技版化学高考第一轮复习——化学键与化学反应(学案含答案)一部分主要考查化学键、离子键、共价键的概念和含义,离子键共建、离子键的形成和化学反应中物质变化的实质。
第二部分考查化学反应中能量变化的实质和化学能与热能的转化。
五. 知识要点化学反应中不仅有物质变化,还伴随着能量变化。
研究化学反应有时是为了制取所需要的物质,有时是为了利用反应所放出的能量。
化学反应中为什么会发生物质变化?又为什么会发生能量变化呢?(一)化学键与物质变化1. 化学键(1)定义物质内相邻的两个或多个原子间的强烈的相互作用叫做化学键。
(2)化学反应中物质变化的实质了解化学键概念后,可以根据化学键的观点来分析化学反应的过程。
如:氢气、氯气化合生成氯化氢。
H2+Cl2=2HCl氢气、氯气分子内化学键断裂,氢原子和氯原子间形成新的化学键。
其他化学反应与其类似,都是反应物中的化学键断裂,形成生成物中的化学键。
2. 化学键的类型(1)共价键原子间通过共用电子对形成的化学键,叫做共价键。
a. 成键元素:非金属原子之间或某些不活泼的金属和非金属原子之间。
b. 成键微粒:原子。
c. 成键性质:共用电子对与两原子的电性作用。
d. 成键条件:成键原子提供电子形成共用电子对,相互间通过共用电子对结合形成共价键。
(2)离子键阴、阳离子之间通过静电作用形成的化学键,叫做离子键。
a. 成键元素:活泼的金属元素和活泼的非金属元素。
b. 成键微粒:阴、阳离子。
c. 成键性质:阴、阳离子之间的静电作用。
d. 成键条件:成键原子之间发生电子得失,形成阴、阳离子。
3. 化学键与化合物种类(1)共价化和物a. 共价化合物的定义:把只含有共价键的化合物称为共价化合物。
例如:HCl、CO2、CH4、NH3等。
b. 共价化合物的判断:共价化合物中一定没有离子键,故只含有共价键的化合物才是共价化合物。
(2)离子化合物a. 离子化合物的定义:把含有离子键的化合物称为离子化合物。
化学键复习试卷一、选择题1、下列电子式书写正确的是( )A. B. C. D.2、化①离子化合物一定含离子键,也可能含极性键或非极性说法正确的是()A.化学反应中能量变化的主要原因是化学键的断裂与生成B.铝热反应中, 反应物的总能量比生成物的总能量低C.图I所示的装置能将化学能转变为电能D.图II所示的反应为吸热反应3、下列有关晶体的叙述中错误的是( )A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子B.氯化钠晶体中每个Na+周围紧邻的有6个Cl—C.CsCl晶体中每个Cs+周围紧邻的有8个Cl—,每个Cs+周围等距离紧邻的有6个Cs+D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子4、下列说法正确的是( )A.离子化合物中不可能含有共价键B.共价化合物中可能含有离子键C.化学键存在于分子之间D.化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程5、下列各组元素(数字表示原子序数),能形成AB型离子化合物的是()2A.6和8 B.1和16 C.12和17 D.16和86、下列变化中破坏离子键的是( )A.NaOH溶于水B.HCl溶于水C.SiO2熔化 D.酒精溶于水7、根据化学反应的实质是旧键断裂和新键形成这一观点,下列变化属于旧键断裂但没有发生化学反应的是 ( )A.氯化钠受热熔化B.石墨在高温高压下转化为金刚石C.单质碘受热升华D.固态S8加热到444.6℃时变成硫蒸气S28、已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量2分子中化学键断裂时需要吸收243 kJ的能量由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量。
下列叙述正确的是()A.反应物总能量为679kJB.生成物总能量为431kJC.氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ·mol-1能量D.氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ·mol-1能量9、下列化学用语表达正确的是 ( )10、现有如下各种说法:①在水中氢、氧原子间均以化学键相结合②金属和非金属化合时一定形成离子键③离子键是阳离子、阴离子的相互吸引力④根据电离方程式HCl==H++Cl-,判断HCl分子里存在离子键⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成共价键的过程。
2.下列表达正确的是( )3.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。
下列化合物中同时存在极性和非极性共价键的是( )A.Z2Y B.X2Y2C.Z2Y2D.ZYX4.下列变化需克服相同类型作用力的是( )A.碘和干冰的升华B.Na2O2和C60的熔化C.氯化氢和氯化钾的溶解D.溴的汽化和NH45.下列各图中的大黑点代表原子序数从1~18号元素的原子实ANH3C2H4CCl4CO26.下列说法正确的是( ①在水中氢、氧原子间的作用力均为化学键 ②金属和非金属化合时一定形成离子键 ③根据电离方程式HCl===H分子内存在离子键 ④Cl2分子的反应过程是分子内共价键发生断裂生成原子,而后子形成离子键的过程A.①②④B.都不正确C.④D.①7.短周期三种元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子最外层电子数之和为14,且X、Y和Z的电子数之和为26,下列有关推测正确的是( )A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XYB.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZC.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物X2ZD.XYZ3是一种离子化合物,且Y与Z可形成共价化合物YZ3 8.(1)请用下列10种物质的序号填空:①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2只有离子键的是________;只有共价键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为离子化合物CaF2,其电子式为________;若XY2为共价化合物CS2,其结构式为________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×103Pa),但在180 ℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是______________________。
1.【2017届上海市闵行区高三化学二模】醋酸钠中不存在()
A.离子键B.极性键C.非极性键D.分子间作用力
2.下列物质中含有相同的化学键类型的是()
A.NaCl、HCl、H2O、NaOH B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2D.Na2O2、H2O2、H2O、O3
3.下列过程中,破坏的作用力相同的是()
A.干冰升华和碘升华B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化D.NH4Cl受热分解和HI受热分解
4.下列说法正确的是()
A.含有共价键的化合物是共价化合物
B.两种不同元素形成的化合物中可以同时有离子键和非极性键
C.离子键是阴阳离子间的静电引力
D.分子中一定含有化学键
5.下列分子中所有原子都满足最外层为8电子稳定结构的是()
A.H2O B.CO2C.PCl5D.BF3
6.【2017届广东省仲元中学高三上9月月考】下列说法中正确的是()A.Na2O2分子中所有原子最外层均达到8电子稳定结构
B.NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键
C.同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物
D.NH4Cl仅由非金属元素组成,所以它是共价化合物
7.在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤H2O2、⑥NH4Cl、⑦NaOH、⑧Ar、⑨CO2、⑩C2H4(用物质前序号填空)
(1)只存在非极性键的分子是________;既存在非极性键又存在极性键的分子是________;
(2)不存在化学键的是__________。
(3)既存在离子键又存在极性键的是_______;既存在离子键又存在非极性键的是________
8.X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布。
X元素单质能在氢气中燃烧,产生苍白色火焰;Y元素氢化物的分子式是H2Y,其最高氧化物含有40%的Y;Z元素的离子具有紫色的焰色反应。
(1)根据以上条件,推断元素名称:X:_____,Y:_____,Z:________。
(2)X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是________。
(3)用电子式表示Z2Y的形成过程:___________,其化合物中化学键的类型是________。
1.【2017届河北省沧州一中高三上学期9.22周测】X、Y为两种短周期元素,其原子的最外层电子数分别为1和6,则X、Y两种元素形成的常见化合物或离子不可能是()
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴、阳离子个数之比为1:1的离子化合物
D.可形成双核离子或四核离子
2.下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是()
A.NH4Cl=NH3↑+ HCl↑
B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.
3.【2017届湖北省松滋市第一中学高三上学期9月月考】下列物质中均既有离子键又有共价键的一组是()
A.NaOH、H2O、NH4Cl B.KOH、Na2O2、NH4Cl
C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2
4.下列说法正确的是()
A.只含H、N、O三种元素的化合物,可能是离子化含物,也可能是共价化合物。
B.元素周期表中,ⅠA族与ⅦA族元素间只能形成离子化合物。
C.NaHCO3、CH3COONa均含有离子键和共价键。
D.化合物MgO、SiO2、SO3中化学键的类型相同。
5.下列说法正确的是()
①共价化合物一定含共价键,也可能含离子键②离子化合物一定含离子键,也可能含极性键或非极性键③由非金属元素组成的化合物一定是共价化合物④含金属元素的化合物不一定是离子化合物⑤固态不导电、熔融状态能导电的化合物一定是离子化合物⑥由分子组成的物质中一定存在共价键
A.②③⑤B.①④⑥C.②④⑤D.①③⑥
6.【2017届河北省定州中学高三上第一次月考】下列说法中正确的是()A.化合物中一定只有离子键而没有共价键
B.化合物中阳离子和阴离子个数不一定相等
C.所含元素一定不在同一周期也不在第一周期
D.化合物中阳离子半径一定大于阴离子半径
7.请用下列10种物质的序号填空:
①O2②H2③He ④K2O2⑤Ba(OH)2⑥CH4⑦Al ⑧NaF ⑨NH3⑩I2。
(1)其中由共价键形成的单质是__________,既有离子键又有极性键的是_____。
属于离子化合物的是_______________.常温下是固态分子的是____________。
(2)⑨NH3的电子式是________________
根据以上物质总结出的下列结论正确的有______________
①离子化合物只含有离子键
②只要有离子键的化合物就是离子化合物
③只要有共价键的物质就是共价化合物
④共价化合物只有共价键
⑤极性键不可能存在于离子化合物中
⑥金属元素与非金属元素之间只能形成离子键
⑦非金属元素与非金属元素之间只能形成共价键.
8.W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子与Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同主族元素,它们能形成两种常见化合物;
③X和Z属同周期元素。
它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素的名称是;Z元素在周期表中的位置。
(2)化合物XY2和WX2的电子式分别是和。
(3)X与Z,Y与Z可以形成同类化合物XZ2和YZ2;该类化合物按性质分类,叫。
(4)WX2与Z的氢化物反应可生成一种焊接、切割金属的原料气,反应的化学方程式:。
1.【2017天津卷】根据元素周期表和元素周期律,判断下列叙述不正确
...的是()
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
2.【2016年高考上海卷】下列各组物质的熔点均与所含化学键的键能有关的是()A.CaO与CO2B.NaCl与HCl C.SiC与SiO2D.Cl2与I2
3.【2016年高考江苏卷】下列有关化学用语表示正确的是()
O B.Mg2+的结构示意图:
A.中子数为10的氧原子:10
8
C.硫化钠的电子式:D.甲酸甲酯的结构简式:C2H4O2
4.【2015新课标Ⅰ卷理综化学】W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。
下列说法正确的是()A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
5.【2015新课标Ⅱ卷理综化学】原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、
7、1。
a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。
下列叙述错误
..的是()
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
6.【2015海南化学】a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子
数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。
下列叙述错误
..的是()
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d与氢形成的化合物中化学键均为极性共价键
7.【2015上海化学】某晶体中含有极性键,关于该晶体的说法错误的是()A.不可能有很高的熔沸点B.不可能是单质
C.可能是有机物D.可能是离子晶体
8.【2015上海化学】将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有()
A.2种B.3种C.4种D.5种
9.【2015四川理综化学】(13分)X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。
X和R 属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是_____________________。
(2)利用价层电子对互斥理论判断TU3的立体构型是______。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);Z和U的氢化物中沸点较高的是_____(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是_______________________。