第11章 配位化学章节要点及习题
- 格式:pdf
- 大小:213.03 KB
- 文档页数:6


第十一章配位化合物首页第十一章配位化合物基本要求重点难点讲授学时内容提要1 基本要求 [TOP] 1.1 掌握配合物的命名原则,学会由名称写出化学式。
1.2 掌握配位平衡的基本计算。
1.3 熟悉配合物的价键理论,能够用以解释或推测一些配合物的磁矩和相对稳定性。
1.4 熟悉酸碱反应、沉淀反应和氧化还原反应对配位平衡的影响。
1.5 了解晶体场理论。
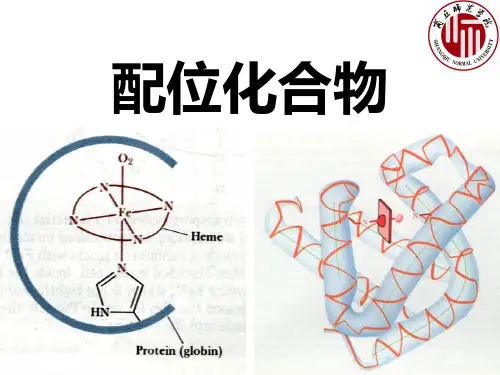
1.6 了1.6 了解生物体内的配合物。
1.7 掌握配合物的离解平衡 1.8 了解螯合物的结构特点螯合剂氨羧螯合剂 EDTA 及其二钠盐金属氨羧配合物的稳定性 1.9 配合物与医学的关系,对生命现象的重要作用2 重点难点 [TOP] 2.1 重点 2.1.1 配合物的命名原则。
2.1.2 配位平衡的基本计算。
2.1.3 配合物的价键理论。
2.2 难点晶体场理论。
3 讲授学时 [TOP] 建议4 学时4 内容提要 [TOP] 第一节第二节第三节第四节14.1 第一节配位化合物的基本概念 4.1.1 配位化合物的定义配合物是以具有接受电子对的离子或原子(统称中心原子)为中心,与一组可以给出电子对的离子或分子(统称配体),以一定的空间排列方式在中心原子周围所组成的质点(配离子或配分子)为特征的化合物。
玻尔假定:电子沿着固定轨道绕核旋转;当电子在这些轨道上跃迁时就吸收或辐射一定能量的光子。
轨道能量为4.1.2 配合物的组成大多数配合物由配离子与带有相反电荷的离子组成。
配离子由中心原子与配体组成。
配体中提供孤电子对的原子称配位原子。
常见的配位原子是电负性较大的非金属的原子N、O、C、S、F、Cl、Br、I 等。
只含有一个配位原子的配体称为单齿配体。
含有两个或两个以上配位原子的配体称多齿配体。
4.1.3 配合物的命名配位化合物的命名与一般无机化合物的命名原则相同。
1.配合物的命名是阴离子在前、阳离子在后,像一般无机化合物中的二元化合物、酸、碱、盐一样命名为“某化某”、“某酸”、“氢氧化某”和“某酸某”。



第十一章配位化合物11.1 基本概念 (1)11.2 化学键理论 (6)11.3 晶体场理论 (11)11.4 螯合物 (18)11.5 配位平衡 (19)11.1 基本概念11.1.1 配位化合物的基本概念前言配位化合物是一类由中心金属原子(离子)和配位体组成的化合物。
第一个配合物是1704年普鲁士人在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸钠在铁锅中强烈煮沸而得到的,即KFe[Fe(CN)6]。
配合物的形成对元素和配位体都产生很大的影响,以及配合物的独特性质,使人们对配位化学的研究更深入、广泛,它不仅是现代无机化学学科的中心课题,而且对分析化学、生物化学、催化动力学、电化学、量子化学等方面的研究都有重要的意义。
1.配位化合物的定义配合物是由中心原子(或离子)和配位体(阴离子或分子)以配位键的形式结合而成的复杂离子或分子,通常称这种复杂离子或分子为配位单元。
凡是含有配位单元的化合物都称配合物。
如:[Co(NH3)6]3+、[HgI4]2-、Ni(CO)4等复杂离子或分子,其中都含配位键,所以它们都是配位单元。
由它们组成的相应化合物则为配合物。
如:[Co(NH3)6]Cl3、k2[HgI4]、Ni(CO)411.1.2 组成2.配位化合物的组成图11-01表11-01 常见的配体表11.1.3 命名3.配位化合物的命名对于整个配合物的命名,与一般无机化合物的命名原则相同,如配合物外界酸根为简单离子,命名为某化某;如配合物外界酸根为复杂阴离子,命名为某酸某;如配合物外界为OH-,则命名为氢氧化某。
但配合物因为存在较为复杂的内界,其命名要比一般无机化合物复杂。
内界的命名顺序为:例如:11.1.4 配合物的类型4.配位化合物的类型(1).简单配位化合物简单配位化合物是指由单基配位体与中心离子配位而成的配合物。
这类配合物通常配位体较多,在溶液中逐级离解成一系列配位数不同的配离子。
例如:这种现象叫逐级离解现象。

![[精选]第11章配位化合物-01--资料](https://uimg.taocdn.com/e2b0230783c4bb4cf7ecd156.webp)