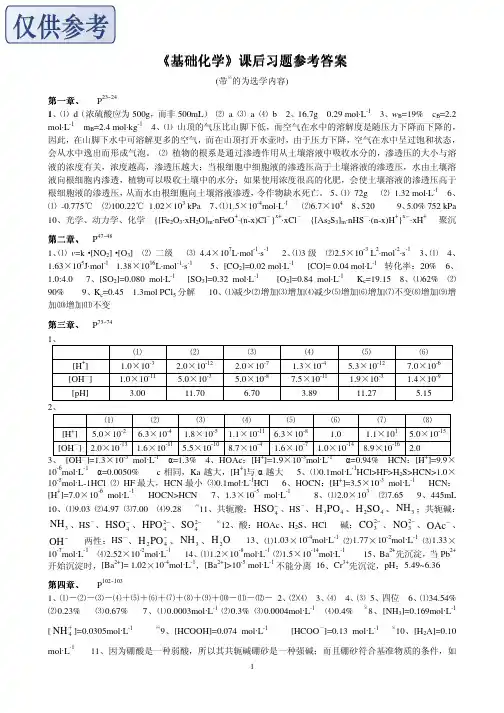
基础化学
- 格式:ppt
- 大小:713.50 KB
- 文档页数:24

大学基础化学试题及答案一、选择题(每题2分,共10分)1. 下列关于原子结构的描述,正确的是:A. 原子核由质子和中子组成B. 电子在原子核内运动C. 原子核由电子和质子组成D. 原子核由电子和中子组成答案:A2. 元素周期表中,元素的排列顺序是:A. 按原子量递增B. 按原子序数递增C. 按电子层数递增D. 按电子数递增答案:B3. 下列化合物中,属于共价化合物的是:A. NaClB. CaOC. H2OD. NaOH答案:C4. 酸的通性包括:A. 能与金属反应生成氢气B. 能与碱反应生成盐和水C. 能与金属氧化物反应生成盐和水D. 以上都是答案:D5. 下列物质中,属于电解质的是:A. 蔗糖B. 酒精C. 硫酸D. 醋酸答案:C二、填空题(每题2分,共10分)1. 原子的核外电子排布遵循______原则。
答案:能量最低2. 化学反应中,能量变化通常表现为______和______。
答案:吸热、放热3. 元素的化学性质主要取决于原子的最外层______。
答案:电子数4. 氧化还原反应中,氧化剂和还原剂之间发生的是______转移。
答案:电子5. 溶液的酸碱性通常用______值来表示。
答案:pH三、简答题(每题5分,共20分)1. 简述什么是化学键,并举例说明离子键和共价键的区别。
答案:化学键是相邻原子之间强烈的相互作用力。
离子键是由正负离子之间的静电吸引力形成的,如NaCl;共价键是由两个原子之间共享电子对形成的,如H2O。
2. 解释什么是摩尔,并说明摩尔质量与相对分子质量的关系。
答案:摩尔是物质的量的单位,表示含有6.022×10^23个粒子(原子、分子、离子等)的物质。
摩尔质量是1摩尔物质的质量,单位是克/摩尔。
摩尔质量与相对分子质量的数值相等,但单位不同。
3. 什么是酸碱中和反应?请举例说明。
答案:酸碱中和反应是酸和碱反应生成盐和水的过程。
例如,HCl(盐酸)与NaOH(氢氧化钠)反应生成NaCl(氯化钠)和H2O(水)。

基础化学试题库(附参考答案)一、判断题(共100题,每题1分,共100分)1.在实验室里,倾注和使用易燃、易爆物时,附近不得有明火。
A、正确B、错误正确答案:A2.缓冲溶液的缓冲能力是无限的。
A、正确B、错误正确答案:B3.当某弱酸稀释时,其解离度增大,溶液的酸度也增大。
A、正确B、错误正确答案:B4.用Na2C2O4标定KMnO4,需加热到70~80℃,在HCl介质中进行。
A、正确B、错误正确答案:B5.将0.1mol/LHAc稀释为0.05mol/L时,H+浓度也减小为原来的一半。
A、正确B、错误正确答案:B6.对于同类型的难容电解质,在一定的温度下,Ksp越小。
其溶解能力越小。
A、正确B、错误7.某物质如果含有6.02×1023个粒子,它的物质的量就是1mol。
A、正确B、错误正确答案:A8.由于溶液的体积随温度变化而变化,所以物质的量浓度也随温度的变化而改变。
A、正确B、错误正确答案:A9.标准物质在分析中主要用于分析仪器的校准和分析方法的评价。
A、正确B、错误正确答案:A10.质量百分比浓度是溶液的质量与溶质的质量的百分比。
A、正确B、错误正确答案:B11.在滴定分析中一般利用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定,这一点称为化学计量点。
A、正确B、错误正确答案:B12.将醋酸溶液加水稀释一倍,则溶液中的氢离子浓度就减少到原来的二分之一。
A、正确B、错误13.溶液的体积随温度变化而变化,但物质的量浓度不受温度变化的影响。
A、正确B、错误正确答案:B14.实验中,应根据分析任务、分析方法对分析结果准确度的要求等选用不同等级的试剂。
A、正确B、错误正确答案:A15.定量分析中产生的系统误差是可以校正的误差。
A、正确B、错误正确答案:A16.EDTA滴定某金属离子有一允许的最高酸度(PH值),溶液的PH 再增大就不能准确滴定该金属离子了。
A、正确B、错误正确答案:B17.在溶解过程中,溶质和溶剂的体积之和一定就是溶液的体积。

基础化学习题及详细答案第三章电解质溶液首页难题解析学生自测题学生自测答案章后习题解答难题解析[TOP]例3-1 (1) NaOH和H3PO4溶液等体积混合,测得溶液pH值为4.66,溶液的渗透浓度为200 mmol·L-1,求混合前NaOH和H3PO4溶液的浓度各为多少?(2)若此NaOH和H3PO4溶液以2:1的体积混合,溶液pH和渗透浓度各为多少?(已知H3PO4:p K a1=2.16;p K a2=7.21;p K a3=12.32) 分析(1) NaOH和H3PO4溶液等体积混合,由pH=4.66知混合后只有NaH2PO4,那么NaOH和H3PO4浓度相等,再由混合溶液渗透浓度求得NaOH和H3PO4溶液的浓度。
(2)NaOH和H3PO4以2:1体积混合,可计算出溶液pH和渗透浓度。
解(1)因NaOH和H3PO4溶液等体积混合后pH=4.66=(p K a1+p K a2)/2,可判断混合溶液只含有NaH2PO4,因此混合前NaOH和H3PO4浓度相等,又混合溶液的渗透浓度为200 mmol·L-1,即2×c(NaH2PO4)= 200 mmol·L-1c(NaH2PO4)= 0.10 mol·L-1根据c(NaH2PO4)推出混合前c(NaOH)= 0.20 mol·L-1,c(H3PO4)= 0.20 mol·L-1(2) NaOH和H3PO4溶液以2:1的体积混合发生的反应为:2NaOH(aq) + H3PO4(aq)Na2HPO4(aq) + 2H2O(aq)由于混合前c(NaOH)= 0.20 mol·L-1,c(H3PO4)=0.20 mol·L-1,混合后溶液只含有Na2HPO4,浓度为c(Na2HPO4)= (2/3)×0.20 mol·L-1因此溶液的渗透浓度为3×(2/3)×0.20×1000 mmol·L-1=400 mmol·L-1由于混合溶液只含有Na2HPO4两性物质,pH=(p K a2 + p K a3)/2=(7.21+12.32)/2=9.76例3-2在0.100 mol·L-1HA溶液的解离度α为1.32%,(1)计算HA的解离常数。

基础化学试题库与答案一、判断题(共100题,每题1分,共100分)1.游离金属指示剂本身的颜色一定要和与金属离子形成的配合物颜色有差别。
A、正确B、错误正确答案:A2.溶解度在1~10g之间的物质叫微溶物质。
A、正确B、错误正确答案:B3.当某弱酸稀释时,其解离度增大,溶液的酸度也增大。
A、正确B、错误正确答案:B4.配制硫酸、盐酸和硝酸溶液时都应将酸注入水中。
A、正确B、错误正确答案:A5.影响氧化还原反应速度的主要因素有反应物的浓度、酸度、温度和催化剂。
A、正确B、错误正确答案:A6.在实验室里,倾注和使用易燃、易爆物时,附近不得有明火。
A、正确B、错误正确答案:A7.分析天平的稳定性越好,灵敏度越高。
A、正确B、错误正确答案:B8.缓冲溶液的缓冲容量大小只与缓冲比有关。
A、正确B、错误正确答案:B9.EDTA标准溶液采用间接法配制,原因是EDTA溶液不稳定。
A、正确B、错误正确答案:B10.凡是优级纯的物质都可用于直接法配制标准溶液。
A、正确B、错误正确答案:B11.由于K2Cr2O7容易提纯,干燥后可作为基准物直接配制标准溶液,不必标定。
A、正确B、错误正确答案:A12.由于K2Cr207容易提纯,干燥后可作为基准物自接配制标准液,不必标定。
A、正确B、错误正确答案:A13.酸碱指示剂的变色与溶液中的氢离子浓度无关。
A、正确B、错误正确答案:B14.炔烃的熔点、沸点比相应的烯烃高,密度稍大。
A、正确B、错误正确答案:A15.所有的烷烃分子都可以用普通命名法命名。
A、正确B、错误正确答案:B16.对于同类型的难容电解质,在一定的温度下,Ksp越小。
其溶解能力越小。
A、正确B、错误正确答案:A17.从分析天平称量所得的数据,应保留小数点后四位有效字。
A、正确B、错误正确答案:A18.凡是基准物质,使用之前都需进行干燥(恒重)处理。
A、正确B、错误正确答案:A19.生理盐水的浓度为0.9%,是指每100mL溶液中含0.9g的氯化钠。

基础化学内容基础化学是化学学科的基础,是化学学习的重要组成部分。
它包括了化学元素、化学反应、化学键、化学式等基础概念,是化学学习的基础。
本文将从这些方面来介绍基础化学的内容。
一、化学元素化学元素是构成物质的基本单位,是化学学科的基础。
目前已知的元素有118种,其中92种是自然存在的元素,其余的都是人工合成的元素。
元素的性质是由其原子结构决定的,包括原子序数、原子量、电子结构等。
元素周期表是化学元素的分类表,它按照元素的原子序数和化学性质将元素分为若干个周期和族。
二、化学反应化学反应是化学学科的核心内容之一,是指物质之间发生的化学变化。
化学反应可以分为物理反应和化学反应两种。
物理反应是指物质的物理状态发生变化,如固体变成液体、液体变成气体等。
化学反应是指物质的化学性质发生变化,如氧化、还原、酸碱中和等。
化学反应的速率受到多种因素的影响,如温度、浓度、催化剂等。
三、化学键化学键是化学元素之间的结合力,是构成分子的基本单位。
化学键可以分为离子键、共价键和金属键三种。
离子键是由正负离子之间的静电作用力形成的,如NaCl。
共价键是由共享电子形成的,如H2O。
金属键是由金属原子之间的电子互相流动形成的,如铜。
四、化学式化学式是用化学符号表示化学物质的组成和结构的方法。
化学式可以分为分子式和离子式两种。
分子式是表示分子中原子种类和数量的化学式,如H2O。
离子式是表示离子化合物中离子种类和数量的化学式,如NaCl。
化学式的写法有一定的规则,如原子量、电价等。
基础化学是化学学科的基础,包括了化学元素、化学反应、化学键、化学式等基础概念。
学好基础化学对于深入学习化学学科和应用化学知识都有很大的帮助。

化学基础试题(附参考答案)一、单选题(共49题,每题1分,共49分)1.佛尔哈德法测定氯含量时,溶液应为( )A、弱酸性B、酸性C、碱性D、中性正确答案:A2.卤烷烷化能力最强的是( )。
A、RFB、RBrC、RClD、RI正确答案:D3.既有颜色又有毒性的气体是( )A、Cl2B、H2SC、COD、CO2正确答案:A4.湿氯气对铁管具有较强的腐蚀作用,其腐蚀作用的主要原理包括( )①2Fe+3Cl2 2FeCl3;②Fe+Cl2 FeCl2;③Cl2+H2O HCl+HClO;④FeCl3+3H2O Fe(OH)3+3HCl;A、①②B、②③C、③④D、①④正确答案:D5.在K2Cr2O7溶液中加入Pb2+,生成的沉淀物是( )A、PbCr2O7B、PbCrO4C、PbO2D、PbO正确答案:B6.苯、液溴、铁粉放在烧瓶中发生的反应是( )A、取代反应B、氧化反应C、水解反应D、加成反应正确答案:A7.关于氨的下列叙述中,错误的是( )A、氨在空气中可以燃B、氨水是弱碱C、氨易溶于水D、是一种制冷剂正确答案:A8.缓冲容量的大小与组分比有关,总浓度一定时,缓冲组分的浓度比接近( )时,缓冲容量最大。
A、1:1B、3:1C、1:2D、2:1正确答案:A9.电解食盐水,在阴、阳电极上产生的是( )A、氢氧化钠、氧气B、氢氧化钠、氯气C、金属钠、氯气D、氢气、氯气正确答案:D10.目前有些学生喜欢使用涂改液,经实验证明,涂改液中含有许多挥发性有害物质,二氯甲烷就是其中一种。
下面关于二氯甲烷(CH2Cl2)的几种说法:①它是由碳、氢、氯三种元素组成的化合物;②它是由氯气和甲烷组成的混合物;③它的分子中碳、氢、氯元素的原子个数比为 1 :2 :2;④它是由多种原子构成的一种化合物。
说法正确的是( )A、①③B、②④C、②③D、①④正确答案:A11.干燥H2S气体,通常选用的干燥剂是( )A、浓H2SO4B、P2O5C、Na2NO3D、NaOH正确答案:B12.下列电子运动状态正确的是( )A、n=4、L=3、m=±1B、n=2、L=0、m=±1C、n=1、L=1、m=0D、n=3、L=3、m=±1正确答案:A13.下列反应中哪个是水解反应( )A、炔烃与水反应B、在酸存在下腈与水反应C、烯烃与水反应D、甲醛与水反应正确答案:B14.成熟的水果在运输途中容易因挤压颠簸而破坏腐烂,为防止损失常将未成熟的果实放在密闭的箱子里使水果自身产生的( )聚集起来,达到催熟目的。

基础化学考试题+答案一、判断题(共100题,每题1分,共100分)1.任何原子的摩尔质量在数值上等于该原子的相对原子质量。
A、正确B、错误正确答案:A2.配位滴定指示剂称为金属指示剂,它本身是一种金属离子。
A、正确B、错误正确答案:B3.生理盐水的浓度为0.9%,是指每100mL溶液中含0.9g的氯化钠。
A、正确B、错误正确答案:A4.乙烷、乙烯和乙炔分别通入溴水中,能使溴水褪色的一定是乙烯。
A、正确B、错误正确答案:B5.用NaOH标准溶液标定HCl溶液浓度时,以酚酞作指示剂,若NaOH溶液因贮存不当吸收了CO2,则测定结果偏高。
A、正确B、错误正确答案:A6.乙酸不溶于水,易溶于有机溶剂。
A、正确B、错误正确答案:B7.变色范围必须全部在滴定突跃范围内的酸碱指示剂才可用来指示滴定终点。
A、正确B、错误正确答案:B8.提高反应溶液的温度能提高氧化还原反应的速度,因此在酸性溶液中用KMnO4滴定时,必须加热至沸腾才能保证正常滴定。
A、正确B、错误正确答案:B9.滴定突跃范围的宽窄,与酸碱的浓度无关,只与酸碱的性质有关。
A、正确B、错误正确答案:B10.烯烃的化学性质比较稳定,原因是双键比单键牢固。
A、正确B、错误正确答案:B11.烯烃很容易被氧化,冷的稀高锰酸钾碱性溶液就能把烯烃氧化。
A、正确B、错误正确答案:A12.缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。
A、正确B、错误正确答案:A13.配合滴定中,一般情况下,对主反应影响最大的是EDTA的浓度。
A、正确B、错误正确答案:B14.乙酸乙酯是易挥发,并有水果香味的液体。
A、正确B、错误正确答案:A15.同一溶液,其组成的表示方法不同,所含溶质的质量也不同。
A、正确B、错误正确答案:B16.溶液稀释前后溶质的物质的量不变,但物质的质量发生了变化。
A、正确B、错误正确答案:B17.有效数字当中不包括最后一位可疑数字。

《基础化学Ⅱ》课程标准课程代码:B0300103 课程类别:专业基础课授课系(部):制药与环境工程系学分学时: 82学时一、课程定位与作用1.课程的定位:《基础化学Ⅱ》是工业分析技术、药品质量与安全、食品营养与检测、食品生物技术等专业学生的一门重要的专业基础课程,主要研究有机化合物。
本课程以有机化合物的基本知识、基本理论和基本技能为主线,阐述了烃类、卤代烃、醇、酚、醚、醛、酮、羧酸及其衍生物等有机物的结构和性质。
2.课程的作用:通过本课程的教学,要求学生掌握与专业相关的有机化学基础理论知识和基本操作技术、从事化工、药品、食品等生产工作必需的基本知识和操作技能,确立正确的“有机”的理念,提高学生分析和解决问题的能力,培养实事求是的科学态度和认真细致的工作作风,为学习后续课程或实际工作打下良好的基础。
3.与其他课程的关系:《基础化学Ⅱ》的前导课程是《基础化学Ⅰ》,后续课程有工业分析技术专业的《有机产品分析》、药品质量与安全专业的《药物化学》、《药物分析》、《药物合成技术》、食品营养与检测专业、食品生物技术专业的《食品营养与检测》等。
二、课程目标通过对《基础化学Ⅱ》课程的学习,使学生获得从事化工、药品、食品等生产工作必需的有机化学基本理论、基础知识,注重培养学生的基本技能,应用所学的知识分析和解决化工、药品、食品等生产中的实际问题,为学习专业课和毕业后从事相关工作,打下坚实的基础。
1.知识目标(1)学习有机化合物的特性及其结构的特点,掌握其系统命名法。
(2)掌握各类有机化合物的结构与性质的内在关系及其变化规律。
(3)熟悉自由基取代、亲电加成、亲电取代、亲核取代、亲核加成反应机理,并能运用电子效应、空间效应理解有机化合物的变化规律。
(4)熟知进行有机化合物的制备的基本思路和确定合成路线的原则。
(5)熟悉立体化学的基本知识、糖类等天然有机化合物的性质。
2.能力目标(1)学生能进行简单的物质推断,写出结构简式。

基础化学知识点总结1. 原子结构原子是构成物质的基本单位,由原子核和绕核运动的电子组成。
原子核由质子和中子组成,质子带正电荷,中子不带电。
电子带负电荷,质子的电量等于电子的电量,原子是电中性的。
原子的质量数等于质子数加上中子数,原子的元素符号通常表示为A(原子质量)Z(原子序数)X, 其中A是质子数和中子数之和,Z是原子核中的质子数,X是元素的标记。
例如,氢元素的记号是1H1。
原子序数Z表示了元素的电子数和化学性质,而质子数和中子数则决定了元素的质量。
不同原子质量相同的元素称为同位素。
2. 化学键原子通过化学键相互结合形成分子或离子。
化学键的形成是由原子间的静电相互作用力产生的。
原子通过共价键、离子键和金属键进行化学结合。
共价键是由共享电子对形成的,共价键的原子之间的电负性差异小。
例如,氢气中的氢分子H2,氩气中的氩原子Ar,水分子H2O都是通过共价键形成。
离子键是由电子的转移而形成的,形成的化合物中通常包含阳离子和阴离子。
例如,氯化钠NaCl中的钠离子Na+和氯离子Cl-。
金属键是金属原子间的结合力,金属元素形成晶体结构,在晶格中形成电子海和离子核。
金属键使金属具有良好的导电性和导热性。
3. 化学反应化学反应是指原子间的连接和分离导致物质转化的过程。
化学反应所涉及的物质被称为反应物,产生的物质被称为产物。
化学反应的速率受到多种因素的影响,包括反应物浓度、温度、催化剂等。
化学反应速率可通过化学反应速率方程进行描述。
化学反应的热力学性质最常使用的是焓变和反应热计算。
焓变可通过计算反应物和产物之间的热量差异而确定,通常表示为△H。
4. 化学方程式化学反应可以通过化学方程式进行描述。
化学方程式中反应物和产物分别用化学式表示,反应物与产物之间用箭头相连。
例如,氢气和氧气生成水的化学方程式为:2H2 + O2 →2H2O。
化学方程式中必须满足质量守恒、电荷守恒和能量守恒。
化学方程式的平衡是指反应物与产物之间物质的质量比和反应速率达到一定的比例。

基础化学概念
基础化学概念包括物质的变化及性质、化学反应速率和化学平衡、电解质溶液、有机化学、无机化学和分析化学等。
1.物质的变化及性质:包括物理变化和化学变化。
物理变化是没有新物质生成的变化,如
物质的三态变化、形状的改变、位置的移动等。
化学变化是有新物质生成的变化,也称为化学反应。
化学变化常常伴随一些反应现象,如发光、发热、产生气体、改变颜色、生成沉淀等。
2.化学反应速率和化学平衡:化学反应速率是指单位时间内反应物和生成物浓度的变化量。
化学平衡是指在一定条件下,化学反应达到平衡状态,即反应物和生成物的浓度不再发生变化。
3.电解质溶液:电解质是指在水溶液中或熔融状态下能够导电的化合物。
电解质溶液是指
在水溶液中能够导电的化合物溶液。
4.有机化学:有机化学是研究有机化合物的组成、结构、性质和变化的科学。
5.无机化学:无机化学是研究无机化合物的组成、结构、性质和变化的科学。
6.分析化学:分析化学是研究物质的组成、结构和性质的定量分析方法的科学。
这些是基础化学概念的一部分,对于理解化学学科的基本原理和概念非常重要。
基础化学考试题(含答案)一、判断题(共100题,每题1分,共100分)1.混合溶液一定是缓冲溶液。
A、正确B、错误正确答案:B2.pH 越大,酸效应系数越小。
A、正确B、错误正确答案:A3.配合滴定中,一般情况下,对主反应影响最大的是EDTA的酸效应,所以通常仅考虑酸效应的影响。
A、正确B、错误正确答案:A4.两电对的电位值差值越大,平衡常数值越大,反应越完全。
A、正确B、错误正确答案:B5.同一溶液,其组成无论用何种方法表示,所含溶质的质量不变。
A、正确B、错误正确答案:A6.酚酞在酸性溶液中为无色,而在碱性溶液中为红色。
A、正确B、错误正确答案:B7.苯酚具有较强的酸性,可以使指示剂变色。
A、正确B、错误正确答案:B8.实验室中常用的去离子水中加入1~2滴酚酞指示剂,水应呈现无色。
A、正确B、错误正确答案:A9.相同外界条件下,某溶液沸腾时产生的蒸汽压与纯溶剂沸腾时产生的蒸汽压相等。
A、正确B、错误正确答案:A10.在高温高压下,使烷烃分子发生裂解生成小分子的过程称为裂化。
A、正确B、错误正确答案:A11.稀释定律表示溶液在稀释后溶液中的溶质量保持不变。
A、正确B、错误正确答案:A12.易燃液体废液不得倒入下水道。
A、正确B、错误正确答案:A13.影响化学反应平衡常数数值的因素是反应物的浓度、温度、催化剂、反应产物的浓度等。
A、正确B、错误正确答案:B14.对于不同类型的难溶电解质可以用溶度积比较其溶解度的大小。
A、正确B、错误正确答案:B15.所谓终点误差是由于操作者终点判断失误或操作不熟练而引起的。
A、正确B、错误正确答案:B16.配合滴定中,一般情况下,对主反应影响最大的是EDTA的浓度。
A、正确B、错误正确答案:B17.某物质的质量如果是1千克,它的物质的量就是1mol。
A、正确B、错误正确答案:B18.在酸碱滴定中,当滴定终点在较窄的pH范围时可采用混合指示剂。
A、正确B、错误正确答案:A19.乙烷、乙烯和乙炔分别通入高锰酸钾的酸性溶液中,能使其褪色的一定是乙烯。
《基础化学》课程标准一、课程性质本课程是中等职业学校化工类专业必修的一门理论与实践相结合的专业类平台课程,其任务是让化工类各专业学生掌握化学的基础知识和基本技能,为《化学实验技术》《工业分析基础》《化学工业概论》等后续专业课程的学习奠定基础。
二、学时与学分144学时,8学分。
三、课程设计思路本课程按照立德树人的要求,突出职业能力培养,主动对接行业标准、职业标准和岗位规范,兼顾中高职课程衔接,高度融合化学基础知识、基本技能学习和职业精神培养。
1.依据化工专业类行业面向与职业面向,以及《中等职业学校化工类专业课程指导方案》确定的人才培养定位、综合素质、行业通用能力,按照知识与技能、过程与方法、情感态度与价值观三个维度,突出分析和解决涉及化学实际问题能力的培养,结合学生职业生涯发展需要,确定本课程目标。
2.依据课程目标,以及化工专业类技能岗位需求,对接国家职业标准(初级)、职业技能等级标准(初级)中涉及的化学基础知识,兼顾职业基础知识,反映技术进步和生产实际,体现科学性、前沿性、适用性原则,确定本课程内容。
3.按基础化学知识的类别,设置化学原理、元素化合物知识、有机化合物等4个模块,将相关知识和技能有机融入。
遵循学生认知规律,从单一到综合、从知识认知到知识应用,序化各教学单元的内容。
四、课程目标学生通过学习本课程,掌握专业学习和职业发展必需的化学基础知识和基本技能,养成良好的学习习惯,确立良好的职业意识。
1.掌握常见元素的单质、化合物的性质与鉴别方法,重要有机物的官能团特性以及官能团间相互转化的规律。
2.能进行基本化学计算,能正确理解基础化学涉及到的有关概念、方法原理,以及实验现象的特征与形成原因。
3.掌握化学实验的基础知识和基本操作技能。
4.能应用化学原理解释和解决一些日常生活、职业工作中的实际问题。
5.养成勤奋、坚毅、合作、崇尚科学等优良品德,建立安全、质量、环保的职业意识。
五、课程内容与要求六、实施建议(一)教学建议1.以立德树人为基本任务,坚持正确的育人理念,充分挖掘课程思政,聚焦学生科学核心素养培养。