在原电池中,较活泼的金属发生_____反应,是_____极,
活泼性较差的金属发生_____反应,是_____极。
(2)化学电池可以将化学能转化为电能,化学电池的本质
是_____,下列电池中属于二次电池的是_____。
A.碱性锌锰电池
B.铅蓄电池
C.镍镉电池
D.锂离子电池
【解析】化学能转化为电能必须有电子的转移,故化学电 池的本质是氧化还原反应;二次电池即为可充电电池,碱 性锌锰电池是一次性电池。 答案:(1)化学能 电能 氧化 负 还原 正 (2)氧化还原反应 B、C、D
【知识拓展】原电池原理的应用 (1)加快氧化还原反应的进行: ①原理:原电池反应在正极产生相应的物质。 ②应用:如实验室制备H2,下列两种方法都可以加快反应速 率。如用粗锌:实验室中用Zn和稀硫酸反应制H2,常用粗锌, 它产生H2的速率快。因为粗锌中的杂质、锌、稀硫酸形成原 电池,加快了反应进行。
【解析】选B。Zn与O2的反应中,Zn失去电子发生氧化反应Zn -2e-====Zn2+,所以Zn作负极,O2在正极发生还原反应。若 电解质溶液是强酸,电池反应就不是2Zn+O2====2ZnO而是Zn +2H+====Zn2++H2↑,故选项B正确。
6.(1)原电池是一种把_____转化为__________的装置。
③燃料电池 一种将存在于燃料与氧化剂中的化学能直接转化为电能的发 电装置。具有以下特点:能量转化效率高,燃料和空气分别送 进燃料电池,它直接将燃料的化学能转化为电能,中间不经过 燃烧过程。
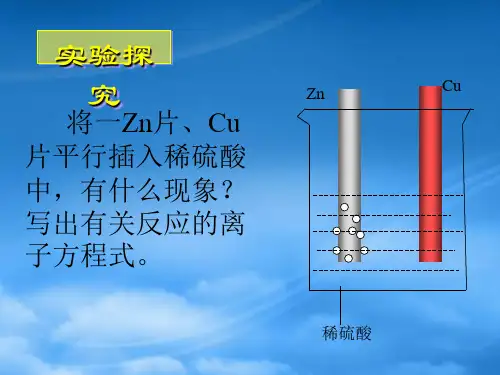
原电池的工作原理 铜锌原电池工作原理如下图:
合作探究
1.原电池是由哪几部分组成?各起什么作用? 提示:构成原电池需有两个活泼性不同的电极,将电极插入 电解质溶液中,两电极间用导线连接使之构成闭合回路。 电极的作用是导电,有些电池中电极材料会参加反应;导线的 作用是传导电子;电解质溶液的作用是通过自由离子的移动 传导电荷。