氧气的性质和用途
- 格式:ppt
- 大小:1.55 MB
- 文档页数:16



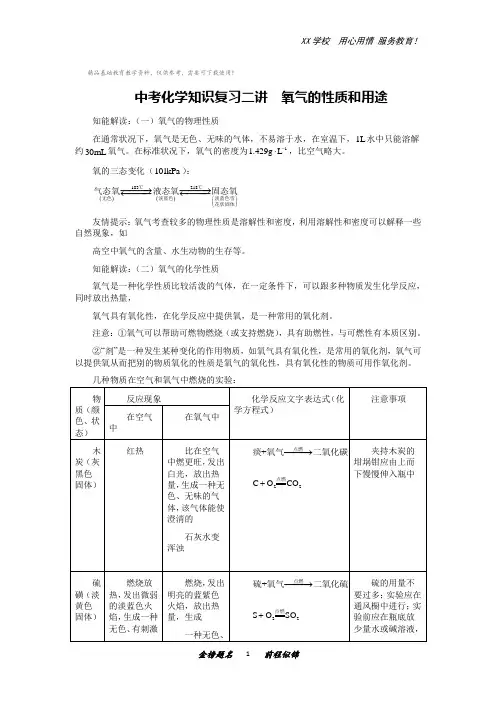
精品基础教育教学资料,仅供参考,需要可下载使用!中考化学知识复习二讲 氧气的性质和用途知能解读:(一)氧气的物理性质在通常状况下,氧气是无色、无味的气体,不易溶于水,在室温下,1L 水中只能溶解约30mL 氧气。
在标准状况下,氧气的密度为11.429g L -⋅,比空气略大。
氧的三态变化(101kPa ):()()-183-218⎛⎫⎪⎝⎭−−−→−−−→←−−−←−−−℃℃无色淡蓝色淡蓝色雪花状固体气态氧液态氧固态氧 友情提示:氧气考查较多的物理性质是溶解性和密度,利用溶解性和密度可以解释一些自然现象,如高空中氧气的含量、水生动物的生存等。
知能解读:(二)氧气的化学性质氧气是一种化学性质比较活泼的气体,在一定条件下,可以跟多种物质发生化学反应,同时放出热量,氧气具有氧化性,在化学反应中提供氧,是一种常用的氧化剂。
注意:①氧气可以帮助可燃物燃烧(或支持燃烧),具有助燃性,与可燃性有本质区别。
②“剂”是一种发生某种变化的作用物质,如氧气具有氧化性,是常用的氧化剂,氧气可以提供氧从而把别的物质氧化的性质是氧气的氧化性,具有氧化性的物质可用作氧化剂。
注意:烟—大量固体小颗粒分散在空气中产生的现象;雾—大量小液滴分散在空气中产生的现象。
光—固体物质燃烧时发光;火焰—气体物质和容易汽化的物质燃烧时产生火焰。
镁条燃烧发出耀眼的强光;木炭在氧气中燃烧产生白光;蜡烛在空气中燃烧产生黄色的火焰,是石蜡汽化后的气体燃烧而产生的;铁丝燃烧没有火焰。
通过以上几个实验,我们可以看出,物质在纯氧气中燃烧比在空气中燃烧要剧烈,甚至某些不能在空气中燃烧的物质能在纯氧气中燃烧,说明氧气的化学性质比较活泼,同时也说明物质燃烧的剧烈程度与氧气浓度有关。
规律总结:上述这些反应的共同特点:①都是物质跟氧气发生的反应;②这类反应属于氧化反应;③生成物都是氧化物。
知能解读:(三)氧气的用途供给呼吸和支持燃烧。
冶炼钢铁(用纯氧炼钢,使生铁中的杂质氧化而除掉);氧炔焰焊接和切割金属(乙炔在纯氧中燃烧,产生高温);液氧炸药(将锯木屑等可燃固体用液氧浸泡后制成炸药);是急救、高空飞行、潜水等的必备品。

氧气的化学知识点总结氧气是一种无色、无味、无臭的气体,在自然界中广泛存在,是生物体进行呼吸作用所需的气体之一。
氧气的化学性质非常活泼,与许多元素和化合物发生反应,具有重要的生物和工业应用价值。
在本文中,我们将对氧气的化学知识点进行总结,包括其性质、制备方法、用途等方面的内容。
一、氧气的基本性质1. 氧气的物理性质氧气是一种无色、无味、无臭的气体,密度为1.429g/L,比空气稍重。
氧气的沸点为-183℃,在常温下为气态,化学符号为O2。
2. 氧气的化学性质(1)燃烧性:氧气是一种支持燃烧的气体,大多数物质在含氧的环境中都可以燃烧。
燃烧反应是一种氧化反应,例如燃烧木材时,木材中的碳和氧气发生反应生成二氧化碳和水。
(2)与金属的反应:大多数金属在高温下与氧气发生化学反应,生成金属氧化物。
例如铁在高温下与氧气反应生成氧化铁,即生锈的过程。
(3)与非金属的反应:氧气与非金属元素也能发生氧化反应,生成相应的氧化物。
例如氢气与氧气在适当的条件下可以发生爆炸反应,生成水。
二、氧气的制备方法1. 分离空气法将液态空气在适当的温度下加压,然后再减压蒸馏的方法分离出液态氮和液态氧。
在这个过程中,通过经有选择性吸附性的吸附剂吸附氮气,并不断地减压蒸馏,可以得到较高纯度的液态氧。
2. 水解过氧化氢法将过氧化氢溶液通过适当的催化剂催化分解,产生氧气和水。
具体的化学反应式为:2H2O2 → 2H2O + O23. 热分解过氧化氢法将过氧化氢溶液放入反应器中,通过加热使之分解,产生氧气和水。
具体的化学反应式为:2H2O2 → 2H2O + O24. 氧化金属法通过氧化金属的热分解反应产生氧气。
例如,氧化铅(PbO2)可以通过加热分解产生氧气和氧化铅:2PbO2 → 2PbO + O2三、氧气的用途1. 生物呼吸作用氧气是生物体进行呼吸作用所需的气体之一,通过呼吸过程,生物体可以将氧气与营养物质发生氧化反应,生成能量和二氧化碳。

氧气知识点总结一、氧气的概述氧气是一种无色、无味、无臭的气体,化学符号为O2,是地球上最常见的元素之一。
氧气是一种强烈的氧化剂,能够支持燃烧和维持生命。
二、氧气的历史氧气的发现可以追溯到1774年,当时瑞典科学家卡尔·威廉·让·舍尔·蒙德把氧气命名为“燃素”。
在这之后,约瑟夫·普里斯特利和安托万-努瓦·拉瓦锡等科学家也做出了氧气的研究,扩大了人们对氧气的了解。
三、氧气的性质1. 物理性质:氧气是一种无色、无味、无臭的气体,密度为1.429g/L,比空气稍重,不易溶于水。
2. 化学性质:氧气是一种强氧化剂,能够与其他元素形成化合物。
它能够支持燃烧并加速燃烧过程,也可以与许多元素和化合物反应,形成氧化物。
四、氧气的产生1. 实验室制取:利用分馏方法、电解水和化学方法等制取氧气。
2. 工业制取:利用空分装置、压缩空气和膜法等制取氧气。
3. 生产制剂:工业上主要通过空气的分离获取氧气,通过空气的分馏方法或通过膜分离法分离空气中的氧气和氮气等其余组分。
五、氧气的应用1. 医疗行业:氧气在医疗行业中被用作呼吸用氧和医用制氧,用于治疗心血管疾病、肺部疾病、中毒等。
2. 工业用途:氧气可以用于金属切割、氧化还原反应、城市污水处理,以及废物处理等方面。
3. 农业用途:氧气可以用于温室气体的植物光合作用和粮食的储藏。
4. 其他用途:氧气还可以用作火箭推进剂、水下呼吸器材、军事领域等。
六、氧气的重要性1. 生命必须:氧气是地球上维持生命必需的气体,是呼吸的原料,在新陈代谢中起到重要作用。
2. 工业生产:氧气在工业生产中有着广泛的应用,包括钢铁生产、电力生产、化工生产等领域。
3. 医疗保健:氧气在医疗领域是一种重要的治疗工具,可以帮助患者恢复健康。
4. 环境保护:氧气可以在环境保护中发挥作用,用于改善城市的环境空气质量,减少污染物的排放。
七、氧气的安全使用1. 空气稀释:在封闭空间使用氧气时,应保证空气的流通,避免氧气浓度过高导致火灾和爆炸。

氧气的性质和用途一、氧气的物理性质:1、通常氧气是无色无味的气体;2、氧气的密度比空气大,标况下密度是1.429g/L ;3、氧气不易溶于水;4、氧气能发生三态变化。
液氧、固态氧呈淡蓝色——储存在蓝色钢瓶二、氧气的检验:1、检验氧气的实验实验步骤:把带火星木条伸到盛有氧气的集气瓶中,观察现象。
实验现象:带火星木条复燃实验结论:氧气能支持燃烧。
氧气具有助燃性。
补充:(1)在空气中,带火星木条不复燃,并逐渐熄灭;在氧气中,带火星木条复燃,并剧烈燃烧。
(2)带火星木条不复燃有两种可能:一是不含氧气,二是氧气含量太低;(3)鉴别两种气体(其中一种是氧气)时,可使用带火星木条;(4)鉴别三种或三种以上的气体(其中一种为氧气)时,可使用燃着木条。
2、氧气的检验 把带火星木条伸入集气瓶中,若木条复燃,则证明该集气瓶中所装气体是氧气。
三、氧气的化学性质:1、几种可燃物燃烧实验【实验1】硫的燃烧实验步骤:……燃烧匙……集气瓶…… 实验现象:硫在空气中燃烧的现象硫在氧气中燃烧的现象 硫在空气中燃烧产生微弱的淡蓝色火焰,生成刺激性气味气体,同时放出大量热。
硫在氧气中燃烧产生明亮的蓝紫色火焰, 生成刺激性气味气体, 同时放出大量热。
实验结论:硫在空气和氧气中都能燃烧,在氧气中燃烧更旺。
文字表达式:硫+氧气——→二氧化硫点燃 注:硫粉点燃后燃烧匙需要由上至下缓慢地插入集气瓶中,目的是______________________。
【实验2】铁丝的燃烧实验步骤:……螺旋状……火柴……快燃尽时……集气瓶……实验现象:铁丝在氧气中剧烈燃烧,火星四射,放出大量热,生成黑色固体。
实验结论:铁丝能在氧气中燃烧,生成四氧化三铁。
文字表达式:铁+氧气——→四氧化三铁点燃 注:(1)先用砂纸打磨铁丝成表面光亮银白色,目的是___________________;(2)把铁丝绕成螺旋状,目的是_______________________;(3)把铁丝绕在火柴上,目的是_______________________;(4)待火柴快要燃尽时,才缓慢插入盛有氧气的集气瓶中,目的是__________________;(5)由上到下缓慢插入盛有氧气的集气瓶里,目的是___________________;(6)集气瓶里预先装入少量水或铺一层细沙,目的是___________________,【实验3】木炭的燃烧实验步骤:……燃烧匙……加热发红……集气瓶……澄清石灰水……实验现象:木炭在氧气中燃烧发出白光,放出大量热,生成气体使澄清石灰水变浑浊。

课题二、氧气的性质和用途一、氧气的性质【物理性质】密度略大于空气的密度。
不易溶于水。
气态的氧是无色无味的,液态氧和固态氧是淡蓝色的。
【化学性质】氧气化学性质比较活泼。
氧气具有助燃性和氧化性。
二、氧气的检验方法:把一根带火星的木条伸入集气瓶中,如果带火星的木条复燃,证明是氧气.三、探究实验1.木炭燃烧实验【实验操作】用坩埚钳夹取一小块木炭,在酒精灯上加热到发红,插入到盛有集气瓶的氧气中(由瓶口向下缓慢插入),观察木炭在氧气里燃烧的现象。
燃烧停止后,取出坩埚钳,向集气瓶中加入少量澄清的石灰水,振荡,观察现象。
【实验现象】木炭在空气中燃烧时持续红热,无烟无焰;在氧气中燃烧更旺,发出白光。
向集气瓶中加入少量澄清的石灰水后,澄清的石灰水变浑浊.【化学方程式】C+O2CO2【注意事项】木炭应该由上向下缓慢伸进盛有氧气的集气瓶中,原因:为了保证有充足的氧气支持木炭燃烧,防止木炭燃烧生成的二氧化碳使木炭熄灭,确保实验成功。
2.硫燃烧实验【实验操作】在燃烧匙里放少量硫,在酒精灯上点燃,然后把盛有燃着硫的燃烧匙由上向下缓慢伸进盛有氧气的集气瓶中,分别观察硫在空气中和在氧气中燃烧的现象。
【实验现象】硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰。
放出热量;生成一种有刺激性气味的气体。
【化学方程式】S+ O2SO2【注意事项】在集气瓶中加入少量的氢氧化钠溶液或者水,可以吸收有毒的二氧化硫,防止造成空气污染。
3.细铁丝在氧气中燃烧的实验【实验操作】把光亮的细铁丝盘成螺旋状,下端系一根火柴,点燃火柴,待火柴快燃尽时,由上向下缓慢插入盛有氧气的集气瓶中(集气瓶底部要先放少量水或铺一薄层细沙)。
【实验现象】细铁丝在氧气中剧烈燃烧,火星四射,生成一种黑色固体.【化学方程式】3Fe+2O2Fe3O4【注意事项】①用砂纸把细铁丝磨成光亮的银白色,是为了除去细铁丝表面的杂质.②将细铁丝盘成螺旋状,是为了增大细铁丝与氧气的接触面积。

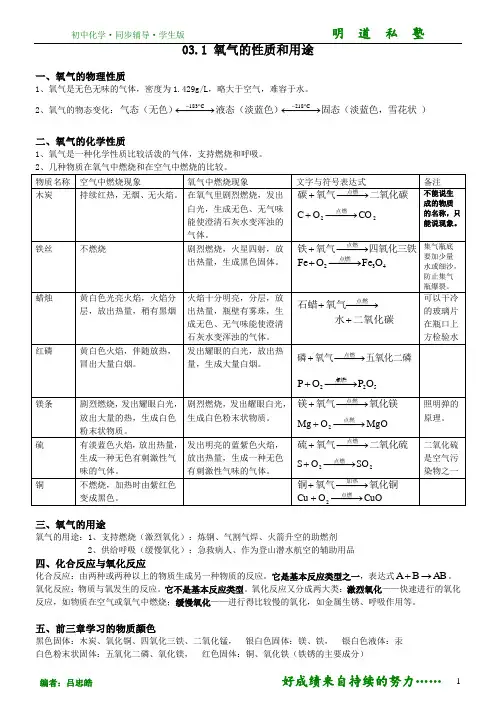
初中化学·同步辅导·学生版 明 道 私 塾编者:吕忠皓 好成绩来自持续的努力……103.1 氧气的性质和用途一、氧气的物理性质1、氧气是无色无味的气体,密度为1.429g/L ,略大于空气,难容于水。
2、氧气的物态变化:)固态(淡蓝色,雪花状液态(淡蓝色)气态(无色)−−→←−−→←--C218C183二、氧气的化学性质1、氧气是一种化学性质比较活泼的气体,支持燃烧和呼吸。
2、几种物质在氧气中燃烧和在空气中燃烧的比较。
物质名称 空气中燃烧现象 氧气中燃烧现象 文字与符号表达式备注木炭持续红热,无烟、无火焰。
在氧气里剧烈燃烧,发出白光,生成无色、无气味能使澄清石灰水变浑浊的气体。
二氧化碳氧气碳点燃−−→−+22CO O C −−→−+点燃不能说生成的物质的名称,只能说现象。
铁丝不燃烧剧烈燃烧,火星四射,放出热量,生成黑色固体。
四氧化三铁氧气铁点燃−−→−+432O Fe O Fe −−→−+点燃集气瓶底要加少量水或细沙,防止集气瓶爆裂。
蜡烛黄白色光亮火焰,火焰分层,放出热量,稍有黑烟 火焰十分明亮,分层,放出热量,瓶壁有雾珠,生成无色、无气味能使澄清石灰水变浑浊的气体。
二氧化碳水氧气石蜡点燃+−−→−+可以干冷的玻璃片在瓶口上方检验水 红磷黄白色火焰,伴随放热,冒出大量白烟。
发出耀眼的白光,放出热量,生成大量白烟。
五氧化二磷氧气磷点燃−−→−+52点燃2O P O P −−→−+镁条剧烈燃烧,发出耀眼白光,放出大量的热,生成白色粉末状物质。
剧烈燃烧,发出耀眼白光,生成白色粉末状物质。
氧化镁氧气镁点燃−−→−+ MgO O Mg 2−−→−+点燃照明弹的原理。
硫有淡蓝色火焰,放出热量,生成一种无色有刺激性气味的气体。
发出明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体。
二氧化硫氧气硫点燃−−→−+ 22S O O S −−→−+点燃 二氧化硫是空气污染物之一 铜 不燃烧,加热时由紫红色变成黑色。

氧气的性质和用途主要内容鹿邑玄武一中 栾志伟1·氧气的物理性质1)通常情况下,氧气是一种无色、无味的气体;2)不易溶于水;3)密度比空气略大(比空气略重);4)氧气常温气体,冷却至-183度时变为液氧是淡蓝色的,-218度时变为淡蓝色的固态氧。
2·氧气的化学性质 物质现象 碳在空气中保持红热,在氧气中发出白光,产生使澄清石灰水变浑浊的气体C + O 2 点燃 CO 2 磷产生大量白烟4P + 5O 2 点燃 2P 2O 5 硫在空气中发出微弱的淡蓝色火焰,而在氧气中发出明亮的蓝紫色火焰, 产生有刺激性气味的气体S + O 2 点燃 SO 2 镁发出耀眼的白光,放出热量,生成白色固体2Mg+O 2 点燃2MgO 4Al + 3O 2 点燃 2Al 2O 3 铝铁剧烈燃烧,火星四射,生成黑色固体(Fe 3O 4) 3Fe+2O 2点燃Fe 3O 4 石蜡 在氧气中燃烧发出白光,瓶壁上有水珠生成,产生使澄清石灰水变浑浊的气体总之,氧气的化学性质比较活泼,在常温或点燃及加热的条件下,能与许多物质发生化学反应。
如:铜在空气中加热变黑 2Cu+O 2∆2CuO甲烷的燃烧 CH 4+2O 2═点═燃CO 2+2H 2O乙醇(酒精)燃烧 C 2H 5OH+3O 2═点═燃2CO 2+3H 2O乙炔的燃烧 2C 2H 2+5O 2═点═燃4CO 2+2H 2O氢气的燃烧 2H 2+O 2═点═燃2H 2O一氧化碳燃烧 2CO+O 2═点═燃2CO 23·氧气的用途1)支持燃烧;2)供给呼吸。
4·习题1)现有:①O 2;②C ;③Fe ;④O 2;⑤ MgO ;⑥H 2O ;⑦KClO 3;⑧空气 ⑴其中属于混合物的是______;⑵其中属于氧化物的是_______.⑶属于含氧化合物,但不属于氧化物的是______;⑷含有氧分子的是________;⑸含有元素种类最多的化合物是________;⑹含有物质种类最多的是________。
氧气的性质和用途(基础)责编:董亚娇【学习目标】1.掌握氧气的物理性质和化学性质;掌握氧气的检验方法;知道氧气的重要用途。
2.认识氧化反应、缓慢氧化。
【要点梳理】要点一、氧气的物理性质(高清课堂《氧气的性质》)在通常状况下,氧气是一种无色无味的气体。
在标准状况下,氧气密度比空气略大,不易溶于水。
在降温,加压的条件下,氧气可以变为淡蓝色液体和淡蓝色雪花状的固体。
工业生产的氧气,一般以液态形式贮存在蓝色钢瓶中。
【要点诠释】1.氧气不易溶于水,不等于氧气不溶于水,只是溶解较少而已。
河水、海水中的鱼虾等能生存,可以证明自然界的水中溶有氧气。
2.在标准状况下,氧气的密度为1.429g/L,比空气的密度(1.293g/L)大,利用这一性质可推出收集氧气的方法之一是向上排空气法。
要点二、氧气的化学性质1.氧气是一种化学性质比较活泼的气体在一定条件下可以和许多物质发生化学反应,同时放出热量。
氧气具有氧化性,是一种常见的氧化剂。
2.氧气与物质发生反应的现象等方面的对比:反应物条件反应现象化学反应的文字表达式在空气中燃烧在氧气中燃烧反应后木炭和氧气点燃持续红热,放出热量剧烈燃烧,发出白光,放出热量生成使澄清石灰水变浑浊的气体碳+氧气二氧化碳硫磺和氧气发出微弱的淡蓝色火焰,放出热量发出明亮的蓝紫色火焰,放出热量生成有刺激性气味的气体硫+氧气二氧化硫红磷和氧气发黄白光,放出热量发出耀眼的白光,放出热量产生大量白烟磷+氧气五氧化二磷铁丝和氧气灼烧至红热,离火后迅速变凉(不能燃烧)剧烈燃烧,火星四射,放出热量生成黑色固体铁+氧气四氧化三铁【要点诠释】1.氧气支持燃烧,但其本身无可燃性;物质燃烧一般要发光放热。
2.根据可燃物在氧气中燃烧比在空气中燃烧更剧烈(如硫),还有在空气中不燃烧的物质却可以在氧气中燃烧(如铁),可得到如下结论:(1)可燃物燃烧剧烈程度与氧气的浓度有关;(2)反应的剧烈程度与可燃物和氧气的接触面积有关。
3.做硫、磷等物质在氧气中燃烧的实验时,盛有可燃物的燃烧匙应自上而下慢慢伸入到集气瓶的中下部;如果迅速伸入到瓶底,物质燃烧放出的热量使氧气受热膨胀,大量氧气逸出到瓶外,可燃物将不能持续燃烧。