专题21 有机合成(练习)-2019年高三期末化学大串讲(解析版)
- 格式:doc
- 大小:6.37 MB
- 文档页数:63

题型六有机合成与推断(选修)有机合成与推断题是高考的必考题型。
涉及考点主要有有机物官能团的结构与性质、常见有机反应类型的判断、有机物结构的推断与书写、同分异构体的书写与判断、有的还涉及有机合成路线的设计等。
题型特点近几年来高考有机题目有两大特点:(1)常与当年的社会热点问题结合在一起。
题目常给出一些新信息,要求考生具备一定的自学能力,能迅速捕捉有效信息,并使新旧信息产生联系,将新信息分解、转换、重组,从而解决题目要求的问题。
(2)常把有机推断与设计有机合成流程图结合在一起。
从考查内容来看,一般是给出一些信息作为知识的铺垫,既考查了考生处理信息的能力,又增加了题目的综合性,该类题常考常新, 起点高落点低,因此要想拿到解决此类问题的“金钥匙”,应熟练掌握有机物之间的转化关系,充分利用题给信息,合理推断与设计。
有机合成的解题思路:有机推断的解题技能:一二一、有机推断题例1现以有机物A、苯酚等为原料合成有机物D的流程如下(其他试剂、产物及反应条件均省略):一二已知:①有机物A为苯的同系物,其相对分子质量为 106;②;③。
请回答下列问题:(1)A的化学名称为。
(2)D中含氧官能团的名称是。
(3)C→E的反应类型为。
(4)已知B的分子式为C8H6Cl4,B→F的化学反应方程式为。
一二(5)写出F与新制Cu(OH)2反应的化学方程式:。
(6)E与G反应生成的高分子化合物的结构简式为。
(7)符合下列条件的G的同分异构体有种。
其中核磁共振氢谱有4组峰的有机物的结构简式为。
①能与银氨溶液反应②能与NaHCO3溶液反应释放出CO2③与NaOH溶液反应得到一种有机物,该有机物用酸处理后能与FeCl3 溶液发生显色反应一二答案(1)邻二甲苯(2)酚羟基、羧基、羰基(3)取代反应(或水解反应) (4) +4NaOH+4NaCl+2H2O (5)+4Cu(OH)2+2NaOH+2Cu2O↓+6H2O(6) (7)3一二解析(1)根据M的结构简式可知,A分子中苯环的取代基处于邻位,A为苯的同系物,且其相对分子质量为106,则其结构简式为,其名称为邻二甲苯。

2021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕2021 高考化学专题练习 -有关有机分子式确定的计算〔含解析〕一、单项选择题1.等物质的量以下物质中,完全燃烧时消耗O2最少的是〔〕A. 甲烷B苯.C乙.酸丙酯D乙.二醛〔 OHC﹣CHO〕2.某有机物 2.3 克,完全燃烧后的产物依次通过浓硫酸与NaOH 溶液,分别增重克与克,该有机物可能是〔〕A. CH4B. C2H4C. C2H6D. C2H6O3.将 0.2mol 某烷烃完全燃烧后,生成的气体缓缓通过0.5L 2mol/L 的 NaOH 溶液中,生成正盐和酸式盐的物质的量之比为1: 3,那么该烷烃是〔〕A. 甲烷B乙.烷C丙.烷D丁.烷4.某有机物在氧气中充分燃烧,生成的CO2和 H2O 的物质的量之比为1: 2,那么〔〕A. 分子中 C、 H、 O 个数之比为 1:2:3B.分子中 C、H 个数之比为 1: 2C. 有机物一定是 CH4D有.机物可能是 CH4O5.某共价化合物含碳、氢、氮三种元素,分子内有四个氮原子,且四个氮原子构成正四面体〔如白磷结构〕每两个氮原子间都有一个碳原子.分子内无碳碳单键,也没有碳碳双键,那么该化合物的分子式为〔〕A. C6H12N4B. 4CH8N4C. 6CH10N4D. 6CH8N46.分析以下各项结构的规律,按此规律排布第8 项的分子式应为〔〕A. C158H118B. C158H116C. C160H116D. C160H1187.相同质量的以下烃,完全燃烧时,需要氧气最少的是〔〕A. CH4B. C2H4C. C3H6D. C2H28.1 体积某气态烃和 2 体积氯气发生加成反响后,最多还能和 6 体积氯气发生取代反响.由此可以断定原气态烃是〔气体体积均在相同条件下测定〕〔〕A. 乙烷B丙.炔C丁.炔D丙.烯9.一定量的某有机物完全燃烧,生成0.2mol CO2和 5.4g H2O,该有机物不可能是〔〕A. CH≡ CHB. CH3CH3C. CH3CH2 OHD. CH3OCH310.某羧酸酯的分子式为C18H26O5, 1mol 该酯完全水解可得到2mol 乙酸和 1mol 醇,该醇的分子式为〔〕A. C14H18O5B. C14H22O3C. C14H22O5D. C14H10O511.有机物 A 和 B 只由 C、H、O 中的两种或三种元素组成,等物质的量的 A 和 B 完全燃烧时,消耗相等物质的量的氧气,那么 A 和 B 的相对分子质量的差值〔其中n 为正整数〕不可能为〔〕2021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕二、填空题12.为研究 A 的组成与结构,某同学进行了如下实验:实验步骤〔 i〕将 9.0g A 在足量纯O2中充分燃烧,并使其实验结论〔 i〕A 的实验式为________.产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重 5.4g 和.〔 ii〕通过质谱法测得其相对分子质量为90.〔ii〕A的分子式为________〔 iii 〕另取 9.0g A,跟足量的NaHCO3粉末反响,〔 iii 〕 A 中含有的官能团名称为________.生成 2.24L CO2〔标准状况〕,假设与足量金属钠反应那么生成 2.24L H2〔标准状况〕.〔 iv〕A 的核磁共振氢谱有四组吸收峰,其峰面积之比为 2: 2: 1:1.〔 iv〕综上所述, A 的结构简式为________.〔 v〕写出 A 与 NaHCO3反响的化学方程式________.13.现有 CH4、C2H6、C2H4、C3H6、C6H6五种有机物,质量相同时,完全燃烧消耗O2的量最多的是 ________〔填分子式,下同〕,完全燃烧所生成的CO2最多的是 ________,生成的水最多的是 ________;120℃, 101kPa 下,将上述五种有机物分别与足量的空气混合,引燃反响后恢复到原来的状态,气体体积不变的是________与 ________.14.2mol 某烃 A 在氧气中充分燃烧后,生成化合物B、 C 各 12mol .试答复:①烃A的分子式为 ________.②假设取一定量的烃 A 做核磁共振氢谱实验发现只有一个峰,且能使溴水反响褪色,那么烃A与氢气反响生成饱和链烃D,那么该链烃 D 的名称为________.15.完全燃耗 0.2mol 某烃,燃烧产物依次通过浓硫酸、浓氢氧化钠溶液,浓硫酸增重,浓氢氧化钠增重.该烃的化学式为________,并写出其同分异构体中所有碳原子在同一个平面上的结构简式________.16.两种气态烃组成的混合物〔标准状况〕,完全燃烧生成2和2O,那么该混合烃中一定含有 ________ 〔化学式〕,假设另一种烃一定条件下最多能与等物质的量的H2完全加成,那么该烃的名称为________.17.某烷烃蒸汽的密度是相同状况下氢气密度的36 倍,那么该烷烃可能的结构有________几种,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:________.18.〔 1〕由 A、B 两种气态烃组成的混合气体,对H2的相对密度为 17.常温常压下,取这种混合气体 10mL 与 80mL 氧气〔过量〕混合,当完全燃烧后恢复到原状态时,测得气体的体积为 70mL.试求:① 混合气体的平均组成为〔用C x H y的形式表示〕 ________ ;② 假设上述两种气体按体积1: 1 混合时,那么两种气态烃的可能组成为________〔2〕具有支链的化合物X 的分子式为 C4 H8O, X 既能使 Br2的四氯化碳溶液褪色,又能与Na 反响.①X的结构简式是________,2/172021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕19.在 100℃时,某有机物蒸汽20mL 与 60mL 氧气混合,点燃后恰好完全反响,生成CO2与水蒸气体积为 1:,假设将混合气体通过盛浓硫酸的洗气瓶后,气体变为40mL,有机物的分子式为 ________.三、解答题20.将 11.2L 标准状况下的甲烷和某单烯羟的混合气体通入足量的溴的四氯化碳溶液中充分反响,溴的四氯化碳溶液增加了.该烯羟对氢气的相对密度为21〔相对密度〕① 试确定该烯烃;② 求原混合气体中甲烷与烯烃的物质的量之比以及质量之比.21.有机物 A 是烃的含氧衍生物,在同温同压下, A 蒸气对乙醇蒸气的相对密度是2,完全燃烧后,假设将燃烧的产物通过碱石灰,碱石灰的质量会增加;假设将燃烧产物通过浓硫酸,浓硫酸的质量会增加.假设将 13.8gA 与足量金属钠充分反响,所得氢气的体积为〔标准状况〕.通过计算确定 A 的相对分子质量、分子式及结构简式.22.叶绿素在光的作用下可将CO2和 H2O 转化为葡萄糖〔 C6H12O6〕和 O2, 6CO2+6H2OC 6H12O6+6O2,葡萄糖可进一步合成淀粉[〔 C6H10O5〕n].科学家预言,在不久的将,人类将模拟生物体内的这一变化过程,从工厂中由CO2和 H2O 直接生产出淀粉.这样,合成优质叶绿素将十分重要.叶绿素有 a、b 两种,某种叶绿素中仅含有C、H、O、N、Mg 五种元素,且知该叶绿素中各元素的质量分数分别是:w〔C〕=73.99%w〔 H〕=8.072% w〔 O〕 =8.969% w 〔N〕=6.278%w〔 Mg〕 =2.691%经测定该叶绿素的相对分子质量小于1000,试确定该叶绿素的分子式.四、实验探究题23.为测定某有机化合物 A 的结构,进行如下实验:〔1〕将一定量的有机物 A 置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气〔标准状况下〕,那么该物质的实验式是________.〔2〕用质谱仪测定该有机化合物的相对分子质量,得到如图 1 所示的质谱图,那么其相对分子质量为 ________,该物质的分子式是________.〔3〕请预测 A 的可能结构并写出结构简式:________.〔4〕核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值〔信号〕,根据峰值〔信号〕可以确定分子中氢原子的种类和数目.例如甲基氯甲基醚〔 Cl﹣ CH2﹣ O﹣CH3,有2 种氢原子〕的核磁共振氢谱如图 2 所示:2021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕经测定,有机物 A 的核磁共振氢谱图如图 3 所示,那么 A 的结构简式为________.五、综合题24.某一氯代烷,与足量的氢氧化钠溶液混合后加热,充分反响后,用足量硝酸酸化,向酸化后的溶液中参加﹣ 120mL 1mol?L AgNO3溶液时,不再产生沉淀.〔1〕通过计算确定该一氯代烷的分子式:________〔2〕写出这种一氯代烷符合以下条件的结构简式:________ ①核磁共振氢谱有 4 组峰② 水解产物经催化氧化生成醛类.25.某气态烷烃与烯烃的混合气9g,其密度为相同状况下氢气密度的11.25 倍,将混合气体通过足量的溴水,溴水增重,求:〔1〕混合气体的平均摩尔质量为________ g?mol﹣1.〔2〕以下关于混合气体组成,判断正确的选项是〔填字母编号〕A. 必有甲烷B. 必有乙烯C. 无法判断〔3〕气态烯烃的物质的量________ mol .2021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕答案解析局部一、单项选择题1.【答案】 D【考点】有关有机物分子式确定的计算【解析】【解答】解:烃及烃的含氧衍生物组成为C x H y O z〔 z=0 时为烃〕,那么 C x H y O z+〔 x+﹣〕 O2xCO2+H2O,故 1mol 的耗氧量为〔x+﹣〕mol, A.1mol 甲烷耗氧量为〔 1+〕mol=2mol;B.1mol 的耗氧量为〔 6+〕;C.1mol 乙酸丙酯〔 C5H10O2〕的耗氧量为〔5+﹣〕;D.1mol 乙二醛〔 C2H2O2〕的耗氧量为〔2+﹣〕,应选: D.【分析】烃及烃的含氧衍生物组成为C H O〔 z=0 时为烃〕,1mol 的耗氧量为〔x+﹣〕x y zmol .2.【答案】 D【考点】有关有机物分子式确定的计算【解析】【解答】解:完全燃烧后的产物依次通过浓硫酸与NaOH 溶液,分别增重 2.7 克与4.4 克,可知n〔 H2 O〕 ==0.15mol ,n〔 CO2〕==0.1mol ,那么有 n〔 H〕=0.3mol ,m〔 H〕,n〔 C〕=0.1mol ,m〔 C〕=0.1mol ×,那么<,所以一定含有 O 元素,且 m〔 O〕﹣, n〔 O〕 ==0.05mol ,所以: n〔 C〕: n〔 H〕:n 〔O〕: 0.3mol : 0.05mol=2 : 6: 1,故该有机物的化学式为C2H6O,应选 D.【分析】完全燃烧后的产物依次通过浓硫酸与NaOH 溶液,分别增重 2.7 克与 4.4 克,可知2021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕n〔 H2O〕 ==0.15mol ,n〔 CO2〕==0.1mol ,那么有 n〔 H〕=0.3mol ,m〔 H〕,n〔 C〕=0.1mol ,m〔 C〕=0.1mol ×,结合质量守恒判断有机物中是否含有O 元素,进而可计算该有机物的化学式.3.【答案】 D【考点】有关有机物分子式确定的计算【解析】【解答】设Na2CO3物质的量为xmol, NaHCO3物质的量为3xmol ,由 Na 元素守恒得: n〔Na+〕=n〔 NaOH〕=n〔NaHCO3〕+2n〔Na2CO3〕,即:2x+3x=0.5L ×2mol/L=1mol,解得: x=0.2 mol ,由 C 元素守恒得: n〔 CO2〕 =x+3x=0.8 mol,C n H2n+2~ nCO21n0.2 mol 0.8 mol× 1}{0.2mol}=4,该烷烃分子中含有 4 个 C,为丁烷,应选 D.【分析】正盐为碳酸钠、酸式盐为碳酸氢钠,根据钠原子守恒计算出碳酸钠、碳酸氢钠的物质的量,再根据 C 原子守恒计算出生成二氧化碳的物质的量,然后根据烃的物质的量、二氧化碳的物质的量可确定该烷烃的分子式.4.【答案】 D【考点】有关有机物分子式确定的计算【解析】【解答】有机物在氧气中充分燃烧充分生成CO2和 H2O 的物质的量之比为 1:2,根据原子守恒可知,原有机物中的 C 和 H 的物质的量之比为1:4,有机物可能是CH4,也可能是含氧有机物CH3OH,应选 D.分析】有机物在氧气中充分燃烧,生成的CO2和 H2 O 的物质的量之比为 1: 2,那么确定有机物分子中C、 H 个数之比为1: 4,有机物可能是甲烷,也可能是含氧有机物.5.【答案】 A【考点】有关有机物分子式确定的计算【解析】【解答】四个氮原子构成正四面体,正四面体有 6 条边,所以有 6 个 C 原子,因为N 原子构成正四面体的四个顶点,与 3 个 C 原子成键,分子内无碳碳单键,也没有碳碳双键,每个 C 还有两个共价键可以和 H 原子结合,共要结合 12 个氢原子,即化合物的化学式是C6H12N4.应选 A.【分析】形成化合物时,碳可形成 4 个键,氢形成 1 个键,氮下形成三个键均是饱和的以及分子构型,以此可确定有机物的分子式.6.【答案】 A【考点】有关有机物分子式确定的计算【解析】【解答】解:1 的分子式为: C25H20, 2 的分子式为: C44H34, 3 分子式为: C63H48,由此规律得到, C 的个数为 25+〔 n﹣ 1〕×19, H 的个数为: 20+〔n﹣ 1〕×15﹣〔 n﹣ 1〕,据此可知第 8 个分子式中 C 的个数为:25+〔 8﹣ 1〕×19=158, H 的个数为: 20+〔 8﹣ 1〕×15﹣〔 8﹣ 1〕 =118,所以第 8 项的分子式应: C158H118,应选 A.【分析】 1 的分子式为 C25H20, 2 的分子式为 C44H34, 3 的分子式为 C63H48,由此规律离子: C 的个数为 25+〔 n﹣1〕×19, H 的个数为: 20+〔 n﹣ 1〕×15﹣〔 n﹣ 1〕,据此第8 个分子式可求.7.【答案】 D【考点】有关有机物分子式确定的计算【解析】【解答】解:由C~ O2~ CO2, 4H~ O2~2H2O 进行比拟,消耗 1molO 2,需要12gC,而消耗 1molO 2,需要 4gH,可知有机物含氢量越大,等质量时消耗的O2越多,那么选项中物质的最简式分别为CH4、 CH2、 CH2、CH,由最简式 CH n中 n 值越大,含氢量越高,所以根据烃分子的化学式可知,完全燃烧消耗O2的物质的量最少的应该是C2H2,应选 D.【分析】由 C~ O2~ CO2, 4H~ O2~2H2O 进行比拟,消耗 1molO 2,需要 12gC,而消耗 1molO 2,需要 4gH,可知有机物含氢量越大,等质量时消耗的O2越多,以此进行比较.8.【答案】 C【考点】有关有机物分子式确定的计算【解析】【解答】 1 体积某气态烃和与 2 体积氯气发生加成反响,说明分子中含 2 个双键或1个 C≡C.生成的 1 体积该卤代烷能和 6 体积氯气发生取代反响,说明 1 个卤代烷中含有 6 个H 原子,即气态烃分子中还含有 6 个H 原子,选项中只有丁炔符合,应选:C.【分析】1 体积某气态烃和与 2 体积氯气发生加成反响,说明分子中含 2 个双键或 1 个 C≡C.生成的 1 体积该卤代烷能和 6 体积氯气发生取代反响,说明 1 个卤代烷中含有 6 个H 原子,即气态烃分子中还含有 6 个H 原子.9.【答案】 A【考点】有关有机物分子式确定的计算【解析】【解答】解:有机物完全燃烧,生成 0.2mol CO2和 5.4g H2O,水的物质的量为=0.3mol ,可知有机物中子个数比为1: 1,故C、 H 原子个数比为A 选;0.2mol :× 2=1:3,A.乙炔中C、H原B.乙烷中C、 H 原子个数比为1:3,故 B 不选;C.乙醇中C、 H 原子个数比为1: 3,故 C 不选;D.甲醚中C、H 原子个数比为1: 3,故 D 不选;应选 A.【分析】有机物完全燃烧,生成 0.2mol CO2和 5.4g H2O,水的物质的量为=0.3mol ,可知有机物中 C、 H 原子个数比为 0.2mol : 0.3mol ×2=1:3 ,可能为烃或烃的含氧衍生物,以此来解答.10.【答案】 B【考点】有关有机物分子式确定的计算【解析】【解答】解:某羧酸酯的分子式为C18H26O5, 1mol 该酯完全水解可得到1mol 醇和 2mol 乙酸,说明酯中含有 2 个酯基,设醇为M,那么反响的方程式为C18H26O5+2H2O=M+2C2H4O2,由质量守恒可知M 的分子式为C14H22O3,应选 B.【分析】 1mol 该酯完全水解可得到1mol 醇和 2mol 乙酸,那么说明酯中含有 2 个酯基,结合酯的水解特点以及质量守恒定律判断.11.【答案】 B【考点】有关有机物分子式确定的计算【解析】【解答】解: A.当 A 与 B 互为同分异构体时,分子式相同,消耗氧气的量相等,那么 A 和 B 的相对分子质量的差值为0,故 A 正确;B.A 与 B 的分子组成只相差n 个“CH〞2时,即 A 和 B 的相对分子质量的差值为14n 时,消耗氧气的量不等,故 B 错误;C. A 与 B 的分子组成只相差 n 个“H2O〞时,即 A 和 B 的相对分子质量的差值为 18n 时,消耗氧气的量相等,故 C 正确;D.A 与 B 的分子组成只相差 n 个“ CO2〞时,即 A 和 B 的相对分子质量的差值为 44n 时,消耗氧气的量相等,故 D 正确.应选 B.【分析】等物质的量的有机物消耗相等的物质的量的氧气有以下几种情况:①分子间相差n 个 CO2;②分子间相差n 个 H2O;③分子间 1个 C相当于 4 个 H,即少一个C要多 4 个 H;④ 同分异构体.二、填空题12.【答案】 CH2O;C3H6O3;羧基、羟基;;【考点】有关有机物分子式确定的计算2021 高考化学专题练习 -有关有机分子式确定的计算〔含解析〕【解析】【解答】解:〔 i 〕浓硫酸增重,那么生成水的质量是,生成 n 〔 H 2O 〕==0.3mol ,所含有 n 〔 H 〕,碱石灰增重 ,生成 m 〔 CO 2〕是, n 〔 CO 2〕 ==0.3mol ,所以 n 〔 C 〕=0.3mol ,9gA 中 n 〔O 〕==0.3mol ,那么 n 〔 C 〕: n 〔 H 〕:n 〔 O 〕=0.3mol :0.6mol : 0.3mol=1 :2:1,那么有机物 A 的实验 式为: CH 2O , 故答案为: CH 2O ;( i i 〕有机物 A 的实验式为故 x=3,那么 A 的分子式为:故答案为: C 3H 6O 3;CH 2O ,设其分子式为 〔 CH 2O 〕x ,相对分子质量为 90,那么 30x=90, C 3 H 6O 3 ,〔iii 〕 9.0gA 的物质的量 ==0.1mol , A 和碳酸氢钠反响说明 A 中含有羧基,生成2〔标准状况〕,n 〔CO 2〕 =,所以含有一个﹣COOH ;醇羟基和羧基都可以和金属钠发生反响生成氢气,与足量金属钠反响那么生成 2〔标准状况〕, n 〔 H 2〕 ==0.1mol ,反响中羧基或羟基的物质的量与氢气的物质的量之比为 2:1,而 A 的物质的量与氢气的物质的量之比是 1:1,那么说明 A 中除了含有一个﹣ COOH外还含有一个﹣ OH ,故答案为:羧基、羟基; 〔iv 〕 A 的核磁共振氢谱图有4 个峰值,那么含 4 种类型的等效氢原子,且氢原子的个数比是2:2: 1: 1,所以结构简式为:,(v)与 NaHCO 3 反响的化学方程式为:,故答案为: ;.【分析】〔 i 〕浓硫酸可以吸收水,碱石灰可以吸收二氧化碳,根据元素守恒确定 9gA 中 C 、H 原子物质的量,再根据A 的质量确定氧原子物质的量, 可得有机物 A 的实验式;〔 ii 〕结合A 的实验式、相对分子质量可以确定有机物 A 的分子式;〔 iii 〕羧基可以和 NaHCO 3 发生化学反响生成二氧化碳, 9gA 为 0.1mol ,生成二氧化碳为0.1mol ,那么有机物 A 含有 1 个﹣ COOH ,﹣OH 、﹣ COOH 和金属钠发生化学反响生成氢气,与足量金属钠反响那么生成 H 2 为 0.1mol ,反响中羧基或羟基的物质的量与氢气的物质的量之比为2: 1,而 A 的物质的量与氢气的物9/172021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕氢谱图中有几个峰值那么含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比,结合 A 的分子式、含有的官能团确定 A 的结构简式.13.【答案】 CH4; C6H6; CH4; CH4; C2H4【考点】有关有机物分子式确定的计算【解析】【解答】解: CH4、 C2H6、 C2H4、 C3 H6、 C6H6五种有机物,最简式分别为CH4、 CH3、CH2、 CH2、 CH,那么质量相同时,氢元素质量分数越大,消耗氧气越多,完全燃烧消耗O2的量最多的是 CH4,等质量是苯中含 C 量最大,由 C 原子守恒可知完全燃烧所生成的CO2最多的是 C6H6,等质量时甲烷中含H 量最大,由 H 原子守恒可知生成的水最多的是CH4,120℃, 101kPa 下,水为气体,烃中 H 原子数为 4 时,反响前后的体积不变,符合条件的烃为 CH4、 C2H4,故答案为: CH4; C6H6; CH4; CH4; C2H4.【分析】相同质量情况下,氢元素质量分数越大,消耗氧气越多;根据 n=可知,相同质量情况下,摩尔质量越小,物质的量越大,结合C、H 原子守恒判断生成的二氧化碳、水;120℃, 101kPa 下,水为气体,由C x H y+〔x+〕O2xCO2+H2O,气体体积不变,那么1+x+ =x+,烃中 H 原子数为 4 时,反响前后的体积不变.14.【答案】 C6H12;2, 3﹣二甲基丁烷【考点】有关有机物分子式确定的计算【解析】【解答】解:①2molC x H y→ 12molCO2 +12molH 2O,由原子守恒可知x=6,y=12,那么烃A 的分子式为 C6H12,故答案为: C6H12;②假设取一定量的烃 A 做核磁共振氢谱实验发现只有一个峰,且能使溴水反响褪色,那么 A 应为,与氢气反响生成饱和链烃 D,D 为,为2,3﹣二甲基丁烷,故答案为:2,3﹣二甲基丁烷.【分析】〔 1〕 2molC x H y→ 12molCO2+12molH 2 O,由原子守恒分析;〔 2〕假设取一定量的烃 A 做核磁共振氢谱实验发现只有一个峰,且能使溴水反响褪色,那么 A 结构对称,以此判断.15.【答案】 C6H12;【考点】有关有机物分子式确定的计算【解析】【解答】解:浓硫酸增重,为水的质量,可知n 〔 H2O〕 ==1.2mol ,浓氢氧化钠增重.为二氧化碳的质量,可知n〔 CO2〕 ==1.2mol ,那么 1mol有机物含有6molC、12molH ,分子式为C6H12,其同分异构体中所有碳原子在同一个平面上,应为,故答案为:C6H12;.10/17【分析】浓硫酸增重,为水的质量,可知n 〔H2O〕 ==1.2mol ,浓氢氧化钠增重.为二氧化碳的质量,可知n〔CO2〕==1.2mol ,可知有机物的分子式,结合结构特点判断结构简式,以此解答该题.16.【答案】 CH4;乙烯【考点】有关有机物分子式确定的计算【解析】【解答】解:烃的物质的量为=0.3mol ,n〔 H2O〕==0.6mol ,完全燃烧生成2和2O,可知烃的平均组成为CH4,那么一定含 CH4,可能含乙烯或丙炔,假设另一种烃一定条件下最多能与等物质的量的H2完全加成,那么只有一个碳碳双键,为乙烯,故答案为:CH4;乙烯.【分析】烃的物质的量为=0.3mol ,n〔 H2O〕==0.6mol ,完全燃烧生成2和2O,可知烃的平均组成为 C H4,以此来解答.17.【答案】 3;【考点】有关有机物分子式确定的计算【解析】【解答】解:该烷烃蒸气蒸气的密度是H2的 36 倍,故该烷烃的相对分子质量为36× 2=72,故该烃的分子式为 C5H12;其主链有 5 个碳原子的同分异构体有:;其主链有 4 个碳原子的同分异构体有:;其主链有 3 个碳原子的同分异构体有,;其中有一种一氯取代物只有一种,应为,故答案为: 3;.【分析】相同条件下,密度之比等于相对分子质量之比,该烷烃蒸气蒸气的密度是H2的 36倍,故该烷烃的相对分子质量为36×2=72,据此书写分子式;根据分子式写出符合条件的同分异构体的结构简式,其中有一种一氯取代物只有一种,那么应只含一种H 原子,以此解答该题.11/1718.【答案】 CH4; CH4和 C4 H4或 C2H4和 C3H4或 C2H2和 C3H6;;CH2=CH﹣CH2﹣ CH2OH、 CH2=CH﹣ CH〔 OH〕 CH3、 CH3﹣CH=CH﹣CH2OH.【考点】有关有机物分子式确定的计算【解析】【解答】〔 1〕① 设混合烃的平均分子式为C x H y,密度与摩尔质量成正比,混合烃对 H2的相对密度为17,那么混合烃的平均摩尔质量为17g/mol ×2=34g/mol,那么 12x+y=34,混合烃燃烧的方程式为:C x H y+〔 x+〕O2xCO2+H2O,△ n,1x+x1+10mL〔 10+80﹣ 70〕 =20mL(1+ 〕:1=20mL:10mL,解得: y=4,将 y=4 代入 12x+y=34 可得,所以混合气体的平均组成为 CH4,故答案为: CH4;② 混合气体的平均组成为 C H4,当含有甲烷时,那么另一种烃分子中含有H 数目为 4,设另一种烃含有的 C 数目为 x,那么:,解得: x=4,所以另一种烃为C4H4;当不含甲烷时,必须含有 2 个 C 的烃,假设为 C2H4,另一种烃分子中 H 数目必须为4,设另一种烃中含有 C 数目为 y,那么:,解得: y=3,即另一种气态烃为C3H4;假设为 C2H2,设另一种烃中含有 C 数目为 z,那么,解得 z=3,设另一种烃中含有H 数目为 a,那么:=4,解得 a=6,即另一种气态烃为C3H6,故答案为: CH4和 C4H4或 C2H4和 C3H4或 C2H2和 C3H6;〔2〕具有支链的化合物 X 的分子式为C4 H8O, X 既能使 Br2的四氯化碳溶液褪色,又能与Na 反响,说明含官能团羟基和碳碳双键,X 的结构简式为:,含羟基和碳碳双键的同分异构体为: CH2=CH﹣ CH2﹣CH2OH、 CH2=CH﹣CH〔 OH〕CH3、 CH3﹣CH=CH﹣CH2OH;故答案为:; CH2=CH﹣ CH2﹣ CH2OH、 CH2=CH﹣ CH〔 OH〕 CH3、 CH3﹣ CH=CH ﹣CH2OH.【分析】〔 1〕① 密度与摩尔质量成正比,混合烃对H2的相对密度为 17,据此可以计算出混合烃的平均摩尔质量,然后设出混合烃的平均分子式,根据差量法计算出平均H 原子数,再根据平均摩尔质量计算出含有的平均 C 原子数;② 根据平均分子式及两种气体按体积1:1 进行讨论,得出每种体积的烃的组成;〔2〕具有支链的化合物X 的分子式为C4 H8O, X 既能使 Br2的四氯化碳溶液褪色,又能与12/172021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕Na 反响,说明含官能团羟基和碳碳双键,据此写出 X 的结构简式和符合条件的同分异构体.19.【答案】 C2H6O【考点】有关有机物分子式确定的计算【解析】【解答】解:有机物完全燃烧生成CO2与水蒸气体积为1:,那么该有机物中 C、H原子数目之比为 1: 3,通过盛浓硫酸的洗气瓶后,剩余40ml为 CO2,那么有机物分子含有 2 个 C 原子、 6 个 H 原子,生成水的体积为:40mL×1.5=60mL,有机物、氧气、二氧化碳、水的物质的量之比=20:60: 40: 60=1:3: 2: 3,根据 O 原子守恒可知有机物中O 原子数目为:=1,所以该有机物分子式为:C2H6O,故答案为: C2H6O.【分析】有机物完全燃烧生成CO2与水蒸气体积为 1:,那么该有机物中 C、H 原子数目之比为 1: 3,通过盛浓硫酸的洗气瓶后,剩余40ml 为 CO2,那么有机物分子含有2个C原子、 6 个 H 原子,再根据氧原子守恒确定该有机物中O 原子数目.三、解答题20.【答案】解:① 该烯羟对氢气的相对密度为21,那么相对分子质量为 42,应为 C3H6,为丙烯,答:该烯烃为丙烯;② 丙烯与溴发生加成反响,溴的四氯化碳溶液增加的质量为12.6g ,那么: m〔 C3H6〕,n〔 C3H6〕 ==0.3mol ,而 n〔CH4〕+n〔 C2H4〕==0.5mol ,所以 n〔 CH4〕=0.5mol ﹣ 0.3mol=0.2mol ,故m〔 CH4〕=0.2mol ×,故甲烷与烯烃的物质的量之比为0.2mol :0.3mol=2 : 3,原混合气体中甲烷与乙烯的质量之比: 12.6g=16: 63,答:原混合气体中甲烷与烯烃的物质的量之比以及质量之比分别为2: 3、 16: 63【考点】有关有机物分子式确定的计算【解析】【分析】该烯羟对氢气的相对密度为21,那么相对分子质量为42,应为 C3 H6,为丙烯,丙烯与溴发生加成反响,溴的四氯化碳溶液增加的质量为丙烯的质量,计算混合气体、丙烯的物质的量,进而计算甲烷的物质的量,再计算甲烷的质量,以此解答该题.21【. 答案】解:在同温同压下, A 蒸气对乙醇蒸气的相对密度是2,那A 的相对分子质量为:么46× 2=92;13.8g A完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g 为燃烧生成二氧化碳、水的质量,假设将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g 为水的质量,故燃烧生成二氧化碳质量为:﹣,13.8g A 的物质的量为:=0.15mol ,燃烧生成水的物质的量为:=0.6mol ,13/172021 高考化学专题练习-有关有机分子式确定的计算〔含解析〕二氧化碳的物质的量为:=0.45mol ,根据原子守恒,有机物 A 分子中 C 原子数目为:=3、H 原子数目为:=8,故 O 原子数目为:=3,故有机物 A 的分子式为 C3H8O3;将〔0.15mol 〕与足量金属钠充分反响,所得氢气的体积为〔标准状况〕,生成氢气的物质的量为:=0.225mol ,说明 0.15molA 分子中含有 0.45mol 羟基,那么 A 的结构简式为: CH2〔 OH〕 CH〔 OH〕 CH2 OH,答:A 的相对分子质量为 92,分子式为 C3H8O3,结构简式为 CH2〔 OH〕CH〔OH〕CH2OH.【考点】有关有机物分子式确定的计算【解析】【分析】相同条件下气体的相对密度与相对分子量成正比,据此计算出 A 的相对分子量;13.8g A 完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g 为燃烧生成二氧化碳、水的质量,假设将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g 为水的质量,故燃烧生成二氧化碳质量﹣,根据 n=计算有机物 A、水、二氧化碳的物质的量,根据原子守恒计算有机物 A 分子中 C、H 原子数目,再根据相对分子质量计算O 原子数目,进而确定有机物 A 的分子式;根据与钠反响生成氢气的量确定 A 分子中含有的官能团类型,然后结合分子式确定其结构简式.22.【答案】解:根据叶绿素中各元素的质量分数可知,叶绿素中Mg 的质量分数最小,可设叶绿素分子中只有 1 个 Mg 原子,那么: M 〔叶绿素〕×2.691%=24,解得: M 〔叶绿素〕,假设叶绿素分子中有2个 Mg 原子,那么叶绿素的相对分子质量为1783.6 > 1 000,不合题意;可见叶绿素分子中只有 1 个 Mg 原子,该分子中其他原子个数分别为:N〔 C〕 ==55,N〔 H〕 ==72,N〔 O〕 ==5,N〔N〕 ==4,故该叶绿素的分子式是:C55H72O5N4Mg ,答:该叶绿素的分子式是C55H72O5N4Mg .14/17。

有机合成一、选择题(共14题)1.下列反应可以在烃分子中引入卤原子的是( )A .苯和溴水共热B .甲苯蒸气与溴蒸气在光照条件下混合C .溴乙烷与NaOH 水溶液共热D .溴乙烷与NaOH 的醇溶液共热2.可在有机物中引入羟基的反应类型是( )①取代 ②加成 ③消去 ④酯化 ⑤还原A .①②B .①②⑤C .①④⑤D .①②③ 3.1,4二氧六环可通过下列方法制取:烃A ―→B ――――――→NaOH 水溶液△C ――――――→浓硫酸,△-2H 2O1,4二氧六环,则该烃A 为( ) A .乙炔B .1丁烯C .1,3丁二烯D .乙烯4.下列说法不正确的是( )A .有机合成的思路就是通过有机反应构建目标化合物的分子构架,并引入或转化成所需的官能团B .有机合成过程可以简单表示为基础原料→中间体→目标化合物C .逆合成分析法可以简单表示为目标化合物→中间体→基础原料D .为减少污染,有机合成不能使用辅助原料,不能有副产物5.卤代烃能发生下列反应:2CH 3CH 2Br +2Na ―→CH 3CH 2CH 2CH 3+2NaBr ,下列有机物可以合成环丙烷的是( )A .CH 3CH 2CH 2BrB .CH 3CHBrCH 2BrC .CH 2BrCH 2CH 2BrD .CH 3CHBrCH 2CH 2Br 6.下列说法不正确的是( )A.可发生消去反应引入碳碳双键B.可发生催化氧化引入羧基C.CH3CH2Br可发生取代反应引入羟基D.与CH2===CH2可发生加成反应引入环7.用丙醛(CH3CH2CHO)制取聚丙烯的过程中发生的反应类型依次为()①取代②消去③加聚④水解⑤氧化⑥还原A.①④⑥B.⑤②③C.⑥②③D.②④⑤8.某有机物甲经氧化后得乙(分子式为C2H3O2Cl);而甲经水解可得丙,1 mol 丙和2 mol乙反应得一种含氯的酯(C6H8O4Cl2),由此推断甲的结构简式为()A.B.C.D.HOCH2CH2OH9.某石油化工产品X的转化关系如图所示,下列判断错误的是()A.X→Y是加成反应B.乙酸→W是酯化反应,也是取代反应C.Y能与钠反应产生氢气D.W能与NaOH溶液反应,但不能与稀硫酸反应10.结构为的有机物可以通过不同的反应得到下列四种物质: ② ③ ④,生成这四种有机物的反应类型依次为( )A .取代、消去、酯化、加成B .酯化、消去、缩聚、取代C .酯化、取代、缩聚、取代D .取代、消去、加聚、取代11.A 、B 、C 都是有机化合物,具有如下的转化关系:A 去氢加氢B ――――→催化氧化C ,A 的相对分子质量比B 大2,C 的相对分子质量比B 大16,C 能与A 反应生成酯(C 4H 8O 2),以下说法正确的是( )A .A 是乙炔,B 是乙醇B .A 是乙烯,B 是乙炔C .A 是乙醇,B 是乙醛D .A 是环己烷,B 是苯12.以乙醇为原料,用下列6种类型的反应:①氧化;②消去;③加成;④酯化;⑤水解;⑥加聚,来合成乙二酸乙二酯()的正确顺序是( )A .①⑤②③④B .①②③④⑤C .②③⑤①④D .②③⑤①⑥13.对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基:――――――→Fe ,HCl ,H 2,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )A .甲苯――→硝化X ――→氧化甲基Y ――→还原硝基对氨基苯甲酸B .甲苯――→氧化甲基X ――→硝化Y ――→还原硝基对氨基苯甲酸C .甲苯――→还原X ――→氧化甲基Y ――→硝化对氨基苯甲酸D .甲苯――→硝化X ――→还原硝基Y ――→氧化甲基对氨基苯甲酸14.某优质甜樱桃中含有一种羟基酸(用M 表示),M 的碳链结构无支链,分子式为C 4H 6O 5;1.34 g M 与足量NaHCO 3溶液反应,生成标准状况下的气体0.448 L 。

专题21 实验排序题专练1.氮的氧化物(NOx )是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx 还原生成N2。
某同学在实验室中对NH3与NOx反应进行了探究。
(1)实验室最常用...的制备氨气的化学方程式为______________________(2)欲用上述方法收集一瓶干燥的...氨气,装置连接顺序为:__________________(按气流方向,用小写字母表示,包括发生装置和尾气处理)。
2.SO2为大气污染物,研究它的性质对环境治理具有重要意义。
在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
(1)①装置中导管X的作用是:______________(2)利用制得的CH4和SO2并结合B~G装置验证反应产物:CH4+2SO22S+CO2+2H2O生成的单质S和CO2。
①B装置作用除了干燥气体和充分混合气体外还有______________________②实验装置依次连接的合理顺序为B、______________(每个装置只用一次)3.某学习小组查阅资料可知高温下,FeCl2与O2反应一定生成Fe2O3,可能生成FeC13或Cl2。
该小组同学利用如下装置对该反应进行探究。
回答下列问题:查阅资料:FeCl2固体呈绿色,熔点为674℃,沸点为1023℃;FeC13在100℃左右升华。
(l)装置A中盛放蒸馏水的仪器名称为____。
(2)按气流从左到右的顺序,上述装置合理的连接顺序为____(填仪器接口的小写字母)。
4.二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
并且Li-SOCl2电池可用于心脏起搏器。
该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。
电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
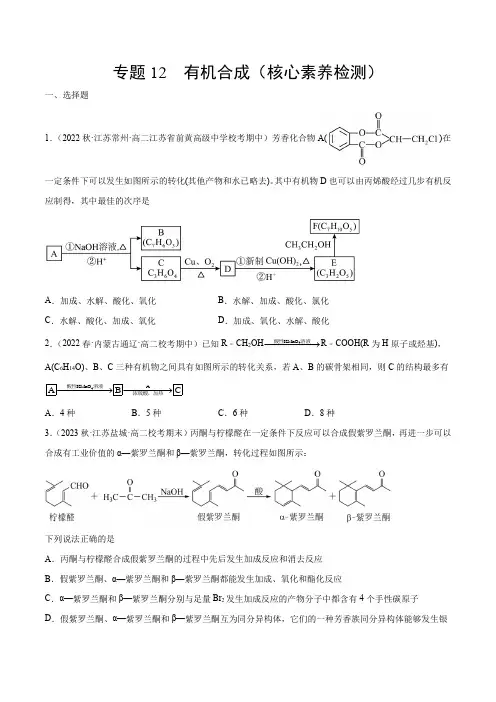
专题12 有机合成(核心素养检测)一、选择题1.(2022秋·江苏常州·高二江苏省前黄高级中学校考期中)芳香化合物A()在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
其中有机物D 也可以由丙烯酸经过几步有机反应制得,其中最佳的次序是A .加成、水解、酸化、氧化B .水解、加成、酸化、氯化C .水解、酸化、加成、氧化D .加成、氧化、水解、酸化2.(2022春·内蒙古通辽·高二校考期中)已知R ﹣CH 2OH 4KMnO −−−−−−→酸性溶液R ﹣COOH(R 为H 原子或烃基),A(C 6H 14O)、B 、C 三种有机物之间具有如图所示的转化关系,若A 、B 的碳骨架相同,则C 的结构最多有 4KMnO A A B C −−−−−−→−−−−−→酸性溶液浓硫酸,加热A .4种B .5种C .6种D .8种3.(2023秋·江苏盐城·高二校考期末)丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的α—紫罗兰酮和β—紫罗兰酮,转化过程如图所示:下列说法正确的是A .丙酮与柠檬醛合成假紫罗兰酮的过程中先后发生加成反应和消去反应B .假紫罗兰酮、α—紫罗兰酮和β—紫罗兰酮都能发生加成、氧化和酯化反应C .α—紫罗兰酮和β—紫罗兰酮分别与足量Br 2发生加成反应的产物分子中都含有4个手性碳原子D .假紫罗兰酮、α—紫罗兰酮和β—紫罗兰酮互为同分异构体,它们的一种芳香族同分异构体能够发生银镜反应4.(2023秋·江苏常州·高二常州市第一中学校考期末)聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。
我国化学家近年来合成的聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解过程如图所示:下列有关说法中不正确的是A.M与A均能使酸性高锰酸钾溶液和溴水退色B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应C.1 mol M与热的烧碱溶液反应,可消耗2 mol的NaOHD.A、B、C各1 mol分别与金属钠反应,放出的气体的物质的量之比为n∶2∶25.(2023秋·江苏镇江·高二校考期末)物质Z是一种用于合成内分泌调节剂的药物中间体,其合成路线如图:下列说法正确的是A.X在浓硫酸催化下加热可发生消去反应B.1molZ能和4molH2反应C.Y的不饱和度是6D.化合物Z中含有手性碳原子6.(2023秋·江苏南京·高二南京师大附中校考期末)甲氧苄啶是一种广谱抗菌药,其合成路线中的一步反应如下。

2019年高三期末化学大串讲:专题06氧化还原反应(专练)1.对于反应3Cl 2+6NaOH5NaCl+NaClO 3+3H 2O ,以下叙述正确的是( )A . Cl 2既做氧化剂又做还原剂B . 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1C . Cl 2是氧化剂,NaOH 是还原剂D . 氧化剂得电子数与还原剂失电子数之比为5∶1 【答案】A2.常温下,将等浓度的FeSO 4和(NH 4)2SO 4两种浓溶液混合可制得一种晶体,该晶体(称摩尔盐)是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH 4)2Fe(SO 4)2·6H 2O Fe 2O 3+2NH 3↑+N 2↑+4SO 2↑+17H 2O 。
下列说法正确的是( )A . 该反应中氧化产物是N 2、NH 3,还原产物是SO 2、Fe 2O 3B . 1mol 摩尔盐强热分解时转移电子的物质的量为8N AC . 向摩尔盐溶液中滴入足量浓NaOH 溶液,最终可得刺激性气体和红褐色沉淀D . 常温下,摩尔盐的溶解度比FeSO 4、(NH 4)2SO 4大 【答案】C【解析】反应中铁元素化合价升高,氮元素化合价升高,硫元素化合价降低。
A. 该反应中氧化产物是N 2、Fe 2O 3,还原产物是SO 2,故错误;B. 反应中转移8个电子,所以1mol 摩尔盐强热分解时转移电子的物质的量为4N A ,故错误;C. 向摩尔盐溶液中滴入足量浓NaOH 溶液,可得刺激性气体氨气和氢氧化亚铁白色沉淀,但氢氧化亚铁沉淀能被空气中的氧气氧化,最终氢氧化铁红褐色沉淀,故正确;D. 将等浓度的FeSO 4和(NH 4)2SO 4两种浓溶液混合可制得一种晶体,说明常温下,摩尔盐的溶解度比FeSO 4、(NH 4)2SO 4小,故错误。
3.某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是A.该反应中Cl-为氧化产物B.反应后溶液的碱性减弱C.消耗1 mol还原剂,转移6 mol电子D.该反应说明非金属性Cl>N【答案】B4.下列各项叙述正确的是①水玻璃、碱石灰、漂白粉、福尔马林、淀粉均为混合物②进行中和热的测定实验时,必须用到两个量筒和两个温度计③由不同种原子间形成的共价键一定是极性共价键④有单质参加的反应或有单质产生的反应一定是氧化还原反应⑤碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物⑥蒸馏在天然香料,药物提取及核燃料处理等技术中得到了广泛的应用⑦Ca(HCO3)2、Fe(OH)3可由化合反应制得,Fe3O4可以由置换反应制得A.①③⑤ B.①⑤⑦ C.②③⑤⑦ D.①②④⑥【答案】B【解析】①水玻璃为硅酸钠的水溶液,碱石灰的主要成分是氧化钙和氢氧化钠的。

(1)考纲要求(一)有机化合物的组成与结构1.能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
2.了解常见有机化合物的结构。
了解有机物分子中的官能团,能正确地表示它们的结构。
3.了解确定有机化合物结构的化学方法和某些物理方法。
4.了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体(不包括手性异构体)。
5.能根据有机化合物命名规则命名简单的有机化合物。
6.能列举事实说明有机分子中基团之间存在相互影响。
(二)烃及其衍生物的性质与应用1.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
2.了解天然气、石油液化气和汽油的主要成分及其应用。
3.举例说明烃类物质在有机合成和有机化工中的重要作用。
4.了解卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
5.了解加成反应、取代反应和消去反应。
6.结合实际了解某些有机化合物对环境和健康可能产生影响,关注有机化合物的安全使用问题。
(三)糖类、氨基酸和蛋白质1.了解糖类的组成和性质特点,能举例说明糖类在食品加工和生物质能源开发上的应用。
2.了解氨基酸的组成、结构特点和主要化学性质,氨基酸与人体健康的关系。
3.了解蛋白质的组成、结构和性质。
4.了解化(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
【答案】C6H12O6羟基取代反应9【解析】分析:葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,A在浓硫酸的作用下发生分子体异构),即、、、、、、、、。

2019届高三化学高考二轮臻品资源专题:有机化学基础(附解析)1.了解常见有机化合物的结构。
了解有机物分子中的官能团,能正确地表示它们的结构。
2.了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体(不包括手性异构体)。
3.能根据有机化合物命名规则命名简单的有机化合物。
4.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
5.了解烃类物质、卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
6.掌握常见的有机反应类型。
7.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
8.了解合成高分子的组成与结构特点,能依据简单合成高分子的结构分析其链节和单体。
Ⅰ.客观题(1)考查有机物同分异构体的数目判断。
(2)以陌生有机物为背景,考查碳原子的成键特征、有机反应类型、官能团的结构与性质之间的关系。
(3)考查有机物的检验、提纯和分离。
(4)考查有机物的命名。
Ⅱ.主观题该部分内容的命题设计常以新医药、新材料的合成为载体,以有机物合成与推断综合题呈现,考查内容主要有以下几个方面:(1)有机物官能团的结构、性质以及相互转化。
(2)同分异构体的书写或数目判断、有机反应类型的判断。
(3)有机物结构简式、有机方程式的书写等。
(4)依据题设要求,设计有机物的简单合成路线和流程。
一、有机物的组成、结构和性质1.常见官能团的特征反应(1)能发生加成反应的有机物通常含有、、—CHO或苯环,其中—CHO和苯环一般只能与H2发生加成反应。
(2)能发生银镜反应或能与新制Cu(OH)2悬浊液反应的有机物必含有—CHO。
(3)能与Na2CO3或NaHCO3溶液反应放出CO2或使石蕊溶液变红的有机物必含有—COOH。
(4)能发生消去反应的有机物为醇或卤代烃等。
(5)能发生水解反应的有机物为卤代烃、酯(油脂)、糖或蛋白质等。
(6)遇FeCl3溶液显紫色的有机物必含有酚羟基。
(7)能发生连续氧化的有机物是伯醇或烯烃。

姓名:班级3.5.1 有机合成的主要任务本课重点(1)碳骨架的构建和官能团的转化本课难点(2)官能团的保护一、选择题1.“神十一”宇航员使用的氧气瓶是以聚酯玻璃钢为原料,甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料,下列说法中错误的是A.甲物质可以在引发剂作用下生成有机高分子化合物B.1mol乙物质可与2mol钠完全反应生成1mol氢气C.丙物质能够使酸性高锰酸钾溶液褪色D.甲、乙、丙三种物质都属于烃的含氧衍生物【答案】D【详解】A.甲物质分子中含有碳碳双键,可在一定条件下发生加聚反应生成有机高分子化合物,A 项正确;B.乙物质分子中含有两个羟基,1mol乙物质可与2mol金属钠完全反应生1molH2,B项正确;C.丙物质分子中含有碳碳双键,可使酸性高锰酸钾溶液褪色,C项正确;D.甲、乙物质都属于烃的含氧衍生物,丙只含有C、H两种元素,属于烃类,D项错误;故选D。
2.(2021·黑龙江·哈九中高二开学考试)某有机物的结构简式如图,下列说法正确的是A.分子式为C12H18O5B.分子中含有2种含氧官能团C.能发生加成、取代、氧化、水解等反应D.分子中所有C原子一定共面【答案】B【详解】A.由题给结构简式可知该有机物的分子式为C12H20O5,A错误;B.分子中含有羧基、羟基这2种含氧官能团,B正确;C.该有机物有碳碳双键能发生加成、羧基与羟基能发生酯化反应属于取代、羟基可以氧化等反应,但不能发生水解反应,C错误;D.饱和碳原子是四面体构型:饱和碳原子及其相连接的原子最多三个共平面,则分子中所有C原子不可能共面,D错误;故选B。
3.(2021·江苏·马坝高中高二期中)有机物E具有抗肿瘤、镇痉等生物活性,它的一种合成路线的最后一步如图。
下列说法错误的是A.化合物G的一卤代物有7种B.G→E发生了还原反应C.E分子中不可能所有碳原子在同一平面内D.一定条件下,G、E均能与H2、NaOH溶液、酸性KMnO4溶液反应【答案】A【详解】A.化合物G分子中含有6种类型氢原子,其一卤代物有6种,A错误;B.G→E羰基转化为羟基,发生了还原反应,B正确;C.E分子中五元环上连接2个甲基的碳原子与其相连的4个碳原子不可能在同一平面内,C正确;D.G分子含有苯环和羰基、E分子含有苯环,均能与H2发生加成反应;G、E分子中均含有酯基,均能与NaOH溶液发生水解反应;G分子中苯环上连有甲基、E分子含有羟基,均能与酸性KMnO4溶液发生氧化反应,D正确;答案选A。

高三化学专题复习——有机合成推断题【重点、难点分析】有机推断是对有机化学知识综合能力的考查,通常可能通过4~6问的设问包含有机化学的所有主干知识,是有机化学学习中最重要的一个组成部分。
因而也成为高考命题者青睐的一类题型,成为历年高考必考容之一。
考查的有机基础知识集中在:有机物的组成、结构、性质和分类、官能团及其转化、同分异构体的识别、判断和书写、物质的制备、鉴别、分离等基础实验、有机物结构简式和化学方程式的书写、高分子和单体的互定、有机反应类型的判断、有机分子式和结构式的确定等。
综合性的有机试题一般就是这些热点知识的融合。
此类试题综合性强,有一定的难度,情景新,要求也较高。
此类试题即可考查考生有机化学的基础知识,还可以考查考生利用有机化学知识进行分析、推理、判断的综合的逻辑思维能力及自学能力,是一类能较好反映考生的科学素养的综合性较强的试题。
一、有机推断题的解题方法 1.解题思路:原题-------------→审题、综合分析 隐含条件明显条件-------------→找出解题突破口 性质、现象、特征结构、反应 --------→顺推可逆推结论2.解题关键:(1)据有机物的物理性质,有机物特定的反应条件寻找突破口。
(2)据有机物之间的相互衍变关系寻找突破口。
(3)据有机物结构上的变化,及某些特征现象上寻找突破口。
(4)据某些特定量的变化寻找突破口。
二、知识要点归纳1.十种常见的无机反应物(1)与Br 2反应须用液溴的有机物包括:烷烃、苯、苯的同系物-----取代反应。
(2)能使溴水褪色的有机物包括:①烯烃、炔烃-----加成反应。
②酚类-----取代反应-----羟基的邻、对位。
③醛(基)类-----氧化反应。
(3)能使酸性KMnO 4褪色的有机物包括:烯烃、炔烃、苯的同系物、醇类、苯酚、醛(基)类-----氧化反应。
(4)与浓硫酸反应的有机物包括:①苯的磺化-----反应物-----取代反应。

第四节有机合成课后篇巩固提升基础巩固1.在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。
①置换反应②化合反应③分解反应④取代反应⑤加成反应⑥消去反应⑦加聚反应⑧缩聚反应等反应类型中,能体现这一原子最经济原则的是( )A.只有①②⑤B.只有②⑤⑦C.只有⑦⑧D.只有⑦答案B2.已知:乙醇可被强氧化剂氧化为乙酸。
BrCH2CHCHCH2Br经三步反应可制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是( )A.水解、加成、氧化B.加成、水解、氧化C.水解、氧化、加成D.加成、氧化、水解解析BrCH2CHCHCH2Br先发生水解得到HOCH2CHCHCH2OH,然后和氯化氢加成,最后用强氧化剂将醇氧化为羧酸即可。
发生的反应类型依次为水解反应、加成反应、氧化反应,故A正确。
答案A3.已知RCHO+R'CHO。
在此条件下下列烯烃被氧化后,产物中可能有乙醛的是( )A.B.C.D.解析根据信息分析可知,反应物分子中存在“”结构的物质,被氧化后可生成CH3CHO。
答案C4.乙烯酮(CH2CO)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示为CH2CO+H—A。
乙烯酮在一定条件下与下列试剂加成。
其产物不正确的是( )A.与HCl加成生成B.与H2O加成生成C.与CH3OH加成生成D.与CH3COOH加成生成解析由题给信息可知,加成时活泼氢加到CH2原子团上,试剂中的剩余部分直接连在上,故C项错误,应生成。
答案C5.用溴乙烷为主要原料制备乙二醇,下列方案最合理的是( )A.CH3CH2BrCH3CH2OHCH2BrCH2Br乙二醇B.CH3CH2BrCH2BrCH2Br乙二醇C.CH3CH2BrCH2BrCH3CH2BrCH2Br乙二醇D.CH3CH2BrCH2BrCH2Br乙二醇解析B、C两项都应用了取代反应,难以得到纯净的有机取代产物;而A项设计过程的前两步可以合并成一步,即CH3CH2Br在NaOH醇溶液中发生消去反应制乙烯,即A项过程不是最合理的。
专题19 有机化学基础(1)考纲要求(一)有机化合物的组成与结构1.能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
2.了解常见有机化合物的结构。
了解有机物分子中的官能团,能正确地表示它们的结构。
3.了解确定有机化合物结构的化学方法和某些物理方法。
4.了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体(不包括手性异构体)。
5.能根据有机化合物命名规则命名简单的有机化合物。
6.能列举事实说明有机分子中基团之间存在相互影响。
(二)烃及其衍生物的性质与应用1.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
2.了解天然气、石油液化气和汽油的主要成分及其应用。
3.举例说明烃类物质在有机合成和有机化工中的重要作用。
4.了解卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
5.了解加成反应、取代反应和消去反应。
6.结合实际了解某些有机化合物对环境和健康可能产生影响,关注有机化合物的安全使用问题。
(三)糖类、氨基酸和蛋白质1.了解糖类的组成和性质特点,能举例说明糖类在食品加工和生物质能源开发上的应用。
2.了解氨基酸的组成、结构特点和主要化学性质,氨基酸与人体健康的关系。
3.了解蛋白质的组成、结构和性质。
4.了解化(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
【答案】 C6H12O6羟基取代反应9【解析】分析:葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,A在浓硫酸的作用下发生分子体异构),即、、、、、、、、。
专题28 有机合成1.(化学——选修5:有机化学基础)PBAT(聚己二酸/对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,可由聚合物PBA和PBT共聚制得,一种合成路线如下:已知:回答下列问题:(1)B的化学名称为____________,C所含官能团的名称为____________。
(2)H的结构简式为________________________。
(3)②、④的反应类型分别为________________________、________________________。
(4)⑤的化学方程式为________________________。
(5)写出所有的与D互为同分异构体且满足以下条件的结构简式________________________。
①能与NaHCO3溶液反应;②能发生银镜反应;③能发生水解反应;④核磁共振氢谱四组峰,峰面积比为1:6:2:1(6)设计由丙烯为起始原料制备的单体的合成路线_______________(其它试剂任选)。
【答案】环己醇羰基HOCH2CH2CH2CH2OH 氧化反应缩聚反应(5)与D互为同分异构体且满足①能与NaHCO3溶液反应,含-COOH;②能发生银镜反应,含-CHO;③能发生水解反应,含-COOC-,④核磁共振氢谱四组峰,峰面积比为1:6:2:1,则分子中含2个甲基,四种H,满足条件的结构简式为HOOCC(CH3)2CH2OOCH或HOOCCH2C(CH3)2OOCH;(4)C为,化合物W 的相对分子质量比化合物C 大14,W比C 多一个CH2,遇FeCl3 溶液显紫色含有酚羟基,属于芳香族化合物含有苯环,能发生银镜反应含有醛基,第一种情况是苯环上放三种基团,醛基、羟基和甲基,先固定醛基和羟基的位置,邻间对,后放甲基,共10种,第二种情况是苯环上放两种基团,-OH和-CH2CHO,邻间对,共3种,所以W 的可能结构有13种;符合①遇FeCl3 溶液显紫色、②属于芳香族化合物、③能发生银镜反应其中核磁共振氢谱显示有5 种不同化学环境的氢、峰面积比为2:2:2:1:1要求的W 的结构简式:,故答案为:13;。
1 2 专题21 有机合成 1.I.下列氯代烃中不能由烯烃与氯化氢加成直接得到的有__________ A.氯代环己烷 B.2,2-二甲基-1-氯丙烷 C.2-甲基-2-氯丙烷 D.2,2,3,3-四甲基-1-氯丁烷 II.盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:
回答下列问题: (1)已知A的分子式为C8H10O,其化学名称为_______________。 (2)B中的官能团的名称为____________________。 (3)由A生成C的化学反应方程式为_________________________,反应类型是_______。 (4)由D的结构可判断,D应存在立体异构。该立体异构体的结构简式为________________。 (5)若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与C反应,生成物的结构简式为_____________________。 (6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有_______种;其中核磁共振氢谱为4组峰,峰面积比为6︰2︰1︰1的结构简式为__________。 【答案】BD 2,6-二甲基苯酚 溴原子、羰基
取代反应 8 1
2 为。 故答案为:。 (6)能与三氯化铁溶液发生显色反应证明含有酚羟基。若苯环上取代基只有两个,则为乙基和酚羟基(可有邻间对三种不同结构);若苯环上有三个取代基,若两甲基位于邻位,则苯环上有两种等效氢,故加羟基有两种同分异构体;若两甲基位于对位,则苯环上有一种等效氢,故加羟基有一种同分异构体;若两甲基位于间位,除去A的结构,则苯环上有两种等效氢,故加羟基有两种同分异构体;故一共有8种同分异构1 2 体;
核磁共振氢谱为4组峰,峰面积比为6︰2︰1︰1的同分异构体为3,5-二甲基苯酚,结构简式为。 故答案为:8;。 2.香草酸广泛用于食品调味剂, 作香精、 香料, 合成线路如下:
(1)C 的结构简式是_____, B 转化为 C 的反应类型为_____。 (2)A 中含有的官能团名称是_____。 (3)B 的分子式是_____。 (4)在 B 中滴入 FeCl3溶液, 其现象是_____。 (5)与 F 官能团相同的芳香族化合物的同分异构体有_____种。 (6)写出 F 与乙醇进行酯化反应的方程式_____。
(7)写出由的合成线路图_____。 【答案】 取代反应 (酚)羟基、醛基 C7H5O2Br 溶液呈现紫色 9 1
2 1
2 基为邻、对位取代基,且苯酚容易被氧化所以不能直接发生硝化反应,由题干的合成路线可以得:
。 3.化合物I可用于某种高分子的接枝,其一种合成路线如下:
回答下列问题: (1)A的化学名称是_______________________。 (2)②的反应类型是______________________。 (3)C的结构简式为_________________;H的分子式为__________________。 (4)F中含氧官能团的名称是___________。 (5)芳香化合物W是E的同分异构体,W能发生水解反应和银镜反应,核磁共振氢谱有四组峰,面积比为1︰1︰2︰6,写出一种符合要求的W的结构简式:___________。
(6)尼泊金丙酯(HO--COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
【答案】间二甲苯(或1,3-二甲苯) 取代反应 C10H14O4 酯基和醚键 或或或 1
2 路线如下:。 1
2 4.有机化合物I是治疗制揽伤的药物,合成I的--种路线如下:
已知: ① ②E的核磁共振氢谱只有1组峰 ③C能发生银镜反应。 请回答下列问题: (1)有机物C的结构简式________,D的化学名称________。 (2)C中所含官能团的名称为__________. (3)HI的化学方程式为_______,其反应类型为_____。 (4)X与B含有相同的官能团,相对分子质量比B大14,X的结构有______种,其中核磁共振氢谱有4组峰,且峰面积之比为2:2:3:3的有________ (写结构简式)。
(5)写出用乙烯为原料制备化合物(丁二酸二乙酯)的合成路线_______ (其他无机试剂任选)。 【答案】 2-甲基-1-丙烯(2-甲基丙烯) 醛基、溴原子
酯化(取代) 反应 14 , 1 2 1
2 5.化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:
已知以下信息: A的核磁共振氢谱表明其只有一种化学环境的氢;R—CH=CH2R—CH2CH2OH 化合物F苯环上的一氯代物只有两种;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。 请回答下列问题: (1)C的化学名称为________________________。 1 2 (2)E的结构简式为______________________。 (3)A→B的反应类型为_________________、__________________;E+H→I的反应类型为_______________________。 (4)F生成G 的化学方程式为 ____________________________________。 (5)E+H→I的化学方程式为___________________。 (6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件: ①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,这样的同分异构体共有_______种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式___________。 【答案】2-甲基-1-丙醇 (CH3)2CHCOOH 消去反应 中和反应 酯化反应(或取代反应)
+2Cl2+2HCl (CH3)2CHCOOH + + H2O 18 1
2 分子质量小14,则少一个CH2,J的同分异构体中能同时满足如下条件: ①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则含有一个醛基和一个羧基,则除苯环外两个取代基可以是-CHO和-CH2CH2COOH、-CHO和-CH(CH3)COOH、-CH2CHO1 2 和-CH2COOH、-CH(CH3)CHO和-COOH、-CH2CH2CHO和-COOH、-CH3和-CH(CHO)COOH六种,而在苯环上两个取代基的位置有邻、间、对位,故共有18种同分异构体; J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,则酸化后高度对称两个羧基等效,J的这种同分异构
体的结构简式为。 6.以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。
已知: Ⅱ.反应①、反应②、反应⑤的原子利用率均为100%。 请回答下列问题: (1)B的名称为____________________。 (2)X中的含氧官能团名称为______________,反应③的条件为_______________,反应④的反应类型是__________________。
(3)关于药物Y()的说法正确的是________________。 A.药物Y的分子式为C8H8O4,遇氯化铁溶液可以发生显色反应 B.1 mol药物Y与氢气、浓溴水中的Br2反应,最多消耗氢气和Br2的物质的量分别为4 mol和2 mol C. 1 mol药物Y与足量的钠反应可以生成33.6 L氢气 D. 药物Y中⑥⑦⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦ (4)写出反应E→F的化学方程式_________________________。 1 2 (5)写出符合下列条件的E的所有同分异构体的结构简式__________________。 ①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应。 (6)设计一条以CH3CHO为起始原料合成Z的线路________(无机试剂及溶剂任选)。 【答案】苯乙烯 酯基 NaOH水溶液、加热 消去反应 AD 1
2 7.以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
回答下列问题: (1)葡萄糖的分子式为___________________。 (2)A中含有的官能团的名称为_________________。 (3)由B到C的反应类型为___________________。 (4)C的结构简式为___________________________。 (5)由D到E的反应方程式为__________________________________________。 1 2 【答案】C6H12O6 羟基 取代反应
8.有机物F是一种香料,其合成路线如图所示: (1)D的名称为__________,试剂X的结构简式为___________,步骤Ⅵ的反应类型为_________。 (2)步骤Ⅱ反应的化学方程式为__________________________________。 (3)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜