酰化反应原理与实例解析
- 格式:doc
- 大小:1.76 MB
- 文档页数:26

第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1、围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2、围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3、围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品。
学习目标1、掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化、酯化中的应用;2、掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;3、掌握生产中操作及注意事项;4、掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用,在生产中的应用及注意事项5、理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;6、掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7、了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标● 掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用; ● 掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
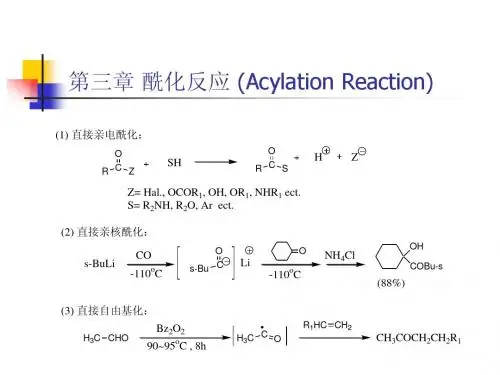
● 掌握生产中操作及注意事项● 了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章 酰化技术第一节 概述一、酰化反应 1. 概念酰化反应就是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基 就是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2. 反应通式RZOR SOHZ(式中RCOZ 为酰化剂,Z 代表X,OCOR,OH,OR ˊ,NHR ″等;SH 为被酰化物,S 代表R ˊO 、R ″、Ar 等。
)二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂(RCOZ)中R 基相同时,其酰化能力随Z —的离去能力增大而增加(即酰化剂的酰化能力随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯 >酸酐 > 羧酸酯 > 羧酸 > 酰胺三、酰化反应在化学制药中的应用永久性酰化 制备含有某些官能团的药物 保护性酰化第二节 N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂与酰氯酰化剂 一、羧酸酰化剂 1、反应过程R C NR'R''O R C L O NR'R''R C LO R'R''NHH HL_★2、适用对象 羧酸就是弱的酰化试剂,一般适用于酰化活性较强的胺类。

化学反应中的酰化反应与酰化机理解析酰化反应是化学领域中一种重要的有机合成方法,通过将酸酐或酸氯与醇或胺反应,生成酯或酰胺。
这种反应在药物合成、香料合成、高分子材料等许多领域都有广泛的应用。
本文将深入解析酰化反应的机理,并探讨其在实际应用中的重要性。
一、酰化反应机理酰化反应的机理包括两个主要步骤:酯化与脱水。
1.1 酯化酯化是酰化反应的第一步,通常是酸催化的。
在这一步中,酸酐或酸氯与醇或胺反应生成中间体酯或酰胺。
在酸催化条件下,酸酐或酸氯中的酰基(-C=O)发生亲电加成,与醇或胺中的氢原子发生亲核取代反应,生成酯或酰胺。
这一步反应通常是可逆的。
例如,酸酐与醇反应的化学方程式为:RCOOCOR' + ROH → RCOOR' + R'OH1.2 脱水脱水是酰化反应的第二步,它使酯或酰胺生成为最终的产物。
在这一步中,水分子从中间产物中脱离,产生酯或酰胺。
脱水过程可以通过加热或去水剂等方式实现。
例如,酸酐与醇酯化反应的化学方程式为:RCOOCOR' + H2O → RCOOH + R'OH二、酰化反应的重要性酰化反应在有机合成中具有重要的应用价值,主要体现在以下几个方面:2.1 药物合成许多药物分子中都含有酯或酰胺结构,酰化反应常被用于合成药物的关键步骤。
通过酰化反应能够构建出具有生物活性的化合物,从而得到对人体具有疗效的药物。
2.2 香料合成酯是许多香料的重要组成部分,包括水果、花卉和烹饪调味品中的香气成分。
利用酰化反应可以合成出各种不同的酯类化合物,为香料工业提供了广阔的发展空间。
2.3 高分子材料通过酯化反应可以合成不同结构的聚酯,如聚乙烯酯、聚丙烯酯等。
这类高分子材料具有良好的可塑性、耐热性和机械性能,广泛应用于塑料、纤维和涂料等领域。
2.4 生态友好相比于其他有机合成方法,酰化反应产生的副产物较少,反应废物也相对较少。
因此,酰化反应在绿色化学合成中具有较高的环境友好性。




烷基酸的酰化反应烷基酸作为一种有机化合物,在生物、化工和医药等领域中具有广泛的应用。
其中,烷基酸的酰化反应是一种重要的化学反应,常用于制备酰化产物以及合成酰化衍生物。
本文将从反应原理、反应机理和应用等方面探讨烷基酸的酰化反应。
1. 反应原理烷基酸的酰化反应,是指将一种烷基酸和一种醇在酸催化下反应,生成酯和水的反应。
通常情况下,该反应需要一定的温度和压力,反应速率也受到反应物浓度、酸催化剂种类等因素的影响。
反应方程式如下:RCOOH + R'OH → RCOOR' + H2O其中,RCOOH为烷基酸,R'OH为醇,RCOOR'为酯,H2O为水。
反应过程中,烷基酸中的羧基与醇中的羟基发生酰化反应,形成酯键。
2. 反应机理酸催化是烷基酸酰化反应中最为常用的反应条件。
在酸性条件下,烷基酸和醇中的羟基会被质子化,成为易发生反应的反应物。
酸催化反应机理主要有两种,即协同反应机理和分步反应机理。
协同反应机理:在酸性条件下,烷基酸和醇中的羟基先分别被质子化,形成RCOOH2+和R'OH2+。
随后,两者之间的电子云互相作用,形成共振结构RCOOH2+···HO-R'。
最终,共振结构中的OCO-R'键发生亲核加成,形成酯并释放出水分子。
分步反应机理:在酸性条件下,烷基酸和醇中的羟基先分别被质子化,形成RCOOH2+和R'OH2+。
随后,两者中的羟基发生消去反应,失去水分子,生成酸酐和ROH。
最后,酸酐和ROH之间发生亲核加成反应,生成酯并释放出质子。
3. 应用烷基酸的酰化反应在生产和合成中有着广泛的应用。
最常见的应用场景是制备酯类,具体包括以下几个方面:1) 食品工业。
烷基酸酯类物质是食品中的常见添加剂,可以用于增香、防腐和营养强化等方面。
2) 化工生产。
多种烷基酸酯类物质的合成需要通过酰化反应完成,包括各种脂肪族和芳香族的酯类。

化学反应中的酰化反应化学反应是我们日常生活中不可缺少的一部分,它不仅应用于我们周围的生活和工作中,也是科研领域中不可或缺的一个技术支撑。
而酰化反应则是其中的一个十分重要的反应类型。
本篇文章将介绍酰化反应的定义、机理、应用等方面的内容。
1. 酰化反应的定义酰化反应是一种有机合成反应,指的是酸酐(anhydrides)或酸卤(acyl halides)与醇(alcohol)或酚(phenol)等亲核试剂发生酰化反应。
其中,酸酐和酸卤均具有电子丰富的羰基(carbonyl)结构,容易被亲核试剂进行攻击,产生新的酯(ester)化合物。
2. 酰化反应的机理酰化反应的机理可分为两步:亲核试剂攻击和质子转移。
在第一步中,亲核试剂(如醇或酚)的亲核性中心(如羟基)攻击羰基碳原子,形成一个稳定的中间体:酸酐或酸卤与亲核试剂的加合物。
接着,在第二步中,质子转移将中间体中的酰基(acyl)基团从原来的酸酐或酸卤转移到了亲核试剂中,同时释放出质子(H+),生成酯化合物。
3. 酰化反应的应用酰化反应在有机合成领域中具有广泛的应用,尤其是在制备大分子化合物和药物研发中更是不可或缺。
例如,酰化反应被用于制备各种功能酯和酰胺(amides)等有机化合物,这些化合物在多种领域都有广泛的应用。
同时,酰化反应还可以被用作催化反应的催化剂。
除了有机合成领域外,酰化反应还在食品、香料、染料等领域中有应用。
例如,在香水制造过程中,酰化反应可以用于制备各种具有特殊香味的酯化合物。
4. 酰化反应的影响因素酰化反应的影响因素有很多,其中最为重要的因素是反应物的浓度和反应温度。
反应物浓度的影响是非常明显的。
当反应物浓度越高时,相同的酰化反应所需要的时间和反应温度就相对较低。
这是因为反应物浓度高,反应速度快,反应所需要的时间和温度就自然而然地降低了。
反应温度也是影响酰化反应的重要因素。
当反应温度较低时,由于分子运动较慢,分子之间的相对位置不稳定,酰化反应的过程会较为缓慢。

化学反应中的酰化反应化学反应是一种物质之间发生转化的过程,其中酰化反应是一种重要的有机合成反应。
它通过酰化剂和醇或酚反应,生成酯的化学过程。
酰化反应在有机合成中具有广泛的应用,被广泛用于制备酯类化合物。
酰化反应的机理基本上可以分为两步:酰化质子化和取代反应。
首先,酰化剂和醇或酚发生质子化反应,生成酰化质子。
然后,酰化质子与酯或醇的氢原子发生取代反应,生成酯类产物。
酰化反应具有以下特点:1. 反应条件温和:酰化反应通常在室温或较低温度下进行,因此可以避免大量的能量损失和副反应的发生。
2. 反应速度较快:酰化反应反应速度较快,通常只需较短的反应时间即可完成。
3. 可逆性较强:酰化反应具有一定的可逆性,可以通过调整反应条件实现反应的正向或逆向进行。
4. 应用广泛:酰化反应可以用于制备不同性质的酯类化合物,这些化合物在医药、农药、香料等领域都有重要的应用。
以苯甲酸和乙醇为例,来具体介绍酰化反应的实际应用。
苯甲酸和乙醇反应生成乙酸苯酯,反应方程式为:苯甲酸 + 乙醇→ 乙酸苯酯 + 水通常情况下,酰化反应需要催化剂的存在,常用的催化剂有酸性催化剂和酶。
在酸性催化剂存在下,酰化反应的速率更快,但是酸性催化剂的存在也可能引发副反应,如酸催化剂引发的醇酸缩聚反应。
酰化反应除了通过酸性催化剂进行外,还可以通过酶进行催化。
酶催化的酰化反应具有选择性高、效率高以及环境友好的优点。
然而,酶催化反应的应用范围受限于酶的稳定性和高成本等因素。
在实际应用中,酰化反应常常需要考虑反应条件、催化剂的选择、废气处理等问题。
对于工业化生产,酰化反应的反应条件优化可以降低生产成本,提高产物的选择性和产率。
总之,酰化反应是化学反应中的一种重要反应,具有温和条件、反应速度快和广泛的应用等特点。
通过对酰化反应的研究和优化,可以实现高效合成有机化合物,推动有机合成领域的发展。

乙酸的酰化反应化学是一个复杂的学科,涵盖了许多不同的领域和分支。
其中一项重要的反应是酰化反应,它是合成有机化合物的基础。
本篇文章将详细介绍一种常见的酰化反应——乙酸的酰化反应。
一、酰化反应的概念及类型酰化反应是指酸性介质中羧酸与醇发生反应,生成酯和水。
它是一种重要的有机合成反应,广泛应用于医药、化工等领域。
酰化反应的类型有很多,其中最常见的是酸催化酰化反应。
在这种反应中,羧酸和醇在存在酸催化剂的条件下发生反应,生成酯和水。
常用的催化剂有硫酸、氯化亚砜、磷酸等。
二、乙酸酰化反应的基本原理乙酸酰化反应是在酸性介质中,乙酸与醇反应生成乙酸酯的反应。
这种反应的基本原理是,乙酸(CH3COOH)分子中的羧基(COOH)与醇分子中的羟基(-OH)反应,失去一个水分子(H2O),生成一个酯基(-COO-)和一个质子(H+)。
这个反应的化学方程式如下:CH3COOH + ROH → CH3COOR + H2O其中,R是代表一个烃基的符号。
三、乙酸酯的物理性质乙酸酯是一类具有特殊气味的无色或淡黄色液体。
在常温下多为挥发性液体,常用作溶剂和香料。
它的沸点通常在150℃左右,密度为0.9g/mL左右。
乙酸酯在酸性条件下会水解成乙酸和醇,因此它不稳定。
四、乙酸酰化反应的应用乙酸酰化反应具有广泛的应用价值。
首先,它可以用于工业生产中。
例如,它是生产乙酸乙酯的主要方法之一。
此外,在医药和农业方面,乙酸酰化反应也有很多应用。
例如,它可以用于制造药物、香料、染料等。
五、酯化反应的发展趋势随着化学技术的发展,酯化反应也在不断创新。
为提高酯化反应的效果和效率,研究人员尝试采用新的催化剂和新的反应条件。
除此之外,对于酯化反应的副产物进行利用也是一个研究方向。
例如,利用酯化反应产生的甲酸和环氧乙烷,可以制备绿色化学品环氧乙醇。
总结起来,乙酸酰化反应是一种重要的化学反应,具有广泛的应用价值。
它的基本原理和应用领域有很多研究和发展的空间。
胺类酰化的原理及应用1. 胺类酰化的定义胺类酰化是指通过将胺基反应到酸性环境中,生成相应的酰胺类物质的化学反应。
这个过程通常需要使用酰化试剂,如酸酐或醚酐,来促进胺类化合物的酰化反应。
2. 胺类酰化的原理胺类酰化反应基于酰化试剂和胺基之间的反应,其中胺基通过与酰化试剂中的酰基或酸酐反应而形成酰胺结构。
这个反应过程遵循亲核加成取代反应的原理,主要包括以下几个步骤:2.1 打开酸酐环在酰化试剂中存在的酸酐环可以被胺基的亲核进攻所打开,生成一个酰基中间体。
这个中间体在后续的反应中发挥重要作用,可以被胺基进一步反应。
2.2 胺基进攻胺基通过亲核进攻反应与中间体中的酰基部分发生反应,这个过程中胺基上的氮原子将取代酰基中的一个酰氧原子,形成酰胺结构。
2.3 脱水反应在酰胺形成的过程中,通常伴随着一个水分子的脱离,以保持反应的平衡。
这个脱水反应的条件取决于具体的实验条件和酰化试剂的选择。
3. 胺类酰化的应用胺类酰化反应是一种常用的有机合成方法,在许多领域都有广泛的应用。
以下是一些典型的应用领域:3.1 药物合成胺类酰化反应在药物合成中扮演着非常重要的角色。
许多药物分子中都含有胺基结构,胺类酰化反应可以用来合成这些药物分子的关键结构单元。
3.2 材料科学胺类酰化反应在材料科学中也有重要的应用。
例如,酰化反应可以用来制备聚酰胺材料,这些材料具有良好的力学性能和化学稳定性,被广泛应用于纤维、薄膜和涂料等领域。
3.3 高分子合成胺类酰化反应也在高分子合成中起着关键作用。
许多重要的高分子材料,如聚酰胺、聚酰亚胺等,都可以通过胺类酰化反应来合成。
3.4 生物医学研究胺类酰化反应在生物医学研究中也有广泛的应用。
例如,可以利用胺类酰化反应合成荧光标记的胺基化合物,用于细胞成像和分子追踪等研究领域。
4. 总结胺类酰化反应是一种重要的有机反应,通过将胺基与酰化试剂反应,可以合成酰胺类化合物。
这个反应在药物合成、材料科学、高分子合成和生物医学研究等领域有广泛的应用。
精心整理第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标●掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;●掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
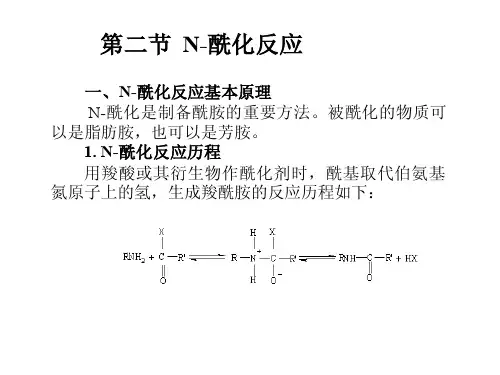
●掌握生产中操作及注意事项●了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章酰化技术第一节概述一、酰化反应1.概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2.反应通式代表RR基反应精馏脱水法主要用于乙酸与芳胺的N-酰化,例如,将乙酸和苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺。
溶剂共沸脱水法主要用于甲酸(沸点100.8℃)与芳胺的N-酰化反应。
(以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺)(2)催化剂强酸作催化剂适用于活性较强的胺类的酰化缩合剂作催化剂适用于活性弱的胺类、热敏性的酸或胺类常用的此类缩合剂有★DCC(Dicyclohexylcarbodiimide,二环己基碳二亚胺)DIC(DiisopropylCarbodiimide,二异丙基碳二亚胺)等。
DCC是一个良好的脱水剂,以DCC作脱水剂用羧酸直接酰化,条件温和,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
二、羧酸酯酰化剂反应过程1.反应物活性(1)对于羧酸酯(RCOORˊ)的合成)将7—ACA、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA 基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成。
苯环上酰化反应后处理标题:苯环上的酰化反应及其后处理引言:苯环上的酰化反应是有机化学中一种常见的反应,通过引入酰基(acyl group)可以改变苯环的化学性质和物理性质。
本文将介绍苯环上酰化反应的基本原理、反应条件以及后处理方法,希望能为读者提供一定的参考。
一、酰化反应的基本原理酰化反应是指将酸酐(酰化试剂)与苯环中的氢原子发生置换反应,形成酰苯(acylbenzene)。
在酰化反应中,酸酐起到供应酰基的作用,而苯环则接受酰基。
酰化反应通常需要适当的催化剂和反应条件,以促进反应的进行。
二、酰化反应的反应条件1. 催化剂:常用的催化剂包括酸性催化剂(如硫酸、三氯化铁等)和酸性固体催化剂(如硅铝酸等)。
催化剂的选择主要取决于反应的具体要求。
2. 反应温度:酰化反应通常在适当的温度下进行,一般在室温至中温范围内。
温度过高容易导致副反应的发生,而温度过低则反应速率较慢。
3. 反应时间:反应时间的长短取决于反应物的浓度、反应温度以及催化剂的活性等因素。
一般情况下,反应时间在数小时至数天之间。
4. 反应溶剂:选择适当的溶剂有助于反应物的溶解和反应的进行。
常用的溶剂包括苯、甲苯、二甲苯等。
三、酰化反应的后处理方法酰化反应完成后,需要对产物进行后处理,以获得纯度较高的酰苯。
常用的后处理方法包括以下几种:1. 结晶纯化:将反应混合物进行结晶,通过溶剂结晶或温度结晶的方式,将杂质分离出来,得到较纯的酰苯。
2. 蒸馏纯化:利用酰苯和杂质的不同沸点,通过蒸馏的方式进行纯化。
酰苯通常具有较低的沸点,可以通过加热使其汽化,然后冷凝回收,得到纯度较高的产物。
3. 活性炭吸附:将反应混合物通过活性炭柱进行吸附,可以去除一部分杂质,提高产物的纯度。
4. 结合多次反应:将产物再次进行酰化反应,利用酰化反应的选择性,可以将杂质进一步去除,得到更纯的酰苯。
结论:苯环上的酰化反应是一种重要的有机合成反应,通过引入酰基,可以改变苯环的性质和用途。
第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1、围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2、围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3、围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品。
学习目标1、掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化、酯化中的应用;2、掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;3、掌握生产中操作及注意事项;4、掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用,在生产中的应用及注意事项5、理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;6、掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7、了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标●掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;●掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
● 掌握生产中操作及注意事项● 了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章 酰化技术第一节 概述一、酰化反应 1. 概念酰化反应就是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基 就是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2. 反应通式RZOR SOHZ(式中RCOZ 为酰化剂,Z 代表X,OCOR,OH,OR ˊ,NHR ″等;SH 为被酰化物,S 代表R ˊO 、R ″、Ar 等。
)二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂(RCOZ)中R 基相同时,其酰化能力随Z —的离去能力增大而增加(即酰化剂的酰化能力随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯 >酸酐 > 羧酸酯 > 羧酸 > 酰胺三、酰化反应在化学制药中的应用永久性酰化 制备含有某些官能团的药物 保护性酰化第二节 N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂与酰氯酰化剂 一、羧酸酰化剂 1、反应过程R NR'R''O R C NR'R''R LO R'R''NHH _★2、适用对象 羧酸就是弱的酰化试剂,一般适用于酰化活性较强的胺类。
3、反应条件及催化剂 (1)反应条件酸过量 为了加速反应,并使反应向生成酰胺的方向移动,必须使反应物之一过量,通常就是酸过量。
脱水 可用以下方法脱水高温熔融脱水酰化法 适用于稳定铵盐的脱水,例如苯甲酸与苯胺加热到225℃进行脱水,可制得N-苯甲酰苯胺。
反应精馏脱水法 主要用于乙酸与芳胺的N-酰化,例如,将乙酸与苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺。
溶剂共沸脱水法 主要用于甲酸(沸点100、8℃)与芳胺的N-酰化反应。
(以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺) (2)催化剂强酸作催化剂 适用于活性较强的胺类的酰化缩合剂作催化剂 适用于活性弱的胺类、热敏性的酸或胺类 常用的此类缩合剂有★DCC (Dicyclohexylcarbodiimide,二环己基碳二亚胺) DIC (Diisopropyl Carbodiimide,二异丙基碳二亚胺)等。
DCC 就是一个良好的脱水剂,以DCC 作脱水剂用羧酸直接酰化,条件温与,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
CH 2OCONHCH 2COOHHOCH 2CHCOOC 2H 5NH 2DCC/HTFHOCH 2CHCOOC 2H 5NHCOCH 2NHCOOCH 2(83%)r.t.H (27)NHPh 3C NH Ph 3C CHCO (67%)DCCNS CH 3CH 3COOCH 2PhN S CH 3CH 3COOCH 2PhONSCONHCH 3CH 3COOHONSNH 2Me MeCOOHORCOOHr.t.R二、羧酸酯酰化剂 反应过程R'O RCONHR''R C OO NH 2R''碱R OR'O 2R''R C OR'OH R C OR'O R''NH 2H 1.反应物活性(1)对于羧酸酯(RCOOR ˊ)位阻 若酰基中R 空间位阻大,则活性小 电性 有吸电子取代基则活性高,易酰化。
离去基团的稳定性 离去基团越稳定,则活性越高 (2)对于胺类胺的碱性 碱性越强,活性越高, 空间位阻 空间位阻越小,活性越高(3)羧酸二酯与二胺类化合物,如果反应后能得到稳定的六元环,则反应易发生。
如哌拉西林等青霉素药物中间体乙基-2,3-哌嗪二酮(6)催眠药苯巴比妥(Phenobarbital,7)等的合成。
C 2H 5NHCH 2CH 2NH 2NHN OO 2H5(COOC 2H 5)250C 2H 5OH2(6 )C(COOC 2H 5)2C 2H 5PhO NH 2H 2N CC 2H 5Ph C NNC OOOH H ( 7 )2.催化剂(1)强碱作催化剂 由于酯的活性较弱因此在反应中常用碱作为催化剂脱掉质子,以增加胺的亲核性。
用的碱性催化剂有醇钠或更强的碱,如NaNH2、n-BuLi 、LiAlH4、Na 等 (2)反应物胺作催化剂 过量的反应物胺也可起催化作用。
(3)催化剂的选择与反应物的活性有关 反应物活性越高,则可选用较弱的碱催化;反之,则需用较强的碱催化。
(4)在此类酰化反应中还可加入BBr3来提高酰化的收率。
CH 3COCH 2COOC 2H 5PhCH 2NH 2CH 3COCH 2CONHCH 2PhN S OOOHCOOCH 3CH3NH 2N(8)N SOOOHCONH CH 3NCOOC 2H 5COOC 2H 5NH 2ClCONH CONHClCl3.活性酯制备活性酯时主要考虑增加酯分子中离去基团的稳定性,以促使其离去CH 3COO CH 3CH 2O CH 3CH 2( 9 )PhCH 2COO NHRNRO NHR NR( 10)RCOOO 2N NO 2O 2N NO 2O( 11 )★4、生产实例(头孢噻肟酸的合成)N SH 2NC C ON OCH 3SSN +SOH 2N COOHCH 2OCOCH 33N SH 2NCC ONOCH 3N SOCOOH CH 2OCOCH 3H将7—ACA 、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA 基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成。
操作注意事项 (1)水与丙酮的配比 (2)三乙胺用量及滴加速度 (3)活性酯质量(5)有机酸的种类及用量 (6)温度控制 流程框图; ●三、酸酐酰化剂1、反应过程(RCO)2O ★2、反应条件与催化剂酸酐 用量 一般略高于理论量的5~10%(不可逆),最常用的酸酐就是乙酸酐,通常在20~90℃可顺利进行反应(活性高)溶剂不另加溶剂 被酰化的胺与酰化产物熔点不太高时 非水惰性有机溶剂 被酰化的胺与酰化产物熔点较高时水 被酰化的胺与酰化产物易溶于水(乙酰化速度比乙酸酐的水解速度快) ★3、应用脂肪族酸酐主要用于较难酰化的胺类(酸酐酰化能力强)CH 3CH 2NHCH 2CH 2H 2SO 4CH 3CH 2NCH 2CH 2COCH 3Ac 2O环状的酸酐为酰化剂时,制得二酰亚胺类化合物(高温)C O O PhCH 2CHCOOH 2N CHCOOH 2PhC O (95%)4、混合酸酐★特点反应活性更强产品三乙胺 活性酯注: TLC 检测终点位阻大或离去基团离去能力强制备 混合酸酐由某些位阻大的羧酸与一些试剂作用制得★5、生产实例(1)头孢拉定的生产头孢拉定的合成就是以双氢苯甘氨酸(DHPC)为原料,成盐后经两次缩合制成混酐,再与7-ADCA 进行酰化反应,而后经水解、中与、结晶与精制等过程制得的。
反应过程(2)对硝基―α―乙酰氨基苯乙酮(氯霉素中间体)的制备 反应过程2O 2NONH 2·HCl + CH 3COONa +(CH 3CO)2O2O 2NONH COCH 3+ 2CH 3COOH + NaCl操作过程向乙酰化反应罐中加入母液加入乙酸酐,搅拌均匀后,先慢后快地加入38%~40%的乙酸钠溶液。
反应,测定反应终点 终点到达后,冷却 析出晶体,过滤、洗涤 甩干称重交缩合岗位 滤液回收乙酸钠 终点测定取少量反应液,过滤,往滤液中加入碳酸氢钠溶液中与至碱性,在40℃左右加热后放置15min,滤液澄清不显红色示终点到达,若滤液显红色或混浊,应适当补加乙酸酐与乙酸钠溶液,继续反应。
★反应条件及影响因素 PH 值PH 过低,在酸的影响下反应物会进一步环合,PH 过高,不仅游离的氨基酮会发生双分子缩合,而且乙酰化物也会发生双分子缩合。
加料次序与加乙酸钠的速度 四、酰氯酰化剂酰氯性质活泼,很容易与胺反应生成酰胺反应为不可逆) 反应过程RCOCl R'NH 2(ArNH 2)RCONHR' (RCONHAr)HCl1. 反应条件(1)加入碱性试剂以中与生成的氯化氢(防止氯化氢与胺反应成铵盐)中与生成的氯化氢可采用三种形式使用过量的胺反应加入有机碱(同时起到催化作用) 加入无机碱(2)反应采用的溶剂常常根据所用的酰化试剂而定对于高级的脂肪酰氯由于其亲水性差,而且容易分解,应在无水有机溶剂如氯仿、乙酸、苯、甲苯、乙醚、二氯乙烷以及吡啶等中进行。
吡啶既可做溶剂,又可中与氯化氢,还能促进反应,但由于其毒性大,在工业上应尽量避免使用。
对于乙酰氯等低级的脂肪酰氯由于其反应速度快,反应可以在水中进行。
为了减少酰氯水解的副反应,常在滴加酰氯的同时,不断滴加氢氧化钠溶液、碳酸钠溶液或固体碳酸钠,始终控制反应体系的pH值在7~8左右对于芳酰氯芳酰氯的活性比低级的脂肪酰氯稍差,反应温度需要高一些,但一般不易水解,可以在强碱性水介质中进行反应。
★2.应用活性低的氨基的酰化位阻大的胺以及热敏性物质的酰化3.生产实例在干燥的反应器中加入DMA、羟基-EPCP,溶解后冷却,向其中加入7-ATCA的DMA溶液,反应得头孢哌酮酸。
向上述反应液中加入碳酸氢钠,缓慢升温反应。