江苏省化学会考知识点
- 格式:pdf
- 大小:1.21 MB
- 文档页数:7

⾼中化学会考重要知识点详细总结化学重要知识点详细总结⾼中化学重要知识点详细总结⼀、俗名⽆机部分:纯碱、苏打、天然碱、⼝碱:Na2CO3⼩苏打:NaHCO3⼤苏打:Na2S2O3⽯膏(⽣⽯膏):CaSO4.2H2O 熟⽯膏:2CaSO4·.H2O 莹⽯:CaF2重晶⽯:BaSO4(⽆毒)碳铵:NH4HCO3 ⽯灰⽯、⼤理⽯:CaCO3⽣⽯灰:CaO ⾷盐:NaCl 熟⽯灰、消⽯灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、⽕碱、苛性钠:NaOH 绿矾:FaSO4·7H2O ⼲冰:CO2明矾:KAl (SO4)2·12H2O 漂⽩粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧⽔:H2O2皓矾:ZnSO4·7H2O 硅⽯、⽯英:SiO2刚⽟:Al2O3 ⽔玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀⽯:Cu2 (OH)2CO3菱铁矿:FeCO3⾚铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4⽯硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然⽓、沼⽓、坑⽓(主要成分):CH4⽔煤⽓:CO和H2硫酸亚铁铵(淡蓝绿⾊):Fe (NH4)2 (SO4)2溶于⽔后呈淡绿⾊光化学烟雾:NO2在光照下产⽣的⼀种有毒⽓体王⽔:浓HNO3与浓HCl按体积⽐1:3混合⽽成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2有机部分:氯仿:CHCl3电⽯:CaC2电⽯⽓:C2H2 (⼄炔) TNT:三硝基甲苯酒精、⼄醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层。

高中化学会考知识点总结高中化学是中学化学教育的重要一部分,也是学生在学习中考试的重要内容之一。
高中化学会考是对学生对于化学基础知识理解和应用的检验,也是对学生思维逻辑能力和实验操作能力的考查。
在高中化学会考中,掌握以下知识点将为学生取得较好的成绩提供基础。
1. 基础概念知识点在高中化学中,学生需要掌握一些基础的概念知识点,如原子结构、离子键和共价键的形成、化学式和化学方程式的表示、摩尔和物质的量关系、溶液浓度等。
掌握这些基础概念,是理解和应用化学知识的基础。
2. 元素周期表与化学物质元素周期表是高中化学的重要内容之一。
学生需要学会读懂元素周期表,掌握常见元素的基本性质和周期规律,了解元素的分类和性质。
另外,化学物质的分类和命名也是重要的知识点,学生需要掌握元素、化合物和混合物的基本概念,以及各种化合物的命名规则和命名方法。
3. 化学反应及平衡化学反应及平衡是高中化学中的重要内容之一。
学生需要掌握化学反应的基本概念,如氧化还原反应、酸碱中和反应、沉淀反应等。
此外,了解化学反应速率、化学平衡和化学反应的热力学变化也是重要的知识点。
4. 酸碱与盐酸碱与盐是高中化学中的重要内容。
学生需要掌握酸碱的基本概念,了解酸碱的性质、酸碱中和反应和酸碱溶液的浓度计算。
另外,学生还需要了解盐的性质和盐的制备方法。
5. 有机化学基础有机化学是高中化学的重要分支,学生需要掌握一些有机化合物的基本结构和性质,了解一些有机反应和有机合成的基本原理。
此外,学生还需要了解一些常见的有机物,如烃、醇、醛、酮等。
6. 化学计算化学计算是高中化学的重要内容之一,学生需要掌握一些化学计算的基本方法,如摩尔质量计算、溶液浓度计算、气体的体积计算等。
另外,学生还需要了解一些化学实验中的计算方法,如反应的理论产率计算、纯度计算等。
7. 化学实验操作化学实验操作是高中化学的重要组成部分。
学生需要了解一些常见的化学实验操作,如称量、加热、搅拌、过滤、结晶等。

最全面高中化学会考超详细知识点总结1、高等酸和酸:1)定义:高等酸是指具有比常规酸更强的水解能力的酸,它们能够完全分解水,产生二价阴离子和氢离子,因此也叫“强酸”。
常规的酸则只能部分水解,只能产生单价的阴离子。
2)性质:强酸具有较强的氧化性、腐蚀性和分子吸附性,氢离子的生成使溶液的pH较低。
此外,强酸还具有丰富的应用前景,可以用来制造有机无机复合材料、纤维素酸盐和有机酸类等材料。
3)常见的强酸:一水硫酸、磷酸、硫酸、硝酸、盐酸、氟酸、溴酸、三氯酸、四氯化碳、硫代硫酸等。
2、液体溶液:1)定义:溶液是指混合了溶质和溶剂的物质,这种物质混合物拥有均匀的物理性质,它分子结构松散,分子键相对短,所以透明的、无定形的物质,具有导电性和遇水变溶的性质,叫做液体溶液。
2)性质:液体溶液主要具有可以溶解任意大小的介质的性质,可以将溶质的分子分散开来,从而使得各种溶质在溶剂中能够被完全溶解,同时,液体溶液也具有很好的助溶作用,可以帮助溶质更容易溶解,增加混合液体中的溶质浓度。
3)常见液体溶液:乙醇-水溶液、醋酸钠-水溶液、硝酸铵-水溶液、氢氧化钠-水溶液等。
3、化学反应:1)定义:化学反应是物质经过一系列的复杂过程,其中产物物质的数量和种类有所不同于反应前原料物质的变化过程。
2)性质:化学反应主要表现为物质组成的变化。
它通过能量变化,使原本混合在一起的物质分离开来,重新组合成新的物质,因而实现物质转化;每一种物质都拥有特定的物理性质,所以它们同样也有不同的能量变化特性,因此,任何类型的物质以及它们的组合都可能造成各种不同的化学反应。
3)常见的化学反应:燃烧反应、溶液中的化学反应、合成反应、氧化还原反应、气体反应等。
4、原子:1)定义:原子是构成物质的最基本组成单位,它是物理和化学变化的基础,也是所有平衡物质复合体的基本单元。
2)性质:原子具有相对恒定的电荷和质量,决定着它们的吸引力、形状和大小,且在未受其他物质外力作用的前提下,原子不会发生外来变化。

2022年江苏学业水平测试化学考前重点知识提示必修11.常见的有机物有:甲烷、乙烯、苯、乙醇、乙酸、糖类、油脂、蛋白质等。
2.常见的混合物有煤,石油,漂白粉,硬铝、黄铜、钢等合金,氯水,氨水等溶液,胶体。
3.液氯、液氨、冰醋酸属于纯净物。
4.常见的电解质有:酸、硷、盐等,其在水溶液中能发生电离。
5.鉴别溶液和胶体的方法:丁达尔效应6.反应前后元素化合价发生变化的反应是氧化还原反应。
一般而言,反应物或生成物中有单质的肯定是氧化还原反应。
7.失、高、氧还原剂失去电子,化合价上升,被氧化,得到氧化产物得、低、还氧化剂得到电子,化合价降低,被还原,得到还原产物 8.摩尔是物质的量的单位9.摩尔质量的单位g/mol或g.mol-110.22.4l/mol的使用条件:①标準状况下(0℃ 101kpa);②气体。
注:水在标準状况下为液体。
11.n=12.c(浓溶液)·v(浓溶液) = c(稀溶液)·v(稀溶液)13.配製肯定物质的量浓度溶液必需的仪器:xx ml容量瓶、量筒、烧杯、玻璃棒、胶头滴管。
14.过滤用于分离固体和液体的混合物,主要仪器:漏斗。
15.蒸馏用于分离液体混合物,如:乙醇和水的混合物。
冷凝水“下进上出”。
16.萃取可用于提取碘水中的碘单质。
主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不行使用酒精。
17.分液用于分离互不相溶的液体,如:乙酸乙酯和饱和na2co3溶液,植物油和水。
主要仪器:分液漏斗。
使用时留意“下放上倒”。
18.蒸发的主要仪器:蒸发皿。
当蒸发皿现较多的固体时,停顿加热。
19.氢氟酸应存放在塑料瓶中,不能存放在玻璃瓶中。
20.氢氧化钠溶液在存放时不能使用磨口玻璃塞,应该用橡皮塞。
21.金属钠、钾存放在煤油中。
22.氯水、浓硝酸存放在棕色瓶中。
23.托盘天平精确到0.1g,量筒精确到0.1ml。
24.可直接加热的仪器:试管﹑蒸发皿、坩埚。
25.点燃可燃气体前要验纯。

高中会考的化学知识点高中会考必备的化学知识点离子共存1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。
H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
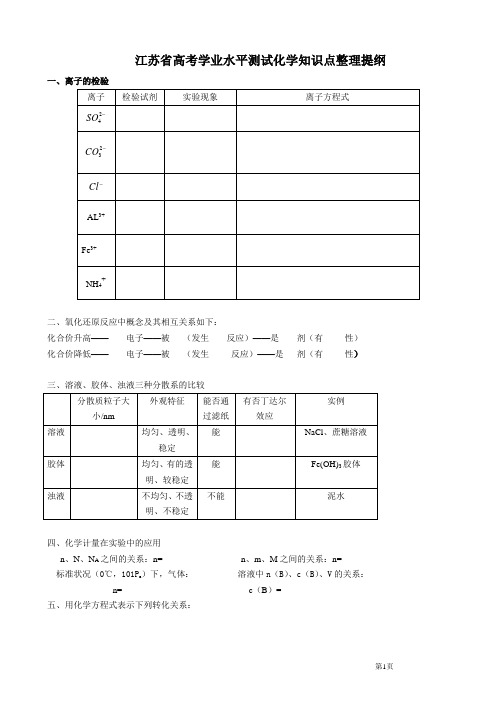
江苏省高考学业水平测试化学知识点整理提纲一、离子的检验二、氧化还原反应中概念及其相互关系如下:化合价升高——电子——被(发生反应)——是剂(有性)化合价降低——电子——被(发生反应)——是剂(有性)三、溶液、胶体、浊液三种分散系的比较四、化学计量在实验中的应用n、N、N A之间的关系:n= n、m、M之间的关系:n=标准状况(0℃,101P a)下,气体:溶液中n(B)、c(B)、V的关系:n= c(B)=五、用化学方程式表示下列转化关系:3④ ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨①⑧Al Al 3 Al(OH)3① ②③ ④⑤ ⑥⑦ ⑧⑨①③⑥Fe 3O 4 Fe FeCl 2 Fe(OH)3⑩① ②③ ④⑤ ⑥⑦ ⑧⑨ ⑩NaOH H +或Si F 4 SiO 2 Na 2SiO 3 H 2SiO 3CaO H 20+CO 2CaSiO 3① ②③④⑤⑥⑦⑧⑨⑩六、填空1.氯气与金属铁反应:2.氯气与金属铜反应:3.氯气与金属钠反应:4.氯气与氢气反应:5.氯气与水反应:6.次氯酸光照分解:7.氯气与氢氧化钠溶液反应:8.氯气与消石灰反应:9.漂白粉长期置露在空气中:10.二氧化硫与水反应:11.二氧化硫与氧气在催化剂的作用下反应:12、三氧化硫与水反应:13、氮气与氧气在放电下反应:14、一氧化氮与氧气反应:15、二氧化氮与水反应:16、氨水受热分解:17、氨气与氯化氢反应:18、氯化铵受热分解:19、碳酸氢氨受热分解:20、硝酸铵与氢氧化钠反应:21、氨气的实验室制取:22、硫酸铵与氢氧化钠反应:23、浓硫酸与铜反应:24、浓硫酸与木炭反应:25、浓硝酸与铜反应:26、稀硝酸与铜反应:27、Li与O2反应(点燃)28、卤素单质间的置换反应:(1)氯水与饱和溴化钠氯水与饱和碘化钠溶液反应P9 (2)溴水与碘化钠溶液反应:29、用电子式表示氯化钠的形成过程:P20用电子式表示氯分子的形成过程:P20用电子式表示氯化氢的形成过程:P20用电子式表示下列分子:H2N2H2OCO2CH4P2130、化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小,与反应条件无关。
化学必修一会考知识点总结
【实用版】
目录
1.化学必修一会考知识点总结的意义和目的
2.化学必修一会考的主要知识点
3.化学必修一会考知识点的具体内容
4.如何有效复习化学必修一会考知识点
5.化学必修一会考知识点总结的建议
正文
化学必修一会考知识点总结对于学生来说是非常重要的,因为它能够帮助学生系统地掌握化学知识,提高学习效率,并为之后的学习打下坚实的基础。
化学必修一会考的主要知识点包括化学基本概念、化学计量、化学反应、化学热力学、元素周期表和化学键等。
化学必修一会考知识点的具体内容包括:了解化学反应的类型、化学反应的平衡、化学键的类型和性质、化学热力学的基本概念和应用、元素周期表的结构和应用、化学计量的基本概念和计算方法等。
为了有效地复习化学必修一会考知识点,学生可以采取以下方法:首先,学生需要系统地阅读教材,理解每一个知识点的概念和原理;其次,学生需要通过做题来巩固和加深对知识点的理解;最后,学生需要对做题过程中出现的错误和不理解的地方进行针对性的复习。
第1页共1页。
高二化学会考知识点高二化学是中学化学学科的重要阶段,也是学生准备面对高考化学考试的关键年级。
在高二化学学习中,学生需要掌握一系列的知识点,以提高他们的学习成绩。
本文将介绍高二化学会考的知识点,帮助学生更好地备考。
一、化学反应1. 化学方程式:学生需要掌握如何编写和平衡化学方程式。
熟练掌握化学方程式的编写和平衡可以帮助学生更好地理解化学反应过程。
2. 反应的类型:学生需要了解不同类型的化学反应,包括合成反应、分解反应、置换反应、氧化还原反应等。
理解不同类型的反应有助于学生的化学思维能力的培养。
3. 反应速率:学生需要了解反应速率的含义以及影响反应速率的因素。
熟悉反应速率的概念和影响因素可以帮助学生更好地分析和理解各种反应。
二、化学平衡1. 平衡常数和平衡表达式:学生需要掌握平衡常数和平衡表达式的概念,并且能够计算平衡常数。
理解平衡常数的意义可以帮助学生更好地理解化学平衡过程。
2. 平衡的移动:学生需要了解平衡的移动条件及其原因。
掌握平衡的移动条件可以帮助学生在实验中控制化学反应的方向。
3. 平衡与酸碱反应:学生需要了解酸碱反应中平衡的影响。
熟悉酸碱反应中的平衡变化可以帮助学生更好地理解酸碱中和的原理。
三、化学电池1. 电解质溶液:学生需要了解电解质溶液的概念以及电解质溶液的电离过程。
掌握电解质溶液的理论可以帮助学生深入理解电解质溶液的性质。
2. 导电性与电解质:学生需要了解物质的导电性与其电解质性质之间的关系。
理解导电性与电解质性质的关系有助于学生更好地理解化学电池的工作原理。
3. 电池的组成与工作原理:学生需要了解电池的组成以及电池的工作原理。
熟悉电池的组成和工作原理可以帮助学生更好地理解电池反应的发生过程。
四、化学分析1. 离子方程式:学生需要了解如何编写和平衡离子方程式。
熟练掌握离子方程式的编写和平衡可以帮助学生更好地进行化学分析实验。
2. 沉淀反应:学生需要了解沉淀反应的原理和条件。
理解沉淀反应的原理和条件可以帮助学生更好地进行化学分析实验。
江苏省高二会考知识点 江苏省高二会考是指江苏省高中二年级学生需要参加的一项考试,旨在测试学生对各学科知识点的掌握情况。本文将以各学科知识点为主线,对江苏省高二会考的内容进行概述,帮助考生更好地备考。
一、语文 1.古代文学 涵盖诗、词、曲、文言文等内容,重点关注唐宋元明四大名著、文言文的阅读理解和鉴赏能力。
2.现代文学 包括小说、散文、戏剧等,重点关注现当代作家及其作品的阅读和文学常识。
3.修辞手法 针对修辞手法的辨析和运用进行考察。 4.写作 要求学生能够独立完成议论文、说明文等文体的写作,并注重表达能力和语言组织能力。 二、数学 1.函数与方程 包括一元二次函数、指数函数、对数函数、三角函数等,主要考察函数的性质和方程的求解。
2.几何与向量 主要内容有向量的表示、平面与空间几何、等腰三角形与等边三角形等,重点考察几何运算和性质的应用。
3.概率与统计 包括事件的概率计算、抽样与统计推断等,主要考察概率与统计的基本理论和应用能力。
4.数列与数学归纳法 主要内容包括等差数列、等比数列等,要求学生能够熟练运用数列的性质和数学归纳法解题。
三、英语 1.阅读理解 主要考察学生对各种类型阅读材料的理解和推理能力。 2.完形填空 考察学生对文章整体结构和细节的理解,以及语法和词汇的运用。
3.写作 包括议论文、应用文等,要求学生能够熟练运用所学语言知识和表达能力进行写作。
四、物理 1.力学 主要考察牛顿运动定律、万有引力定律等力学基础知识的理解和应用能力。
2.电学 主要考察电流、电阻、电势差等电学基础知识的理解和计算能力。
3.光学 主要考察光的反射、折射、干涉等基本现象的理解和解题能力。 五、化学 1.无机化学 主要考察元素周期表、化学键、化学反应等基础知识的掌握和应用能力。
2.有机化学 包括有机物的命名、结构与性质等内容,要求学生能够熟练运用有机化学的基本规律解题。
化学会考知识点总结1. 常见的有机物有:甲烷、乙烯、苯、乙醇、乙酸、糖类、油脂、蛋白质等。
2.常见的混合物有煤,石油,漂白粉,硬铝、黄铜、钢等合金,氯水,氨水等溶液,胶体。
3.液氯、液氨、冰醋酸属于纯净物。
4. 常见的电解质有:酸、碱、盐等,其在水溶液中能发生电离。
5. 鉴别溶液和胶体的方法:丁达尔效应6. 反应前后元素化合价发生变化的反应时氧化还原反应。
一般而言,反应物或生成物中有单质的一定是氧化还原反应。
7. 升失氧还原剂:化合价升高,失去电子,被氧化,是还原剂8. 摩尔是物质的量的单位9. 摩尔质量的单位g/mol或g.mol-110.22.4mol/L的使用条件:①标准状况下(0℃ 101Kpa);②气体。
注:水在标准状况下为液体。
11.n=m/M;n=V/22.4;n=cmol/L.V(aq)L12.c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)13.配制一定物质的量浓度溶液必需的仪器:XX mL容量瓶、烧杯、玻璃棒、胶头滴管。
14.过滤用于分离固体和液体的混合物,主要仪器:漏斗。
15.蒸馏用于分离液体混合物,如:乙醇和水的混合物。
冷凝管中冷凝水下进上出,温度计的水银球在蒸馏烧瓶的支管口。
16.萃取可用于提取碘水中的碘单质。
主要仪器:分液漏斗;萃取剂不能溶于水,常用四氯化碳,不可使用酒精。
17.分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水。
主要仪器:分液漏斗。
使用时注意上倒下放。
18.蒸发的主要仪器:蒸发皿。
当蒸发皿中出现较多的固体时,停止加热。
19.氢氟酸应存放在塑料瓶中,不能存放在玻璃瓶中。
20.氢氧化钠溶液在存放时不能使用玻璃塞。
21.金属钠、钾存放在煤油中22.氯水存放在棕色瓶中23.托盘天平精确到0.1g,量筒精确到0.1mL。
24.可直接加热的仪器:试管﹑蒸发皿、坩埚。
25.点燃可燃气体前要验纯。
26.酒精着火应迅速用湿抹布盖灭,钠、钾着火用细沙盖灭27.离子检验Cl-:稀HNO3和AgNO3 产生白色沉淀: Cl-+Ag+=AgClSO42-:稀HCl和BaCl2;加稀盐酸无明显现象,滴入BaCl2溶液有白色沉淀;SO42-+Ba2+=BaSO4Fe3+:KS溶液,溶液呈红色Fe2+:先加KS溶液,再加氯水,先无明显变化,后溶液呈红色,2Fe2++Cl2=2Fe3++2Cl-NH4+:NaOH溶液,加热,湿润红色石蕊试纸,试纸变蓝 NH4++OH-=NH3+H2ONa+:焰色反应,火焰呈黄色K+:焰色反应,透过蓝色钴玻璃,火焰呈紫色Al3+:NaOH溶液至过量,先白色沉淀后逐渐溶解Al3++3OH-=Al(OH)3,Al(OH)3+OH=AlO2+2H2O28.钠是质软、密度小、熔点低29.过氧化钠为淡黄色固体,可作供氧剂。