最新14含硅矿物与信息材料
- 格式:ppt
- 大小:1.18 MB
- 文档页数:25
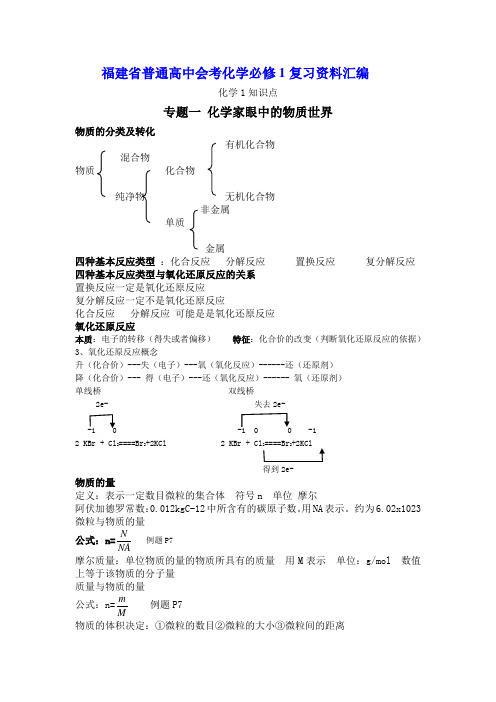
福建省普通高中会考化学必修1复习资料汇编化学1知识点专题一 化学家眼中的物质世界物质的分类及转化有机化合物 混合物物质 化合物纯净物 无机化合物 非金属 单质金属四种基本反应类型 :化合反应 分解反应 置换反应 复分解反应 四种基本反应类型与氧化还原反应的关系 置换反应一定是氧化还原反应 复分解反应一定不是氧化还原反应化合反应 分解反应 可能是是氧化还原反应 氧化还原反应本质:电子的转移(得失或者偏移) 特征:化合价的改变(判断氧化还原反应的依据) 3、氧化还原反应概念升(化合价)---失(电子)---氧(氧化反应)------还(还原剂) 降(化合价)--- 得(电子)---还(氧化反应)------ 氧(还原剂) 单线桥 双线桥2e- 失去2e--1 0 -1 0 0 -1 2 KBr + Cl 2====Br 2+2KCl 2 KBr + Cl 2====Br 2+2KCl得到2e-物质的量定义:表示一定数目微粒的集合体 符号n 单位 摩尔 阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。
用NA 表示。
约为6.02x1023 微粒与物质的量公式:n=NAN例题P7摩尔质量:单位物质的量的物质所具有的质量 用M 表示 单位:g/mol 数值上等于该物质的分子量 质量与物质的量公式:n=Mm例题P7物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离微粒的数目一定 固体液体主要决定②微粒的大小 气体主要决定③微粒间的距离体积与物质的量公式:n=VmV例题P10标准状况下 ,1mol 任何气体的体积都约为22.4l阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数 物质的量浓度:单位体积溶液中所含溶质B 的物质的量。
符号CB 单位:mol/l公式:CB= VnB物质的量浓度的配制 配制前要检查容量瓶是否漏水步骤:1. 计算 m=c ×v ×M 2.称量 3. 溶解 4。


高一化学碳硅及其化合物试题答案及解析1.硅及其化合物在材料领域中应用广泛。
下列说法正确的是()A.硅酸钠可用于制备木材防火剂B.硅单质广泛用于光纤通讯C.利用盐酸刻蚀石英制作艺术品D.水晶项链是硅酸盐制品【答案】A【解析】硅酸钠是一种重要的防火材料;硅单质主要应用于半导体材料,二氧化硅才是应用于光纤通讯的材料;盐酸与二氧化硅不能发生反应;水晶项链的主要成分是二氧化硅而不是硅酸盐。
【考点】含硅矿物与信息材料2.下列有关说法中正确的是()A.硅是非金属元素,与任何酸都不发生反应B.SiO2溶于水生成硅酸,其水溶液显酸性C.硅的性质很稳定,但在自然界中不存在游离态D.二氧化硅是酸性氧化物,可以与碱反应,但是不能与酸反应【答案】C【解析】硅在常温下可以与氢氟酸反应,A项错误;SiO2不溶于水,也不能与水反应,B项错误;自然界中没有游离态的硅,化合态的硅几乎全部是二氧化硅和硅酸盐,C项正确;SiO2是酸性氧化物,但是可以与氢氟酸反应,D项错误。
【考点】含硅矿物与信息材料3.有科学家提出硅是“21世纪的能源”“未来的石油”的观点。
假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥的是()A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料B.自然界中存在大量的单质硅C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制D.自然界的硅易开采,且可再生【答案】B【解析】自然界中没有单质形式的硅。
【考点】含硅矿物与信息材料4.下列说法正确的是()A.在粗硅的制取中发生2C+SiO22CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2D.由Na2CO3+SiO2CO2↑+Na2SiO3可知硅酸的酸性大于碳酸【答案】C【解析】依据元素周期律,硅的还原性大于碳,上述反应能发生是因为产物中有CO气体生成,使平衡向右移动,A错误;硅酸钠是一种黏合剂,B错误;D选项中的反应不是在水溶液中进行的,且产物中有气体生成,与酸性强弱无关,D错误。

1) 2KClO32KCl+3O 2↑2) 2H2O 22H 2O+O 2↑3) 2KMnO 4K 2MnO 4+MnO 2+O 2↑4) NH 4HCO 3NH 3↑+H 2O+CO 2↑5) NH 4Cl+NaOH =NaCl+NH 3·H 2O(不加热一般得到NH 3·H 2O ,加热得NH 3)6) (NH 4)2SO 4+2NaOH =MnO 2Na 2SO 4+2NH 3·H 2O7) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O8) NH 4Cl+NaOH NaCl+NH 3↑+H 2O (遇湿润的红色石蕊试纸变蓝色)9) (NH 4)2SO 4+2NaOHNa 2SO 4+2NH 3↑+2H 2O10) NH 4NO 3+NaOHNaNO 3+NH 3↑+H 2O铵离子 的检验11) NH 4Cl+AgNO 3=AgCl ↓+ NH 4NO 3 (氯离子检验先加AgNO 3后加稀HNO 3)12) (NH 4)SO 4+BaCl 2=BaSO 4↓+2NH 4Cl (硫酸根检验先加稀HCl 无现象再加BaCl 2)专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物 1) 2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑(阳极产生氯气,阴极产生氢气和OH -)2) MnO 2+4HCl (浓) MnCl 2+Cl 2↑+2H 2O (用饱和NaCl点燃通电除HCl ,浓硫酸除H 2O )3) 2Fe+3Cl 2 2FeCl 3 (棕褐色的烟,产物只能生成+3价的Fe)4)Cu+Cl 2 CuCl 2 (棕黄色的烟) 5)2Al+3Cl 2 2AlCl 3 6)2Na+Cl 2 =2NaCl (白烟) 7)H 2+Cl 2 2HCl (苍白色火焰) 8)Cl 2+H 2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色)(离子方程式HClO 不能拆开) 9)2HClO 2HCl+O 2↑ 10)Cl 2+2NaOH =点燃点燃 点燃 光照NaCl+NaClO+H2O(Cl2尾气吸收)11)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(工业生产漂粉精)主要成分CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2漂白原理12) Ca(ClO)2+2HCl=CaCl2+2HClO13) Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO如表示漂白粉失效,方程式有两个,后一个是HClO见光再分解14) Cl2+2NaBr=2NaCl+Br215) Cl2+2KI=2KCl+I2(可用淀粉碘化钾溶液检验Cl2)16) Br2+2KI=2KBr+I2(氧化性Cl2﹥Br2﹥I2 还原性I—﹥Br—﹥Cl—)17) NaBr+AgNO3=AgBr↓+ NaNO3(淡黄色沉淀)18) KI+AgNO3=AgI↓+ KNO3(黄色沉淀可检验I—)第二单元钠、镁及其化合物1) 2Na+2H2O=2NaOH+H2↑(熔成小球,浮在水面,四处游动,嘶嘶作响,酚酞变红)2) 4Na+O 2=2Na 2O (白色固体)(Na 2O 在空气中加热可转化为Na 2O 2)3) 2Na+O 2Na 2O 2 (淡黄色固体)4) 2Na+Cl 2=2NaCl(白烟)5) 2Na+S =Na 2S (研磨爆炸)6) 4Na+TiCl 4 Ti+4NaCl (熔融情况下Na 可冶炼贵重金属,在溶液中不能)点燃 700~800通电7) 2NaCl2Na+Cl2↑8) Na2O+H2O=2NaOH9) 2Na2O2+2H2O=4NaOH+O2↑(Na2O2既是氧化剂,又是还原剂)2Na2O2+4HCl=4NaCl+2H2 O+O2↑(Na2O是碱性氧化物,Na2O2不是碱性氧化物)相当于增加1mol H2的质量10) Na2O+CO2=Na2CO311) 2Na2O2+2CO2=2Na 2CO 3+O 2↑(Na 2O 2是供氧剂,又具强氧化性,有漂白性)相当于增加1mol CO 的质量12) Na 2CO3+2HCl =2NaCl+H 2O+CO 2↑13) CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑(CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或BaCO 3沉淀生成,原因弱酸一般..不制强酸) 14) NaHCO 3+ HCl =NaCl+H 2O+CO 2↑(比Na 2CO 3和盐酸反应剧烈)15) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ (NaHCO 3强酸制 弱酸固体转化为Na2CO3用Δ)16) NaHCO3+NaOH=Na2CO3+H2O (NaHCO3溶液转化为Na2CO3可加入NaOH)17) CO2+H2O+Na2CO3=2NaHCO3(CO2中混有HCl不用饱和碳酸钠,而用碳酸氢钠)18) CO2+2NaOH=Na2CO3+H2O(少量CO2)CO2+NaOH=NaHCO3(足量CO2)19) CH 3COOH+NaOH =CH 3COONa+H 2O20) 2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑21) CH 3COOH CH 3COO -+H +(弱电解质电离符号是可逆的,用表示)常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、CH 3COOH 、H 3PO 4(中强)、HCN (极弱)、H 2SiO 3(不溶) 常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22) CaCO 3CaO+ CO 2↑ 23) 2O =Ca(OH)224) Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2高温 镁的提取25) Mg(OH)2+2HCl =MgCl 2-+2H 2O26) MgCl 2Mg+Cl 2↑(MgO 熔点高,工业上用电解MgCl 2)27) 3Mg+N 2Mg 3N 2 28) 2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应)29)* Mg+2H 2O Mg(OH)2+H 2↑ 专题3 从矿物到基础材料第一单元 从铝土矿到铝合金1) Al 2O 3+2NaOH =2NaAlO 2+H 2O2) NaAlO 2+2H 2O+CO 2(过量)=从铝 土矿 中提 取铝 点燃通电点燃Al(OH)3↓+NaHCO 33) 2Al(OH)3 Al 2O 3 +3H 2O 4) 2Al 2O 34Al+3O 2↑ (只能用电解Al 2O 3,而AlCl 3不行)5) 2Al+6HCl= 2AlCl 3+3H 2↑6) 2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2↑Al 与冷的浓硫酸、冷的浓硝酸钝 7) 2Al+Fe 2O 3 Al 2O 3+2Fe 利用铝热反应还可以把其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、V 2O 5等)中还原出来8) Al(OH)3+3HCl =AlCl 3+3H 2O 通电Al 是两性元素高温 Al(OH)3是两性元素9) Al(OH)3+NaOH =NaAlO 2+2H 2O10) AlCl 3+3NaOH =Al(OH)3↓+3NaCl11) Al(OH)3+NaOH =NaAlO 2+2H 2O12)* AlCl 3+4NaOH (过量)=NaAlO 2+3NaCl+2H 2O13) 制备氢氧化铝:(1)从铝盐制备最好用氨水: Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+AlCl 3中 逐滴加入NaOH 溶 液至过量(2)从偏铝酸盐最好通CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(足量CO2)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(少量CO2)*(3)从铝盐和偏铝酸盐制备:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2- +Al3+ +6H2O=4Al(OH)3↓15) 明矾净水原理:明矾溶于水后完全电离:KAl(SO4)2===K++Al3++2SO42-铝离子与水反应生成:Al(OH)3胶体:Al3++3H2O===Al(OH)3(胶体)+3H+16)侯氏制碱:NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(可用于工业制备小苏打,苏打)一、物质的分离和提纯二、溶液的配置步骤(1)计算:(2)称量(量取):(3) 溶解(稀释):并冷却到室温;(4) 转移:(5)洗涤:(6)定容:(7)摇匀:(8)装瓶。


第三单元含硅矿物与信息材料第1课时硅酸盐矿物与硅酸盐产品1.下列材料的特性及用途说法错误的是()A.氧化铝陶瓷具有两性,不可用来制造人造牙齿B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机C.光导纤维导光的能力很强,是非常好的通信材料D.压电陶瓷十分敏感,可以将极其微弱的机械振动转换成电信号,可用来制压电地震仪解析:Al2O3具有两性,可与酸、碱反应,牙齿经常接触酸性物质,但氧化铝陶瓷性质相当稳定,酸碱很难将其腐蚀,且氧化铝制成的假牙与天然牙齿十分接近,选项A说法错误。
答案:A2.下列表述正确的是()①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐③三峡大坝的建造使用了大量水泥,水泥是硅酸盐材料④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能A.①②③B.②④C.③④⑤D.③⑤解析:本题主要考查硅及其化合物的具体应用。
刚玉的主要成分为Al2O3;玛瑙的主要成分是SiO2;玻璃的主要成分为SiO2和硅酸盐;水泥的主要成分为3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3等,为硅酸盐材料;Cu2O虽然是红色的,但它不能变色,也不能吸收有害光线;硅材料不会产生对环境有害的物质。
答案:D3.城市建设在改善城市面貌的同时,也给城市环境带来了一场严重的环境灾难——石棉污染,吸入石棉纤维者易患肺癌。
已知石棉是硅酸盐矿物,某种石棉的化学式表示为Ca2Mg x Si y O22(OH)2,式中x,y的值分别是()A.5,8B.8,3C.3,8D.8,5解析:硅酸盐是一种比较复杂的化合物,在化合物中,各元素的化合价的代数和为0。
)2,2×2+2x+4y+(-2)×22+(-1)×2=0,可得:2x+4y=42,从式中可知,x=5,y=8。
高中化学学习材料 金戈铁骑整理制作 专题三 常见非金属及其化合物 第一单元 氯、溴、碘及其化合物 一、选择题 1.下列叙述,正确的是 ( )。 ①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水 ④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水 A.①②③ B.②③④ C.③ D.③⑤ 解析 氯气与氢气混合,达到爆炸极限,在点燃或光照的条件下才能发生爆炸,①错,氢氧化钙溶液中溶质浓度小,实验中用氢氧化钠溶液吸收多余的氯气,②错,排除A、B项;HCl气体与AgNO3溶液也可产生沉淀,④错;将气体通入饱和食盐水,除去的是HCl气体,而不是Cl2,⑤错,排除D项。 答案 C 2.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( ) ①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液 A.③⑥ B.①②③④ C.②④⑤ D.①②③④⑥ 解析 能使干燥的蓝色石蕊试纸先变红后褪色的物质,应具有酸性和漂白性等性质。 在题中所给的物质①、②中只存在Cl2分子,其既无酸性,又无漂白性。④中存在的是Cl2分子和乙醇分子,也没有酸性和漂白性。⑤中只存在H+和Cl-及水分子,其只能使试纸变红,却不能使之褪色。只有③新制氯水和⑥盐酸酸化的漂白粉溶液,因溶液中存在H+和HClO,符合要求。 答案 A 3.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是( ) A.加入有色布条,一会儿有色布条褪色。说明溶液中有Cl2存在 B.溶液呈黄绿色,且有刺激性气味,说明有Cl2存在 C.加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在 D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 解析 氯水中存在三种分子:Cl2、HClO、H2O,四种离子:Cl-、ClO-、H+、OH-,其中HClO具有漂白性,能使有色布条褪色;氯水中含有氯气分
第2课时 二氧化硅与信息材料1.下列关于硅的叙述中,错误的是( )①硅广泛存在于自然界中,自然 单质硅叫水晶 ②单质硅的导电性介于导体和绝缘体之间 ③晶体硅具有金属光泽,故它属于金属材料,能导电 ④含硅的钢具有良好的导磁性和耐酸性A .①②B .②③C .①③D .②④2.在自然界中,硅存在于地壳中的各种矿物和岩石中的主要形式是( ) A .晶体硅 B .硅酸 C .二氧化硅和硅酸盐 D .SiC 3.关于硅的化学性质的叙述中,不正确的是( ) A .在常温下,不与任何酸反应 B .在常温下,可与强碱溶液反应 C .在加热条件下,能与氧气反应 D .单质硅的还原性比碳的还原性强 4.下列说法不正确的是( )A .由于SiO 2不溶于水,故H 2SiO 3不是SiO 2对应的酸或者说SiO 2不是H 2SiO 3对应的酸酐B .CO 2通入Na 2SiO 3溶液中可以得到硅酸沉淀C .SiO 2是一种空间立体网状结构的晶体,熔点高、硬度大D .氢氟酸能够雕刻玻璃5.30 g SiO 2和足量的焦炭在高温下反应:SiO 2+2C=====高温Si +2CO ↑,下列叙述正确的是( ) A .反应中有12 g C 被还原B .反应生成了22.4 L CO(标准状况)C .反应中有3.01×1023个电子发生转移D .反应中有0.5 mol SiO 2被氧化 6.下列离子方程式不正确的是( )A .石英与烧碱反应:SiO 2+2OH -===SiO 2-3+H 2OB .硅与烧碱反应:Si +2OH -+H 2O===SiO 2-3+2H 2↑ C .向小苏打溶液中加入过量的石灰水:2HCO -3+Ca 2++2OH -===CaCO 3↓+2H 2O +CO 2-3D .往水玻璃中加入盐酸:SiO 2-3+2H +===H 2SiO 3↓ 7.下列说法正确的是( )A .二氧化硅是酸性氧化物,它可以与碱反应,但不能与任何酸反应B .依据反应SiO 2+CaCO 3=====高温CaSiO 3+CO 2↑可以推知,硅酸的酸性比碳酸的酸性强 C .二氧化碳通入硅酸钠溶液中可以制得硅酸 D .晶体硅常被用来制造光导纤维8.下列关于SiO 2和Si 的叙述中错误的是( ) A .SiO 2是一种酸性氧化物,Si 是一种非金属单质B .常温下,SiO 2与Si 均不与盐酸、硫酸、硝酸、碳酸反应C .常温下,SiO 2与Si 均能与HF 、NaOH 溶液发生反应D .SiO 2溶于水显酸性9.素有“水晶之乡”美称的江苏东海县盛产水晶,现存于国家地质博物馆的水晶大王就出自东海县。