有机化学烯烃
- 格式:ppt
- 大小:4.45 MB
- 文档页数:108


大学有机化学反应方程式总结烯烃的加成反应烯烃是一类具有双键结构的有机化合物,它们在化学反应中具有独特的活性和多样的反应方式。
其中,加成反应是一种重要的反应类型,通过该反应烯烃可以与其他物质发生加成,生成新的化合物。
本文将对大学有机化学反应方程式总结烯烃的加成反应进行详细介绍。
一、烯烃的加氢反应烯烃可以通过加氢反应与氢气发生反应,生成相应的烷烃。
这是一种典型的加成反应,其反应方程式如下所示:例如,将1-丁烯与氢气加热反应,可得到丁烷。
二、烯烃的卤素加成反应烯烃可以与溴或氯等卤素发生加成反应,生成相应的1,2-二卤代烷烃。
这是一种常见的烯烃加成反应,其反应方程式如下所示:例如,将1-丁烯与溴反应,可得到1,2-二溴丁烷。
三、烯烃的醇加成反应烯烃可以与醇发生加成反应,生成相应的醚化合物。
这是一种重要的烯烃加成反应,其反应方程式如下所示:例如,将1-丁烯与乙醇反应,可得到乙基丁醚。
四、烯烃的羰基化加成反应烯烃可以与酰基化试剂(如酸酐、酰卤等)发生加成反应,生成相应的羰基化合物。
这是一种重要的烯烃加成反应,其反应方程式如下所示:例如,将1-丁烯与乙酸酐反应,可得到丁酸乙酯。
五、烯烃的羟基化加成反应烯烃可以与过氧化氢或氧化镁等试剂发生加成反应,生成相应的醇化合物。
这是一种重要的烯烃加成反应,其反应方程式如下所示:例如,将1-丁烯与过氧化氢反应,可得到2-丁醇。
六、烯烃的电子吸引基团加成反应烯烃可以与电子吸引基团发生加成反应,生成相应的加成产物。
这是一种常见的烯烃加成反应,其反应方程式如下所示:例如,将1-丁烯与苯酚反应,可得到2-(4-甲基苯基)丁醇。
总结:通过以上的介绍,我们了解到烯烃的加成反应是一种重要的有机化学反应类型。
通过与不同的试剂发生加成反应,烯烃可以生成多种不同的产物,从而扩展了它们的化学性质和应用范围。
熟练掌握烯烃的加成反应方程式对于有机化学学习和实验研究具有重要的意义。
因此,在大学有机化学课程中,学生们应该充分理解和掌握这些反应的特点和机理,并通过实践加深对反应的理解,提高自己在有机合成领域的能力。

有机化学基础知识点烯烃的命名规则烯烃是有机化学中一类重要的碳氢化合物,其分子结构中含有一个或多个双键。
在有机化学中,烯烃的命名规则非常重要,它不仅能够准确描述烯烃的结构和属性,还有助于有机合成和反应机理的研究。
本文将介绍烯烃的命名规则及其应用。
一、烯烃的基本命名规则烯烃的命名主要涉及到以下几个方面:分子中双键位置的确定、烯烃链中双键个数的描述以及支链命名等。
1. 双键位置的确定确定双键的位置是烯烃命名的首要任务。
通常情况下,双键的位置可以通过两种方式确定:数字和字母表示法。
(1)数字表示法:双键所在碳原子的位置用数字表示。
例如,丙烯的结构式为CH2=CH-CH3,可以简化为1-丙烯。
(2)字母表示法:双键所在碳原子前的碳原子标记为α,双键所在碳原子后的碳原子标记为β。
例如,丙烯可以表示为α,β-丙烯。
2. 烯烃链中双键个数的描述当烯烃分子中有两个以上的双键时,需要准确描述双键的个数。
通常使用前缀di-、tri-、tetra-等来表示双键的个数。
例如,1,3-戊二烯中的二表示有两个双键。
3. 支链命名当烯烃链上有支链或官能团时,需要对其进行命名。
支链可以通过前缀和后缀进行命名。
常见的前缀有甲基、乙基、异丙基等,表示在烯烃链上连接一个碳原子。
后缀通常使用-yl来表示。
例如,2-甲基丁-1-烯表示在丁烯上连接一个甲基基团。
二、烯烃的命名示例下面将通过几个烯烃的命名示例来进一步说明烯烃命名规则的应用。
1. 丙烯丙烯的分子式为C3H6,结构式为CH2=CH-CH3。
根据双键位置的确定,可以以数字表示法命名为1-丙烯或以字母表示法命名为α,β-丙烯。
2. 异丁烯异丁烯的分子式为C4H8,结构式为CH2=C(CH3)-CH2-CH3。
根据双键位置的确定,可以以数字表示法命名为2-异丁烯或以字母表示法命名为α,β-异丁烯。
3. 戊二烯戊二烯的分子式为C5H8,结构式为CH2=CH-CH=CH2。
根据双键位置的确定,可以以数字表示法命名为1,4-戊二烯或以字母表示法命名为α,β-戊二烯。

烯烃的命名烯烃是一类重要的有机化合物,广泛存在于自然界和人工合成中。
它们由于其独特的化学性质和广泛的应用而备受关注。
在有机化学中,烯烃的命名是非常重要的一步,它使化学家们能够准确、清晰地描述和讨论这些化合物。
本文将介绍烯烃的命名方法,并探讨一些常见的烯烃化合物。
首先,让我们先了解一下什么是烯烃。
烯烃是一类由碳和氢组成的有机分子,其分子结构中包含碳碳双键。
这种双键分布在烃分子的不同位置,从而产生不同类型的烯烃。
根据烯烃中双键的位置,我们可以将其分为直链烯烃、支链烯烃和环烯烃三类。
在命名烯烃时,我们遵循的是IUPAC(国际纯粹与应用化学联合会)的命名规则。
根据规则,我们应该从碳链的一个端点开始,并尽量选择离氧、羰基等官能团最近的碳原子作为编号的起点。
在进行编号时,我们需要选取离双键最近的碳原子作为第一号碳原子。
对于直链烯烃,命名是相对简单的。
我们以最长连续的碳原子链作为主链,并用“-ene”后缀表示它是一种烯烃。
然后,我们选择最低的编号方式,使双键所在的碳原子编号最小。
例如,丙烯是一个三碳直链烯烃,其中两个碳原子之间有一个双键,我们可以通过编号为1-丙烯来表示它。
当烯烃中存在支链时,我们首先要找到主链,主链是由双键所在的碳原子和与其相连的其他碳原子构成的最长连续碳原子链。
然后,我们以主链上离支链最近的碳原子作为编号的起点,并选择最低的编号方式。
接下来,我们需要给支链命名,并在主链的名称前面添加它们的名称和位置。
最后,我们使用“-ene”后缀表示它是一种烯烃。
例如,2-甲基-1-丁烯是一个四碳直链烯烃,其中双键位于第一碳和第二碳之间,而甲基支链位于第二碳上。
如果烯烃是一个环状结构,我们首先要找到并指定主链中的一个位置作为编号的起点,并选择最低的编号方式。
然后,我们使用“-en e”后缀表示它是一种烯烃。
例如,环戊烯是一个五元环烯烃,其中只有两个碳原子之间有一个双键。
现在,让我们来看看一些常见的烯烃化合物,以更深入地了解它们的命名方法。

烯烃总结知识点烯烃的结构烯烃是一类含有碳碳双键结构的有机化合物,通式为CnH2n。
它们的命名根据碳碳双键的位置,可分为α,β-烯烃和α,ω-烯烃两种。
烯烃中的双键结构使得分子能够发生加成反应,并具有许多特殊的化学性质。
烯烃的性质1.化学性质烯烃具有一定的稳定性,但碳碳双键的存在使得其分子极易发生加成反应。
一般而言,烯烃可以与氢气发生加成反应,生成饱和的烷烃;也可以与卤素发生加成反应,生成相应的卤代烃。
此外,烯烃还可以与含氧基团的化合物发生加成反应,生成醇、醛、酮等化合物。
2.物理性质烯烃的物理性质与其分子组成和结构有关,通常来说,烯烃比相似碳原子数的饱和烷烃具有较高的沸点和密度。
这是因为双键结构的存在增加了分子间的分子力,使得烯烃的沸点和密度相对较高。
烯烃的应用烯烃是一类重要的有机化合物,具有广泛的应用。
下面我们就来详细介绍烯烃在不同领域中的应用。
1.化工领域作为一种重要的化工原料,烯烃广泛应用于合成橡胶、合成树脂、合成纤维等方面。
例如,α-烯烃可以用于生产聚乙烯,而β-烯烃可以用于生产聚丙烯。
此外,烯烃还可以用于生产各种合成塑料、润滑油、燃料油等化工产品。
2.医药领域烯烃还具有一定的药用价值,一些天然存在的烯烃化合物具有抗菌、抗炎、抗肿瘤等药理作用。
另外,烯烃也被用于合成一些药物原料。
3.农药领域烯烃还可以用于生产农药,例如用于生产杀虫剂、杀菌剂等。
4.染料领域某些烯烃化合物可以用于合成染料,广泛应用于纺织、印刷等领域。
总之,烯烃是一类重要的有机化合物,具有广泛的应用前景。
未来随着科学技术的发展,烯烃的应用领域将得到进一步拓展,为人类社会的发展做出更大的贡献。


第三章烯烃Alkenes12烯烃的结构烯烃的顺反异构烯烃的命名烯烃的物理性质CONTENT1234烯烃的化学性质烯烃的制备56SP杂化轨道C C C C7乙烯键长和键角乙烷键长和键角134 pm 烯烃的键长和键角烯烃的结构特征•sp2杂化•π-键•C=C键长比C-C短•π键电子云流动性较大•存在顺反异构——相同基团在双键同侧为顺式,不同侧为反式83.3 烯烃的命名•主链应含双键称“某碳烯”•C10•主官能团的位号尽可能小•如烯烃存在位置异构,母体名称前要加官能团位号•取代基的位置、数目、名称按“次序规则”顺序写在母体前面•Z或E加圆括号,写在化合物名称最前面123.5 烯烃的化学性质1. 烯烃的亲电加成2. 烯烃的自由基加成3. 硼氢化反应4. 催化氢化5. 烯烃的氧化6. 烯烃的α−卤化7. 聚合反应21烯烃亲电加成的原则当不对称烯烃与极性试剂加成时:试剂中的正离子(或带有部分正电荷的部分)加到带有部分负电荷的双键碳原子上试剂中的负离子(或带有部分负电荷的部分)加到带有部分正电荷的双键碳原子上24可能发生重排反应重排反应( rearrangement)——在化学键的断裂和形成过程中,组成分子的原子配置方式发生了改变,从而形成组成相同,结构不同的新分子。
31结论•反应是亲电加成反应•反应是分步进行的•立体化学上表现为反式加成38反应特点•Br2, Cl2对烯烃的加成主要为环正离子过渡态的反式加成•碘加成一般不发生,但ICl, IBr可与烯键发生定量加成反应,用来监测油脂中双键的含量40。

大学有机化学反应方程式总结烯烃的加成反应与芳香化反应大学有机化学反应方程式总结:烯烃的加成反应与芳香化反应有机化学是研究有机化合物及其反应性质的科学。
在有机化学的学习过程中,烯烃的加成反应和芳香化反应是两个重要的反应类型。
本文将总结并简要介绍这两类反应的方程式及其反应机理。
一、烯烃的加成反应烯烃是含有碳碳双键的有机化合物。
加成反应是指在双键上发生新的化学键形成反应。
烯烃的加成反应可以分为电子亲攻和碳碳自由基加成两种类型。
1. 电子亲攻加成反应电子亲攻加成反应的特点是有亲电试剂与烯烃之间的化学键形成,生成新的化合物。
常见的电子亲攻剂包括卤素、酸和氢等。
举例来说,苯乙烯和卤素(如溴)发生加成反应,生成1,2-二溴乙烷:C6H5CH=CH2 + Br2 → C6H5CHBrCH2Br2. 碳碳自由基加成反应碳碳自由基加成反应的特点是由自由基试剂与烯烃之间的化学键形成,生成新的化合物。
常见的自由基试剂包括过氧化氢、过氧化苯和遇光照射的溴代烷等。
举例来说,乙烯和过氧化氢反应,生成乙醇:CH2=CH2 + H2O2 → CH3CH2OH二、芳香化反应芳香化反应是指芳香烃或强碱和芳香醛酮之间发生的反应。
该反应可以改变芳香环的数目、位置和取代基等,形成新的芳香化合物。
芳香化反应的机理分为电子亲电试剂和电子亲碱试剂两种类型。
1. 电子亲电试剂芳香化反应电子亲电试剂芳香化反应的特点是在芳香化合物中引入新的基团,如卤素、硝基、醛基等。
举例来说,苯和溴发生芳香化反应,生成溴苯:C6H6 + Br2 → C6H5Br + HBr2. 电子亲碱试剂芳香化反应电子亲碱试剂芳香化反应的特点是在芳香化合物中引入新的基团,如乙酰基、烷基等。
举例来说,苯和醋酐反应,生成苯乙酮:C6H6 + CH3CO2H → C6H5COCH3 + H2O总结:通过以上的介绍,我们可以看到,烯烃的加成反应和芳香化反应是有机化学中两类重要的反应类型。

有机化学基础知识点烯烃的物理性质烯烃是有机化合物中一类重要的碳氢化合物,具有许多独特的物理性质。
本文将介绍烯烃的物理性质,包括密度、沸点、溶解性等方面。
了解这些性质对于深入理解有机化学的基础知识点以及在实际应用中具有重要意义。
1. 密度烯烃的密度通常较轻,一般介于0.6至0.8克/毫升之间。
这是因为烯烃分子结构中含有碳碳双键,使得碳原子之间的键长较短,分子排列较紧密。
此外,烯烃的分子量相对较小,分子间相互作用较弱,因而密度较低。
2. 沸点烯烃的沸点与其分子量、分子结构以及分子间的弱相互作用有关。
一般来说,烯烃的沸点随着分子量的增加而增加。
例如,低碳烯烃(如乙烯、丙烯)的沸点较低,约为-103℃和-47℃;而高碳烯烃(如辛烯、十二烯)的沸点较高,约为140℃和200℃。
烯烃分子中的碳碳双键使得分子结构不饱和,导致分子间作用力减弱,因此烯烃的沸点通常较低。
3. 溶解性烯烃在溶剂中的溶解性一般较好。
烯烃分子中的碳碳双键使其具有较好的亲脂性,可以与无极性溶剂(如正庚烷、苯)以及极性溶剂(如醇、醚)形成溶液。
高碳烯烃由于分子量较大,分子间相互作用较强,因此在非极性溶剂中的溶解性相对较差。
4. 燃烧性烯烃具有较好的燃烧性,在适当条件下可以燃烧产生热量和水。
烯烃分子中的碳碳双键使其分子结构不饱和,容易与氧气反应燃烧。
例如,乙烯在氧气存在下可以燃烧产生二氧化碳和水,同时释放出大量能量。
总结:烯烃具有较轻的密度、较低的沸点、较好的溶解性以及良好的燃烧性等物理性质。
这些性质与烯烃分子中的碳碳双键有关,使得烯烃在有机化学中具有重要的地位。
深入理解烯烃的物理性质不仅可以帮助我们掌握有机化学基础知识点,还能为以后在实验设计和应用研究中提供参考依据。
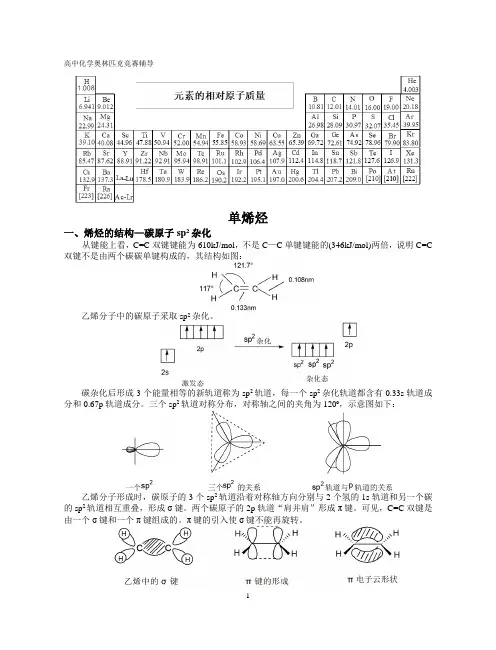
高中化学奥林匹克竞赛辅导单烯烃一、烯烃的结构—碳原子sp2杂化从键能上看,C=C双键键能为610kJ/mol,不是C—C单键键能的(346kJ/mol)两倍,说明C=C 双键不是由两个碳碳单键构成的,其结构如图:乙烯分子中的碳原子采取sp2杂化。
碳杂化后形成3个能量相等的新轨道称为sp2轨道,每一个sp2杂化轨道都含有0.33s轨道成分和0.67p轨道成分。
三个sp2轨道对称分布,对称轴之间的夹角为120º,示意图如下:乙烯分子形成时,碳原子的3个sp2轨道沿着对称轴方向分别与2个氢的1s轨道和另一个碳的sp2轨道相互重叠,形成σ键。
两个碳原子的2p轨道“肩并肩”形成π键。
可见,C=C双键是由一个σ键和一个π键组成的。
π键的引入使σ键不能再旋转。
碳碳双键中π键键能=碳碳双键键能—碳碳单键键能=615–348=267kJ/mol<348kJ/mol。
碳碳双键中π键的特点:①不如σ键牢固,π键键能(267kJ/mol)小于单键键能(348kJ/mol)。
②不能自由旋转(π键没有轨道轴的重叠)。
③电子云重叠少,不集中,易极化,发生反应。
二、烯烃的异构和命名1.烯烃的同分异构烯烃的同分异构包括碳链异构、C=C双键位置不同引起的位置异构和双键两侧的基团在空间的位置不同引起的顺反异构。
顺反异构:由于双键不能自由旋转,双键碳上所连接的四个原子或原子团是处在同一平面的,当双键的两个碳原子各连接两个不同的原子或原子团时,就能产生顺反异构体。
顺式烯烃是指两个双键碳原子的相同基团分布在C=C双键的同侧;反式烯烃是指两个双键碳原子的相同基团分布在C=C双键的异侧。
产生顺反异构体的必要条件:某个C=C双键碳原子上所连的两个基团要不同,两个C=C双键碳原子上所连的基团要有相同的。
顺反异构体的物理性质不同,因而分离它们并不很难。
2.烯烃的系统命名法(1)选主链:选择含C=C双键的最长碳链为主链,称为某烯。
(2)编号:从离C=C双键最近的主链碳原子一端开始依次编号。
大一有机化学知识点烯烃烯烃是有机化合物中的一类重要物质,它由碳和氢组成,具有不饱和的双键结构。
在大一有机化学中,学生需要了解烯烃的结构、性质以及反应等知识点。
下面将对大一有机化学知识点烯烃进行详细介绍。
一、烯烃的结构烯烃的一般结构式为CnH2n,其中n表示烯烃分子中碳原子的数量。
烯烃的结构中存在一个或多个双键,双键的存在使得烯烃比饱和烃更为活泼和化学反应性更强。
烯烃可以分为直链烯烃和环烯烃两大类。
直链烯烃是指烯烃分子中的碳原子直接连在一起形成链状结构,而环烯烃则是由一条或多条碳链组成的环状结构。
二、烯烃的物理性质1. 不饱和性:烯烃的分子中含有双键,使得其具有不饱和性,容易进行加成反应和氧化反应。
2. 沸点和熔点:烯烃的沸点和熔点较相应链状饱和烃高,由于双键的影响,烯烃之间分子间作用力较弱,因此烯烃之间分子间力较小。
3. 密度:烯烃的密度比相应链状饱和烃小,主要是由于双键使得分子中原子排列较为松散。
三、烯烃的命名烯烃的命名主要根据碳原子的分布情况进行,首先要确定烯烃分子中碳原子的数量,然后根据双键的位置来命名。
其中,当双键在分子中的位置靠近末端时,使用代表位置号的数字+ene的方式来命名,如1-丙烯;当双键在分子中的位置不靠近末端时,必须指明双键所在的碳原子的位置号,如2-丁烯。
四、烯烃的重要反应烯烃由于含有不饱和的双键结构,具有一些特殊的性质和反应。
以下列举几个大一学习中比较重要的烯烃反应。
1. 加成反应:烯烃可以与许多试剂发生加成反应,其中最典型的是氢气的加成反应,将烯烃转化为饱和烃。
2. 氢化反应:烯烃可以通过氢气的催化氢化反应,加成氢原子到双键上,形成相应的饱和烃。
3. 氢卤酸的加成反应:烯烃可以与氢卤酸发生加成反应,生成相应的卤代烃。
4. 水的加成反应:烯烃可以与水发生加成反应,生成相应的醇。
除了以上几个重要的加成反应外,烯烃还可以通过自身或外加的试剂进行环化反应等。
五、烯烃在生活中的应用由于烯烃具有不饱和性和反应活性高的特点,因此在生活中有着广泛的应用。
烯烃的同分异构全文共四篇示例,供读者参考第一篇示例:烯烃是一类含有碳碳双键的碳氢化合物,其化学式为CnH2n。
由于烯烃中含有不饱和的碳碳双键,因此烯烃具有一系列同分异构体。
同分异构是指分子式相同,结构式不同的化合物。
烯烃的同分异构体之间的结构差异主要体现在碳碳双键的位置不同以及碳链的长度不同。
首先我们来看一下烯烃的同分异构体之间的结构差异。
烯烃的同分异构体主要是由于碳碳双键的位置不同而产生的。
以C4H8为例,烯烃的分子式为C4H8,可有两种不同位置的同分异构体:1-丁烯和2-丁烯。
1-丁烯的结构式为CH2=CH-CH2-CH3,2-丁烯的结构式为CH3-CH=CH-CH3。
可以看到,这两种同分异构体的碳碳双键的位置不同,导致它们的化学性质和物理性质也会有所区别。
烯烃的同分异构体在化学性质和物理性质上也有所不同。
由于碳碳双键的存在,烯烃的同分异构体比饱和烃更容易发生加成反应和氧化反应。
在加成反应中,碳碳双键会被破裂,生成新的化学键;在氧化反应中,烯烃会和氧气发生反应,生成醇和醛等氧化产物。
烯烃的同分异构体之间的沸点、密度、溶解性等物理性质也会有所差异,这些差异主要源于分子结构的不同。
第二篇示例:烯烃是一类具有双键结构的碳氢化合物,分子式为CnH2n,其中n为整数。
烯烃是碳氢化合物中重要的一类,其同分异构特性极为突出,拥有许多种不同结构的同分异构体。
烯烃同分异构是指具有相同分子式但结构式不同的烯烃化合物。
由于双键的存在,烯烃分子结构中的双键位置可以发生变化,从而形成不同的同分异构体。
烯烃的同分异构体可以通过双键位置的不同来区分,常见的同分异构体包括1-烯烃、2-烯烃、3-烯烃等。
1-烯烃是指分子中的双键位于碳链的第一个碳原子上,例如乙烯(C2H4)就是一种1-烯烃。
2-烯烃是指双键位于碳链的第二个碳原子上,例如丙烯(C3H6)就是一种2-烯烃。
3-烯烃则是指双键位于碳链的第三个碳原子上,常见的例子包括1-丁烯(C4H8)。
有机化学基础知识点整理烯烃的合成与反应有机化学基础知识点整理:烯烃的合成与反应烯烃,是有机化合物中一类重要的碳氢化合物,分子结构中含有碳碳双键。
烯烃的合成与反应是有机化学中的重要内容之一。
本文将对烯烃的合成方法和常见反应进行整理,以帮助读者更好地理解和掌握这一知识点。
一、烯烃的合成方法烯烃的合成方法主要分为以下几种:1. 非选择性消除反应非选择性消除反应是指通过消除反应(如脱水、脱卤等)从有机化合物中生成烯烃。
常用的反应有酸催化下的醇的脱水、烷基卤代物的脱卤等。
例如,醇经酸催化脱水可以生成烯烃:CH3-CH2-OH → CH2=CH2 + H2O2. 消除-加成反应消除-加成反应是指通过先进行消除反应生成低级烯烃,再进行加成反应生成高级烯烃。
常见的反应有醇的酸催化脱水再加氢化铝烷的加成。
例如,乙醇经酸催化脱水生成乙烯,再与氢化铝烷发生加成反应生成丁烯:CH3-CH2-OH → CH2=CH2 + H2OCH2=CH2 + AlH3 → CH2=CH-CH23. 分子内环化反应分子内环化反应是指有机分子中存在两个相对位置合适的官能团,通过内环化反应生成烯烃。
常见的反应有烃基卤代物与碱的反应,生成环丙烷。
例如,1,5-戊二烯经过环化反应生成环丙烷:CH2=CH-CH2-CH=CH2 + 2 Na → CH2=CH-CH2-CH2-CH=CH2 + 2 NaX以上是烯烃的三种合成方法,每种方法都有其特定的适用范围和反应条件,读者在实际应用中需注意选择合适的方法。
二、烯烃的常见反应烯烃作为一类重要的有机化合物,具有丰富的反应性。
下面将介绍几种烯烃的常见反应。
1. 加成反应烯烃可以通过加成反应与其他有机物发生加成反应,生成新的有机化合物。
加成反应通常在非常温和的条件下进行,生成的产物的配置通常遵循Markovnikov规则。
例如,乙烯与溴化氢发生加成反应生成溴乙烷:CH2=CH2 + HBr → CH3CH2Br2. 氢化反应烯烃可以在催化剂的催化下与氢气发生氢化反应,生成饱和烃。
有机化学中的烯烃的立体化学烯烃是一类重要的有机化合物,其分子结构中存在碳碳双键。
烯烃的立体化学是指双键两侧的立体构型,包括顺式和反式异构体以及立体异构体的构象。
1. 顺式和反式异构体顺式异构体是指双键两侧的取代基或原子位于同一侧,而反式异构体是指双键两侧的取代基或原子位于不同侧。
以丁二烯为例,顺式丁二烯的双键两侧的氢原子位于同一侧,而反式丁二烯的双键两侧的氢原子位于不同侧。
两者的分子结构不同,性质和化学反应也会有所差异。
2. 立体异构体的构象另一种烯烃的立体化学是立体异构体的构象。
立体异构体是指在同一分子中,由于双键的限制性旋转,使得取代基或原子的空间排列存在不同的构象。
以正戊烯为例,其中一个碳原子上存在两个不同的取代基:甲基和乙基。
这两个取代基相对于双键的排列方式不同,分别称为顺式构象和反式构象。
在顺式构象中,甲基和乙基位于双键的同一侧,而在反式构象中,甲基和乙基位于双键的不同侧。
3. 立体异构体的性质差异烯烃的立体异构体具有不同的空间结构,因此在性质和化学反应上表现出差异。
例如,顺式丁二烯由于双键两侧的氢原子位于同一侧,分子结构更加接近线性,容易发生加成反应。
反式丁二烯由于双键两侧的氢原子位于不同侧,分子结构更加扭曲,不容易与其他化合物发生反应。
立体异构体的存在还会影响烯烃的物理性质,如沸点、熔点和溶解度等。
不同的构象会导致分子之间相互作用的差异,进而影响它们在化学反应中的活性和选择性。
4. 研究方法与应用研究烯烃的立体化学需要使用一系列的分析和测定方法,如核磁共振(NMR)、红外光谱(IR)和质谱(MS)等。
这些方法可以帮助确定烯烃分子中取代基的相对位置和构象。
在有机合成领域,烯烃的立体化学研究对于设计和合成拥有特定立体结构的化合物至关重要。
通过控制反应条件,选择适当的立体异构体,可以高效地合成目标化合物。
此外,烯烃的立体化学也在药物研发和生物领域具有重要应用。
了解烯烃分子的立体构型,可以深入研究药物与受体的相互作用,从而设计出具有较高活性和选择性的药物分子。